Method Article
研究伤口引起的多倍体化的果蝇模型
摘要
伤口诱导的多倍体化是一种保守的组织修复策略,其中细胞在大小上生长,而不是分裂,以弥补细胞损失。下面是一个详细的协议,如何使用果蝇作为模型来测量皮骨及其遗传调控在上皮伤口修复。
摘要
多倍体是一种常见现象,对机体健康和疾病的影响仍然鲜为人知。如果细胞包含的染色体的二倍体拷贝多,则细胞被定义为多倍体,这是最终复制或细胞融合的结果。在组织修复中,伤口诱导的多倍体化(WIP)被发现是一种保存的愈合策略,从果蝇到脊椎动物。WIP比细胞增殖具有若干优点,包括抗致癌生长和基因毒性应激。挑战在于确定多倍体细胞产生的原因,以及这些独特的细胞如何发挥作用。提供一个详细的协议,研究WIP在成人果蝇上皮,其中多倍体细胞产生后2天内穿刺伤口。利用 D.黑色素加斯特广泛的 基因工具包,启动和调节WIP所需的基因,包括 Myc,已经开始被识别。使用这种方法的持续研究可以揭示其他遗传和生理变量,包括性别、饮食和年龄如何调节和影响WIP的功能。
引言
果蝇黑色素是一个有吸引力的模型系统,研究上皮伤口修复的细胞和分子机制。与哺乳动物一样,使用的组织修复机制取决于组织及其发育阶段。无疤痕伤口愈合发生在果蝇胚胎中,在上皮前缘形成一个果蝇胚胎,使伤口无缝关闭1,1,2。幼虫、幼虫和成年果蝇的胚胎后伤口愈合导致细胞外基质重塑、黑色素疤痕形成和上皮细胞生长,3、4、5、6。45,63上皮细胞通过细胞融合和内环增加大小,这是一个不完全的细胞周期,,绕过了3、4、7、847的线粒体。因此,细胞损耗通过多倍体细胞生长而不是细胞分裂来补偿。成年苍蝇后肢、中毛细胞和卵泡上皮也依靠多倍体细胞生长来补偿组织损伤后细胞损失,9、10、11。,11
多倍体是植物和昆虫有机体发育的一个众所周知的方面,但近年来,多倍体是脊椎动物12的一种保守组织修复策略,这一点越来越明显。斑马鱼,它有能力再生其心脏,依靠多倍体细胞生长来治愈受损的史诗13。多倍体也有助于哺乳动物肝脏再生和肾管上皮修复后急性损伤14,15。14,在这些示例中,多倍体细胞通过内环或内氧体进行内向生成,由于细胞因子12中的块而导致双细胞化。谜是为什么多倍体细胞在伤口修复过程中出现,以及多倍体如何影响组织功能。最近的研究为多倍体是提供治疗优势还是劣势的问题提供了新的见解。在斑马鱼史诗中,多倍体提高了伤口愈合的速度13。在D.黑色素和哺乳动物肝脏中,多倍体被发现对致癌生长有保护作用11,14。11,14在成人苍蝇上皮,最近发现,多倍体使伤口修复在基因毒性应力16的存在。内光对DNA损伤具有抗药性,当细胞增殖时,伤口愈合,否则就会受到损害。然而,对于小鼠和斑马鱼心脏中的心肌细胞,多倍体会减缓愈合,从而增强疤痕形成18,19。18,因此,根据器官和/或细胞类型,多倍体可以是一个有益或有害的组织修复策略。D. 黑色素糖酯遗传学的可及性,加上伤口诱导多倍体化 (WIP) 反应的分析,使其成为阐明指导伤口愈合策略的分子和细胞机制的理想模型系统。
在这里,我们提出了一个协议,用于分析在成人 D.黑色素体上皮的 WIP。其中包括果蝇损伤、解剖、免疫污点、安装、成像以及再上皮化、细胞融合和内皮(倍数)分析的说明。成像和倍体分析也可以适应其他模型,以测试是否发生 WIP。应当指出,随着核DNA含量的增加,核尺寸往往相应增加。然而,在生物学中有许多例子,核尺寸没有反映20倍体的相应变化。在解释细胞经常扩散或伸展以覆盖伤口场址的伤口环境中解释核尺寸时,应更加谨慎。因此,胶质变化的唯一明确证据是用这种方法(或其他方法,如全基因组测序)测量DNA含量21。该方法提高了成人 D.黑色素腹 上皮作为研究多倍体在伤口修复中的作用和调节的模型的适用性。
研究方案
1. 成年果蝇的分期和伤伤
- 选择 选择 D. 黑色素 罗加斯特菌株(即 epi-Gal4/UAS 菌株, 参见材料表)。
注:此处,Gal4/UAS 系统用于启用 UAS 下游编码的基因或 RNAi 的上皮特异性基因表达 (epi-Gal4)。本研究使用荧光膜蛋白(UAS-Cd8.mRFP)、线粒体诱导剂(UAS-fzr RNAi、UAS-stg)和WIP抑制剂(UAS-E2F1RNAi;RNAiUAS-RacDN。 - 收集两瓶10-15新封闭的雌性果蝇,并在25°C的新鲜食物小瓶上老化,直到3-5天大。一个小瓶将作为未受伤的控制,另一个小瓶将受伤,如下所述。雌性苍蝇应与雄性苍蝇保持(+5/瓶)。
- 要缠绕苍蝇,请用单个 0.10 mm 不锈钢销组装多个销架。确保销的尖端朝外。针脚在刺穿苍蝇后很容易弯曲或切屑,并且应丢弃钩住或损坏的销。
- 在立体显微镜下用CO2-fly垫麻醉老年雌性果蝇,用画笔将它们对齐成一排。戴上安全眼镜,一手握住销架,另一只手握钳子,用钳子将苍蝇的腹腹部朝上放置。
- 在腹中线尾体两侧的特格石A4的上皮胸膜区域内刺穿成年雌性苍蝇(图1A)。使这个心室区域的穿刺提供了远离解剖点的最佳空间,在那里组织边缘将被机械加工撕裂。
- 返回受伤的苍蝇到食物小瓶和年龄到期望的一天后受伤后 (dpi).上皮伤口愈合从1 dpi开始,以3 dpi结束。末值在 2 dpi 时,这是 EdU 测定的理想(第 4 节, 图 2)。
2. 飞腹解剖
注意:在此步骤中,重要的是避免接触腹腹组织与解剖工具,因为它将损害上皮的完整性。
- 获取解剖所需的所有材料:Grace 的溶液、钳子、Vanna 的弹簧剪刀、0.10 mm 针脚、解剖板、9 孔玻璃解剖盘、固定溶液(1x PBS 中的 4% 甲状甲醛)、1x PBS、湿巾、移液器和 30 μm 的技巧以及手套(参见材料 表)。
- 确认苍蝇在立体显微镜下的CO2-fly垫上麻醉受伤的苍蝇,并检查伤口疤痕是否存在(即腹部黑色素斑点,参见 图1B)。丢弃实验组未成功受伤的苍蝇。
- 要开始解剖,请用格蕾丝的溶液填充 9 井玻璃解剖盘的一个井。使用一对钳子抓住受伤的雌性苍蝇在胸部的后侧,并淹没在含有格雷斯溶液的井中的苍蝇。
- 使用另一只手的钳子而不释放胸部,刺穿三石 A6 下方的背皮,将角质层从果蝇的后端拉下。内部器官(卵巢和肠道)通常会在这一步出来。如果没有,用钳子轻轻推在腹部的背侧,挤出剩余的器官,丢弃成空井。
- 使用钳子在 Tergite A2 上方的胸交界处捕捉整个腹部,然后将腹部转移到含有格蕾丝溶液 ±100 μL 的空井。
- 重复步骤2.3-2.5,直到所有苍蝇腹部被解剖。
- 将 Grace 溶液的体积在包含池水解剖腹部的井中减至 30 μL。
- 一只手将腹部放在背部侧部,然后用钳子将 Vanna 弹簧剪刀的底部刀片插入腹腔,使腹部开角。沿着后侧中线切割,直到腹部完全打开,这可能需要多达三个切口(图1C,1D)。
- 设置一个干燥的解剖板,每个腹部安装区域有四个 0.10 mm 针脚。每个 35 mm 解剖板可容纳多达 7 个安装区域。在每个安装区域上滴管 30 μL 的 Grace 溶液,将一个圆角腹部转移到每个液滴。
- 将圆角腹部固定在四个后角上的盘子上(图1E)。确保组织平整,不会撕裂或过度拉伸腹部组织。
- 要固定组织,移液器关闭 Grace 的溶液,并将 30 μL 的固定溶液添加到固定腹部。
注意:在处理固定溶液时戴手套,因为甲醛是有毒的。 - 重复步骤 2.10-2.11,直到所有圆角腹部固定在解剖板上。
- 在每个菜的底部放置一个胶带标签,以标记每个控制和实验组。在室温 (RT) 下固定样品 30-60 分钟。
- 通过将 1.5 mL 的 1x PBS 移液到每个板中,洗掉固定溶液。根据机构指南,将固定溶液和塑料处理在适当的液体或干化学废物容器中。
- 用 1.5 mL 的 1x PBS 清洗板 2x,将覆盖在 1.5 mL 1x PBS 中的固定组织存放在带盖子的塑料容器中。在容器底部加入一层湿纸巾,并在4°C下储存样品,直到解剖后1周内准备好进行免疫。
3. 免疫荧光
- 新鲜准备的试剂(参见材料 表):洗涤缓冲液(0.3% Triton X 100,1x PBS 中的 0.3% BSA)。剩余的洗涤缓冲液可以在4°C下保存,并在2天的染色协议期间使用。每次检测准备足够的原抗体溶液(图2),使用抗FasIII(1:50小鼠抗法西林-III)在洗涤缓冲液中,具有抗Grh(1:300亲和纯兔抗粒头8)或抗RFP(1:1,000兔子抗RFP)。原抗体溶液可保存在4°C,并重复使用多次,直到信号显著减少。
- 通过移液1x PBS,加入1.5 mL的洗涤缓冲液,并在RT的轨道摇床(80 rpm)上孵育至少30分钟,使组织渗透。
- 用1.5 mL的原抗体溶液在一夜之间去除洗涤缓冲液和污渍组织,在4°C的轨道摇床(80 rpm)上孵育。 收集原抗体溶液,在4°C下保存在管中,供将来实验使用。
- 首先用1x PBS快速冲洗样品,然后用1.5 mL的洗涤缓冲液冲洗3x。每次洗涤时,在轨道摇床上用RT孵育样品至少30分钟。
- 在最后一次洗涤期间,准备二次抗体溶液:1:1,000驴抗兔子Alexa 488或568和1:1,000山羊抗小鼠Alexa 488或568(或荧光团选择)在洗涤缓冲液中。
- 用1.5 mL的二次抗体溶液去除洗涤缓冲液和染色组织。用铝箔覆盖样品,在RT的轨道摇床上孵育3小时。或者,样品可以在4°C的轨道摇床上孵育过夜。
- 首先丢弃二次抗体溶液,然后用 1x PBS 快速冲洗样品,然后用 1.5 mL 洗涤缓冲液冲洗三次。每次洗涤时,在轨道摇床上用RT孵育样品至少30分钟。
- 通过将 DAPI 稀释至洗涤缓冲液中的 10 μg/mL 来制备 DAPI 解决方案。最后洗涤后,用1.5 mL DAPI溶液的污渍样品在RT孵育30分钟。
- 丢弃 DAPI 溶液,在 1.5 mL 的 1x PBS 中冲洗样品 2x。将染色组织存放在 1.5 mL 的 1x PBS 黑暗中,用铝箔覆盖在 4°C 下,直到准备好安装在带盖玻片的玻璃幻灯片上。安装步骤应在 1 周内执行。
4. 细胞周期活动(EdU测定)
- 在 dH20 中溶解 EdU 粉末并混合约 15 分钟,直到完全溶解,从Click-iT 套件(参见材料表)中制作 10 mM EdU 库存溶液。库存溶液可等分(每管250μL),储存在-80°C。
- 饲料苍蝇EdU首先稀释EdU股票到5mM在dH2O.加入干酵母,直到溶液是多云和短暂的漩涡混合。切断0.5 mL管盖,并放在飞食瓶的底部。将盖子推入食物中,这样它就是稳定的。
- 麻醉苍蝇,并转移3-5天大的苍蝇到小瓶。点击苍蝇到一个边缘,所以没有卡在帽子。
- 移液 75 μL 酵母-EdU溶液进入盖。苍蝇应每天喂新鲜酵母-EdU溶液,并每隔一天转移到一个新鲜食物瓶与帽子,以确保苍蝇不会卡在小瓶的底部。
- 要转移苍蝇,请翻转到带帽子的新小瓶中,将苍蝇置于睡眠状态,将苍蝇点击到一侧,然后加入新鲜的酵母-EdU溶液。
- 第三天,伤害苍蝇,并继续喂酵母-EdU,直到解剖在2dpi(图4A)。有关解剖和固定方法,请参阅协议第 2 节。
- 准备EdU染色试剂:洗涤缓冲液(0.3%Triton X 100, 0.3% BSA 在 1x PBS 中),渗透缓冲液(0.5% Triton X 100 在 1x PBS 中),阻塞缓冲液(1x PBS 中的 3% BSA),以及从 EdU 测定试剂盒中准备试剂(参见材料 表),包括制造商指示的 1x 反应缓冲液和 1x 反应缓冲液添加剂。
- 清洗样品1小时,在RT下混合在1.5 mL的洗涤缓冲液中。
- 加入1.5 mL的渗透缓冲液和孵化样品20分钟。
注:使用 500 μL/板的体积解冻和制备反应鸡尾酒溶液。 - 使用 1x PBS 快速清洗样品 1 倍,然后用 1 mL 的阻塞缓冲液快速清洗样品 3 倍。
- 切掉所有剩余的阻塞缓冲液,每盘加入500μL的反应鸡尾酒溶液。旋转板,以确保组织完全覆盖。在黑暗中的抽屉里孵育 1 小时。
- 使用 1.5 mL 的阻挡缓冲液快速清洗样品 1 倍。
- 在洗涤缓冲液中用 1.5 mL 的 DAPI 溶液染色 30 分钟。
- 用1x PBS快速清洗2x,用铝箔包裹,并在4°C的黑暗中储存,直到3天内准备好安装样品。
5. 安装染色组织
- 获取安装所需的所有材料:玻璃滑梯、玻璃盖玻片、透明指甲油、安装介质、一对钳子和湿巾。
- 要安装染色的苍蝇组织,使用立体显微镜下的钳子从解剖板中解开腹部。将组织转移到玻璃盖玻片上 ±30 μL 的安装介质,用后侧侧轻轻抓住组织,注意避免用钳子接触腹体区域。
- 在立体显微镜下,腹部组织定向,使内侧朝下朝向盖玻片(即外部角质层/刷毛朝上)。使用钳子将定向腹部拉到介质液滴的边缘。表面张力有助于保持组织扁平(图1F)。
注:在此阶段,将腹部组织成柱或行有助于成像。 - 标记玻璃幻灯片(即控制或实验),然后慢慢使滑轨靠近盖玻片,拿起盖玻片。翻转滑动,用擦拭轻轻抹印,以去除多余的安装介质。
- 用清晰的指甲油密封盖玻片的边缘,并对所有剩余的实验组重复。将幻灯片存放在 4 °C 的幻灯片框中,直到准备好进行成像。
6. 成像和处理
- 首先使用共体显微镜定位黑色素疤痕(图1B),即点扫描仪或具有40倍油或干面的结构化照明(ApoTome),对苍蝇腹部伤口区域进行成像。
- 检查每个通道上的曝光,确保信号低于饱和度。成像设置应基于最亮的样本组。这对于倍体分析尤其重要,因为 DAPI 通道需要保持线性范围,以准确测量 DNA 含量。
- 在所有三个通道中拍摄完整的 z 堆栈图像,切片之间的最佳距离至少为 0.50 μm。保存捕获的图像并在图像分析程序斐济(也称为 ImageJ)中打开该文件。
- 对于每个图像,使用所有通道的切片总和选项创建 z 堆栈投影。
- 必要时旋转图像,以确保核在图像上水平排列(图3A 和图4E)。
- 将所有图像裁剪为以伤口位置或未受伤控制中心为中心的矩形选择 300 μm x 300 μm。通过绘制矩形并选择"编辑 |"选择 |指定。检查缩放单位是否以微米为单位,以确保用于分析的所有图像使用相同大小的框。
7. 末数(倍数)分析
- 使用斐济,选择 Grh 通道窗口 并复制图像。然后使用 阈值工具 创建蒙版。手动调整阈值,滑动顶部柱线以最小化背景,而不会导致核急剧收缩(图 4D)。
- 如果 Grh 通道中的任何核在阈值图像中接触,请使用 画笔工具 (2 像素宽度)与背景颜色相同,在核之间绘制一条线。单击以在完成后应用 1 倍以生成最终掩码。
- 使用"分析粒子"功能生成感兴趣区域 (ROI) 贴图 :将大小设置为 5 μm-60 μm,以便在不包括背景的情况下捕获大部分核。
- 根据 ROI 管理器中所需的需要手动调整 ROI 映射。删除任何不是核的选择,并将未识别的任何核添加到列表中,通过使用徒手选择工具概述核并将其添加到 ROI 管理器 (图 4D)。
- 选择 DAPI 通道, 然后单击 ROI 管理器中的 " 全部显示", 将 Grh 通道中生成的 ROI 映射应用于 DAPI 通道。
- 从 ROI 图中删除上皮核轮廓与无皮核重叠(例如,肌肉或脂肪的核)的任何选择。颗粒头只染色上皮核,而DAPI染色所有核。检查每个轮廓选择是否只包含一个原子核,并删除或编辑具有多个原子核的任何选择。保存已编辑的 ROI 列表。
- 使用斐济的分析工具测量 ROI 图中每个上皮核的面积和集成密度。将值导出到电子表格程序中。
- 使用圆形选择工具测量平均图像背景。绘制三个不与 DAPI 图像不同区域中的任何核重叠的圆。将每个圆的面积和集成密度添加到电子表格程序中,以建立背景图像亮度。
- 首先计算每个图像的单位面积的平均背景,方法是将每个背景集成密度值除以其相应的面积。然后对图像的三个区域测量值进行平均,以获得单位面积的平均背景。
- 接下来,通过将原子核面积乘以单位面积的平均背景来计算每个 DAPI 核的总背景。然后,可以通过从所测得的综合密度中减去每个原子核的总背景来计算所测出的每个原子核的规范化DAPI强度。
- 平均未受伤的上皮控制的所有规范化 DAPI 强度值。未受伤的上皮核先前计算为具有2C的倍体值,可作为从实验条件8计算上皮核中倍体性的参考。
- 通过将每个原子核的规范化 DAPI 强度除以规范化值与参考未受伤的上皮控制 (2C) 来计算每个原子核的倍数,然后将值乘以 2 等于规范化的 ploid(C 值):
(核综合密度 - 背景核综合密度)/平均核综合密度(未受伤的上皮核 = 2C) x 2 = 上皮核倍数 (C) - 具有 p体值的图形核作为点图、直方图或相应地分组到条形图中(即, 2C [0.6-2.9C], 4C [3.0-5.9C], 8C [6.0-12.9C], 16C [13.0-24.9C], >32C [>25.0C] (图 3F)
结果
提供了详细的方案,使用D.黑色素糖酯作为模型来研究伤口诱导的多倍体化(WIP)。这种伤口愈合模型比哺乳动物和其他WIP飞行模型具有许多优势。多倍体很容易被一个机械穿刺诱导与昆虫针和多倍体细胞在短时间内产生(2-3 dpi)(图1A,1B)4。4主要的挑战是解剖完整的腹部组织,没有任何扰动的上皮。D. 黑色素座上皮很容易被锋利的解剖工具意外撞伤或划伤。因此,在使用和分析之前,应执行此协议的步骤。
首先,损伤仅限于腹腹女性腹部,这为成像提供了一个扁平的透明组织区域。穿刺伤口是在胸膜上皮,位于腹中线尾体两侧,并针对特克石(T)段T4-T5(图1A-C)。此伤口放置提供了一个较大的可见区域,不会因解剖而中断。具有挑战性的步骤包括腹部弹簧剪刀切割和固定步骤(图1D,1E)。当腹部在Grace溶液(±30μL)的体积减少,以减少组织运动时,弹簧切削步骤效果最佳。需要沿着后侧中线进行居中切口,以便为腹部后侧瓣提供足够的区域,以销在解剖板上(图1C)。腹部必须轻轻地固定在四个角上,不要过度用力(图1E)。过于硬的针推会扭曲腹部组织,甚至会将组织推入解剖板。如果发生这种情况,必须丢弃组织。腹部组织固定后,留在解剖板上,直到免疫荧光染色完成,腹部被安装在玻璃盖玻片上进行成像(图1F)。
伤口愈合需要连续的上皮表形成,这是取决于内显和细胞融合4,4,16。标记细胞结的隔膜结结蛋白FasIII提供了一个指标,说明在制备过程中是否发生任何处理扰动(图1G,1H)。必须丢弃有较大划痕(未污染区域)的腹部,不得用于进一步分析(图1H)。
下一步是分析完整的样本,以发现WIP中的任何缺陷。该协议包括不同的检测,以检测WIP响应的不同方面(图2)。当一个中央的、大的、多核的细胞覆盖伤口疤痕时,伤口修复就完成了(图3A)。在这里,细胞融合通过染色法西/Grh和量化的Grh+上皮核的数量包含在FasIII概述区域4中。当发现上皮片中 >10 μm 的间隙时,检测到伤口闭合或重新上皮化的缺陷(图 3B,红色箭头)。例如,当WIP通过stg,fzrRNAi的表达被激活的线粒体循环所抑制时,正如最近报道的16。在这种遗传条件下,52%的伤口无法在伤口鳞片上形成连续的上皮片(图3B,3C)。
在此模型中测量伤口修复的另一个方法是使用 UAS-mCD8-ChRFP4的 epi-Gal4 表达来可视化上皮膜(图 2,图 3D)。在控制中,91%的上皮伤口完全闭合3 dpi,但抑制WIP通过阻断内显性(E2f1RNAI)RNAi和细胞融合(RacDN)同时,如先前报道,导致92%的上皮伤口保持完全开放(图3D,3E)8,16。8,16Figure 3通过stg、fzrRNAi的表达激活线状细胞周期也导致了上皮伤口闭合缺陷。然而,通过可视化上皮细胞膜,可以确定再上皮缺陷的程度。WIP突变体(E2f1RNAI,RacDN)RNAi飞行伤口比stg,fzrRNAiRNAi伤口更开放(图3D,破折号红色轮廓)16。这种膜伤口愈合测定提供了更多关于伤口修复缺陷程度的信息。因此,再上皮化缺陷可以分组为完全打开、部分关闭(即 >10 μm 间隙),或完全闭合(图 3D,3E)。
除了细胞融合外,上皮细胞还通过内显性而增长,这是一个不完整的细胞周期,使核DNA含量翻倍。通过细胞周期活性和直接核DNA倍体测量(图2和图4)测定了内分法。在这里,细胞周期活性通过加入胸腺素模拟,EdU(图4A,4B)来检测。Figure 4发现D.黑色素体上皮细胞进入内环,这是一个不完整的细胞周期,在S和G相之间摆动,没有介入M阶段4,12。4,成人D.黑色素糖酯饮食在受伤前辅以EdU+食物,苍蝇维持在EdU+饮食,直到解剖在+2 dpi(图4A)。然后使用制造商的 Click-iT 协议检测到 EdU。此 EdU 测定用于确定触发的核在何时、何时和多少个核进入 S 相以响应伤口。使用Gal4/UAS系统,最近发现,myc的上皮特异性表达可以阻止(mycRNAi)或加剧(Myc过度表达)上皮细胞进入S相的能力。因此,它已被证明,Myc足以诱导后质细胞的末位繁殖,即使没有伤害16,22。16,
接下来,通过直接测量核DNA含量确定上皮倍体。上皮特异性标记Grh(图4D)的免疫荧光染色确定了上皮核。在斐济成像软件中,上皮核被系统识别,然后使用Grh核污渍进行阈值。然后将核分离,将ROI覆盖在堆栈DAPI图像(图4 D,绿色D箭头)上。在测量所选核的集成密度之前,手动删除了任何重叠的原子核(图4D,红色箭头)。这种半自动的方法允许人们量化大多数核的分布和倍体在整个没有受伤和修复的苍蝇腹部上皮8。据最近报道,伤口周围的上皮核由44%的多倍体核组成,DNA含量在3dpi(图4E,4F)16时超过3C。16正如EdU结果所料,myc的敲击导致在内显性上产生一个显著的块,因为只有9%的上皮核是多倍体,而 Myc的超表达导致伤口位点周围100%的多倍体上皮核(图4F)16。上皮核大小也明显受到myc 表达的影响, 存在减少或放大的核。然而,核区域不能准确测量倍体和生理效应,因为细胞拉伸等因素也会影响核尺寸,而不会影响核DNA含量20。
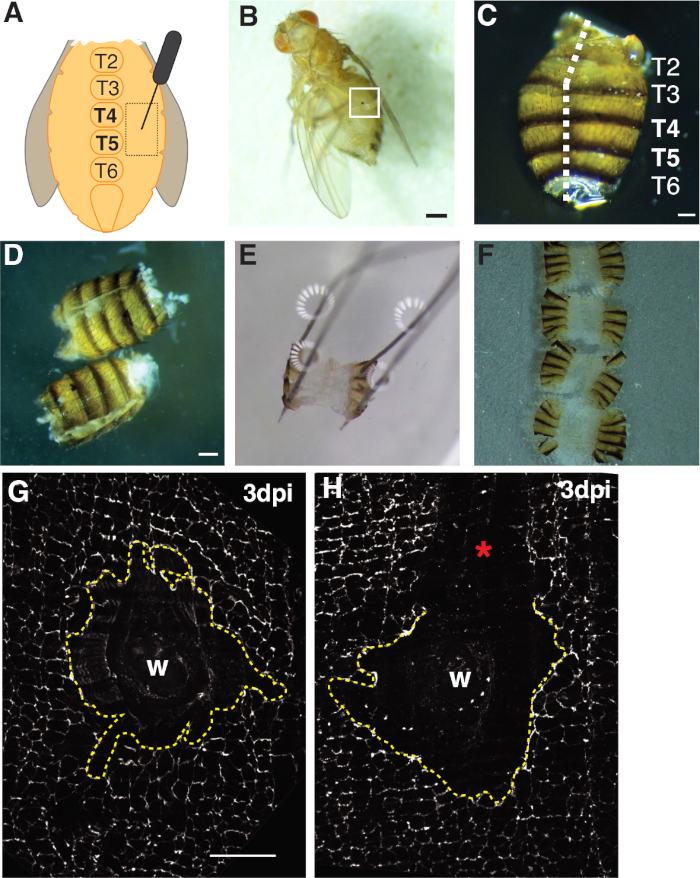
图1:成人果蝇腹部受伤,解剖和组织安装。 (A) 成人腹部受伤测定图。苍蝇应在三叶草 4 (T4) 的腹部两侧受伤。(B) 成年雌性果蝇 3 dpi 与黑色素疤痕形成伤口愈合 (白盒).比例杆 = 50 μm. (C) 解剖成人腹部,背部视图,标有三叶草。腹部被圆角向下侧的中线(白色虚线)。刻度杆 = 50 μm. (D) 固定前解剖和圆角的成人腹部。比例线 = 50 μm. (E) 将成人腹部固定在解剖板上.在腹部的四个角落各放置一个针。组织被轻轻地打开,但没有拉伸,以避免撕裂。(F) 成人腹部被安装并放置在玻璃盖玻片上,腹部内侧朝下朝向盖玻片,角质层朝向玻璃滑梯。(G) 完整的伤口区域的FasIII染色,没有加工扰动和中央同步(虚线黄线)。比例线 = 50 μm. (H) 划伤伤口区域的图像 (*) 与未沾污的 FasIII 区域,扰乱同步。 请单击此处查看此图的较大版本。
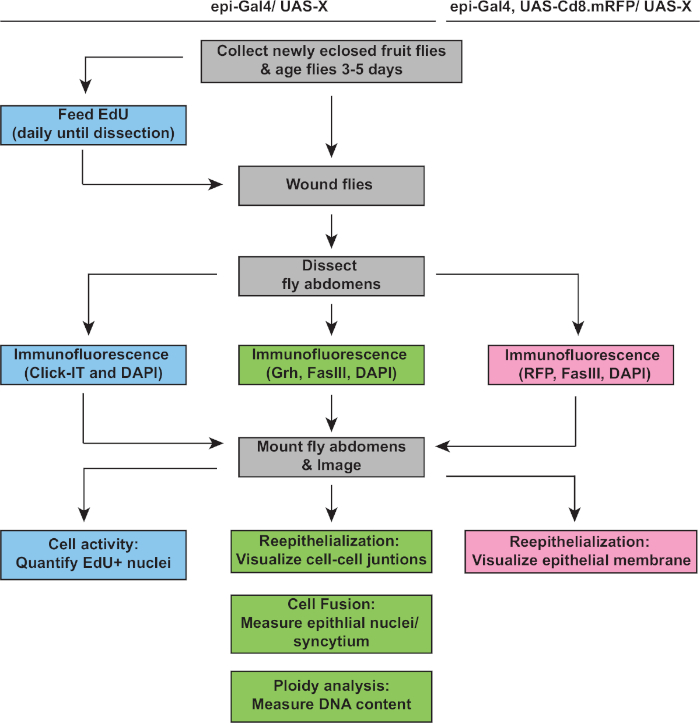
图 2:WIP 分析工作流。 流程图描述了本研究中描述的三种检测方法,以及用于检测和测量 WIP 响应的重叠和独特的步骤。EdU 测定测量细胞周期活性(蓝色框)、胶体和再上皮化由 Grh/FasIII 免疫覆盖(绿色盒)检测,膜 RFP 的表达允许测量上皮伤口闭合的程度(粉红色框)。常见的步骤是灰色框和 D.黑色素菌株 基因型在上面列出。 请单击此处查看此图的较大版本。
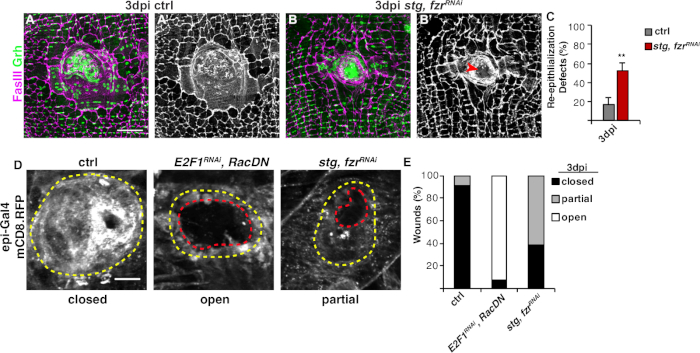
图3:在WIP期间检测再上皮化的方法。当WIP在基因上被抑制时,再上皮化是不安的。控制 ( A ) 和stg的免疫荧光图像, fzrRNAi (B) 在 3 dpi.上皮核和隔膜结分别沾染了Grh(绿色)和法西(品红色)。(A' 和 B')FasIII 染色本身表明, 重新上皮受损 (红箭头) 在stg, fzrRnai上皮。刻度杆 = 50 μm. (C) 再上皮缺陷的定量 (%)在 3 dpi (灰色): 控制 (n = 8), stg, fzrRnai (n = 6) 。错误栏指示标准错误;统计显著性是通过学生的 T 测试 (**P < 0.01) 测量的。使用表皮-Gal4,UAS-mCD8-RFP表达膜链接RFP,也可以在伤口修复过程中检测到再上皮化。(D) 控制、E2F1RNAi、RacDN和stg、fzrRNAi 的免疫荧光图像,以 3 dpi 表示。比例线 = 20 μm。伤口疤痕(黄色轮廓)和开放上皮伤口区域(红色轮廓)。(E) ctrl (n = 11)、 E2F1RNAi、 RacDN (n = 13) 和stg、fzrRNAi (n = 13) 中伤口闭合的定量。改编自格林德勒等人16。请单击此处查看此图的较大版本。
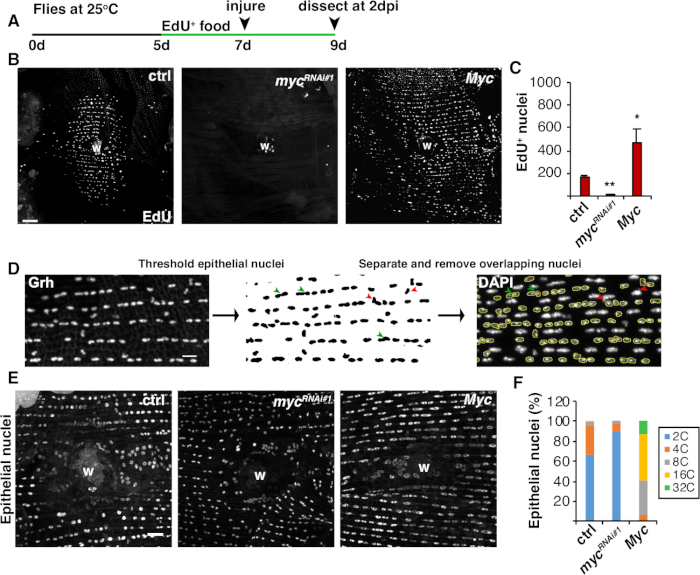
图4:在WIP期间检测末位的方法。(A) EdU 测定时间轴:成人果蝇在受伤前 2 天每天被喂食 75 μL 5 mM 酵母-EdU,并一直持续到 2 dpi。(B) 飞株中 EdU 标签的免疫荧光图像,以 2 dpi 表示与 epi-Gal4/UAS 系统表示。伤口疤痕 (W)。比例线 = 50 μm. (C) 每只苍蝇平均数 EdU + 上皮核数 2 dpi: ctrl (n = 37), mycRNAi#1 (n = 10), 和Myc (n = 8)。错误栏指示标准错误;统计显著性是通过学生的 T 测试测量的,*P < 0.05, **P < 0.01。(D) 上皮核倍体检测和测量的示意图。在斐济,通过抗Grh染色,识别和阈值的上皮核。重叠的上皮核被分离(绿色箭头)或移除(红色箭头),如果覆盖在非皮核。测量了相应DAPI染色核图像的综合密度和核面积。(E) 在 3 dpi 时, 由myc 表达式改变的表皮核大小 (Grh) 。(F) 表皮核倍体 (%)在 3 dpi: ctrl (n = 4), mycRnai #1 (n = 6) 和Myc (n = 3) 。改编自格林德勒等人16。请单击此处查看此图的较大版本。
讨论
提出了一个详细的协议,如何解剖和使用成人D.黑色素腹上皮研究基因如何调节WIP通过改变重新上皮和伤口修复期间,末日化16。使用这种方法,原生基因 Myc 最近被确定为 WIP 的关键调节器。Myc是上皮细胞的致癌后,足以使静态上皮细胞内循环在成人苍蝇上皮和附属腺体16,22。,22研究还发现,通过stg、fzrRNAi的表达将上皮细胞切换到线粒细胞周期对伤口修复有害。使用这种方法的持续研究将确定在WIP期间调节再上皮化和末位化所需的其他基因,揭示多倍体调控和在各种组织中功能的相似性和差异。
该模型和方法具有独特的优势,包括多倍体与机械穿刺的容易诱导和多倍体细胞在几天内产生的事实。组织解剖和准备方案是基于幼虫解剖技术23,但成人苍蝇腹部更僵硬,因此容易扰动。因此,该协议需要实践和精度来分离一个完整的组织来研究WIP。然而,一旦解剖,上皮清晰可见,易于成像,产生伤口愈合过程的快照。这种方法提供了大量有关成年苍蝇上皮组织、细胞和同步大小以及细胞和单个核的倍体的信息。虽然活成像在完整的果蝇中还不可能由于其不透明的角质层,但该协议可以进行调整,以包括目前可用的外活体培养条件,用于D.melanogaster进行短期活体成像研究24。
将来,该模型将非常适合研究细胞对细胞串扰和其他细胞类型对WIP的贡献,通过调节基因表达与Gal4/UAS系统在其他细胞类型的兴趣。类似的问题也可以回答使用各种遗传和突变背景。解剖的成人苍蝇腹部包含各种细胞类型,可以使用这种方法很容易可视化,包括脂肪身体和月青细胞,侧肌纤维,感觉神经元,气管,和巨噬细胞状血细胞。此外,该模型将允许研究人员研究生理变量如何影响WIP,包括性别、饮食、感染、年龄和环境压力因素。虽然协议使用成年雌蝇由于其更大的大小,擦拭也发生在雄性果蝇(Gjelsvik和洛西克,未出版)。多倍体细胞在哺乳动物肝脏、大脑、眼睛和心脏的衰老和年龄相关疾病中被发现出现。果蝇模型将使研究人员能够研究生理和疾病背景下的多倍体化,因为人类疾病相关基因具有高度的保存性。
披露声明
没有。
致谢
在波士顿学院,我们要感谢埃里克·福尔克博士使用实验室的相机和立体镜显微镜设置成像和布雷特·贾德森在波士顿学院成像核心的基础设施和支持。我们还要感谢苍蝇社区资源:布卢明顿果蝇种群中心(NIH P40OD018537)、维也纳果蝇资源中心和哈佛医学院的TRIP中心(NIH/NIGMS R01-GM084947)提供了本研究中使用的转基因种群。小鼠FasIII抗体来自由NIHNICHD支持的发展研究杂交瘤库,并维持在爱荷华大学生物系,爱荷华市,IA。本出版物中报告的研究得到了国家卫生研究院国家普通医学研究所的支持,编号为R35GM124691。内容完全由作者负责,不一定代表国家卫生研究院的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| 35 mm Petri dishes | Fisher Scientific | FB0875713 | For creating plates to dissect in |
| 50 mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | For preparing staining reagents in |
| AxioImager M2 with Apotome | Zeiss | NA | For imaging samples |
| Blowgun mini | Genesee Scientific | 54-104M | For anethesizing D. melanogaster strains |
| Bovine Serum Albumin, 30% | Sigma | A7284-500ML | For immuostaining |
| Carbon dioxide tank | various distributors | N/A | For anethesizing D. melanogaster strains |
| Click-iT EdU 594 Kit | Thermofisher | C10339 | For EdU assay |
| Coverslips | Thermofisher | 3406 | For mounting |
| DAPI | Sigma | D9542-10MG | For immuostaining |
| Dissecting Plates (use Sylgard 184 Sil Elastic Kit) | Ellsworth Adhesives | 184SIL | For creating plates to dissect in. Mix epoxy as directed, let dry overnight |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A21206 | For secondary immuostaining |
| Donkey anti-Rabbit IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A10042 | For secondary immuostaining |
| Drosophila tubing and fittings | Genesee Scientific | 59-124C, 59-123, 59-140 | For anethesizing D. melanogaster strains |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | For dissecting |
| epi-Gal4 | Bloomington Drosophila Stock Center (b) | b38793 | Losick et al. Current Biology, 2013 |
| epi-Gal4, UAS-mCD8.RFP | Bloomington Drosophila Stock Center (b) | b38793, b27392 | Losick et al. Current Biology, 2013 |
| Excel | Microsoft | For performing ploidy calculations | |
| Fiji/ImageJ (image analysis software) | NIH | https://imagej.nih.gov/ij | For image analysis |
| Fly food | Archon Scientific | N/A | Corn Syrup/Soy food |
| Flystuff Flypad | Genesee Scientific | 59-114 | For anethesizing D. melanogaster strains |
| Glass dissecting dish | Fisher Scientific | 13-748B | For performing dissections in |
| Glass slides | Fisher Scientific | 12-518-104C | For mounting |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 488 conjugate | Thermofisher | A11001 | For secondary immuostaining |
| Goat anti-Mouse IgG (H+L) Secondary Antibody, Alexa Fluor 568 conjugate | Thermofisher | A11031 | For secondary immuostaining |
| Grace's Insect Medium, unsupplemented | Thermofisher | 11595030 | For dissecting in |
| Insect pins | Fine Science Tools | 26002-10 | For wounding and pinning fly abdomens flat |
| Mouse anti-Fasciclin III (Drosophila) Primary Antibody | Developmental Studies Hybridoma Bank | 7G10 | For immunostaining epithelial cell-cell junctions |
| Mouting media | Vector Laboratories | H-1000 | Anti-fade mounting media to prevent photo bleaching during imaging |
| Nail polish | Electron Microscopy Sciences | 72180 | For sealing slides |
| Ortibal shaker | Fisher Scientific | 02-217-988 | For immuostaining |
| Phosphate Buffered Saline, PH 7.4 | Sigma | P3813-10PAK | For staining |
| Pin holders | Fine Science Tools | 91606-07 | For wounding |
| Rabbit anti-Grainyhead Primary Antibody | N/A | N/A | For immunostaining epithelial nuclei. Protocol to make antibody can be found (Ref. #4 and 8) |
| Rabbit anti-RFP Primary Antibody | MBL | PM005 | For immunostaining mCD8-RFP fly epithelium |
| Stereomicroscope | Olympus | SZ51 | For dissecting and mounting fly tissue |
| Triton X-100 | Sigma | 10789704001 | For immuostaining |
| UAS-E2F RNAi, UAS-RacDN | VDRC (v) and Bloomington Drosophila Stock Center (b) | v108837, b6292 | Losick et al. Current Biology, 2013 |
| UAS-fzr RNAi, UAS-Stg | VDRC (v) and Bloomington Drosophila Stock Center (b) | v25550, b56562 | Grendler et al. Development, 2019 |
| UAS-Myc | Bloomington Drosophila Stock Center (b) | b9674 | Grendler et al. Development, 2019 |
| UAS-myc RNAi | Bloomington Drosophila Stock Center (b) | b36123 | Grendler et al. Development, 2019 |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | For dissecting |
参考文献
- Abreu-Blanco, M. T., Verboon, J. M., Liu, R., Watts, J. J., Parkhurst, S. M. Drosophila embryos close epithelial wounds using a combination of cellular protrusions and an actomyosin purse string. Journal of Cell Science. 125 (Pt 24), 5984-5997 (2012).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Galko, M. J., Krasnow, M. A. Cellular and genetic analysis of wound healing in Drosophila larvae. PLoS Biology. 2 (8), E239(2004).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and cell fusion contribute to wound healing in the adult Drosophila epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Wang, Y., et al. Integrin Adhesions Suppress Syncytium Formation in the Drosophila Larval Epidermis. Current Biology. 25 (17), 2215-2227 (2015).
- Ramos-Lewis, W., LaFever, K. S., Page-McCaw, A. A scar-like lesion is apparent in basement membrane after wound repair in vivo. Matrix Biology. 74, 101-120 (2018).
- Lee, C. W., Kwon, Y. C., Lee, Y., Park, M. Y., Choe, K. M. cdc37 is essential for JNK pathway activation and wound closure in Drosophila. Molecular Biology of the Cell. 30 (21), 2651-2658 (2019).
- Losick, V. P., Jun, A. S., Spradling, A. C. Wound-Induced Polyploidization: Regulation by Hippo and JNK Signaling and Conservation in Mammals. PLoS One. 11 (3), e0151251(2016).
- Tamori, Y., Deng, W. M. Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Developmental Cell. 25 (4), 350-363 (2013).
- Xiang, J., et al. EGFR-dependent TOR-independent endocycles support Drosophila gut epithelial regeneration. Nature Communications. 8, 15125(2017).
- Cohen, E., Allen, S. R., Sawyer, J. K., Fox, D. T. Fizzy-Related dictates A cell cycle switch during organ repair and tissue growth responses in the Drosophila hindgut. Elife. 7, e38327(2018).
- Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. Solving the Polyploid Mystery in Health and Disease. Trends in genetics: TIG. 35 (1), 6-14 (2019).
- Cao, J., et al. Tension Creates an Endoreplication Wavefront that Leads Regeneration of Epicardial Tissue. Developmental Cell. 42 (6), 600-615 (2017).
- Zhang, S., et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver. Developmental Cell. 44 (4), 447-459 (2018).
- Lazzeri, E., et al. Endocycle-related tubular cell hypertrophy and progenitor proliferation recover renal function after acute kidney injury. Nature Communications. 9 (1), 1344(2018).
- Grendler, J., Lowgren, S., Mills, M., Losick, V. P. Wound-induced polyploidization is driven by Myc and supports tissue repair in the presence of DNA damage. Development. 146 (15), 173005(2019).
- Mehrotra, S., Maqbool, S. B., Kolpakas, A., Murnen, K., Calvi, B. R. Endocycling cells do not apoptose in response to DNA rereplication genotoxic stress. Genes & Development. 22 (22), 3158-3171 (2008).
- Patterson, M., et al. Frequency of mononuclear diploid cardiomyocytes underlies natural variation in heart regeneration. Nature Genetics. 49 (9), 1346-1353 (2017).
- Gonzalez-Rosa, J. M., et al. Myocardial Polyploidization Creates a Barrier to Heart Regeneration in Zebrafish. Developmental Cell. 44 (4), 433-446 (2018).
- Webster, M., Witkin, K. L., Cohen-Fix, O. Sizing up the nucleus: nuclear shape, size and nuclear-envelope assembly. Journal of Cell Science. 122 (Pt 10), 1477-1486 (2009).
- Knouse, K. A., Lopez, K. E., Bachofner, M., Amon, A. Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture. Cell. 175 (1), 200-211 (2018).
- Box, A. M., et al. Endocycles support tissue growth and regeneration of the adult Drosophila accessory gland. bioRxiv. , 719013(2019).
- Karim, M. R., Moore, A. W. Morphological analysis of Drosophila larval peripheral sensory neuron dendrites and axons using genetic mosaics. Journal of Visualized Experiments. (57), e3111(2011).
- Dai, W., Montell, D. J. Live Imaging of Border Cell Migration in Drosophila. Methods in Molecular Biology. 1407, 153-168 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。