Method Article
原子力显微镜与红外光谱相结合,作为探测单一细菌化学的工具
摘要
原子力显微镜-红外光谱学(AFM-IR)为细菌研究提供了一个强大的平台,能够实现纳米级分辨率。同时,可以绘制亚细胞变化图(例如,细胞分裂后)以及化学成分的比较研究(例如,耐药性引起的)可以在细菌的单个细胞水平上进行。
摘要
原子力显微镜-红外光谱(AFM-IR)是一种新型的组合技术,能够同时对具有纳米级分辨率的样品的物理特性和化学成分进行表征。通过将 AFM 与红外结合,克服了常规红外空间分辨率的限制,从而实现了 20 100 nm 的分辨率。这为红外线的广泛新应用打开了大门,用于探测小于几微米的样品,而以前通过传统的红外显微镜是无法实现的。AFM-IR 非常适合细菌研究,在单个细胞和细胞内水平上提供光谱和空间信息。全球对健康的关注与对细菌感染的不利预测日益增多,特别是抗菌素耐药性的迅速发展,迫切需要一种能够在单细胞和细胞下进行表型探究的研究工具。AFM-IR 通过对单个细菌的化学成分进行详细描述,为满足这一需求提供了潜力。在这里,我们为单个光谱和映射模式的样品准备和数据采集提供了完整的协议,用于将AFM-IR应用于细菌研究。
引言
细菌是单细胞原生生物,以各种形状和大小发生,通常在几百纳米到微米之间。它们存在于各种生境中,对生命的存在至关重要。在人体内,肠道中大多数细菌是无害的,而且许多细菌实际上是有益的。然而,一些细菌物种是致病性的,并导致一系列传染病。细菌感染可导致败血症和败血症休克的发展:一种危及生命的疾病,由身体对感染的反应2引起。败血症是全球主要的健康威胁,全球流行率高,死亡率高。仅在2017年,全世界就记录了约5000万例败血症病例,其中1100万例导致死亡(约20%)2.此外,由于治疗延迟,病人的存活率下降,以每小时3、4的方式出现。
细菌感染用抗生素治疗。细菌性血液感染 (BSIs) 的潜在后果的严重性,以及快速启动抗菌治疗的明确意义,促使需要立即使用抗生素。然而,由于目前在临床实践中使用的诊断方法(如血液培养)需要相对较长的时间,抗生素的施用往往发生在阳性BSI诊断5之前。这一因素导致抗生素的广泛过度使用,再加上在农业等其他部门过度使用抗生素,对抗微生物药物耐药性(AMR)6、7的发展造成了严重的进化压力。AMR是目前全球最紧迫的健康问题之一,预计到2050年,AMR将成为9号的主要死因。耐药性的发展,加上AMR菌株的传播,正以惊人的速度发生7,8,9,并超过,到目前为止,新抗生素的发现率10。新的耐药表型正在世界各地不断出现,而
致力于了解AMR相关变化的研究往往缓慢,并受到可用方法11的限制。此外,常用的方法,如聚合酶链反应(PCR)和整个基因测序(WGS),只关注基因型的变化。这些都不足以揭示耐药性11的机制,促使迫切需要一个研究工具,使了解细菌的化学成分。
红外光谱学 (IR) 提供了样品的分子特征,因此是表型细菌探测的有希望的候选者。自12日早期应用以来,文献13、14中就证明了其使用的巨大例子。其中包括15属、16型和17、18级细菌的表型基鉴定。然而,由于波长衍射空间分辨率限制为19,常规红外空间分辨率限制在几微米以内。由于大多数细菌的大小低于这一限制(例如,金黄色葡萄球菌的直径≈400纳米),传统的红外线不适用于单细胞或细胞内水平的探测。
最近,通过将红外光谱与原子力显微镜(AFM-IR)相结合,克服了空间分辨率限制。在这种情况下,通过材料19、20、21、22的热膨胀间接检测到红外吸收。简言之,红外辐射的吸收会导致局部温度升高。这可以直接测量23或通过测量振荡的AFM悬臂探头,由力脉冲产生的红外吸收20,21。组合式AFM-IR技术能够达到接近20纳米的空间分辨率,同时提供有关样品(AFM)及其化学成分(AFM-IR)的局部物理特性的信息。可以从选定点收集两个单光谱,并绘制所选区域内选定波数值强度的映射。
考虑到AFM-IR的可实现空间分辨率,该技术显然为单个细菌细胞及其细胞内成分24的化学/表型探查开辟了可能性。迄今为止,在文献19、20、21、22、25、26、27、28中展示了AFM-IR对单一细菌的应用。这些涉及单光谱分析19,21,22和映射在亚细胞水平19,22,25,26,27,28。例如,描述了在单个细菌中检测细胞内脂质囊泡27和病毒28的能力。这些结果表明AFM-IR对单一细菌和临床相关病原体的纳米级研究有用。
因此,我们提出了多层、单层和单细胞细菌样本的AFM-IR数据的样品制备和收集方法。本协议用于研究不同种类的细菌22及其化学成分的变化。特别是,在S.Aureus19的临床对中,对万古霉素耐药性和非易感性达霉素的体内发育进行了研究。在诊所使用和引入这些抗生素之后,最近出现了万科霉素间歇性耐药性和非易感性达霉素,这构成了一个严重的医疗问题。此外,特别是达霉素不易感的机制仍然难以捉摸,阻碍替代药物的发展19,29。所提交的协议侧重于提供单个细菌的可靠AFM-IR光谱,根据实验目标,可以使用各种化学方法进一步分析。它还包括适用于细胞内研究的映射方法。
研究方案
所有有关致病菌的工作,都应采取适当的安全措施。这些措施包括在具有足够生物安全水平的实验室和生物安全舱(PC2)中工作,以及用适当的消毒剂(例如 80% 乙醇溶液)小心地净化工作区域。必须一直佩戴适当的 PPE。
1. 制备溶剂和材料
- 溶剂:使用超纯水作为溶剂。使用纯净水,在实验前自动清除,以避免任何潜在的交叉污染。
- 基板:使用这些基板中的任何一个用于AFM-IR,例如,ZnSe,CaF2,BaF2等。由于AFM-IR原则上是一种无损技术,人们可以将各种其他研究工具应用于AFM-IR分析后的同一样本。例如,如果使用拉曼级 CaF 2 或BaF 2幻灯片,可以执行结果与拉曼光谱学的相关性。
- 使用玻璃瓶代替塑料管,因为塑料会污染样品。
2. 自动对焦场的样品准备
- 样品的生长/孵化
- 在液体介质或固体板上生长细菌。根据所调查细菌物种的具体要求,选择介质、生长条件(例如温度、氧气供应)和生长时间的类型。例如,对于 S. Aureus 心脏输液 (HI) 丙酸酯板,在有氧条件下生长 16 小时,在 37 °C 下生长。
注:为了达到最佳效果,生长/孵化应产生足够的细菌,以便收集微颗粒样品。菌落形成单位或细菌细胞的具体数量取决于细菌的类型和大小。
- 在液体介质或固体板上生长细菌。根据所调查细菌物种的具体要求,选择介质、生长条件(例如温度、氧气供应)和生长时间的类型。例如,对于 S. Aureus 心脏输液 (HI) 丙酸酯板,在有氧条件下生长 16 小时,在 37 °C 下生长。
- 示例沉积
- 使用无菌循环,小心地从阿加板上的菌落中收集细菌,并将其转移到玻璃管中。只从殖民地顶部收集细菌。如果使用移液器从液体培养体收集样品,则将大约 1 毫升的细菌悬浮液转移到玻璃管中。体积可以根据细菌负荷进行修改。
注:重要的是尽量不要从殖民地下面收集(或尽可能减少收集)任何媒介。后续的样品准备步骤旨在消除任何潜在的媒体残留物。从一开始就最大限度地减少潜在的中等残留物,从而能够从纯化细菌细胞中获取数据。步骤 2.2.2 和 2.2.3 适用于从 Agar 板中制备的样品。对于从液体介质中制备的样品,移动到步骤 2.2.4。 - 在管子中加入 1 mL 的超纯水。漩涡,直到收集的细菌颗粒不再可见在管子的底部(通常1-2分钟)。
- 通过将预制解决方案与麦克法兰标准之间的视觉比较30来估计使用的解决方案的粗糙浊度,例如麦克法兰标准。如果细菌悬浮物的浊度似乎非常低,则再次使用无菌循环和漩涡从板中加入更多细菌。重复上述步骤,直到解决方案的粗糙浊度与麦克法兰标准 0.5 和 1 相媲美。这通常会产生大量的细菌颗粒。
- 将细菌悬浮在 3,000 x g 下离心 5 分钟,以获得颗粒。
注:离心参数可以修改,以获得细菌颗粒。如果增加 g 力,应谨慎行事,不要诱发细菌的破坏(特别是在革兰阴性细菌的情况下)。 - 使用移液器,轻轻地从颗粒上方取出超纳特。在管子和漩涡中加入 1 mL 的超纯水,以重新悬浮颗粒。随后,像第 2.2.4 步一样对样品进行离心机。
- 重复洗涤过程(步骤 2.2.2 和 2.2.4)至少三次。如果从液体介质中收集初始样品,则至少重复四次程序(介质去除后再进行三次洗涤)。
- 最后洗涤后,取出超高超,加入超纯水和漩涡至少2分钟。随后,将样品的 5 μL 沉积在基板上(例如拉曼级 CaF2)。
- 如果样品所需的厚度是多层细菌,则让样品晾干。
- 如果所需的厚度为单层或单个细菌,在沉积样品(步骤 2.2.7)后立即加入 20 至 100 μL 的超纯水,并轻轻地与移液器尖端混合。留给空气干燥。
注:水的确切体积可能因实验而异,因为它取决于许多因素(例如,生物体的大小、颗粒的密度等),因此,最好从经验上确定。准备一系列添加不同量超纯水的样品,使人们能够选择具有所需细菌厚度/密度的样品。在随后的阶段,细菌的厚度/密度可以通过AFM轻松可视化。单层和单细胞样本的AFM图像示例显示在 图1A-H中。 - 使用双面胶带将基板安装在 AFM 金属标本盘上。
- 使用无菌循环,小心地从阿加板上的菌落中收集细菌,并将其转移到玻璃管中。只从殖民地顶部收集细菌。如果使用移液器从液体培养体收集样品,则将大约 1 毫升的细菌悬浮液转移到玻璃管中。体积可以根据细菌负荷进行修改。
3. 仪器准备
注:此处描述的工具程序用于 材料表中列出的工具。如果使用 AFM-IR 仪器的新模型,详细工具程序可能与此处描述的程序略有不同。
- 按下 初始化 按钮,打开并初始化仪器。确保激光快门处于激光测试的 开放 位置。
- 如果设置了清除系统,则通过打开 N2 的流量清除 N2仪器。调整氮净化,以达到稳定的湿度水平(例如,20%)。确保湿度在测量期间以及背景和样本数据收集之间不波动。建议允许大约 20 分钟的湿度水平稳定。
- 按下负 载 按钮将样品加载到样品室中。样品加载是通过软件向导进行的。操作软件向导时,首先关注尖端,使用箭头在 Z 方向移动显微镜阶段并单击 Next。其次,调整数据收集点,使用箭头引导机内运动,并使用自动对冲M头顶上的旋钮对齐自动对焦激光和自动对焦传感器。随后,通过在 Z 方向移动显微镜阶段来聚焦样品表面。
注:软件手册31提供了样品加载每个步骤的详细插图。应谨慎地对样本进行重点调查。当以 Z 方向接近样品表面时,使用慢速电机速度。 - 通过单击 "方法" 按钮即可接近示例,而无需参与。
4. 数据收集
- 背景
- 在数据获取之前,收集背景。对于背景收集,确保激光快门处于 打开 位置。选择光谱范围和分辨率(取决于分析目的)以及扫描次数和背景共同平均数。这些通常被推荐为高(例如,1024 次扫描和 3 次共同平均)。
注:一般来说,建议光谱分辨率为 4 厘米-1或 8 厘米-1,光谱范围为 3,200 厘米-12,800 厘米-1和 1,800 厘米-1900 厘米-1。 - 获取后台保存背景文件。文件不会自动存储。将激光快门位置更改为 关闭。
- 在数据获取之前,收集背景。对于背景收集,确保激光快门处于 打开 位置。选择光谱范围和分辨率(取决于分析目的)以及扫描次数和背景共同平均数。这些通常被推荐为高(例如,1024 次扫描和 3 次共同平均)。
- 样品 - 单光谱
- 按 "参与" 按钮以进行示例。系统将开始接近样品表面,直到检测到直接接触。
注:此工作中使用的设定点范围介于 0.15/2 V 之间,反馈增益(I Gain 和 P 增益)通常设置为 3 和 10。NIR2 接触探头常用纳米IR2 系统(型号:PR-EX-nIR2-10,共振频率 (kHz):13 +/+4 kHz,弹簧常数(N/m):0.07×0.4 Nm-1)。 - 收集自动对焦图像以可视化表面。首先,扫描空间分辨率较低的较大区域(例如 50 x 50 μm)(例如 200 x 200 点)(图 1I)。
注:AFM-IR 数据始终以接触模式收集,但是,AFM 数据可以在接触或攻丝模式下收集。 - 从自动对焦高度/偏转图像中,选择特定的兴趣区域,并以更高的空间分辨率重新映像(图 1J+K)。确保数据收集速度适当,提示移动缓慢(例如,扫描速率 0.2 0.4 Hz)。
- 选择测量点(例如单一细菌),并将尖端移到该点。
- 对齐红外激光器。为此,请使用样本吸收的波数。对于生物材料,这可能是,例如,在一(1655厘米-1)。确保 带通过滤器 关闭,并单击 启动红外。纳米IR仪表中的右图(以振幅与频率显示的偏转的 FFT)应至少显示一个清晰的峰值,左图(偏转与时间)应具有周期性波形。如果情况并非如此,则继续优化红外点。
注:即使快速四变换 (FFT) 和偏转显示预期配置文件,也建议对红外点进行至少几个波数的优化,其中波段是预期的。 - 使用选定的波数值优化红外数据收集的热点。使用细菌的传统红外光谱(例如细菌颗粒的 ATR 频谱)来识别菌带的位置并使用它们优化热点是有帮助的。从不同的光谱区域选择不同的波数值(例如 8/10)。
注:如果在AFM-IR数据收集之前无法收集感兴趣的传统红外细菌谱,文献中可用的细菌光谱可以用作粗略指导。优化红外点的结果是图像,该图像在每个 x 和 y 位置显示 FFT 震级信号的地图。具有最大信号的位置会自动选择。软件手册31提供了此类图像的示例。 - 在优化选定波数值的红外点后,定义光谱数据收集的参数:光谱区域、光谱分辨率、扫描次数和应用功率,并将这些参数输入软件中的相应窗口。光谱分辨率应与背景分辨率相匹配,光谱区域应位于收集背景的光谱区域内。
注:一般初始参数集可能是:光谱范围:3200厘米-12800厘米-1 和1800厘米-1-900厘米-1,光谱分辨率:4厘米-1 或8厘米-1,扫描次数:512 2048。 - 如果需要,根据信号调整激光功率。一般来说,激光功率的 8%到 10% 之间的值应该足以满足良好的信号质量。较高的值可以谨慎使用,因为它们可能导致样品损坏。
注意:激光功率百分比可能因红外激光的类型而异。此处给出的百分比值用于 OPO 激光。 - 点击 获取 收集AFM-IR频谱。
- 收集AFM-IR频谱后,从同一区域重新收集AFM数据。这强烈推荐,因为它将揭示任何潜在的漂移和/或破坏性影响样品。
- 如果AFM-IR频谱令人满意,并且没有观察到对样本的破坏性影响,则继续收集数据。如果需要,使用 Array 选项定义一系列数据收集点,并收集 AFM 高度或偏转图像。此选项允许从每个点连续收集光谱,其光谱参数与单个频谱定义的光谱参数相同。
- 如果收集AFM-IR频谱后收集的AFM图像显示对样品(通常是燃烧点)的破坏性影响,则降低功率:选择不同的位置并重复步骤 4.3.8 至 4.3.11。
- 如果 AFM-红外频谱中的信号不尽如人意,请检查红外点优化的正确性(步骤 4.3.6)。如果正确,则稍微增加激光功率并重复步骤 4.3.7e 4.3.11。在实现满意的信号之前,可以重复此情况。
- 按 "参与" 按钮以进行示例。系统将开始接近样品表面,直到检测到直接接触。
- 样品和成像方法
注:强烈建议在收集选定波数值的强度分布图像之前记录细菌的单个AFM-IR光谱。- 记录所选样本区域的 AFM 图像。为此,首先收集空间分辨率较低的较大区域的 AFM 图像(例如,50 x 50 μm,200 x 200 点),然后选择感兴趣的区域,并收集空间分辨率增加的 AFM 图像( 如图 1I×K所示)。
- 选择 AFM-IR 成像的波数值。
- 确保激光的红外点针对选定的波数值(步骤 4.3.6)进行优化。如果某些波数(没有明确的最大值)未优化红外点,则针对它们进行优化。
- 定义图像区域的参数:宽度和高度、X 方向和 Y 方向的数据点数。
注:如果应用了以前AFM图像中连续选择的斑点(如 图1-I-K所示),宽度和高度字段将在标记区域后自动填满。 - 定义光谱信号采集的参数:波长、扫描次数和激光功率。
注:扫描次数需要保持在合理范围内。64 或 32 次扫描通常允许足够的信号量。 - 通过单击 扫描速率来定义 AFM 尖端运动的参数。前一步的扫描次数和 X 方向的数据点数越高,提示移动所需的速度就越慢。这些参数之间缺乏调整将导致尖端移动过快,从而阻止从每个点实际获取定义的扫描次数。
注:例如,对于具有 64 个共同添加点和 200 点的红外信号的适当集合,将扫描速率设置为 0.07 kHz。 - 确保 启用红外成像 盒被勾选。
- 开始成像。所选波数信号强度的 AFM-IR 将与来自该区域的 AFM 数据同时收集。
注:使用 OPO 激光时,可以同时收集接触谐振峰值频率图像。这可用于获取有关不同位置样品相对刚度的信息。 - 使用 捕获序列 窗口设置来自相同区域的连续收集的 AFM-IR 数据,这些数据具有相同的参数,但用于不同的波数值。为此,打开 捕获序列 窗口,键入每个波数,并定义应用激光功率(针对每个波数)。
- 将收集的数据(AFM 和 AFM-IR、单光谱和成像)导出到各种格式中,并使用适合特定研究目的的方法进行分析。
结果
根据样品的初始浓度和添加的水量,上述协议能够在基板上获得一系列类型的细菌细胞分布。 图1 说明了使用来自Gram阳性(S.aureus)和革兰阴性(大肠杆菌)细菌的描述协议从单层和单细胞样本中记录的AFM图像(高度和偏转)的例子。
此处描述的协议可用于单个细菌的细胞内和细胞外结构的 AFM-IR 成像。图2显示了此应用程序的示例,它显示了监测S. aureus细胞分裂期间发生空间局部化学变化的结果。虽然空气干燥通常被认为是细菌制备的固定方法,但细菌在自然界中表现出对温度等外部因素的极高抵抗力,并据报在脱水32中存活下来。这里介绍的结果是从风干样品中获得的。通过连续收集同一区域的12张图像(收集一张图像≈20分钟),通过AFM成像(图2A D+)观察和监测细胞分裂之前形成的隔膜。图 2A/D显示 4 个选定的 AFM 图像,每个图像的收集时间约为 40 分钟。形成的结构(隔膜)是45纳米高。形成的隔膜在AFM高度和偏转图像中清晰可见(图2E F)。从细胞和隔膜区域(图2G,图2F中标记的原点)记录的AFM-IR光谱在比较前被标准化为中间I波段,以最大限度地减少数据收集点之间不同样本厚度的影响。隔膜的AFM-IR光谱的特点是带的相对强度较高,为1240和1090厘米-1,而AFM-IR频谱从细胞区收集。这些归因于碳水化合物和磷酸酯组的细胞壁组件(包括,例如,多肽和硫酸)22。
所述协议还可用于比较多个不同样本之间的单个光谱。此应用程序的示例以及结果显示在 图 3 和 图 4中。这项研究的目的是确定在 S.Aureus(VISA) 中万古霉素间歇性耐药性体内发生化学变化。为此,从患者身上采集了临床对样本,在入院时和抗生素治疗前分离出父菌株(万科霉素易感 性S.Aureus,VSSA),以及入院抗生素和临床失败后与同一患者分离的女儿菌株。样品在阿加介质上进一步生长,并根据协议(图3A-B)准备。从多个单一细菌(和多个样本)中收集了VSSA和VISA的AFM-IR光谱,随后使用几种化学方法(图3C)进行分析。
VSSA和VISA细胞之间没有观察到形态差异(图4A-C)。然而,AFM-IR光谱(图4D,F)及其第二个衍生物(图4E,G)表明耐药菌株和易感菌株之间的化学成分存在明显差异。与易感的对应菌株相比,细胞壁组件(特别是1088厘米-1)中与碳水化合物和磷酸酯组相关的带状的相对强度明显增加。值得注意的是,所有重新编码的光谱(VISA:81,VSSA:88)都显示出一个小的标准偏差。这表明从同一菌株中制备的各种样本中记录的数据可很好地重复,因为从同一菌株的不同样本中记录的光谱之间不可能有区别。观察到的差异表明,与其他文献报告33,34的相对应物相比,耐药菌株的细胞壁厚度增加。

图1:用于AFM-IR测量的各种细菌样本的代表性AFM图像。根据基板的稀释,协议允许人们获得细菌的多层和单层以及单细胞样品。代表AFM图像:(A*D)单层和(E-H)单细胞样本(A、B、E、F)革兰阳性(S.动脉)和(C,D,G,H)革兰阴性(大肠杆菌)细菌。(A,C,E,G)显示高度图像和(B,D,F,H)显示相应的偏转图像。成像区域的大小:(A-D、G、H) 20 x 20 μm,(E,F ) 50 x 50 μm.(I×K) 连续选择用于AFM-IR映射的区域。这是使用AFM成像实现的,在单个S.Aureus细胞示例中空间分辨率增加。通过采样 200 x 200 点收集每幅图像,由于图像区域大小的缩小,空间分辨率增加。成像区域大小:(I) 40 x 40 μm,(J ) 20 x 20 μm 和(K) 2.24 x 2.24 μm。(I)中的黑色正方形标记了在(J)中映像的区域。(J)中的黑色正方形标记了在(K)中映像的区域。请单击此处查看此图的较大版本。
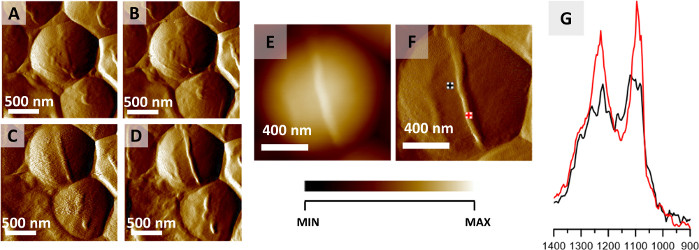
图2:通过AFM-IR监测S.尿素细胞分裂。(A-D) AM图像的S.aureus细胞显示形成隔膜前细胞分裂。成像面积大小:2 x 2 μm。这些图像是从更大的系列中选择的(每20分钟记录12张图像),代表每40分钟记录的数据。成像面积大小 1.17 x 1.15 μm。新形成的结构的高度为45纳米。(G) 从细胞区(黑色)和隔膜区(红色)(标记在(F))记录的AFM-IR光谱,范围为1400-900厘米-1。两个光谱都正常化到中间体I带,并显示隔膜细胞壁组件的相对强度增加。这个数字已经从K.科昌等人修改了22。请单击此处查看此图的较大版本。
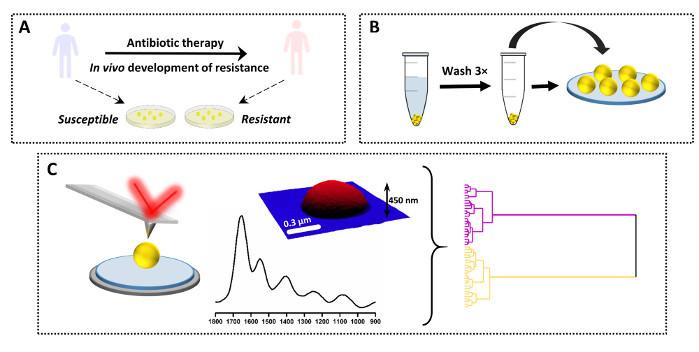
图3:抗菌素耐药性AFM-IR研究实验设计概述。(A) 样本来源和初步准备:易感父母菌株在抗生素治疗前从患者身上收集,女儿耐药菌株在抗生素治疗和临床失败(体内耐药性发展)后从同一患者处获得。细菌在37°C下在心脏输液(HI)agar上被分离并培养16小时。(B) 随后为AFM-IR制备样品,包括收集样品,然后清洗细菌托盘(3×)和样品沉积。(C) AFM-IR 数据收集和分析:AFM 高度和 AFM-红外频谱 (18000 900 厘米-1)。AFM 成像区域的大小:1.7 x 1.4 μm。AFM-IR光谱是从细胞中间收集的。随后使用化学方法(包括分层聚类分析)对数据进行了分析。这个数字已经从K.科昌等人修改为19。请单击此处查看此图的较大版本。
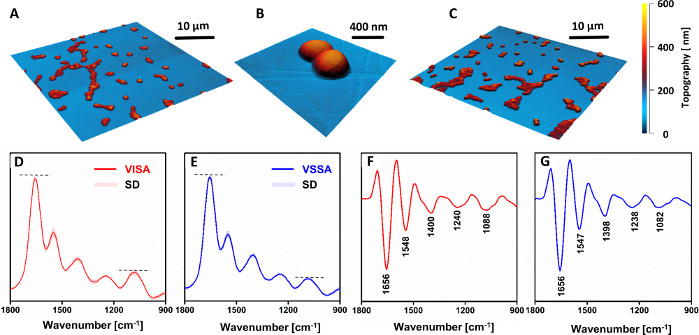
图4:与临床对中易感S.尿素(VSSA)相比,对万古霉素中间S.Aureus(VISA)化学变化的研究结果为AFM和AFM-IR。AFM图像(A-B) VISA 和(C) VSSA 单细胞样本。成像区域的大小:(A,C)40 x 40 μm,(B) 2.56 x 2.45 μm.(D×E) 平均AFM-IR光谱及其(F×G) 第二衍生物为:(D、F) VISA 和(E,G) VSSA 细胞,光谱范围为 1800×900 厘米-1。所呈现的光谱平均为 81 (VISA) 和 88 (VSSA) 单个光谱,并与标准偏差 (SD) 一起呈现。平均值是在所有单个光谱正常化后进行的。主要频段标记为(F 1G)。这个数字已经从K.科昌等人修改为19。请单击此处查看此图的较大版本。

图5:在 S.Aureus 单元的选定波数值下连续注册AFM-IR地图的图像漂移。(上行): AFM 图像与相应的 (下排) AFM-IR 地图同时记录,基于选定波数值的红外信号强度。波数值(966、1055、1079、1106、1234、1398、1454、1540、1656、1740 厘米-1)在下行上方注释。每组(AFM 图像和 AFM-IR 地图)都直接记录在上一张图像之后(每组大约 40 分钟)。成像/映射区域的大小:1.54 x 1.57 μm。图像之间可见清晰的漂移。 请单击此处查看此图的较大版本。
讨论
红外光谱学在各种生物样品的化学成分中对它们进行定性是有用的,这一点是众所周知的。在过去的十年里,红外光谱学已经成为细菌研究的一个有前途的工具,12,13,14,15,16,17。它继续吸引微生物学领域的大量兴趣,是通过化学成分实现表型特征的少数技术之一。在这方面,传统FTIR显微镜的主要缺点在于空间分辨率有限,无法对细菌进行单细胞和亚细胞研究。事实上,小尺寸的细菌不仅对红外,而且对绝大多数技术都构成障碍。因此,可用于单细胞和亚细胞细菌研究的研究工具明显有限。AFM与红外线的结合,克服了红外光谱的空间分辨率限制,为细菌研究提供了一种新工具,能够对化学成分进行纳米级探测。
该技术不限于单个细胞研究,并允许一个人探测各种样品,厚度不等。毫无疑问,干净和仔细的样品准备对于实现高质量的图像至关重要。本协议提供了一种方法来准备各种细菌的多层、单层和/或单细胞样本(图1)。制备样品取决于几个因素,包括初始细菌负荷、洗涤后稀释以及基板上的进一步稀释。稀释洗过的颗粒后和基板沉积之前获得的样品量通常允许准备大量样品。因此,为了获得基板上样品的预期分布,准备一系列样品通常有益,其稀释范围很广。对于旨在收集AFM-IR光谱而不是亚细胞成像的研究,修改样本量(例如,从单层到多层)可能有助于增加信号的强度。
样品制备的另一个关键方面是适当去除中等残留物。根据选定的样品培养方法,样品是从液体介质或琼脂板中收集的。在这两种情况下,中等残留物都可能存在于样本中,尽管从阿加板收集后,其程度要小得多。由于细菌生长介质含有丰富的各种生物成分,因此确保适当去除介质至关重要。我们建议用超纯水清洗三次,用于加糖板样品,至少四次用超纯水清洗从中等温度收集的样品。如果需要,可以增加洗涤次数:但是,对于各种样本之间的比较,保持样本之间的一致性非常重要。演示的协议使用水,而不是溶剂,如磷酸盐缓冲液(PBS)或盐水。PBS 和盐水在空气干燥时都会导致晶体的形成,从而损害细菌。此外,两者都是强烈的红外波段的来源,特别是PBS,在指纹区域包含多个频段。缺乏盐水或PBS的使用能力,目前是该技术的一个重要限制。通常,用水洗涤不会对细菌造成任何破坏性影响:但是,应小心谨慎,如果可能,应限制接触水的时间。如果样品制备协议需要在洗涤阶段暂停,建议在取出水后将样品以颗粒化形式保留。这对革兰氏阴性细菌特别重要,因为含有更薄的细胞壁更容易破裂。
为了确保适当和高质量的AFM-IR数据,数据收集协议中的几个方面至关重要。首先,正确收集背景对于数据获取至关重要。特别是,在整个背景收集以及背景和样本收集之间保持稳定的湿度水平是必要的。为了确保这一点,我们建议用氮清除仪器,并保持湿度水平不高于25%。缺乏清除可能会造成重大限制,尤其是在湿度高的地方。第二,应强调适当优化红外点的重要性。为了获得最佳效果,对波段最大位置的先验知识可能是有益的。例如,传统的红外菌丸谱可用于确定从样品中预期的带的位置。如果无法获得,作为替代方法,用户可以利用文献中可用的红外光谱,或使用细菌中合理的带位(例如,在 I 和中化物 II 中预期的波段位置)开始优化。第三,对于数据收集,必须强调仔细选择电源(允许实现良好的S/N比率)的重要性,因为它可能具有破坏性影响。建议的功率取决于样品的厚度,仪器手册31中提供了粗略的指导。我们建议通过收集 AFM 图像来实证测试样品测量后的状态,因为它将揭示任何破坏性影响。此外,在收集AFM-IR光谱之前和之后从同一区域收集AFM图像,很好地证实了没有发生漂移,光谱确实来自细胞中的选定点。在应用成像模式时,通过在选定波数值下连续成像红外强度,漂移的可能性尤为重要。 图5就说明了这一点。成像区域在实验开始时定义,旨在对所有波数值保持一致。但是,每个 AFM 高度(和相应的红外波数强度)图像之间可见清晰的漂移,每张地图的获取时间约为 40 分钟。因此,对于收集成像数据的用户,我们建议始终选择一个略大于兴趣样本的区域,以确保即使在存在漂移时,兴趣样本也会保留在图像区域内。
该协议的潜在局限性包括缺乏在上述生理解决方案(如盐水或 PBS)中水合状态收集数据的能力。此外,特别是在高湿度地区,往往需要氮清除。此外,该协议还能够探测体积小至100纳米的生物体,但排除了将其用于较小结构的可能性。虽然这可以用不同的激光(例如量子级联激光器,允许达到20纳米的空间分辨率)来克服,但它也与有限的光谱范围以及难以获得良好的信号与噪声比有关。最后,对软表面的探测可能会带来挑战,因为尖端无法正确检测表面并超出接触点,直到断裂。虽然这通常不是细菌样品的问题,但它可能发生在较软的样品的测量中。在这种情况下,建议尝试在靠近样品的基板的清洁表面进行接触。
所述协议可用于多种类型的细菌研究,包括各种样品之间的比较研究以及亚细胞检查。根据研究目的,可以使用单光谱和成像方式35的化学方法分析数据。此外,协议还可以通过添加固定物修改以应用于其他生物材料(如真菌、酵母、细胞等)。
披露声明
我们要感谢布鲁克支付出版费。KK、BRW、AP 和 PH 是国际专利(PCTIB2020/052339)的发明者,该专利描述了该方法的一些基本方面。
致谢
我们要感谢布鲁克的支持。这项工作得到了莫纳什大学促进妇女成功赠款(K.科昌)的支持。A.Y.P 感谢澳大利亚国家健康和医学研究理事会从业者研究金 (APP1117940) 的支持。这项工作由澳大利亚研究理事会发现项目DP180103484资助。我们要感谢芬莱·尚克斯先生给予的帮助和泽尼亚·科斯托利亚斯女士对样品的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| AFM metal specimen disc | PST ProSciTech Pty Ltd | GA530-15 | Recommended 15 mm |
| Anasys AFM-IR nanoIR2 | Anaysys Instruments | model: nanoIR2 | |
| Contact mode NIR2 Probes for nanoIR 2 | Bruker / Anasys Instruments | - | Model: Model: PR-EX-NIR2 |
| Heraeus Pico 17 Microcentrifuge | Thermo Scientific | - | - |
| Matlab | Mathworks Inc | - | Multivariate data analysis software |
| Micro-centrifuge tubes, 1.5 mL | Heathrow Scientific | HEA4323 | Can be replaced with any other micro-centrifuge tube |
| NanoIR 2 instrument | Bruker / Anasys Instruments | - | - |
| PLS toolbox | Mathworks Inc | - | GUI for Matlab |
| Selected bacterial medium (e.g. HBA Columbia Plates) | Thermo Fisher | PP2001 | Provided type of medium is an example and can be replaced by others, depending on the type of experiment |
| Selected bacterial strain | - | - | The source depends on the aim of research (patient isolates, ATCC strains, etc.) |
| Substrate (e.g. Raman grade CaF2) | Crystran | CAFP13-2R | Recommended size: 13 mm Ø x 2.0 mm |
| Tip pipette 1000 µl | Axygen | T-1000-B | - |
| Tip pipette 200 µl | Axygen | T-200-C | - |
| Tip pipette 0.5-10 µl | Axygen | T-300-R | - |
| Ultrapure water | - | - | - |
参考文献
- Sears, C. L. A dynamic partnership: celebrating our gut flora. Anaerobe. 11 (5), 247-251 (2005).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), London, England. 200-211 (2020).
- Seymour, C. W., et al. Time to treatment and mortality during mandated emergency care for sepsis. The New England Journal of Medicine. 376 (23), 2235-2244 (2017).
- Weiss, S. L., et al. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Critical Care Medicine. 42 (11), 2409-2417 (2014).
- Peker, N., Couto, N., Sinha, B., Rossen, J. W. Diagnosis of bloodstream infections from positive blood cultures and directly from blood samples: recent developments in molecular approaches. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. 24 (9), 944-955 (2018).
- Aminov, R. I. The role of antibiotics and antibiotic resistance in nature. Environmental Microbiology. 11 (12), 2970-2988 (2009).
- Levy, S. B., Marshall, B. Antibacterial resistance worldwide: causes, challenges and responses. Nature Medicine. 10 (12), Suppl 122-129 (2004).
- Roca, I., et al. The global threat of antimicrobial resistance: science for intervention. New Microbes and New Infections. 6, 22-29 (2015).
- O'Neill, J. The review on antimicrobial resistance. Tackling drug-resistant infections globally: final report and recommendations. Wellcome Trust. , (2016).
- Perry, J. A., Westman, E. L., Wright, G. D. The antibiotic resistome: what's new. Current Opinion in Microbiology. 21, 45-50 (2014).
- Piddock, L. J. Assess drug-resistance phenotypes, not just genotypes. Nature Microbiology. 1 (8), 16120(2016).
- Naumann, D., Helm, D., Labischinski, H. Microbiological characterizations by FT-IR spectroscopy. Nature. 351 (6321), 81-82 (1991).
- Zarnowiec, P., Lechowicz, L., Czerwonka, G., Kaca, W. Fourier Transform Infrared Spectroscopy (FTIR) as a tool for the identification and differentiation of pathogenic bacteria. Current Medicinal Chemistry. 22 (14), 1710-1718 (2015).
- Quintelas, C., Ferreira, E. C., Lopes, J. A., Sousa, C. An overview of the evolution of infrared spectroscopy applied to bacterial typing. Biotechnology Journal. 13 (1), 1700449(2018).
- San-Blas, E., Cubillán, N., Guerra, M., Portillo, E., Esteves, I. Characterization of xenorhabdus and photorhabdus bacteria by Fourier transform mid-infrared spectroscopy with attenuated total reflection (FT-IR/ATR). Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy. 93, 58-62 (2012).
- Sousa, C., et al. Discrimination of the acinetobacter calcoaceticus-acinetobacter baumannii complex species by Fourier transform infrared spectroscopy. European Journal of Clinical Microbiology & Infectious Diseases. 33 (8), 1345-1353 (2014).
- Rodriguez-Saona, L. E., Khambaty, F. M., Fry, F. S., Calvey, E. M. Rapid detection and identification of bacterial strains by Fourier transform near-infrared spectroscopy. Journal of Agricultural and Food Chemistry. 49 (2), 574-579 (2001).
- Dawson, S. E., et al. Implementation of Fourier transform infrared spectroscopy for the rapid typing of uropathogenic Escherichia coli. European Journal of Clinical Microbiology & Infectious Diseases. 33 (6), 983-988 (2014).
- Kochan, K., et al. Detection of Antimicrobial Resistance-Related Changes in Biochemical Composition of Staphylococcus aureus by Means of Atomic Force Microscopy-Infrared Spectroscopy. Analytical Chemistry. 91 (24), 15397-15403 (2019).
- Dazzi, A., Prater, C. B. AFM-IR: Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging. Chemical Reviews. 117 (7), 5146-5173 (2017).
- Dazzi, A., et al. AFM-IR: combining atomic force microscopy and infrared spectroscopy for nanoscale chemical characterization. Applied Spectroscopy. 66 (12), 1365-1384 (2012).
- Kochan, K., et al. et al. In vivo atomic force microscopy-infrared spectroscopy of bacteria. Journal of the Royal Society, Interface. 15 (140), (2018).
- Katzenmeyer, A. M., et al. Mid-infrared spectroscopy beyond the diffraction limit via direct measurement of the photothermal effect. Nanoscale. 7 (42), 17637-17641 (2015).
- Bruker Life Science Applications. , Available from: https://www.bruker.com/products/surface-and-dimensional-analysis/nanoscale-infrared-spectrometers/nanoscale-ir-spectroscopy-applications/life-sciences.html (2020).
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J. M., Jaillard, D. In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy. Analyst. 135 (10), 2540-2545 (2010).
- Baldassarre, L., et al. Mapping the amide I absorption in single bacteria and mammalian cells with resonant infrared nanospectroscopy. Nanotechnology. 27 (7), 075101(2016).
- Vitry, P., et al. Combining infrared and mode synthesizing atomic force microscopy: Application to the study of lipid vesicles inside Streptomyces bacteria. Nano Research. 9 (6), 1674-1681 (2016).
- Dazzi, A., et al. Chemical mapping of the distribution of viruses into infected bacteria with a photothermal method. Ultramicroscopy. 108 (7), 635-641 (2008).
- Steenbergen, J. N., Alder, J., Thorne, G. M., Tally, F. P. Daptomycin: a lipopeptide antibiotic for the treatment of serious Gram-positive infections. The Journal of Antimicrobial Chemotherapy. 55 (3), 283-288 (2005).
- Garcia, L. S. MacFarlan Standards. Clinical Microbiology Procedures Handbook, 3rd Edition. , American Society of Microbiology. (2010).
- NanolR-2 System Manual. Anasys Instruments. , Available from: https://www.anasysinstruments.com/downloadpr/nanoIR2_s_System_Manual.pdf (2020).
- Whelan, D. R., et al. Detection of an en masse and reversible B- to A-DNA conformational transition in prokaryotes in response to desiccation. Journal of the Royal Society, Interface. 11 (97), 20140454(2014).
- McGuinness, W. A., Malachowa, N., DeLeo, F. R. Vancomycin Resistance in Staphylococcus aureus. The Yale Journal of Biology and Medicine. 90 (2), 269-281 (2017).
- Howden, B. P., Peleg, A. Y., Stinear, T. P. The evolution of vancomycin intermediate Staphylococcus aureus (VISA) and heterogenous-VISA. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 21, 575-582 (2014).
- Perez-Guaita, D., et al. Multispectral Atomic Force Microscopy-Infrared Nano-Imaging of Malaria Infected Red Blood Cells. Analytical Chemistry. 90 (5), 3140-3148 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。