需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用数字高速睫状视频显微镜进行鼻刷采样和处理 – 适应 COVID-19 大流行
摘要
为了保证PCD诊断的成功和高质量的睫状功能分析,一种精确而仔细的呼吸上皮取样和处理方法至关重要。为了在COVID-19大流行期间继续提供PCD诊断服务,睫状视频显微镜检查方案已更新,以包括适当的感染控制措施。
摘要
原发性纤毛运动障碍(PCD)是一种遗传性活动性纤毛病,可导致严重的耳鼻肺疾病。由于不同诊断方式的挑战,PCD诊断经常被遗漏或延迟。睫状视频显微镜使用PCD诊断工具之一的数字高速视频显微镜(DHSV)被认为是进行睫状功能分析(CFA)的最佳方法,包括睫状搏动频率(CBF)和搏动模式(CBP)分析。然而,DHSV缺乏标准化的、公布的处理和分析样品的操作程序。它还使用活呼吸道上皮,这是 COVID-19 大流行期间的一个重要感染控制问题。为了在这场健康危机期间继续提供诊断服务,睫状视频显微镜检查方案已经过调整,以包括适当的感染控制措施。
在这里,我们描述了纤毛呼吸道样本采样和实验室处理的修订方案,重点介绍了为遵守COVID-19感染控制措施而进行的调整。描述了从16名健康受试者获得的鼻刷样品中CFA的代表性结果,根据该协议进行处理和分析。我们还说明了获得和处理最佳质量上皮纤毛条的重要性,因为不符合质量选择标准的样品现在确实允许CFA,这可能会降低该技术的诊断可靠性和效率。
引言
原发性纤毛运动障碍(PCD)是一种遗传性异质性活动性纤毛病,其中呼吸纤毛静止,缓慢或运动障碍,导致粘液纤毛清除受损和慢性耳窦肺疾病1,2,3,4。PCD的临床表现是婴儿早期开始的慢性湿咳和慢性鼻塞,复发性或慢性上呼吸道和下呼吸道感染导致支气管扩张,以及复发性或慢性中耳炎和鼻窦炎5,6,7。大约一半的PCD患者表现为器官偏侧性缺陷,例如位位逆位或位位模糊。一些患者还由于男性精子不动和女性输卵管不动纤毛而出现不孕问题1,2,8。PCD 很少见,但患病率难以定义,范围为 1:10,000 至 1:20,0009,10。然而,由于诊断困难和缺乏临床怀疑,PCD 的实际患病率被认为更高。PCD的症状与其他急性或慢性呼吸系统疾病的常见呼吸表现相似,确认诊断的诊断挑战是众所周知的,导致治疗和随访不足2,5,9,11。
使用数字高速视频显微镜(DHSV)的睫状视频显微镜是PCD4,8,12,13的诊断工具之一。DHSV被认为是进行睫状功能分析(CFA)的最佳方法,包括睫状搏动频率(CBF)和搏动模式(CBP)分析2,14,15,16。DHSV使用活的呼吸道上皮,通常通过鼻刷获得13。
鉴于当前的COVID-19爆发,PCD诊断的确认现在变得更加重要,因为有证据表明,潜在的呼吸道疾病可能导致COVID-19感染后更糟糕的结果17,18。与一般人群相比,在当前大流行期间安全有效的PCD诊断服务也将使确诊的PCD患者受益于额外的保护措施19。
COVID-19的传播主要通过飞沫传播20。鼻样本20中的高病毒载量表明无症状(或症状轻微)患者的传播可能性很高。此外,如果病毒颗粒被雾化,它们会在空气中停留至少 3 小时21。因此,呼吸系统医护人员在进行临床护理和诊断技术样本采集时会暴露在高病毒载量中22。此外,操纵活体呼吸道样本会使技术人员暴露于 COVID-19 污染中。虽然正在实施针对护理COVID-19患者的呼吸内科医生和耳鼻喉外科医生的最佳实践建议23,但缺乏在COVID-19大流行期间实施DHSV的建议。
为了继续提供PCD诊断服务,同时确保医护人员(进行样本采集)和技术人员(进行样本处理)的安全,必须在COVID-19大流行期间调整睫状视频显微镜方案。睫状视频显微镜技术目前仅限于研究服务和专业诊断中心,因为CFA需要广泛的培训和经验。此外,目前,使用DHSV4,13处理和分析样品缺乏标准化和精确的操作程序。
本文的目的是描述DHSV的标准操作程序,特别是感染控制措施和采样和处理活鼻上皮时的安全性。尽管目前COVID-19爆发,但这将使高质量的PCD诊断和护理得以继续。
研究方案
获得了列日医院-教师伦理委员会和大学卫生与健康保护部的批准。
1.呼吸道纤毛上皮取样
- 在采样前,确保受试者至少 4-6 周没有感染,并且没有鼻腔和吸入药物。
- 制备补充的M199制剂:用抗生素溶液(5mL链霉素/青霉素(5μg/ mL))和抗真菌溶液(5mL两性霉素B(2.5μg/ mL))补充细胞培养基199(M199)(500mL)。
- 准备 2 个(每个鼻孔一个)带盖的 15 mL 锥形管,并用 3 mL 补充的 M199 填充每个管。
- 准备支气管细胞学刷(厚度:2毫米,长度:11毫米)。切断电线的末端,确保刷子长约 15 厘米(图 1A,B)。要在进行鼻刷时握住刷子,请使用Weil-Blakesley鼻钳(图1B)。
- COVID-19 适应: 避免处理 COVID-19 状态未知的活鼻上皮样本,在鼻刷前 48 至 72 小时对患者进行 COVID-19 检测以进行睫状视频显微镜检查。该 COVID-19 测试包括来自鼻咽拭子样本24,25 的聚合酶链反应。由于患者目前尚不清楚 COVID-19 状态,因此医生和工作人员必须得到充分的保护23,26,包括 FFP2 口罩、手套、面罩或护目镜以及长袖防水服。在无法获得,不可能或可疑的PCR测试的情况下,在L2生物安全实验室进行鼻刷的所有处理。如果 COVID-19 状态呈阳性,请推迟 PCD 诊断检测,并考虑其他方法来管理患者。
谨慎: 这种用于 COVID-19 检测的鼻咽拭子取样可能会通过破坏鼻呼吸道睫状上皮27,28 来诱发继发性睫状运动障碍。为避免这种情况,请在严格的内窥镜控制下将薄棉签引入鼻腔直至鼻咽部,避免伤害鼻甲或鼻中隔。然后将样本从鼻咽中取出,并在刚性内窥镜的控制下取出棉签。如果设备充足,成人和儿童可以轻松进行 0° 刚性内窥镜检查,而不会造成创伤。
2.获取呼吸道纤毛上皮标本
COVID-19适应:即使患者的COVID-19状态为阴性,由于假阴性率,患者在手术过程中被要求在嘴上保持外科口罩,并且医生戴手套,FFP2口罩和面罩。
- 鼻刷准备
- 要求患者擤鼻涕。
- 在鼻内窥镜检查下进行鼻腔刷鼻或盲目。如果使用鼻内窥镜检查,请在刷鼻前检查 2 个鼻孔(如果之前对 COVID-19 鼻拭子进行 48-72 次,则不要重复)。检查可以验证粘膜的状况(进行刷鼻时高度炎症可能会导致出血,...),下鼻甲的状况(例如排除毛细血管扩张的存在),以及鼻中隔是否直(图1C)。
- 要求患者躺下或舒适地坐着,头部向后靠在椅子上(因为鼻刷会导致反射将头部向后移动)。第二名照护者在刷鼻时握住头部,特别是在儿童中。
- 在鼻刷之前,在补充的M199中摇动刷子(润湿刷子可减少刷牙引起的刺激)。
注意:刷子可能会在补充的 M199 中弄湿;如果患者对抗生素过敏(补充的细胞培养基中存在青霉素和链霉素),请用生理盐水润湿刷子。
- 鼻刷
- 轻轻插入鼻刷,无需局部或全身麻醉13.如果使用鼻内窥镜检查,将内窥镜放在鼻子入口处以观察下鼻甲,然后将细胞学刷插入鼻子。如果进行"盲"鼻刷,请将刷子插入鼻底,沿着鼻底(图1D)。
注意:一些诊断中心使用局部麻醉和萘甲唑啉卫生棉条进行鼻刷。 - 将刷子向后和向前移动数次,在下鼻甲的后部,然后退出。操作者应感觉到刷子摩擦上皮,患者可能会在刷牙的一侧感到单侧水汪汪的眼睛。
注意:如果鼻刷过于靠前,则不会获得纤毛细胞,因为前鼻腔衬有过渡性非纤毛上皮。 - 取样后,立即将鼻刷标本放入培养基中。通过搅拌含有补充M199的管中的刷子来去除获得的呼吸道上皮条,然后关闭管(图1E)。
- COVID-19 适应: 取样后不要通过在补充的M199中搅拌刷子来移开上皮条。将刷子放入管中,切断电线,使其完全适合管内,并立即关闭管子。将样品放入密封的双层袋中。
- 轻轻插入鼻刷,无需局部或全身麻醉13.如果使用鼻内窥镜检查,将内窥镜放在鼻子入口处以观察下鼻甲,然后将细胞学刷插入鼻子。如果进行"盲"鼻刷,请将刷子插入鼻底,沿着鼻底(图1D)。
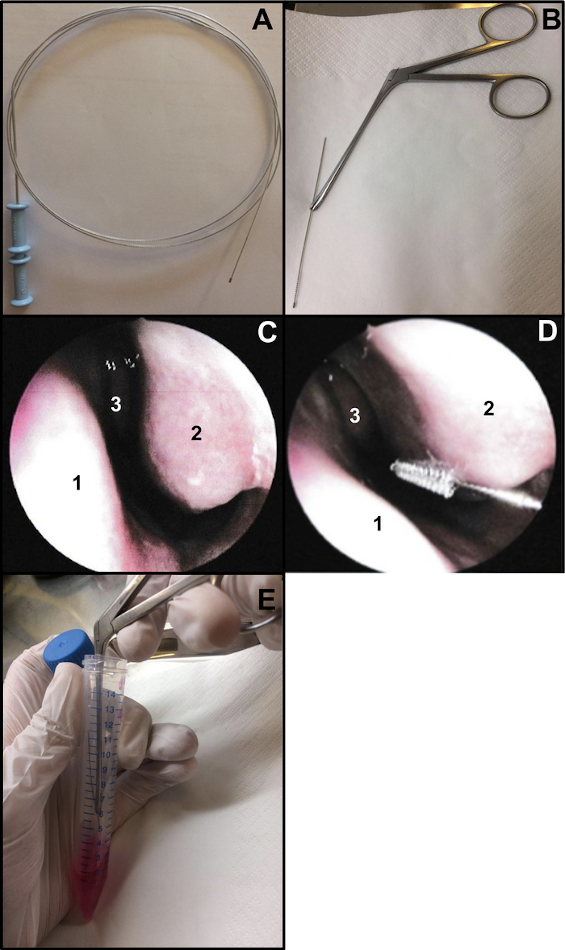
图1:鼻刷技术。 (A) 整个支气管细胞学刷 (B) 准备刷牙:将电线的刷子端切割(约 15 厘米长)并用 Weil-Blakesley 鼻钳固定(C) 鼻腔内窥镜视图:鼻中隔 (1) 下鼻甲 (2) 和中鼻甲 (3) (D) 鼻刷在下鼻甲的后部进行 (2)。鼻中隔 (1) 中鼻甲 (3)。(E)通过在补充的M199细胞培养基中摇动刷子来脱落呼吸道上皮条。 请点击此处查看此图的大图。
3.呼吸道纤毛上皮处理
- 在采样后 9 小时内在显微镜下分析鼻刷样本,因为 CBF 和 CBP 在此时间范围内都是稳定的(未发表的数据)。
- 使用正置或倒置光学显微镜,搭配x100油浸相衬或干涉对比镜头。理想情况下,将显微镜放在防振台上,因为睫状跳动可能会因外部振动(例如来自实验室工作台)而受到伪影的影响13。
COVID-19 适应: 操作员使用个人防护设备进行鼻腔处理,包括 FFP2 口罩、手套和长袖防水服。
- 准备可视化室。
- 将纤毛上皮条悬浮在实验室建造的开放式可视化室中,让纤毛在显微镜下分析时自由跳动。该腔室由盖玻片(22 mm x 40 mm)和载玻片由两个相邻的方形盖玻片(20 mm x 20 mm)分离而成,间隔15 mm的距离,并粘在载玻片12 上(图2, 图4A)。
COVID-19 适应: 上述实验室建造的腔室是开放的,允许样品和环境之间的气体和湿度交换13。在COVID-19大流行的背景下,可以使用双面卡住垫片(0.25毫米深度)使用封闭的可视化室(图3, 图4B)。垫片卡在载玻片上,然后将盖玻片(22 mm x 40 mm)粘在垫片顶部。

图 2:实验室建造的开放式腔室的安装。 (A) 将 2 个方形盖玻片 (20 mm x 20 mm) 放置在载玻片上。(B)方形盖玻片相隔约15毫米的距离,并粘在载玻片上。(C)在补充的M199中用少量纤毛上皮样品(约60μL)填充两个相邻的方形盖玻片之间的腔室。(D)将长矩形盖玻片(22毫米x 40毫米)放在两个相邻的方形盖玻片上,并覆盖腔室。 请点击此处查看此图的大图。

图 3:使用双面卡垫片安装封闭腔室。 (一)载玻片和双面卡垫片。(B)移除垫片一侧的保护装置,然后将垫片粘在载玻片上。(C)从双面卡住垫片的另一侧去除保护,然后在垫片中填充少量样品(约60μL)补充的M199中的纤毛上皮。(D)将长矩形盖玻片(22 mm x 40 mm)卡在垫片上,并关闭腔室。 请点击此处查看此图的大图。
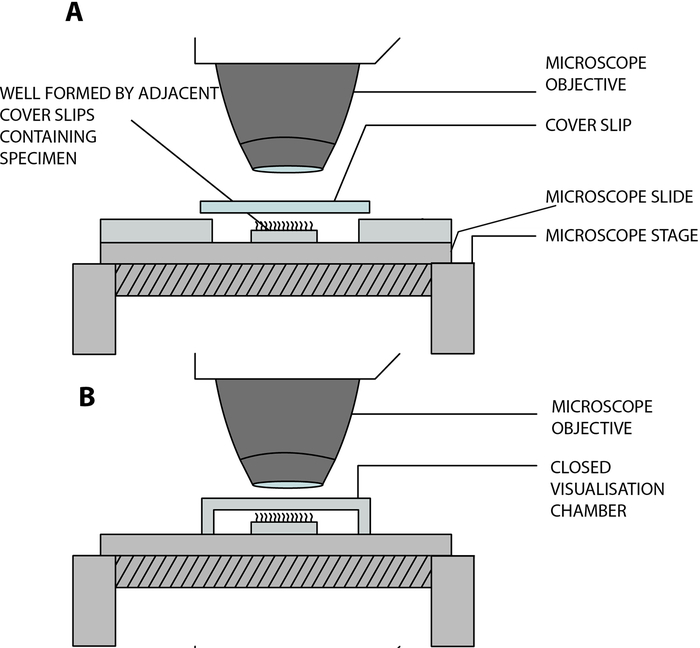
图 4:示意图显示了用于使用数字高速视频显微镜 (DHSV) 进行睫状视频显微镜检查的主要可视化室。 (A)开放式悬挂液滴技术:纤毛样品悬浮在由两个相邻的盖玻片分离盖玻片和载玻片产生的开放室中的细胞培养基液滴中。(B)封闭悬挂液滴技术:纤毛样品悬浮在封闭室中的细胞培养基液滴中,该室由夹在玻璃侧和盖玻片之间的间隔物产生。垫片牢固地粘在载玻片和盖玻片上。复制和修改自Kempeneers等人13。 请点击此处查看此图的大图。
- 温度控制
- 用气泡膜包围显微镜(图5A,B)。
- 使用魔术贴带将透镜加热器安装在物镜周围(图5C)
- 在执行控制温度检查前 1 小时打开镜头加热器控制器。
- 打开显微镜并检查显微镜设置是否完成,因为通过样品的光量可以改变载玻片上的温度。
- 打开加热盒控制器(图 5D)。
- 在启动之前,请检查参考探头是否正常工作。将参考探头尖端夹在手指之间;它应该测量体温。
- 将自由介质放入载玻片中间,粘在上面的两个相邻方形盖玻片(20 mm x 20 mm)之间。
- 将参考探头尖端放入补充的 M199 中。用矩形盖玻片(22 毫米 x 40 毫米)盖住。确保探头完全被介质包围(否则温度可能会下降)。
- COVID-19 适应: 要使用垫片在封闭腔室中进行温度控制,请切割垫片的一侧(此孔必须与参考探头的尺寸相同)。将垫片贴在载玻片上,将自由介质放在垫片的中间。将参比探针的尖端通过垫片的孔放入溶液中,然后将矩形盖玻片(22 mm x 40 mm)贴在垫片上。
- 将载玻片放入加热盒的板上。盖上盖子关闭加热的盒子。
- 在油浸物镜上加油。
- 将加热盒放在显微镜载物台上。
- 调整板和盖子的温度(盖子的温度应比板的温度高2°C,以避免冷凝)以在介质内用参考探头测量37°C。
- 等待5分钟(将样品温度升高到37°C所需的时间)。
- 调整物镜,将其移近载玻片,直到用镜头尖端接触盖玻片。
- 移动物镜以在显微镜中看到探头的中间。
注:确保在计算机屏幕上看到探头(以便在查看纤毛样品之前检查相机系统是否正常工作)。查看探头中间时,屏幕完全黑屏。 - 调节镜头加热器的温度(以补偿油浸透镜与盖玻片接触时的温度损失)。当物镜接触盖玻片时,请务必在培养基内使用参比探头测量37°C。
注意:理想情况下,在温度受控的房间内工作,以便这些温度设置不会改变。如果房间的温度不受控制,则应在进行睫状视频显微镜检查之前每天进行此温度控制检查。 - 检查温度后,从加热盒中取出载玻片。
- 用酒精清洁载玻片和参比探头的尖端并收起。
- 用异丙醇清洁镜片,用打圈运动清洁纸巾。

图5:DHSV实验室使用的设备。 (A)显微镜配备100倍油浸相衬透镜,放置在防振台上,以避免外部振动导致睫状功能分析的伪影(B)显微镜被气泡包装包围,以防止环境空气中的热量散失。(C)油浸物镜产生热损失。这可以通过镜头加热器(箭头)来防止。(D)使用加热箱加热样品。 请点击此处查看此图的大图。
4. 呼吸道纤毛上皮样品的制备
- 轻轻摇动管子,让纤毛在整个管子中扩散(以避免纤毛粘在其他纤毛条、粘液或碎屑上,从而防止它们自由跳动)。
注意:此步骤对于获得纤毛上皮的"最佳边缘"至关重要(图12)。 - 用移液管在管中间的补充M199中提取约50μL纤毛上皮。
- 将样品放在实验室建造的室中(在两个相邻的方形盖玻片(20 mm x 20 mm)之间),并用矩形盖玻片(22 mm x 40 mm)盖住。注意不要添加气泡。
- COVID-19 适应: 在微生物安全柜中执行步骤4.1-4.3。微生物安全柜中的程序。
- 在制备样品前10分钟打开微生物安全柜(以确保环境无菌)。
- 在进行任何处理之前,请用70%乙醇对整个微生物安全柜进行消毒。
- 在放入微生物安全柜之前,用70%乙醇对所有必要的材料进行消毒。
- 在微生物安全柜下仅打开一次包含样品的 15 mL 锥形管,然后在补充的 M199 中搅拌刷子(使用 Weil-Blakesley 鼻钳)来移开上皮条。
- 将垫片贴在载玻片上,然后从双面卡住的垫片上取下保护装置。
- 轻轻摇动管子,让纤毛在整个管子中扩散。
- 用移液管(约60μL)从管中间取出补充的M199中的纤毛上皮小样品并填充垫片。
- 将矩形盖玻片(22 mm x 40 mm)贴在垫片上以关闭腔室。
- 在离开微生物安全柜之前对载玻片进行消毒。
- 从微生物安全柜中取出载玻片。
- 离开微生物安全柜时更换手套。
- 使用后等待10分钟后关闭微生物安全柜(在关门前确保微生物安全柜的环境无菌)。
- 将载玻片放入加热盒的板上。盖上盖子关闭加热的盒子。
- 在油浸物镜上加油。
- 将加热盒放在显微镜载物台上。
- 打开加热盒和镜头加热器。
注意:镜头加热器必须在使用前 1 小时打开。 - 根据在步骤3.4中获得的值调整加热盒和镜头加热器控制器的温度设置。
- 等待5分钟(当对加热箱和物镜加热器使用预定设置时,将样品温度升高到37°C所需的时间)。
- 将物镜靠近载玻片,直到用镜头尖端接触盖玻片。
5. 可视化呼吸纤毛边缘
- 将高速摄像机固定在显微镜上,将相机连接到计算机,然后打开相机。
- 打开计算机。
- 通过软件将数字高速视频显微镜相机连接到计算机(以便通过目镜观看的图像投射到监视器上)。
- 打开软件,然后 主菜单 自动打开(图6A)。
注意:该软件是实验室中用于图像采集和处理的程序。该系统允许以降低的帧速率或逐帧录制和播放视频序列。它可以免费下载。 - 打开 相机 (图6A)。
- 出现" 相机枚举筛选器 "时,选择" 确定 "(图 6B)。
- 选择刷新列表;选择摄像机的名称;选择"接口:专家",然后选择"打开"(图 6C)。
- 在停靠对话框菜单顶部的摄像机控制线上,选择 实时 (图 6D)。
- 选择" 播放 "以查看图像,选择 "停止 "以完成查看(图 6D)。
- 打开软件,然后 主菜单 自动打开(图6A)。

图 6:软件使用说明:将呼吸纤毛边缘可视化到监视器上。 (A) 打开软件时直接出现 主菜单 。(b) 关闭 相机枚举筛选器。(C) 选择相机并选择 接口:专家。(D)实时模式允许在监视器上可视化通过显微镜看到的图像。 请点击此处查看此图的大图。
- 调整相机采集设置(在右上角)(图7)。
- 在 采集设置 上,选择 相机,然后调整帧速率: 速率(Hz):500( 见下文)(图7A)。
- 在 采集设置 中,选择 相机,然后调整感兴趣区域(ROI)(图7A)。
注意:ROI是使用x100油浸物镜观察并投影到监视器上的刻度计算的,以定义对应于50μm的像素数(因为您要记录大约50μm的纤毛边缘(见下文))。 - 在" 采集设置 "中,选择 "录制",然后调整视频的持续时间和录制的总帧数(如果选择的帧速率为 5OO Hz,则为 2 秒持续时间,对应于 1000 帧)(图 7B)。
注意:根据我们的经验,至少需要 2 秒的视频长度才能对 CBF 和 CBP 进行全面分析。 - 选择 文件 ,然后选择保存 相机CFG以保存 新的采集设置(输入名称,如有必要,输入此新配置的注释)(图7C,D)。
- 要打开此新相机配置,请打开 文件 和 加载相机 Cfg (图 7C)。
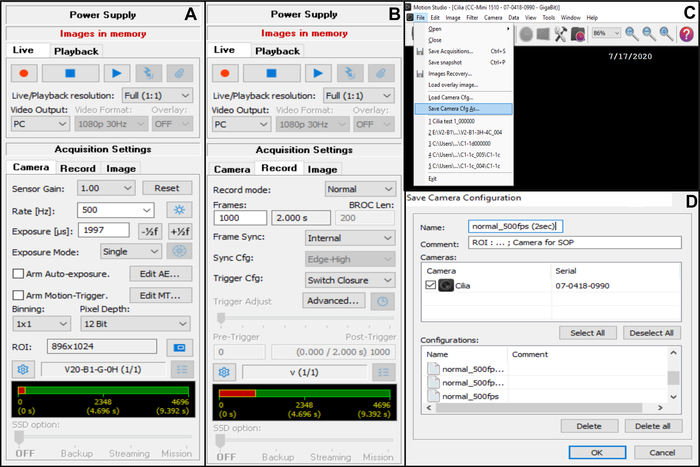
图 7:软件使用说明:调整相机采集设置,用于拍打纤毛边缘的视频录制。 (A) 在采集设置 相机上,调整感兴趣区域 (ROI) 和视频录制的帧速率 (Rate)。(B) 在采集设置"录制"中,调整视频录制的持续时间(根据之前选择的帧速率,所选 录制持续时间所需的帧数)。(C) 可以使用保存相机 Cfg 功能保存此新的相机 配置设置。 加载相机CFG 允许重新打开保存的配置设置以供进一步使用。(D) 可以命名新的摄像机配置设置,并在必要时添加注释。 请点击此处查看此图的大图。
- 通过人工晶状体观察并搜索样品中的细胞或碎片,然后聚焦。
- 检查图像在显示器上是否可见,并通过调整聚光镜(如果使用干涉对比镜头,则调整DIC棱镜)来提高图像质量,并在必要时调整焦点。
- 寻找纤毛上皮条。
6. 呼吸纤毛边缘选择
注意:实验系统允许在三个不同的平面上观察跳动的纤毛:侧向轮廓,直接朝向观察者跳动,以及从正上方(图8)。
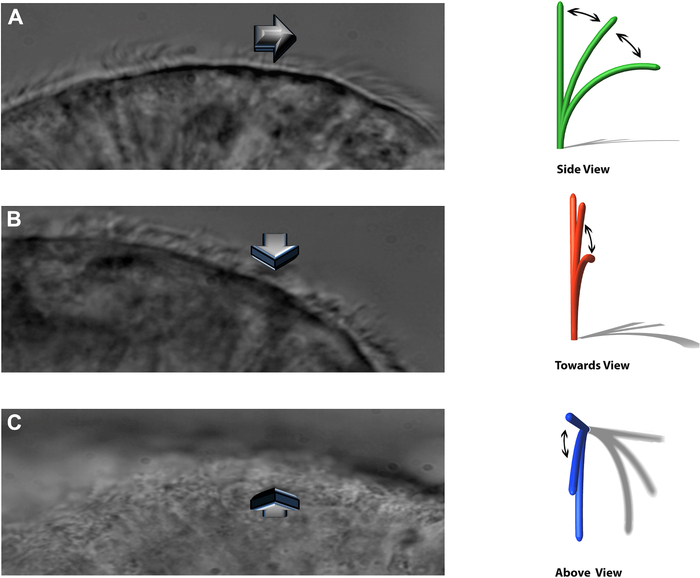
图 8:DHSV 技术允许在三个不同的平面上观察跳动的纤毛。 (A)在侧向轮廓。(B)直接向观察者敲打。 (C)从正上方。转载自Kempeneers等人16。 请点击此处查看此图的大图。
- 仅记录长度至少为 50 μm 的完整未中断纤毛上皮边缘。
- 对于在侧向轮廓上进行的记录,根据Thomas等人29 评分系统确定边缘的质量(图9)。仅使用法线边缘(图 9A)或具有次要突起的边缘(图 9B)进行睫状功能分析。排除分离的细胞(图9E)。

图 9:Thomas 等人29 针对纤毛上皮边缘不同质量的评分系统的代表性图像。(A) 正常边缘:定义为长度为 50 μm >的完整均匀纤毛状上皮条(B) 具有轻微突起的纤毛边缘:定义为长度>50 μm 的边缘,细胞从上皮边缘线突出,但顶端细胞膜的点在相邻细胞的纤毛尖端上方没有突出(C)具有主要突起的纤毛边缘:定义为长度>50μm的边缘,细胞从上皮边缘线突出,顶端细胞膜的至少一个点在相邻细胞的纤毛尖端上方突出(D)分离纤毛细胞:定义为上皮边缘上唯一的纤毛细胞,长度>50μm(E单细胞:定义为自身之间或任何其他细胞类型之间没有接触的纤毛细胞。比例尺:5.5 μm。转载自 Thomas et al.29请点击此处查看此图的大图。
- 仅使用没有粘液和碎屑的纤毛进行CFA,并在为记录的边缘选择的轮廓中跳动。仅选择沿边缘允许至少 2 个 CBF 和 CBP 评估(见下文)的纤毛边缘。
- 仅用于CFA样品,这些样品在侧向轮廓中产生至少6个边缘跳动并符合上述标准;在横向轮廓中最多分析 20 条边。
- 从观察者轮廓上方至少使用1个额外的纤毛边缘来表征CBP。
7. 记录纤毛边缘
- 使用每秒 500 帧的相机帧速率记录跳动的纤毛边缘,并投影到高分辨率监视器上。需要 400 Hz 的最低帧速率才能同时分析 CBF 和CBP 13。以每秒 30 帧的帧速率记录一条边,以评估颗粒清除的效率。
- 在停靠对话框菜单顶部的摄像机控制线上选择 实时(图 6D)
- 选择" 播放 "以查看图像,选择 "停止 "以完成查看(图 6D)
- 要记录边缘,请按 记录 (图 6D)。要在保存前查看录制内容,请转到停靠对话框菜单顶部的摄像机控制线,然后选择 播放。选择" 播放 "以查看录制的视频,选择 "停止 "以完成观看(图 10A)。
注意:保存前停止查看记录的边缘。
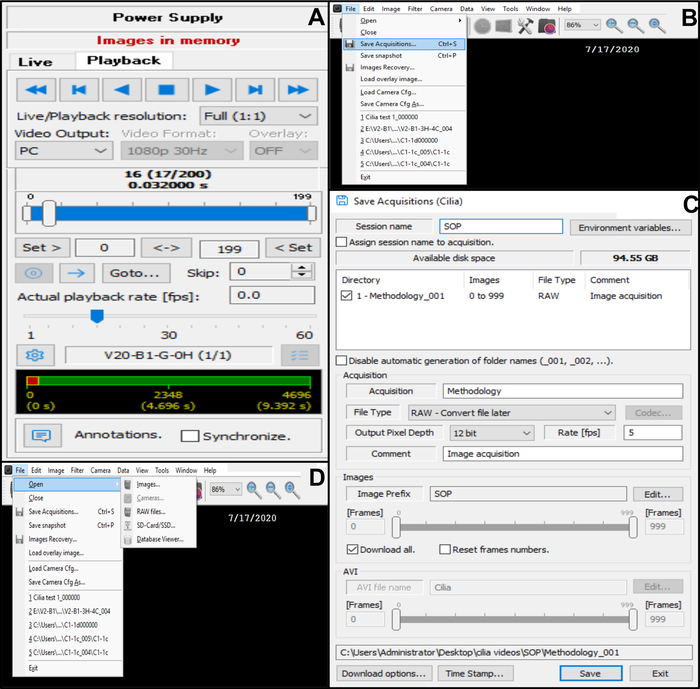
图 10:软件使用说明。 (一)播放模式。要查看跳动纤毛边缘的录制视频序列,请选择"播放模式"。选择"播放"以查看图像,选择"停止"以完成查看。可以调整声望率以改善睫状功能分析 (B, C) 保存跳动纤毛边缘的视频记录 (B) 要保存视频,请选择"文件",然后选择"保存采集"。(C) 输入录制视频的名称,然后选择录制视频的位置。确保录制文件另存为 .RAW 文件 (D) 选择要分析的纤毛边缘的录制:要打开视频录制,请选择"文件",然后选择"打开",然后选择"图像"。请点击此处查看此图的大图。
- 将视频保存在数据库中(图 10B,C)。
- 打开左上角的文件,然后保存采集(图10B)。
- 在 保存采集中,输入录制视频的名称,并确保录制内容另存为 RAW 文件类型格式(图 10C)。
- 保存视频后,返回实时模式(返回停靠对话框菜单顶部的摄像机控制行并选择 实时)(图 6D)。
- 重复该过程以记录满足 CFA 所需选择标准的边数。
注意:可以在准备载玻片后最多20分钟内从一张载玻片记录几个符合选择标准的纤毛边缘(以避免干燥)。20分钟后,如果无法获得足够的符合选择标准的边缘,请准备一张新的载玻片。 - 从加热盒中取出载玻片。
- 取出矩形盖玻片并将其扔进特定的危险医疗废物容器中。
- 用70%乙醇和吸水纸清洁载玻片(上面粘着两个方形盖玻片)。一旦载玻片干净,就可以再次使用。
- COVID-19 适应: 将带有盖玻片和垫片的载玻片放入密封袋中,摘下手套和口罩,然后放入密封袋中。将密封袋放入特定的危险医疗废物容器中。
8. 睫状功能分析
- 进行手动CBF和CBP评估的初步准备
- 打开软件。
- 打开左上角的文件,然后打开,然后打开图像(图 10D)。
- 选择要分析的视频。
- 转到停靠对话框菜单顶部的相机控制行,然后选择 回放 (图10A)。选择 "播放 "以查看录制的视频,然后选择" 停止 "以完成观看。
- 手动睫状搏动频率 (CBF) 分析
- 仅使用侧向边缘执行CBF评估。
- 将纤毛边缘分成大约 5 个相邻区域,每个区域的尺寸约为 10 μm(图 11)。
- 以降低的帧速率识别和可视化纤毛或纤毛群,并且每个区域最多进行 2 次 CBF 测量,从而沿每个边缘最多进行 10 次 CBF 测量(图 11)。
- 记录一组纤毛完成 5 次节拍周期所需的帧数。
- 通过简单的计算转换为 CBF:(CBF= 录制帧速率 (Hz)/(5 拍的帧数)x 5)13,16,30。据报道,不动纤毛的CBF为0 Hz13。
注:播放录制的视频时调整帧速率(图10A)。当分析的纤毛跳动非常缓慢时,这尤其有用。提高帧速率有助于确定纤毛跳动是否非常缓慢或不动。 - 对于每个样本,将平均CBF计算为侧向剖面中记录的所有CBF的平均值(SD)或(95%CI),包括静态纤毛。
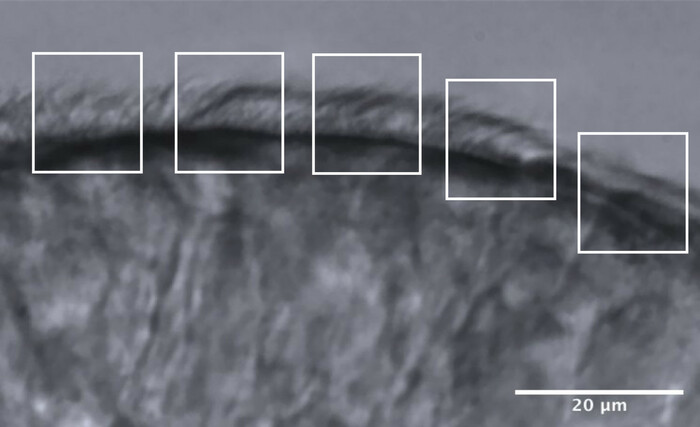
图 11:最佳质量边缘的代表性图像,并划分为 5 个区域以允许 CFA 分析。 最佳质量的纤毛上皮边缘被分成5个相邻区域,每个区域测量10μm。每个区域最多进行 2 次 CBF 测量(和 2 次 CBP 评估),因此沿每个边缘最多进行 10 次 CBF 测量(和 CBP 评估)。比例尺 = 20 μm。 请点击此处查看此图的大图。
- 手动睫状搏动模式 (CBP) 分析
- 要评估运动障碍的标志物,请仅使用侧向轮廓;使用朝向观察点和从上方的平面来表征 CBP13 的类型。CBP 评估存在不同的方法和分数。下面描述了实验室中使用的方法以及运动障碍标志物的定义。
- 样本中每个不同 CBP 的百分比
- 对于确定并用于 CBF 测量的每个纤毛或纤毛组(图 11),以降低的帧速率执行 CBP 分析:将纤毛在整个搏动周期中采取的精确路径与在 DHSV 分析12,30 中观察到的正常 CBP 进行比较。
- 将不同的 CBP(正常、不动、僵硬、圆形、异步(不协调睫状跳动)或运动障碍13)归因于分析的每个纤毛或纤毛组。
- 对于每个样本,计算样本中每个不同 CBP 的百分比;归因于样本的CBP是观察到的主要CBP。
- 计算运动障碍的 3 个标志物。
- 计算不动指数(IMI):样本中不动纤毛的百分比(CBF数量= 0/样品中CBF读数总数X 100)。将IMI表示为平均值(SD)或(95%CI)1,16,31。
- 计算运动障碍评分 (DKS)。将每个纤毛边缘划分为象限,并确定具有运动障碍(或异常跳动)纤毛的象限数。这允许计算 0 到 4 之间的 DKS(0:整个边缘的正常 CBP;1:≤ 25% 纤毛中的异常 CBP;2:纤毛≤ 50% 的纤毛中异常 CBP;3:≤ 75% 纤毛的异常搏动模式;和 4:所有纤毛中的异常 CBP)。计算样本16,29 的中位数 DKS(四分位数范围)。
- 计算正常跳动的百分比:定义为样品中具有正常CBP的纤毛百分比(样品x100的正常CBP读数数/CBP读数总数)。
结果
为了说明该技术的效率,我们在一系列16名健康成年志愿者(5名男性,年龄范围22-54岁)中展示了CFA的结果。
在总共16名志愿者中,来自14名(4名男性,年龄范围24-54岁)的鼻刷样本提供了足够合适的上皮边缘,满足进行CFA所需的选择标准。从这14个鼻刷样本中,共记录了242个纤毛边缘,212个边缘符合定义的纳入标准并进行了分析。所有这些边缘都记录在侧向剖面中(记录并分...
讨论
本文旨在为使用鼻刷样本的CFA提供标准操作程序,并在COVID-19大流行期间根据适当的感染控制考虑进行调整。PCD诊断具有挑战性,根据国际建议,目前需要一组不同的诊断测试,包括鼻一氧化氮测量,使用DHSV的CFA,使用透射电子显微镜(TEM)的睫状超微结构分析,使用免疫荧光标记睫状蛋白,以及PCD致病基因4,37的基因检测。目前,没有单一的测试可?...
披露声明
这些作者没有什么可透露的。
致谢
我们要感谢Jean-François Papon,Bruno Louis,Estelle Escudier以及巴黎东部PCD诊断中心的所有团队成员在访问他们的PCD诊断中心期间的可用性和热烈的欢迎,以及众多的交流。我们还要感谢罗伯特·赫斯特和莱斯特PCD中心的所有团队成员的欢迎和时间,建议和专业知识。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
参考文献
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。