需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过Ussing Chamber技术评估天然组织中肠道紧密连接屏障和离子渗透性的功能评估
摘要
肠上皮不仅提供营养吸收,而且保护免受有毒物质的侵害。顶端最顶端的上皮细胞间连接,即紧密连接,调节细胞旁溶质和离子通透性。这里描述了使用Ussing室技术制备粘膜片和评估紧密连接的离子选择性的方案。
摘要
Ussing室技术最初由丹麦科学家Hans Ussing于1951年发明,用于研究钠在青蛙皮肤上的跨细胞运输。从那时起,这种技术已被应用于许多不同的组织,以研究跨膜运输的生理参数。Ussing室方法比其他方法更可取,因为可以使用天然组织,使其更适用于 体内发生的事情。然而,由于使用天然组织,通量低,时间有限,组织制备需要技能和培训。这些腔室已被用于研究各种组织中的特定转运蛋白,了解疾病病理生理学,例如囊性纤维化,研究药物转运和摄取,特别是有助于了解肠道中的营养转运。鉴于组织的整个上皮运输过程,不仅经上皮途径,而且细胞旁途径也很重要。紧密连接是组织特异性细胞旁细胞通透性的关键决定因素。在本文中,Ussing室技术将用于通过测量经上皮电导和稀释电位来评估离子的细胞旁持久性。
引言
Ussing室方法最初由丹麦科学家Hans Ussing开发。Ussing首先用它来测量钠在青蛙皮肤上的传输短路电流,之后观察到NaCl可以以陡峭的浓度梯度穿过皮肤1。他的系统由安装在两个腔室之间的青蛙皮组成,可以进入皮肤的两侧。每个腔室都包含Ringer的溶液,该溶液被循环和充气。两个狭窄的琼脂振铃桥位于皮肤附近,连接到饱和的KCl-甘汞电极,测量了由增强剂读取的电位差。第二对琼脂铃声桥位于每个腔室的另一端,连接到烧杯,其饱和KCl饱和AgCl以施加电池提供的电动势。使用电位分压器来调节电压,使皮肤上的电位差保持为零,从而产生短路条件。还连接了一个微安表来读取通过皮肤的电流(参见参考文献1 中的原始腔室设计)。
在过去的70年中,该技术已被应用于许多不同的组织,特别是肠道组织,以研究营养和离子运输。例如,通过在这些腔室中安装兔子回肠来研究霍乱引起的腹泻的机制,发现霍乱毒素引起的腹泻是由cAMP2介导的。此外,这些腔室还用于研究通过Na +-葡萄糖共转运蛋白1(SGLT1)3的潜在葡萄糖转运机制。我们的实验室专注于肠上皮细胞中的跨细胞和旁细胞转运。使用Ussing室方法,在Claudin 15敲除小鼠中评估肽转运,这些小鼠具有受损的旁细胞钠转运,使用Ussing室测量不可水解的二肽甘氨酰肌氨酸的吸收。研究发现,腔内Na+ 稳态对质子偶联肽转运很重要4。此外,这些腔室还用于研究小鼠盲肠中的阴离子分泌,以响应丝氨酸蛋白酶胰蛋白酶5激活的蛋白酶激活受体1的粘膜下激活。
Ussing腔室最近也被用于评估上皮组织中的细胞旁通路。细胞旁通路由紧密连接调节,紧密连接是在两个或多个细胞相遇时形成的蛋白质复合物6。屏障功能和离子选择性(阴离子或阳离子是否能够选择性地通过紧密连接)由克劳丁家族蛋白的存在决定;其中一些充当屏障(克劳丁3和7),阴离子孔(克劳丁10a)或阳离子孔(克劳丁2,10b和15)7。已经使用其他方法评估细胞旁通路,例如伴有血浆FITC浓度8或EDTA-Cr9的FITC口服强饲;然而,这些技术的分辨率较低,不能评估离子选择性或肠道部分的特定部分。然而,使用腔室可用于评估目标离子的稀释电位,从而确定紧密连接的离子选择性。例如,使用NaCl,可以通过稀释膜的一侧(通常是粘膜侧)并测量经上皮电位差的变化来计算Na +和Cl-紧密连接的选择性。Na+和Cl-的相对渗透率可以通过Goldman-Hodgkin-Katz方程10来估计,而紧密结的选择性可以使用Kimizuka-Koketsu方程11来估计。因此,这些腔室具有测量组织的电生理参数的优点,因此比其他低分辨率方法提供了有关离子通过紧密连接的更多信息。
Ussing室方法不仅限于肠道,尽管它被广泛用于有关肠道的研究中,但它也有许多其他应用。例如,这些腔室已被用于研究囊性纤维化,特别是氯化物通道囊性纤维化跨膜电导调节剂(CFTR)12。囊性纤维化是由CFTR13突变引起的,导致呼吸道上皮细胞的氯离子分泌和液体运输受损,并导致更厚,更干燥的粘膜层14。气道上皮CFTR的研究已经用这些腔室进行,不仅了解疾病,而且发现治疗疾病的方法。例如,在具有导致囊性纤维化的罕见突变的患者中,对患者呼吸上皮细胞的分析已被用于测试Orkambi和放大器共同治疗等疗法15。
Ussing室也用于研究药物递送途径,例如用人体活检组织来研究药物摄取和药代动力学16。肠道摄取不是药物输送的唯一途径。这些腔室也用于研究鼻腔药物输送系统17。还对眼睛进行了Ussing室的药物输送研究。在兔子角膜中,使用Labrasol进行渗透性和摄取研究,Labrasol是一种旨在增加药物在组织中吸收的药物18。另一项研究检查了苄基氯化铵对兔巩膜中经巩膜药物递送的影响19。
Ussing腔室方法是有用的,因为可以使用天然组织。因此,它优于 体外 模型,如Caco-2细胞系。然而,该技术需要技能和时间来制备样品,因此不适用于高通量应用。细胞单层的电生理特性可以使用这些腔室中的细胞培养插入物进行研究。最近的发现允许培养类器官,这些类器官是从上皮或内皮干细胞的收获中培养的微型器官20。类器官培养可以纵以在单层中生长,从而可以将类器官安装在 Ussing 室 中 21 。可以研究各种上皮和内皮组织的类器官,降低所需的动物数量,因为类器官培养可以长期维持。这也将提高通量,因为不需要耗时且费力的组织解剖和制备步骤。未来,Ussing腔室研究将继续对研究组织运输非常有用,并且在个性化医疗领域尤为重要。
以下方案演示了Ussing室方法的应用,通过测量NaCl的稀释电位来评估Claudin 15敲除(Cldn15-/-)小鼠和野生型(WT)对照的小肠中紧密连接的permselectivity和屏障功能。紧密连接(TJ)在两个或多个细胞在上皮和内皮组织中相遇的点上形成。双细胞紧密连接(bTJ),特别是在bTJ中发现的克劳丁家族蛋白,被认为决定了TJ7的屏障功能和持久性。Cldn15-/-小鼠具有巨大的小肠22,并且由于通过claudin 154,23,24发生的肠道Na +回收的损失而降低了营养吸收能力。Cldn15-/- 小鼠的Na +稳态受损,这使它们成为研究TJ的持久性的有趣模型。以下方案通过测量中小肠中NaCl(PNa / PCl)的稀释电位来评估TJ对NaCl的渗透性。简而言之,通过稀释膜的一侧(M侧或S侧,两者在下面的方案中测量)而发生的膜电位差的变化可用于计算Na +(PNa)和Cl-(PCl)的渗透率,并且稀释电位(PNa / PCl)将显示紧密连接是否具有阳离子或阴离子选择性。
该协议中的实验是使用定制的Ussing室(图1A)进行的,该室由两半组成,其间垂直安装肠道制剂,电压钳放大器,电记录器,电极,盐桥,林格氏溶液,HEPES缓冲液(150mM NaCl),稀释的HEPES缓冲液(75mM NaCl),肠道制剂(有关设备的详细信息,请参见 材料表)。
研究方案
这些实验中使用的所有动物都保存在静冈大学的动物护理设施中,实验是根据静冈大学制定的动物研究指南进行的。所有实验均在静冈大学动物护理和使用委员会的批准下进行(许可证#205272和#656-2303)。
1. NaCl电极的制备
注:这些实验中使用的电极由浓缩的NaCl或KCl组成。KCl/甘汞电极以商业方式购买。在开始实验之前,确保所有电极都用浓缩的NaCl或KCl溶液填充到顶部。
- 准备带塑料盖的小玻璃罐(容量20毫升)。
- 在塑料盖上钻两个孔,一个用于NaCl盐桥(直径2.5毫米),另一个用于银线(直径1毫米; 图1C,氯化钠电极)。
- 用饱和的NaCl溶液填充玻璃罐(约15毫升,直到装满)。
- 将银线(直径0.8毫米,长7厘米)插入罐中,但要确保罐外的线部分可以通过鳄鱼夹(小尺寸)连接到放大器系统。
- 不使用时,用胶片包裹电极并确保孔被覆盖以防止干燥。
2. 盐桥的准备
注意:至少在实验前一天准备盐桥,以提供足够的时间固化。盐桥可以反复使用,但不建议在2个月后使用。
- 氯化钠盐桥
- 准备#7聚乙基管(外径2.3毫米,内径1.3毫米),19克针头和锁式注射器,200毫升1 M NaCl溶液,2克琼脂,用于盐桥储存的可密封塑料容器。
- 通过将管材切割成Ussing室设置所需的尺寸(每个室需要两个盐桥),准备适当数量的盐桥。
- 在注射琼脂之前,用管子做一个U形,并将它们放在温水烧杯中(以创建一个简单的形状来设置盐桥)。
- 通过将11.688克NaCl溶解在200毫升去离子水中,制成200毫升1 M NaCl。
- 将 1 M NaCl 分成 100 mL 份:在 1 M NaCl 中加入 100 mL 2% 琼脂(在 NaCl 中混合 2 克琼脂,在微波炉中加热溶解)。
- 使用19 G针头和锁定注射器,用1M NaCl /琼脂溶液填充注射器。轻轻地开始逐滴排出溶液,同时将针头插入管的一端并填充,直到混合物从另一侧出来。
- 慢慢抽出针头,同时仍然表达溶液并重复,直到所有必需的盐桥都已完成。(如果溶液在注射器或针头中凝固,请在热水中短暂加热,直到溶液再次表达。
- 检查盐桥以确保没有气泡,并将剩余的1M NaCl溶液储存在可密封容器中。
- KCl盐桥
注意:更薄的管子用于KCl琼脂桥,以避免缓冲液中K+ 浓度的增加,因为盐桥尖端会溶解,K+ 会泄漏到缓冲液中。- 准备#3聚乙基管(外径1.0毫米,内径0.5毫米),23克针头和锁定型注射器,200毫升1 M KCl溶液,2克琼脂,用于盐桥储存的可密封塑料容器。
- 通过将管子切割成Ussing室设置所需的尺寸(每个室需要两个盐桥),准备适当数量的盐桥。
- 将 14.91 g KCl 溶于 200 mL 去离子水中,制成 200 mL 1 M KCl。
- 分成两份100毫升:在1 M KCl中制作100毫升2%琼脂(在KCl中混合2克琼脂,在微波炉中加热溶解)。
- 使用23 G针头和锁定注射器,以与NaCl盐桥相同的方式注射含有2%琼脂1 M KCl混合物的管子(确保管完全充满并且没有气泡)。
- 检查盐桥以确保没有气泡,并将剩余的1 M KCl溶液储存在可密封的容器中。
3. 林格氏溶液和HEPES缓冲液的制备
注意:根据安装在Ussing室中的组织,Ringer溶液的成分可能会有所不同。这里介绍的食谱是针对小肠和大肠的。
- 使Ringer的溶液在实验当天新鲜,如 表1所述。
- 用95%的O2 / 5%CO 2 泡泡溶液,为组织提供O2 和缓冲能力。
| 林格氏溶液(小肠) | 林格氏溶液(大肠) |
| 氢氧化钠 – 21.0 mM | 氢氧化钠 – 21.0 mM |
| K2HPO4 – 2.4 毫米 | K2HPO4 – 2.4 毫米 |
| KH2PO4 – 0.6 mM | KH2PO4 – 0.6 mM |
| 氯化钠 – 119.0 mM | 氯化钠 – 119.0 mM |
| 氯化镁2 – 1.2 mM | 氯化镁2 – 1.2 mM |
| 氯化钙2 – 1.2 mM | 氯化钙2 – 1.2 mM |
| 吲哚美辛 – 10 μM(在21 mM NaHCO3中制备1 mM储备液,加入10 mL储备液,用于1升Ringer溶液) | 吲哚美辛 – 10 μM(在21 mM NaHCO3中制备1 mM储备液,加入10 mL储备液,用于1升Ringer溶液) |
| 1 mM 谷氨酰胺 (0.146 克/升) | 10 mM 葡萄糖 |
表1:林格的溶液配方。 为了制造Ringer的解决方案,将所有组分与去离子水混合在一起。Ringer的解决方案最好在实验前新鲜制作。存放在冰箱或冰上直至使用。使用前,使用含有95%O2 / 5%CO 2的气体。
- 如 表2 所述,通过在去离子水中混合成分,使HEPES缓冲液在实验当天新鲜。
- 在pH调节之前,不要调整到缓冲液的最终体积。
- 将HEPES缓冲液加热至37°C,并在搅拌时缓慢加入滴剂1M Tris溶液,将pH值调节至7.4。
- 通过加入适量的去离子水来调整到最终体积。
| 肝素缓冲液 | 稀释型肝素缓冲液 |
| HEPES – 10 mM | HEPES – 10 mM |
| 葡萄糖 – 10 mM (大肠) | 葡萄糖 – 10 mM (大肠) |
| 1 mM 谷氨酰胺 (0.146 g/L) (小肠) | 1 mM 谷氨酰胺 (0.146 g/L) (小肠) |
| 氯化钠 – 150 mM | NaCl – 75 mM + 150 mM 甘露醇(用于调整渗透压差异) |
| 氯化镁2 – 1 mM | 氯化镁2 – 1 mM |
| 氯化钙2 – 2 mM | 氯化钙2 – 2 mM |
| 吲哚美辛 – 10μM(在21 mM NaHCO3中制作1mM储备液,加入10 mL储备液以获得1L林格溶液) | 吲哚美辛 – 10μM(在21 mM NaHCO3中制作1mM储备液,加入10 mL储备液以获得1L林格溶液) |
| 使用 1 M Tris 调节至 pH 7.40 (37°C) | |
表2:HEPES缓冲液配方。 要制作HEPES缓冲液和稀释HEPES缓冲液,请将所有成分溶解在去离子水中。溶液必须用1 M Tris溶液调节pH值,因此不要添加全体积的水(例如,当制作1L时,将所有成分溶解在约800mL水中)。然后将溶液加热到37°C,将pH调节到7.4,然后调节最终体积。
4. 使用室设置
注意:本方案中使用的Ussing室是定制的连续灌注室。为了评估小鼠肠道屏障功能或营养吸收,建议使用直径为4或5mm的腔室25(图1A-C)。
- 为了减少边缘效应26 并帮助密封腔室,请在设置前连接4或5毫米孔打孔石蜡膜(约4 cm2)(图1B)。
- 在开路条件下设置,用于稀释电位测量。设置为电流钳位模式。将输出设置为电流,并将电流脉冲设置为±20 μA。
- 在短路条件下设置用于测量短路电流和跨粘膜电阻时,设置为电压钳位模式。将输出设置为电压,并将电压脉冲设置为±5 mV。
- 确保37°C的水在水套中循环。
- 用林格溶液或HEPES缓冲液填充每个腔室(量取决于所使用的系统,此处使用的腔室每侧需要5 mL),并确保没有泄漏。
- 连接盐桥和电极。
- 确保电压为0且稳定,脉冲电流确保盐桥和电极正确设置。
- 让系统和林格溶液温度平衡至少20分钟。
- 平衡后,校正KCl电极之间的不对称电压差,并通过将其更改为零来补偿流体阻力(查看用于确定正确方法的Ussing腔室系统的手册)。
5. 解剖肠道组织
注意:所有动物实验必须在国家和大学制定的规定范围内进行。
- 在服用肠道组织之前,准备新鲜,冰冷的Ringer溶液,并用95%的O2 和5%的CO 2泡泡15分钟(步骤3)。
- 根据管理动物在研究中使用的指南麻醉小鼠。对于该实验,用麻醉剂施用2%-3%异氟醚麻醉小鼠。通过捏住脚趾并确保没有疼痛反应来检查适当的麻醉。
- 用从骨盆到横膈膜的剪刀在腹部做一个切口;定位胃并切开胃的幽门末端。
- 用镊子抓住附着在小肠上的胃部,轻轻拉动小肠,同时切除肠系膜附件。注意不要以任何方式切割或损坏肠道组织。
- 继续解剖肠道一直到肛门。为了完全切除大肠,切开骨盆骨以露出大肠的远端部分,并通过切除附件小心地切除肠的其余部分。
- 测量肠道的长度并分成所需的部分。对于这个实验,将小肠分成三个部分,并使用中间部分。
- 将所需的片段放入冰冷,起泡的林格溶液中;然后,通过沿着肠系膜附件切割纵向打开每个节段。修剪掉脂肪和结缔组织。
- 将片段返回冰冷的林格氏溶液并彻底洗涤(即使在冰冷的溶液中,腔内上皮的氧合对于维持上皮功能也很重要)。
6.剥离肌肉层并准备肠膜
注意:去除血清(肌肉层)对于使用肠道的运输研究很重要。如果血清保留,肠道组织可能会受到随机肌肉收缩的影响,这会扭曲电生理数据,并且运输可能受到抑制。未剥离的组织在安装在Ussing室中时会迅速恶化,因为血清是底物和氧气的重要扩散屏障。在某些特殊情况下,可能需要保留肌肉层,因此决定取决于研究人员和实验设计。根据去除哪一层,可以通过两种方式制备肠片(图2)。对于该实验,需要粘膜和粘膜下准备(图2,第 2图)。
- 准备用硅橡胶覆盖的解剖板(直径10厘米),针(小针灸针),5毫米冲孔滤纸和石板方块(2厘米x 2厘米;其他系统可能不需要)。
- 将新鲜的,冰冷的,冒泡的Ringer溶液倒入解剖板(足以覆盖组织,约2-3毫升)。
- 在立体显微镜下,固定肠组织的末端(粘膜侧面朝下)。
- 使用细镊子,从下面的粘膜上钝地解剖肌肉层。
- 注意不要撕裂或将任何孔插入组织中。
- 一旦肌肉层被移除,切一块足够大的块,用于5毫米直径的开口。当准备小肠时,应在10分钟内去除血清肌层,因为在这些条件下腔内氧合是困难的。
- 在Ringer溶液中湿5毫米冲孔滤纸正方形,并将肠组织放在其上,粘膜面朝下,因为粘膜下制剂自发地包裹在粘膜外侧。
- 确保开口完全被肠道组织覆盖,并且没有皱纹。在准备工作下方使用黑板检查开口是否完全覆盖。
- 对所需数量的粘膜制剂重复此过程(在本实验中需要两种制剂:一种制剂将用于测量稀释电位,另一种将用于测量基线电参数)。
7. 在缝纫室中安装肠道制剂
注意:设置将取决于所使用的Ussing腔室系统和记录系统的类型。
- 从Ussing室中抽出Ringer的溶液/ HEPES缓冲液。
- 拆卸Ussing室并将滤纸与肠道制备粘膜一侧朝下放在粘膜侧室上,并进行调整,使腔室的窗口与滤纸的孔对齐(图1A,腔室窗口周围的黑色标记可用于制剂的对齐)。
- 小心地将浆膜侧室放在粘膜侧室上并紧紧闭合,但要确保肠片在连接过程中没有移动。
- 用林格溶液或HEPES缓冲液快速重新填充两个腔室,并放置冒泡棒(林格溶液:95%O2 / 5%CO 2;HEPES缓冲液:100%O2)在腔室的另一端,远离膜(气泡太靠近制剂可能会对测量产生影响)。
- 重新连接盐桥,检查电压和脉冲电流是否稳定,以确保连接正常(图1C)。
- 对每个肠道制剂重复上述步骤。
- 让系统平衡约15分钟。如果使用记录系统,在开始实验之前,让电导和ICC/膜电位差稳定下来。
8. 稀释电位实验(开路条件)
- 通过吸入HEPES缓冲液并向每侧加入5mL新鲜预热的HEPES缓冲液来洗涤腔室的两侧。
- 打开录制系统。将范围设置为250 mV(此处使用的系统将输出电压放大10倍),设置标记位置,并设置记录系统进行测量。
- 将腔室系统转为夹紧模式并开始测量。一旦膜电位稳定(约15-20分钟),就可以开始评估。
- 从粘膜侧吸入HEPES缓冲液,并迅速替换为含有75mM NaCl的5mL温热稀释HEPES缓冲液。
- 一旦膜电位达到峰值(5-10分钟),从"粘膜"侧取出稀释缓冲液,并用HEPES缓冲液代替。
- 如有必要,对血清侧重复步骤3,向血清侧添加稀释的HEPES缓冲液。
- 为了确保组织是可行的,将腺苷酸环化酶激活剂毛喉素(终浓度10μM)加入血清侧。
- 一旦膜电位差达到峰值并开始下降,实验就结束了。
9. 测量经上皮电导和基线 Isc(短路条件)
- 通过吸入铃声溶液并向每侧添加5 mL新鲜气泡的铃声溶液来清洗腔室的两侧。
- 打开录制系统。将范围设置为2.5 V(此处使用的系统将输出电压放大10倍),设置标记位置,并设置要测量的记录系统。
- 将腔室系统转为夹紧模式并开始测量;一旦 Isc 和电导稳定(~15-20 分钟),即可获得基线测量值。
- 为了确保组织是可行的,将腺苷酸环化酶激活剂毛喉素(终浓度10μM)加入血清侧。
- 一旦膜电位差达到峰值并开始下降,实验就完成了。
10. 分析结果
- 在开路条件下,根据欧姆定律,根据响应电流脉冲的电压变化计算跨粘膜电导。应用欧姆定律确定来自跨粘膜电压和电导的等效短路电流(Isc)。
- 使用NaCl的稀释电位,用Goldman-Hodgkin-Katz方程10计算相对离子选择性(PNa/PCl)。
- 使用Kimizuka-Koketsu方程11估计每个离子的紧密结的绝对选择性。
- 使用Goldman-Hodgkin-Katz方程从稀释电位计算PNa/ PCl ,并从Kimizuka-Koketsu方程中确定绝对渗透率PNa 和PCl ,如Yu等人10 所述,如下所示:
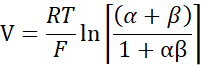

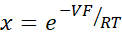

其中,V:稀释电位(mV);α:活动比率。NaCl在HEPES缓冲液中的计算活性除以NaCl在稀释HEPES缓冲液中的计算活性(本实验计算为1.8966);e: 数学常数, 2.71828;GM: 经粘膜电导率 (mS/cm2);F:法拉第常数(96,485.3329 C/mol);R:气体常数(8.314 J/mol K);T: 温度 (310.15 K)
结果
本文显示的结果是已完成的较大项目的一部分(见参考文献4,23,24)。
Cldn15-/-小鼠小肠的经上皮电导降低。
Cldn15-/-小鼠中小肠段的基线经粘膜电导(短路条件下)低于野生型小鼠的测量值(图3A;...
讨论
在该实验中,使用Ussing室测量Cldn15-/-和WT小鼠小肠中NaCl的基线电参数和稀释电位。在进行Ussing腔室实验时,验证实验中使用的膜制备是否可行非常重要。这通常通过添加葡萄糖或腺苷酸环化酶激活剂毛喉素并观察ICC是否适当升高(小鼠100-300μA / cm 2)来完成。评估肠道制剂是否可以接受使用的另一种方法是观察组织的电导率。受损组织通常具有高于正常水平?...
披露声明
作者没有潜在的利益冲突需要披露。
致谢
这项工作由17K00860(到HH)和19K20152(到NI)支持。WH要感谢大冢俊美奖学金基金会在2018-2021年期间提供的财务支持。
材料
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
参考文献
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907 (2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032 (2018).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, 1-19 (2017).
- Östh, K. . The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703 (2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376 (2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。