Method Article
活体转基因小鼠脑围产层钙和血液学成像
摘要
该协议提出了从麻醉小鼠大脑包裹的围带和附近血管的血流数据中获取和分析荧光钙图像的步骤。这些技术可用于壁画细胞生理学的研究,并可以适应研究任何细胞类型的钙瞬态。
摘要
蛋白质生物学和小鼠遗传学的最新进展使得测量 体内 脑细胞的细胞内钙波动并将其与局部血液动力学联系起来成为可能。该协议使用用慢性颅窗制备的转基因小鼠,在α平滑肌肉作用剂促进器下表达基因编码的钙指示器RCaMP1.07,以专门标记壁画细胞,如血管平滑肌肉细胞和包皮膜。步骤概述了如何准备尾静脉导管静脉注射荧光染料,以跟踪血液流动,以及如何测量脑腹膜钙和局部血管血液动力学(直径,红细胞速度等),通过两个光子显微镜 在体内 通过颅窗在氯胺酮/西拉辛麻醉小鼠。最后,通过巴雷特等人开发的图像处理算法,详细介绍了钙的波动和血流电影的分析,重点是这些过程如何适应其他细胞成像数据。
引言
中枢神经系统血管由穿透动脉、毛细血管和上升静脉组成。在这个网络中,壁画细胞,如血管平滑肌肉细胞包裹动脉和腹膜沿第一个动脉分支和毛细血管1扩展细胞过程。围产层在大脑中似乎有几个作用,包括维持血脑屏障1,2,迁移和动能3,潜在的干细胞特性,以及调节脑血流4,5,6。围产期的许多功能作用都与细胞内钙的波动有关,这些波动可能调节这些细胞的扩散或收缩4、5、6。
最近的几项研究已经设定了识别不同类型的脑周细胞7,8的标准。穿透动脉前4个分支中的壁画细胞根据收缩蛋白α光滑肌肉作用素(αSMA)的表达和其突出的卵样索马塔,其过程围绕血管7,8,9包裹,包裹在腹膜上。为了可视化包裹内膜的钙波动,本协议使用一种新的转基因小鼠线,Acta2-RCaMP1.07,也称为Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J10。这些小鼠在βSMA表达细胞(血管平滑肌肉细胞和包皮外膜)中表达红色基因编码钙指标RCaMP1.07。繁殖殖民地通过与杂交动物交叉来维持。RCaMP1.07是一种红色荧光蛋白,具有镇静剂结合域,当与细胞内钙10、11结合时,可增加荧光。本协议概述了两个光子显微镜结合围板钙成像和血流量测量的步骤,包括荧光染料尾静脉注射程序、麻醉小鼠显微镜图像采集以及与编程平台的数据分析(图1)。这些技术可用于解决有关壁画细胞生理学的问题,但可以适应研究大脑或其他器官系统中任何细胞类型的钙瞬态。
一只10个月大的雌性Acta2-RCaMP1.07小鼠被用于本文中提出的实验。两个月前,小鼠接受了慢性颅窗和头部后植入手术。手术方案的细节在以前的研究中讨论12,13和类似的程序已经执行在其他先前公布的协议14,15。血管被标记为绿色荧光素-德克斯特兰(70,000兆瓦,电离溶液,2.5%w/v)静脉注射。这种染料具有成本效益,从商业来源随时可用,但它具有更广泛的排放光谱,可能与 RCaMP 排放重叠,并在显微镜图像采集过程中渗出。下面的第 4 节概述了光谱未混合的步骤,以规避这种情况,但也可能使用其他排放光谱较窄的绿色染料,如基于 EGFP 的染料。
研究方案
马尼托巴大学动物护理委员会批准了所有涉及实验动物的程序,该委员会由加拿大动物护理委员会管理。
1. 程序设置和准备
注:尾静脉导管注射需要以下物品:胰岛素注射器、15 厘米的 PE10 管、30 G 针头、纱布、盐水、钳子、绿色荧光素德克斯特兰染料、钳子和剪刀。此外,准备好一针氯胺酮/西拉津麻醉剂,将在成像会话前注射。
关键:第 1 步和第 2 步中的所有材料和设备在使用前必须用 70% 乙醇自动包装或冲洗进行消毒。如果钳子不能正确消毒,建议使用一对大针架。导管装配必须用钳子和钳子进行,以避免意外的针刺。
- 切割约15-20厘米的聚乙烯管,PE10(公元28毫米):O.D. 61 毫米)。
- 将 27 G 胰岛素注射器填充 0.9% 的盐水,并将注射器的针头插入聚乙烯管的尖端。将盐水推过管子,确保没有泄漏。
- 使用钳子,来回弯曲 30 G 针(0.3 毫米 x 25 毫米),直到它从中心断裂。针必须干净,没有弯曲。
- 用钳子握住针头,小心地将针头插入附着在盐水填充注射器上的PE10管末端,并去除气泡。这是注射导管。
- 在注射前通过 13-25 μm 过滤器过滤 30 μL 的 2.5% (w/v) 荧光素 dextran。
- 用德克斯特兰的 30 μL aliquot 填充另一个胰岛素注射器,并确保填充的注射器中没有气泡。
2. 尾静脉注射
- 用异黄酮(4%感应,1.5%维护)或氯胺酮/西拉津(60毫克/千克;10毫克/千克;即p.)麻醉小鼠,并涂抹眼润滑剂凝胶。氯胺酮/西拉津建议在成像过程中进行更稳定的血流量测量,剂量可增加到90毫克/千克:10毫克/千克氯胺酮/西拉津,用于更长的成像过程。
- 当小鼠在麻醉的手术台上时,在尾巴上放一个装满温水的手套来拉皮横静脉。
- 30岁后取下手套,用乙醇清洁尾巴。
- 将尾巴放在拇指和中指之间。用食指在尾巴上施加压力以拉伸静脉。另一方面,拿起导管的针头,用钳子将挡板向上朝向天花板。
- 用 70% 乙醇清洁尾部后,以 0° 角将针头插入静脉,并通过导管轻轻注射盐水,以确保针头正确放置。
注意:如果柱塞没有阻力,没有尾巴肿胀,那么针头就静脉了。如果有显著的阻力或肿胀,针头应去除。步骤 2.2-2.5 可以在尾部两侧重复多达 3 次,每秒钟试用一次导管末端的 30G 针头,直到放置正确。 - 针头静脉注射后,用含有荧光素德克斯特兰(第 1.6 步)的注射器在导管末端切换盐水注射器。慢慢地将德克斯特兰注入导管管中,确保导管不会冒泡。如果气泡明显,请切开含有气泡的管子将其取出并重新连接注射器。
- 注射所有脱氧酒(30 μL aliquot)后,取出注射器,用盐水注射器代替。将管子中剩余的德克斯特兰注射到鼠标中,直到管子中不留下任何染料。
- 从尾部取下针头,用纱布施加压力10-30s,直到出血停止。
关键:如果经过6次尝试后,尾静脉注射不成功,动物应该在另一个会话中成像。此外,注入鼠标的总体积(盐水和德克斯特兰)不应超过 100 μL。
3. 两次光子显微镜
- 聚焦颅窗
注:在数据采集过程中使用氯胺酮/西拉津麻醉,因为它的血管效应(血管吸附)比异黄酮小。如果在上述步骤中使用异黄酮,请在成像前给小鼠注射氯胺酮/西拉津(建议剂量上述)。- 用螺丝将鼠标通过头柱固定到显微镜下带有加热垫的平台上。
- 将眼润滑剂涂抹在鼠标的眼睛上。
- 用潮湿的牙科施用器清洁颅窗。确保没有粒子会干扰成像过程。
- 在窗口上涂抹超声波凝胶。
- 通过双光子显微镜目标聚焦,直到在窗口下可以看到皮亚血管。
- 检查鼠标的呼吸,并确保加热垫提供足够的温度支持。
- 图像采集
注:本实验中使用的双光子显微镜具有可调谐的Ti-蓝宝石激光器,用于荧光激发,其波克尔细胞控制着到达样品的激光量。发射光由 565 长通二色分割成两个 GaAsP 光电图管 (PMT),带 595/50 频段通过滤镜(红色)和 525/70 频段通过滤镜(绿色)用于检测。
步骤 3.2 到 3.4 中描述的程序使用本协议中的双光子显微镜的特定软件执行(参见 材料表)。这些步骤可以适应其他显微镜软件和设备。- 在关闭房间灯后,将显微镜软件中所需的波长设置为 990 nm,通过单击 2P 激光 盒来激发 RCaMP 和荧光素-德克斯特兰。
- 通过单击 电源/增益 盒/激光 部分,将 Pockels 1 电池电压调整为 30%或 300 值(比例为 1000)来设置激光功率。在此设置下到达样品的激光功率以前被确定为 ±30mW。
- 通过单击 电源/增益 盒/PMT 部分并将值调整为 700-800 来设置 PMT 探测器的灵敏度。
注:这些值可以相对于荧光样品的强度进行调整,在打开房间的灯之前应设置为零。 - 进入 "图像分辨率" 部分,单击 512 x 512 分辨率以获得更大的图像大小。
- 单击 2P 激光/打开 以打开 2P 激光快门。
- 前往 扫描部分 并单击 实时扫描 按钮。
注:通过这些参数和更高分辨率进行实时扫描,可以看到 RCaMP 阳性壁画细胞和荧光标记的血浆。如果信号较弱,则在图像清晰之前,可以增加 pockel 值。
关键:在表面组织层中,激光功率不应超过 50 mW,在本示例中的 Pockels 细胞设置中,激光功率约为 600。
- 获取壁画细胞和血管网络的深度堆栈
注:建议获取深度堆栈,以正确定位血管网络中的围板。穿刺围板位于从穿透动脉7,8,9的第一到第四分支。本协议中使用的显微镜软件将深度堆栈称为"Z 系列"。- 移动X、Y和Z平面的显微镜目标,根据RCaMP的平滑肌肉细胞标记,将大脑表面的大动脉定位。
- 单击 Z 系列 框。
- 聚焦在皮亚尔容器附近的组织顶部,通过单击当前 Z 系列 /开始位置 [μm] 部分,将此设置为 Z 系列堆栈的零点和顶部。单击顶部有四条黑色条纹和一条红色条纹的框。
- 通过单击 当前 Z 系列/停止位置 [μm] 部分,将组织内的焦点向下到所需的深度,并将此设置为堆栈的底部。单击底部有四条黑色条纹和一条红色条纹的框。
- 通过在"步幅大小"按钮下方的框中键入所需的值(步幅大小按钮在Z 系列/当前 Z 系列部分中进行本地化),将每个图像平面的厚度(步幅大小)设置为 1-2 μm。这将定义在堆栈中获取的图片数量。
- 通过单击激光 /PMT 补偿 框并选择 相对(指数梯度),设置激光功率,随着显微镜在堆栈中移动的深度,激光功率呈指数级增长。
- 命名文件,选择一个文件夹来保存它,并点击 开始Z系列。
- 收购后,在成像处理软件中打开 Z 系列。
- 将两个通道合并为彩色图像,并通过点击框 "图像|扫描"以查找感兴趣的围带和血管颜色|拆分通道;图像|颜色|合并通道。
- 选择包含围网体 的兴趣区域 (ROI),并保存位置,以帮助在未来的成像会话中再次定位这些点。
- T 系列钙成像电影采集(时间)
- 使用从上面的深度堆栈和ROI作为参考,在实时扫描模式下移动X、Y和Z轴中的显微镜目标,直到找到感兴趣的围网。
- 要收集腹膜钙事件的电影,请通过访问 图像分辨率 部分并单击 128x128 框来提高获取帧速率(每秒 10 帧>) 。
- 通过单击 T 系列 框并输入持续时间框中的时间,将成像持续时间设置为 60s。
- 在 "保存路径" 框旁边,单击 带有三个点的按钮 ,以使用唯一的文件名称更新保存路径。
- 在容器上进行光学缩放,以考虑较低的分辨率,并通过调整 光学变焦 [mag] 部分的值来更近距离地查看近地层。
- 点击启动T系列获取 T系列。
- 血液动力学测量与 kymograph (线扫描)
- 在实时扫描模式下,以512 x 512像素分辨率聚焦感兴趣的容器。
- 要测量血管直径和红血球速度,请单击 线扫描 ,使用显微镜开始一维扫描。
- 将扫描时间(30-60 秒)设置为毫秒。
- 画一条线,将感兴趣的容器分割开来,沿着容器平行移动。这将生成左侧血管直径的基姆图和通过右侧血管的红血球条纹。
注:只要血管处于同一成像平面,就可以用相同的线进行测量。 - 命名文件并单击 "开始线"以 获取数据。
4. 图像分析
- 钙电影分析。
注:此协议概述了光谱未混合的步骤 (图2) 和两种不同的方法来分析包壳围产层钙事件使用手动,手工选择的ROI (图3) 和基于活动的自动投资回报率选择 (图4)16,17.为了检测和分类信号峰值与从每个投资回报率的规范化钙跟踪,数据是长通和带通过过滤,这有助于平滑数据的振幅和宽度估计,也识别不同形状的峰值:单峰,多峰和高原(图 3B).此分析的参数可以优化以检测不同类型的动态蜂窝信号。下面的步骤将需要使用图像处理软件和编程软件与图像处理包包含不同的代码来分析上述钙电影。请参阅材料表,了解此协议中使用的程序和包的完整列表。可以导入不同类型显微镜的成像数据,这些封装可维护图像中的元数据。
注:步骤 4.1.1-4.1.7 描述了如何在手动图像处理软件中选择 ROI,以便随后在手动钙分析方法中使用(第 4.1.16 步)- 将.xml文件拖到软件工具栏,在图像处理软件中加载钙成像 T 系列。单击 "确定" 框。
- 以堆栈的平均值为例(堆栈的平均值被图像处理软件标记为"Z 投影")。这可以通过单击图像|来完成 堆栈| 工具栏中的 Z 投影。
- 从两个通道制作彩色图像,如第 3.3.9 步。
- 点击框中分析|,打开 ROI 管理器窗口 工具|投资回报率经理,或只是按字母"T"在键盘上。
- 通过单击图像处理软件工具栏上的 多边形形状 来选择多边形工具,并勾勒出可见的包裹围城结构,如 soma 和工艺。
- 单击位于 ROI 管理器窗口中的 "添加 "按钮,在 ROI 管理器中添加选定的 ROI。
- 单击 "重命名" 按钮,为每个感兴趣的区域提供一个独特的名称,并将它们保存为拉链文件夹,稍后可以通过单击 More 在编程软件中加载 >> |保存。
注:步骤 4.1.8-4.1.14 描述了如何将钙 T 系列导入编程平台,以及如何将显微镜 PMT 检测到的不同荧光素解混合到不同的通道中(图 2)。 - 打开编程软件,确保图像处理包的文件夹在路径上(参见 材料表)。
- 通过在编程平台命令窗口中调用 BioFormats 功能将钙 T 系列导入编程软件,该窗口会自动打开文件选择窗口。
- 通过输入所需的数字来定义每个通道上的内容。在此示例数据中,第 1 频道回答=6(cellular_signal)、第 2 频道答案=1(blood_plasma)。
- 将数据绘制为编程软件中的电影,通过调用 绘图 功能来促进可视化。
- 要去除渗入红色 RCaMP 通道的荧光素-德克斯特兰的绿色荧光,请通过调用编程平台命令窗口中的 unmix_chs 功能来解密图像处理包中的通道。
- 选择仅包含第 1 频道此荧光荧光的区域,例如此情况下的 RCaMP。
- 选择仅包含荧光 2 中的荧光的区域,例如此示例中的血浆中的荧光素。
- 选择一个没有荧光的背景区域。这将生成一个光谱贡献矩阵,该矩阵应用于每个通道中的每个像素。它显著改善了 RCAMP 信号的本地化,这将增强这些结构中的钙事件检测。
注:如上所述,在图像处理包中可以分析钙成像数据的方法有很多种。步骤 4.1.16-4.1.23 描述了使用手动选择的 ROI 分析包壳围层钙事件的方法。 - 通过在编程平台命令窗口中调用 CellScan 功能,对未混合的钙膜进行细胞信号分析。
- 代码会询问"您想使用哪种 ROI 检测方法?键入 数字 2 将手选 ROI 加载到编程平台。
- 从拉链文件夹中加载较早前从围网中手工选择的感兴趣区域(步骤 4.1.6)。
- 代码会问"规模因素是什么?确定手选 ROI 相对于所分析的图像系列的刻度因子,并键入刻度数。在此示例中,比例因子为 1,因为 ROI 不需要调整大小,因为它们是在具有 128x128 像素的图像上选择的,其分辨率与原始钙电影相同。
- 通过调用命令窗口中的流程和图示功能,生成每个 ROI 的图图和不同颜色的规范化钙痕迹 (图 3A)。
- 如果代码未检测到单个痕迹中的大多数钙事件,则通过调用 opt_config 函数并调整值来修改配置优化框中的内置参数,例如将短途过滤数据的阈值降低到基线周期标准偏差的三倍,这是 T 系列的前 30 帧。
- 选择优化框中的 "过程 "按钮以应用新参数。
注:为了检测和分类信号,规范化的钙痕迹是长通和带通过滤,这有助于平滑数据的振幅和宽度估计,但也确定信号是单峰,多峰或高原(图3B)。 - 将数据输出为.csv文件,其中包含有关感兴趣区域的空间信息以及通过调用命令窗口中的 output_data 函数来识别的峰值。给文件一个独特的名称,以便在统计程序中进一步分析。
注:步骤 4.1.24-4.1.31 描述了使用基于活动的投资回报率分析分析包膜围层钙事件的方法。 - 重复步骤 4.1.8.-4.1.16 导入钙电影,拆解通道,并在编程平台中调用 CellScan 功能。
- 代码会询问"您想使用哪种 ROI 检测方法?键入 数字 6, 根据 3 维(x、y 和时间)的荧光活动和变化选择自动兴趣识别区域:"3D FLIKA 算法")。
- 通过调用命令窗口中的进程和绘图功能,绘制处理结果,将已确定的兴趣区域视为不同的颜色。每个投资回报率在时间和空间上都非常出色,并作为叠加面膜表示(图4)。
- 如果算法无法检测到眼睛清晰可见的 ROI,请通过调用 opt_config 函数并调整值来修改优化框内的内置参数,例如增加及时平滑数据的高斯过滤器(2 s),将查找 ROI 的阈值降低到基线标准偏差的 3 倍。
- 选择优化框中的进程按钮以应用新参数。随着优化过程,应识别更多的投资回报率(图4B)。
- 将 ROI 绘制为电影,通过将 默认 框的模式更改为优化窗口内 的电影 ,以清晰识别活动区域(以彩虹色勾勒)以进一步可视化。
- 通过在命令窗口中调用 output_data 功能,将数据输出为 csv 文件。此文件可以在统计程序中进一步分析。
注:分析参数可以调整以适应任何类型的动态细胞信号(钙、FRET 比率等)。以上所有步骤都可以使用简单的编程代码实现自动化,以便用相同的设置批量处理许多钙电影。
- 线扫描血流量分析。
- 将第 3.5 节中获取的线扫描 kymograph 数据文件导入编程软件。
- 代码会问"频道 1 和 2 显示的内容?在提示时定义每个通道上的内容。在此示例中,通道 1 是空白(类型 0),通道 2 是blood_plasma(类型 1)。
- 通过调用 LineScanDiam 功能来运行线路扫描中的直径分析功能,该函数打开一个框来选择与 kymograph 中的直径对应的区域(图 5B,左图)。
- 在与容器直径相对应的基姆图荧光边界外绘制一个框。
- 通过调用过程函数来处理此数据类,以测量容器直径最大半宽度,并生成具有绘图函数的图 (图 5C)。
- 通过在命令窗口中调用 output_data 功能,将数据输出为 csv 文件。此文件可以在统计程序中进一步分析。
- 通过调用 LineScanVel 功能来运行速度 radon 转换分析,该函数打开一个框来选择 kymograph 中对应 RBC 速度的区域(图 5B,右图)。
- 在与船速相对应的基姆图荧光边界内绘制一个框。
- 通过调用过程函数来处理此数据类,以便从荧光条纹的角度计算红血球的速度、通量和线性密度。生成具有绘图函数的绘图(图 5D)。
- 通过在命令窗口中调用 output_data 功能,将数据输出为 csv 文件。此文件可以在统计程序中进一步分析。
注:基姆图必须在黑色空间之间具有清晰的荧光和清晰的边缘,以便直径和速度分析准确(图5A,B)。以精确的方式绘制正交线和平行线非常重要,否则将不可能对基姆图进行可靠的分析。与图像处理算法的钙分析类似,可以优化直径和速度计算的参数。
结果
氟辛-德克斯特兰具有广泛的发射光谱,可以渗入红色通道,影响包裹腹膜的 RCaMP 检测(图 2A)。软件程序中数据采集后光谱未混合可减少荧光素出血(图2B,下图),在随后的分析步骤中增强钙信号检测。
使用本协议中使用的图像处理算法进行钙分析,可以采用几种不同的方法来识别 ROI 和细胞内钙波动(即钙信号)。通过手工选择细胞结构可以检测这些区域内的钙波动(图3A),包括不同类型的信号峰值,如单峰和多峰,在规范化的钙痕迹被低通和带通过滤后(图3B)。此外,使用Ellefsen等人开发的图像处理算法(Ellefsen等人开发的2014年16和Barett等人2018年17)将活动像素分组在一起,荧光强度会随着时间的变化而变化,从而识别ROI。这可以通过调整时间、阈值和空间参数来覆盖信号的预期大小和形状,应用于任何动态蜂窝信号。降低信号识别阈值会发现更多感兴趣的区域(图4B)。
可以分析明亮和清晰的血液动力学基仪,以测量近层围板血管的直径和RBC速度(图5A,B)。直径是从荧光最大半宽度(图5C)的全宽度计算出来的。RBC 速度与未标记的 RBC 的条纹大致相关,该条纹将角度输入 Radon 转换以计算速度、通量(细胞/s)和线性密度(单元格/毫米;图5D)。当荧光饱和度、信号对噪声比差或成像场运动(图6A)时,质量差的基姆图会产生不可靠的图,错误点(红十字)无法确定数据(图6B,C)。获得的数据的质量对于取得良好结果至关重要,遵循本协议中描述的步骤可以确保良好的结果。
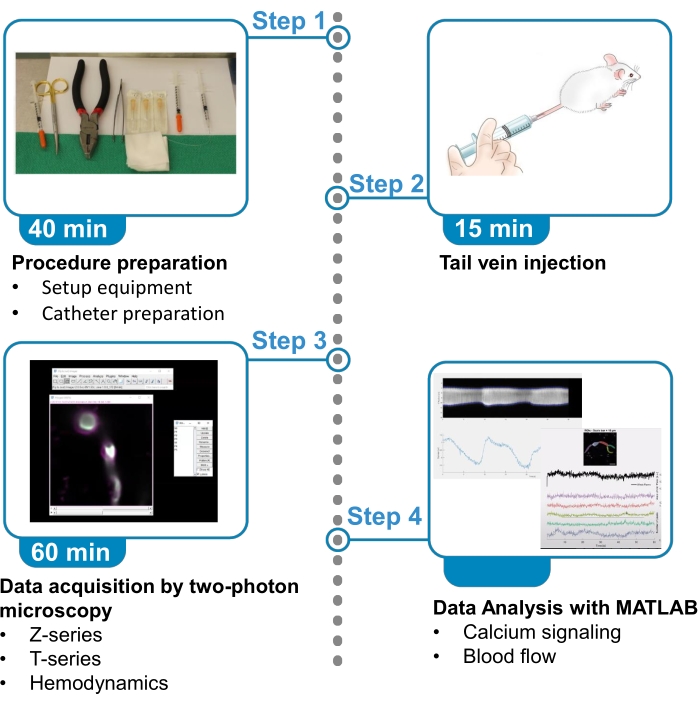
图1。协议摘要。 该协议提出了从麻醉小鼠大脑包裹的近膜和附近血管的血流数据中获取和分析荧光钙图像的步骤。该协议分为 4 个步骤。1) 程序准备:设置设备和导管准备:2) 尾静脉注射;3) 双光子显微镜采集数据:4) 具有图像处理算法的数据分析。 请单击此处查看此图的较大版本。
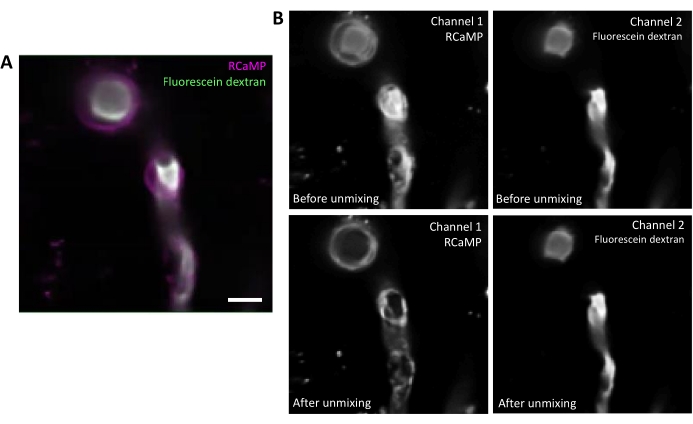
图2。荧光的光谱未混合。 A) RCaMP 包裹腹膜和荧光素- 德克斯特兰标记血管从 T 系列收购代表平均图像。比例栏= 10 μm.B) 上部:在考虑单个频道时,第 2 频道的出血在第 1 频道(左)中显而易见。较低:光谱未混合后,出血通过减少,来自 RCaMP 的信号在围层结构中更加突出。 请单击此处查看此图的较大版本。
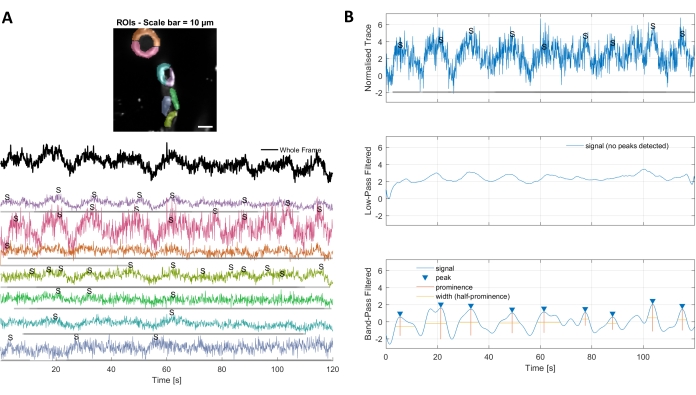
图3。手工选择的ROI和优化的钙痕迹。 A) 使用图像处理软件(彩虹形状)中选择的兴趣区域可用于识别钙信号痕迹。B) 通过低通和带通过滤数据,从规范化的痕迹中识别信号峰值。我们将信号阈值定义为基线周期(前 30 帧)标准偏差的 3 倍,并且任何超过此阈值的峰值都被视为信号(下跟踪)。 请单击此处查看此图的较大版本。
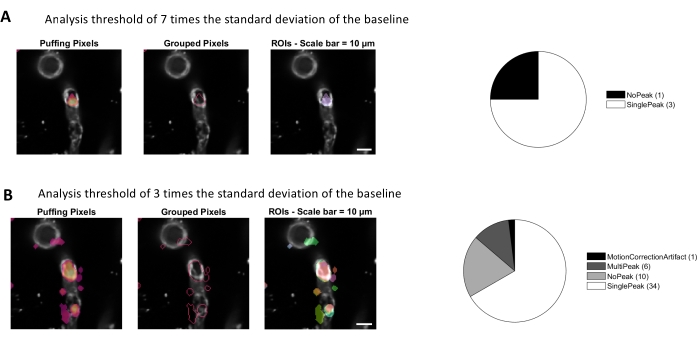
图4。用于钙分析的基于活动的自动 ROI。 分析相同的数据的阈值是基线 (A) 标准偏差的 7 倍,是基线 (B) 标准偏差的 3 倍。降低识别活动像素的阈值会发现周边字节内的更多 ROI (B) 和信号峰值(饼图)。 请单击此处查看此图的较大版本。
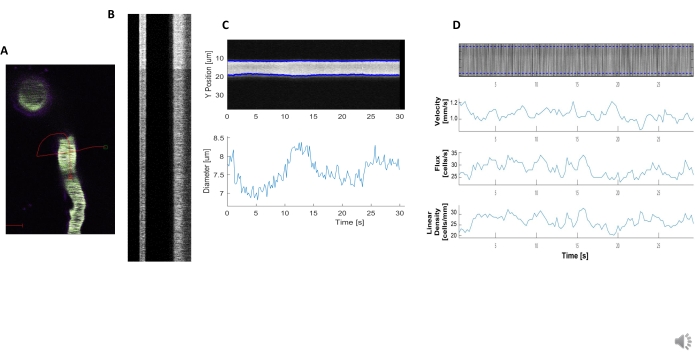
图5。基姆图血态测量。 A) 通过容器进行示例线扫描。B) 直径(左)和速度(右)定义明确的基姆图示例。荧光正确带内的黑色条纹对应于 RBCs .C) 直径分析,具有明显的血管运动波动。D) 速度分析,带 Y 轴+ RBC 通量(单元格/s)、线密度(单元/毫米)、速度(mm/s)和条纹角度(度)、信号与噪声比(任意单位、a.u.)、X 轴+时间(秒)的图。 请单击此处查看此图的较大版本。
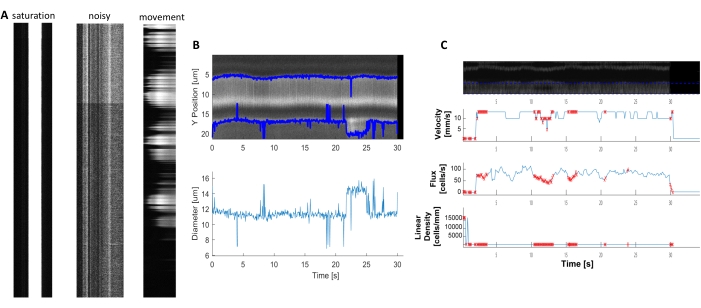
图6。质量差的血液测量的表示。 A) 荧光饱和度、信号与噪声比差或采集过程中成像场移动质量差的 kymograph 示例。B 和 C) 由于基姆图的质量差,与直径和速度数据 图 7 相似的图 7 的绘图具有误点(红点)。(图像 E、Y 轴=直径 (μm)、X 轴=时间 (秒);图像 F、Y 轴+ RBC 通量(单元格/s)、线密度(细胞/毫米)、速度(毫米/秒)和条纹角度(度)、信号与噪声比(a.u.)、X 轴+时间(秒)。 请单击此处查看此图的较大版本。
讨论
本方法通过导管、深度堆叠的双光子显微镜图像采集、细胞钙信号膜、造血机同源测定仪、钙和血液学分析等细节,使用我们的图像处理算法17(图1)。这些技术有几个优点,可以改善体内成像结果,减少会话中的时间、资源和动物压力。首先,使用导管注射尾静脉可以控制针头、注射器和注射到小鼠血液中的物质量。此外,它防止染料注射到尾部组织,节省昂贵的试剂。其次,我们使用转基因小鼠,它表达基因编码的钙传感器在包裹周边细胞,并演示如何定位他们的大脑血管网络与深度z堆栈,这有利于细胞识别和搬迁在随后的成像会议长期。这是围网细胞研究的一个重要因素,并确保正确的细胞分类6,7。第三,我们提供收集钙膜和血液同位素线扫描数据的参数,这些数据是测量动态细胞信号的良好起点。最后,我们介绍了我们的图像处理算法17,一个全面的图像处理工具箱,其中包含图像预处理(如光谱未混合)、钙图像分析和血液同位素分析(直径、速度等)的多种方法。这些算法可以生成图,以便快速、轻松地可视化数据,同时最大限度地减少分析结果所需的用户专业知识水平。此外,它可以自动使用几行代码快速批量处理具有相同参数的多个数据集。这有可能改善数据可视化和研究人员的时间投入。
收集良好的钙成像数据的关键是调整激光功率和PMT设置,以获得清晰的荧光信号,但也以足够的帧速率收集数据,以捕获整个钙事件。此协议中的数据以每秒 10-11 帧的速度获取,从而捕获包裹围板中较慢的钙振荡。分析过程中还有几个步骤可以改进分析结果。首先,如果氟的发射光谱(图2)之间有显著重叠,光谱未混合是有益的。氟辛-德克斯特兰用于本协议,因为它是一种具有成本效益和商业可用的德克斯特兰结合体,通常用于血液测量5。光谱未混合有助于清理数据,以增强钙信号的检测,但也可以使用排放光谱较窄的替代氟。其次,手工选择细胞结构作为ROI(图3)对于对不同亚细胞区域(如索马或工艺分支)的钙事件进行分类是有用的。基于活动的ROI选择(图4)16提供了更多关于个别钙事件的空间和时间信息。当确定特定区域的钙事件频率或将事件传播到其他细胞区域时,这很有帮助。使用编程软件分析成像数据可以节省研究人员处理数据所需的数小时时间,但需要一些初始时间投资来调整参数以获得最佳结果。最重要的因素是活动区域的预期大小(在 μm2中)以及信号的持续时间(必须定义最小信号时间和最大信号时间)。研究人员必须首先检查一些T系列电影的例子,以最好地确定哪些参数适合他们的数据。最后,在显微镜上获得的劣质数据会极大地阻碍钙和血液动力学的分析(图6)。因此,应谨慎优化显微镜采集设置。考虑到这些因素,此协议可以适应钙成像或分析其他组织或细胞类型的其他动态细胞信号(例如荧光钠、钾、代谢物或电压波动)。
此协议有几个限制。首先,这些数据是在麻醉下收集的,麻醉会影响大脑活动,并可能影响血液流动。类似的成像可以在清醒的小鼠身上进行,这些小鼠经过训练,接受头部固定,以获得更多的生理结果。此外,重要的是要记住,我们收集2维图像的3维细胞和血管 在体内。因此,我们只能捕捉到这些细胞内钙事件的一个派系,或者一次在血管的单个部分的血流。
需要注意的另一个限制是,双光子钙成像对运动器件很敏感,在运动器件中进出焦距平面的运动可能被误认为是钙的波动。此协议是在麻醉下执行的,它限制了动物的运动:然而,运动神器可以通过小鼠的呼吸速率,心率,可能的组织肿胀,并在包皮细胞,血管收缩或血管运动的情况下引入4,6,18,19。运动伪影可以通过多种策略来缓解。本协议中使用的图像处理包包括一个可选的运动校正步骤,该步骤利用二维卷积引擎根据可见血管13、17对齐T系列中的图像。焦距平面有显著变化的帧由此算法识别,可排除在分析之外。此外,还可以在成像处理包中使用统计策略,例如生成荧光痕迹时的 Z 分数,以使运动诱发的钙波动正常化20。在双光子成像中,最可靠的解释运动伪影的方法是将同一细胞内两个荧光指示器的表达组合在一起,例如钙指示器(例如 GCaMP)和荧光记者(例如 mCherry),这些荧光灯是独立的。荧光机的波动可以归因于运动,并从钙指示信号中减去,使运动器件正常化。
本协议的目的是明确了解如何 在体内 收集最佳的钙成像和血流数据,并提供研究人员可以实施的新方法和分析工具,以提高其结果。这些技术可用于研究不同围甲酸盐群在血流量控制或不同脑病状态中的作用。这些成像参数还可用于研究其他细胞类型和器官系统的钙和血流,类似的原理也适用于其他基因编码传感器(钙之外)可能实现的其他动态成像技术。
披露声明
作者没有什么可透露的。
致谢
J. Meza 得到米塔克斯和马尼托巴省研究部的研究金的支持。这项工作的资金由加拿大卫生研究所、马尼托巴省研究所、马尼托巴省医疗服务基金会提供,马尼托巴大学和加拿大大脑研究所通过加拿大大脑研究基金提供启动资金,加拿大卫生部和Azrieli基金会提供财政支助。这里表达的观点不一定代表卫生部长或加拿大政府的意见。
材料
| Name | Company | Catalog Number | Comments |
| Acta2-RCaMP1.07 | The Jackson Laboratory | 28345 | In the video protocol the animal model used is a female mouse of 10 months, 1 day old. |
| Applicators (Regular) | Bisco | X-80250P | |
| BioFormats package for MATLAB | NA | NA | Denominated in this protocol as "image processing packages". Available in: https://docs.openmicroscopy.org/bio-formats/ |
| CHIPS MATLAB toolbox | NA | NA | Denomitaded in this protocol as "image processing algorithms". Barrett MJP, Ferrari KD, Stobart JL, Holub M, Weber B. CHIPS: an Extensible Toolbox for Cellular and Hemodynamic Two-Photon Image Analysis. Neuroinformatics. 2018;16(1):145-147. doi:10.1007/s12021-017-9344-y. Available in: https://github.com/EIN-lab/CHIPS |
| Clear Ultrasound Gel, Medium viscosity | HealthCare Plus | UGC250 | |
| Dextran, fluorescein, 70,000 MW, anionic | Thermo Fisher Scientific | D1823 | |
| Dextran, Texas Red, 70,000 MW, neutral | Thermo Fisher Scientific | D1830 | |
| Eye Lube Plus | Optixcare | NA | |
| FIJI | Image J | NA | Denominated in this protocol as "image processor software". Available in: https://imagej.net/Fiji/Downloads |
| GCaMP6sfl/fl | The Jackson Laboratory | ||
| Head Post fixing platform | University of Zurich | NA | |
| Ketamine (Narketan 100 mg/mL) | Vetoquinol | 440893 | |
| MATLAB R2020b | NA | Denominated in this protocol as "programming platform ". Available in: https://www.mathworks.com/downloads/ | |
| Needle 0.3mmx25mm | BD PrecisionGlide | 305128 | |
| Objective XLUMPLFLN20XW | Olympus | NA | https://www.olympus-lifescience.com/en/objectives/lumplfln-w/ |
| PDGFRβ-CreERT2 | The Jackson Laboratory | 30201 | |
| Polyethylene Tubing, PE10 I.D. 28mm (0.11”) O.D. 61mm (.024”) | BD Intramedic | 427401 | |
| Prairie View | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Ultima In Vitro Multiphoton Microscope | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Under Tank Heater | Reptitherm U.T.H | E169064 | |
| Xylazine (Rompun 20 mg/mL) | Bayer HealthCare | 2169592 |
参考文献
- Armulik, A., Genové, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Berthiaume, A. -A., et al. Dynamic remodeling of pericytes in vivo maintains capillary coverage in the adult mouse brain. Cell Reports. 22 (1), 8-16 (2018).
- Rungta, R. L., Chaigneau, E., Osmanski, B. -F. F., Charpak, S. Vascular compartmentalization of functional hyperemia from the synapse to the pia. Neuron. 99 (2), 362-375 (2018).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nature Methods. 9 (3), 273-276 (2012).
- Gonzales, A. L., et al. Contractile pericytes determine the direction of blood flow at capillary junctions. Proceedings of the National Academy of Sciences of the United States of America. 117 (43), 27022-27033 (2020).
- Hartmann, D. a, et al. Pericyte structure and distribution in the cerebral cortex revealed by high-resolution imaging of transgenic mice. Neurophotonics. 2 (4), 041402(2015).
- Grant, R. I., et al. Organizational hierarchy and structural diversity of microvascular pericytes in adult mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 39 (3), 411-425 (2017).
- Hill, R. A., Tong, L., Yuan, P., Murikinati, S., Gupta, S., Grutzendler, J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 87 (1), 95-110 (2015).
- 28345 - STOCK Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J. Jackson Laboratory. , Available from: https://www.jax.org/strain/028345 (2021).
- Ohkura, M., Sasaki, T., Kobayashi, C., Ikegaya, Y., Nakai, J. An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS ONE. 7 (7), (2012).
- Stobart, J. L., et al. Long-term in vivo calcium imaging of astrocytes reveals distinct cellular compartment responses to sensory stimulation. Cerebral Cortex. 28 (1), 184-198 (2018).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. JoVE. (12), e680(2008).
- Lin, X., et al. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. JoVE. (143), e56297(2019).
- Ellefsen, K. L., Settle, B., Parker, I., Smith, I. F. An algorithm for automated detection, localization and measurement of local calcium signals from camera-based imaging. Cell Calcium. 56 (3), 147-156 (2014).
- Barrett, M. J. P., Ferrari, K. D., Stobart, J. L., Holub, M., Weber, B. CHIPS: an extensible toolbox for cellular and hemodynamic two-photon image analysis. Neuroinformatics. 16, 145-147 (2018).
- Hall, C. N., et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 508 (1), 55-60 (2014).
- Nilsson, H., Aalkjaer, C. Vasomotion: mechanisms and physiological importance. Molecular interventions. 3 (2), 79-89 (2003).
- Rungta, R. L., et al. Vascular arbors in layer II / III somatosensory cortex. Communications Biology. , (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。