Method Article
用于慢性和急性体内记录的碳纤维微电极阵列 的 构建和实现
摘要
该协议描述了一种构建碳纤维微电极阵列的程序,用于从多个大脑区域对小鼠(肌肉肌肉)和雪貂(Mustela putorius furo)进行慢性和急性体内电生理记录。在购买原碳纤维到微电极阵列植入后,每个步骤都进行了详细描述,重点是微电极阵列的构建。
摘要
多通道电极阵列提供对工作大脑的洞察,并用于阐明单细胞和电路水平的神经过程。这些工具的开发对于理解复杂的行为和认知以及推进临床应用至关重要。然而,在很长一段时间内稳定和连续地从细胞群中密集记录仍然是一个挑战。许多流行的电极,如四极管和硅阵列,具有大的交叉直径,在插入时产生损伤,并引发与神经元死亡相关的慢性反应组织反应,阻碍稳定,连续的神经活动的记录。此外,大多数线束在通道之间表现出较宽的间距,无法同时记录聚集在小区域中的大量细胞。该协议中描述的碳纤维微电极阵列为这些问题提供了一种可访问的解决方案。该研究提供了一种制造碳纤维微电极阵列的详细方法,可用于 体内急性和慢性记录。这些电极的物理特性使其成为在高细胞密度下稳定和连续的长期记录的理想选择,使研究人员能够在几个月内从单个单元进行稳健,明确的记录。
引言
电极和电极阵列是了解大脑如何在神经元水平上处理信息的宝贵工具。虽然电生理学记录已经实现了两个多世纪1,但仍然不可能以捕获单个神经元尖峰所需的空间和时间分辨率同时测量整个神经回路的活动。虽然非侵入性方法,如脑电图2,正电子发射形貌3和功能磁共振成像4允许全脑测量,但它们不能达到解决神经回路活动所需的空间和时间分辨率2,5。相比之下,使用电压敏感染料或遗传编码钙指示剂的光学成像等成像方法可以实现单单位空间分辨率,但它们带来了诸如时间分辨率低和选择性差等问题3,4,5,6。电气记录是这些方法的强大替代方案。记录电极提供无与伦比的时间分辨率,并允许用户在大脑的任何区域以尖峰时间精度进行测量7。此外,长期植入的多电极阵列(MEAs)能够在几天到几个月的时间内在行为动物中实现大规模(数十至数百个细胞)的单细胞记录8,9。然而,以较高密度记录的硅探针具有较大的足迹并且具有高度侵入性,并且长期植入的阵列通常产生炎症反应,组织封装和神经元死亡10,11,12,13。
现有电极的局限性导致了最近的创新,这些创新允许稳定,高分辨率,长期记录。典型的电极由金属导体组成,例如钨或铂铱,或者是硅基或聚合物基的。虽然基于金属的微线阵列可以保持长期稳定的记录,但它们的占地面积要大得多,单线的直径范围为10-200μm14。相比之下,硅基电极阵列产生具有高空间分辨率的记录,但由于其相对严格的设计,它们通常无法在许多个月内保持来自相同神经元的信号和记录15。硅基阵列的最新发展已经产生了可以可靠地执行慢性记录的电极,但这些阵列不能用于记录大型动物的深部大脑区域,并且用于线性记录9。聚合物阵列的进步提高了单个单元的灵活性和记录稳定性,并在不久的将来提供了高密度记录的潜力,但目前可用性有限8,16,17。碳纤维允许使用此处描述的现成材料进行高密度记录。
碳纤维记录微电极已经使用了几十年,第一个碳纤维电极由插入玻璃微量移液器中的单个碳纤维组成。这些微电极用于单单元细胞外记录,尽管信噪比与最好的玻璃钨微电极相当,但它们具有优势,因为它们具有灵活性,较低的阻抗值和制造简单性18,19。由于碳纤维的生物传感能力,最近加快了开发碳纤维电极阵列的努力。除了增加的生物相容性和优异的导电性外,它们还具有一系列独特的性能,包括耐高温,低相对密度,高拉伸强度,低弯曲刚度,高检测灵敏度以及小横截面积10,12。所有这些特性都推动了碳纤维微电极阵列(CFEA)的发展,这些阵列有助于单个神经元的长期,稳定,高产量记录。这种CFA现在可以手工制作20,21(图1),产生可以在几个月内容纳单个神经元的微电极阵列。这里描述的是CFEA的可访问构建过程,该过程已以两种方式适用于两个物种中单个神经元的急性和慢性记录。
研究方案
所有实验程序均由布兰迪斯大学或华盛顿大学动物护理和使用委员会批准。显示的数据是从一只雌性雪貂和一只雄性小鼠中收集的。
1. 碳纤维和工具的制备
- 商用碳纤维的制备
- 从环氧树脂大小的纤维束中切下8厘米的条带。将条平行地放在坩埚中,然后在400°C的窑中烘烤6小时,以除去商业纤维中的环氧树脂。然后,将烘焙的纤维储存在标准的培养皿或锥形管中。
注:使用直径为7μm的纤维。其他组已使用4μm纤维20、21。 - 准备用于容纳单个纤维的盒。使用3D打印机或激光切割机创建盒和关联的盒式磁带支架(见图2)。
- 将光纤装入盒式磁带。首先在盒式磁带的两长边上放置一块双面胶带,将磁带的边缘与盒式磁带的内边缘对齐。将单个纤维从烤制的束中分离出来,并将它们与盒的短边平行放置,纤维之间保持2-3毫米。确保在每个盒式磁带上安装20-30根光纤。通过在双面胶带上铺设透明胶带,将纤维密封到位。将装满的盒式磁带放入盒式磁带支架中。
注意:对于经验丰富的建筑商,填充一盒纤维需要约1小时。对于新手构建者来说,这个过程可能需要大约1.5-3小时。一个盒子有十个盒,两个盒架可以放在Parylene沉积室中。 - 使用商用真空沉积室用聚对二甲苯C涂覆单个纤维。涂覆需要单次运行。每次运行测量2.3克聚对二甲苯。两个盒式磁带支架一次安装在腔室中。涂层过程每次运行需要约2小时。
注:测量 2.3 g 聚对二甲苯 C 可提供约 1 μm 的涂层。涂层纤维可以无限期储存。
- 从环氧树脂大小的纤维束中切下8厘米的条带。将条平行地放在坩埚中,然后在400°C的窑中烘烤6小时,以除去商业纤维中的环氧树脂。然后,将烘焙的纤维储存在标准的培养皿或锥形管中。
- 碳纤维操纵工具的制备
- 将一小块柔性粘合膜缠绕在30 G针上,与粘合膜形成一个尖锐但柔韧的点。
注意:用线胶片包裹针尖,并在这样做时拉伸线膜,会产生温和的粘合效果,使用户能够拾取和操纵单个纤维。
- 将一小块柔性粘合膜缠绕在30 G针上,与粘合膜形成一个尖锐但柔韧的点。
2. 设计和制造
- 根据要建造的电极的规格选择所需的适当夹具设计。这将基于所需的通道数量以及任何设计添加。
注:夹具是指为电极和电气连接提供锚点的3D打印块。 - 使用计算机辅助设计(CAD)软件创建或更改夹具的特定设计。
- 使用3D打印公司或机构制造商实验室使用高分辨率SLA 3D打印机打印夹具。
3. 组装碳纤维微电极阵列(CFEA)
注意:对于有经验的构建者,此步骤需要约 2 小时,对于新手构建者,此步骤需要约 6 小时。在10倍体视显微镜下执行所有CFEA组装步骤和光纤捆绑步骤。在空气流动最小的环境中完成CFEA的组装,因为这可能会干扰建筑过程。
- 选择构建所需电极所需的适当夹具。
- 使用金属线切割机,切割两根直径为0.003英寸(76.2μm),长约7厘米的钨丝。
- 将每根导线送入夹具连接器端(GND 和 REF)的相应通道。进给足够的材料,直到两端的长度相等,然后将它们拧在一起以将它们固定在夹具上。
注:对于 16 通道急性设计,请确保金属丝适合夹具的脊内。- 涂上紫外线固化的牙科水泥来固定电线。确保在导线通过的开放通道内不会获得任何牙科水泥。
注意:用户应在所有紫外线相关程序中佩戴紫外线过滤护目镜,以防止潜在的眼睛损伤。许多紫外线固化棒都有内置的观察过滤器。 - 使用UV固化棒,固化牙胶20秒。
- 通过夹具的一个臂将夹具固定在珠宝虎钳中。确定夹具的方向,使其中一个侧面平行于地面。
- 在显微镜下定位夹具和虎钳,使连接器端、水槽和漏斗尖端可见。调整夹具的方向,使漏斗远离用户,并且连接器端朝向用户。
- 收集碳纤维工具和锋利的25 G针。
- 将装有Parylene-C涂层纤维的盒放在一张白纸上,胶带面朝上,使纤维不会直接在纸上。
- 使用 25 G 针从暗盒中切出一根碳纤维。通过将针尖滑向要去除的纤维的盒子来执行此操作。
- 如果使用半纤维进行建筑,请如上所述切断纤维的一端。将纤维定向使其笔直,并使用针,通过将纤维切成对纸,将纤维切成两半。为了切割仍然连接到盒的另一半,用先前制作的碳纤维工具握住纤维的自由尖端,然后用针头切割仍然连接到盒的纤维,如上所述。
- 如果使用全纤维进行建筑,请如上所述切断纤维的一端。使用以前制造的碳纤维工具,并保持刚刚切割的纤维的自由端。使用针头将光纤的另一端从盒中切开。
- 使用以前制造的碳纤维工具拾取碳纤维。拿起纤维,使一端距离工具约1厘米。
- 使用附着纤维的碳纤维工具,从夹具的中间盆中通过漏斗片将纤维的较短端送入纤维。使用显微镜进行可视化。
- 继续通过夹具漏斗给光纤,直到光纤的大部分长度通过(见图3A)。
- 使用先前制造的碳纤维工具通过可用通道馈送纤维的后部。通过背部喂养纤维,直到大约5毫米的纤维伸出背部。如有必要,切成所需尺寸(见图3B)。
注:请勿将光纤送入包含金属线的通道。
- 按照上面给出的说明,在夹具的一侧用光纤填充通道的其余部分。
注意:将光纤馈入漏斗时,将一半光纤馈送到漏斗的每个分区中,右半部分通道位于右分区,左半部分通道位于左侧分区。当纤维在漏斗内紧密接触时,纤维之间存在不利的摩擦,导致现有纤维在将新纤维送入夹具时被拉松或断裂。这种分为四个部分提供了一些缓解,因为纤维被保持在较小的束中,直到后面的步骤。 - 使用标准火花轮打火机,将火焰快速传递到连接器端的外露光纤上。确保所有纤维的绝缘层在末端被移除(见图3C)。
注意:暴露于火焰的纤维部分应看起来比纤维的其余部分略薄。 - 通过夹具向火焰纤维供给,以便暴露于火焰的纤维部分现在位于通道内。确保没有纤维伸出夹具的背面(见图3D)。
注:使用碳纤维工具从盆内抓取纤维,并通过夹具将火焰纤维送入。不要触摸暴露于火焰的纤维部分,因为这部分更脆弱。 - 将紫外线固化的牙科水泥涂在夹具盆中的纤维上。填充整个盆地以覆盖通道的开口和漏斗的开口(见图3E)。
- 使用紫外线并固化牙胶20秒。如果牙胶未完全固化,则再固化20秒。
注:确保牙胶不会在通道内流动。
- 使用紫外线并固化牙胶20秒。如果牙胶未完全固化,则再固化20秒。
- 从虎钳上取下夹具,将其翻转,然后按照先前的固定方式将夹具固定在虎钳中。确保包含纤维的一侧现在面朝下。
- 完全按照上述方式用碳纤维填充夹具的空侧。
- 一旦所有通道都有纤维,并且纤维用牙科水泥固定,请从虎钳上取下夹具并定向夹具,以使漏斗指向下方。将夹具固定在虎钳中,使连接器末端指向上方。
- 收集一根尖头25 G针头,一个1毫升注射器,银色导电涂料,棉头涂抹器,油漆稀释剂,纸巾和适当的头戴式连接器。
注:确保银导电涂料混合良好,并且是均匀的溶液。不要让油漆变干。 - 将0.3 mL银漆吸入1 mL注射器中,然后连接尖头25 G针头。
- 小心地将针头插入一个通道,直到被牙科水泥停止。慢慢按下注射器,同时从通道中取出针头,用油漆填充通道(见图3E)。
- 擦拭针头上的所有油漆,然后继续到下一个通道。
- 用油漆填充所有通道。
注:可能需要额外的通道进入通道,因为油漆在通道中设置了前几分钟。
- 用油漆填充所有通道。
- 将棉头涂覆在油漆稀释剂中,然后清洁表面上任何油漆的夹具底座。为此可能需要一些棉头涂抹器。
注意:未浸入油漆稀释剂的棉头涂抹器也可用于清洁夹具。 - 通过将引脚与通道对齐,将头戴式连接器插入正确的方向。确保头戴式连接器直立,并尽可能与夹具齐平(见图3F)。
- 让夹具固化24小时。
- 使用紫外线固化的牙科水泥将头戴式连接器固定到夹具上,方法是沿着头戴式连接器与夹具相遇的边缘涂敷牙科水泥。使用紫外线固化20秒。
- 涂上紫外线固化的牙科水泥来固定电线。确保在导线通过的开放通道内不会获得任何牙科水泥。
4. 纤维束包装
注意:执行此步骤大约需要 30 分钟。对于具有厚厚的PIA材料层的动物模型中使用的电极,请完成此步骤。加固纤维束以尽量减少弯曲。在鼠标过程中,此步骤可能不是必需的。
- 使用水张力将纤维束聚集在一个轴中。使用转移移液器将一滴水从漏斗尖端输送到管束尖端,同时将电极直立固定在虎钳中。
- 首先在漏斗尖端的束周围涂上一层约1.5毫米厚的牙科水泥。用20秒的紫外线固化牙科水泥。
注意:对于皮质记录,不需要进一步的包装。对于更深的大脑区域,在束周围固定一个导管。 - 导管的构造和将管束插入导管
- 测量并切割所需长度的聚酰亚胺管。确保聚酰亚胺管的长度没有留下2毫米的碳纤维尖端。测量并切割一块比聚酰亚胺管短2 mm的30 G金属管。使用旋转工具去除金属管上的任何锋利边缘。将聚酰亚胺管插入金属管内。
- 将电极放置在虎钳中,碳纤维束指向上方。将组装好的管子固定在显微操作器上,并使用显微镜小心地将其降低到纤维束上。使用一层额外的牙科水泥将管子固定到现有的牙科水泥底座上。用20秒的紫外线固化牙科水泥。
注意:施工过程可以在此处暂停。
5. 电极头准备
注意:每个阵列执行此步骤大约需要 30 分钟。
- 将电极切割成所需长度。
- 在准备切割电极头时,堆叠便笺以构建一个约1.5毫米高的平台。从平台的边缘测量所需的电极长度并标记此距离。该平台将作为切割的指南。
- 将电极放入去离子或蒸馏水的烧杯中,直到漏斗尖端完全浸没,首先倾斜并保持垂直于表面。通过将电极从水中取出,将各个碳纤维聚集在一起。表面张力会使束在一起。让电极风干30分钟。
- 将 #10 手术刀刀片固定在手柄上。通过将手术刀和电极置于-18°C冰箱中至少5分钟来冷冻它们。
- 铺设电极,使纤维齐平地躺在导轨的表面上(在步骤5.1.1中制备)。使用滚动运动,用手术刀将纤维切割成所需的长度。快速完成此步骤,以确保电极和手术刀仍然冻结(见图3G)。
- 注入正电流以降低电极尖端的阻抗。
- 使用适当的适配器将电极连接到多电极阻抗测试仪(请参见 材料表)。下电极尖端〜2毫米到0.1米磷酸盐缓冲盐水(PBS)的微量离心管中。将接地线插入微量离心管。
- 以所选幅度和持续时间注入电流。
注意:此步骤旨在降低 CFEA 尖端的阻抗值。在本研究中,在电镀软件图形用户界面中输入了以下参数:电流:0.100μA;持续时间: 10 秒;暂停:1 秒。该过程可以根据需要按通道重复,直到电极阻抗满足所需值(见图4C)。 - 一旦阻抗值达到所需,在去离子或蒸馏水中冲洗纤维以进行清洁。
- 电镀在镀金溶液中。
注意:此步骤应在植入前不久(当天)完成。
注意:制备CFEA吸头时使用的一些化学品具有腐蚀性,包括镀金溶液。使用前请咨询安全数据表,并确定要采取的适当预防措施,以便安全地处理溶液。
注意:为了使纤维束具有刚度,用户可以通过首先将PEG8000溶解在去离子或蒸馏水中以1mg / mL来创建镀金溶液。然后,将625μL溶解的PEG8000和375μL镀金溶液和涡旋溶液混合10 s。PEG8000在大脑中插入纤维后会溶解。- 将电极束尖端降低〜2mm到电镀混合物的微量离心管中。将接地线插入微量离心管。
- 设置适当的电镀参数。在本研究中,在电镀软件图形用户界面中输入了以下参数:电流:-0.05μA;持续时间: 30 秒;暂停:5 秒。
- 用去离子或蒸馏水彻底冲洗纤维。此时,如果需要,请再次测量阻抗值。
6.插入大脑:生存手术,小鼠(肌肉肌肉)和非生存手术,雪貂(Mustela putorius furo)
注意:外科手术应遵循符合IACUC的标准方案。有关详细信息,请参阅Ma等人22关于生存手术方案和Popoovic等人23关于非生存手术方案。根据ASC指南对啮齿动物物种进行生存手术,遵循无菌外科手术程序。这些包括在135°C下高压灭菌所有手术工具和材料15分钟,并用70%乙醇处理立体定位器械和手术区域。在手术过程中使用无菌外科手套,一次性防护服和口罩。
- 生存手术,小鼠(肌肉肌肉)。
- 在诱导盒中用2.5%异氟醚麻醉小鼠约1分钟,直到呼吸频率达到55-65次呼吸/分钟。然后,通过鼻锥给予2.0%异氟醚以维持麻醉。将兽医软膏涂抹在双眼上,以防止角膜损伤。进行脚趾捏以验证麻醉程度是否合适。
- 验证后,遵循Ma等人22中详述的生存手术程序。监测呼吸频率并将其保持在60次/分钟。使用恒温控制的加热垫将体温保持在37°C。请参阅步骤6.3-6.5(详见下文),了解有关准备颅骨切开术,硬骨切开术和电极植入的说明。
- 手术后,将小鼠放回恢复笼中,配有37°C加热垫,与其他动物隔离。
- 用抗生素软膏覆盖手术伤口。监测动物,直到它们恢复足够的意识来维持胸骨卧位,并允许它们在2-5天内恢复。单独存放它们,并持续监测感染或不适的迹象。在手术当天给予动物一剂丁丙诺啡72小时缓释(0.5-1.0mg / kg)作为镇痛药。
- 非生存手术,雪貂(Mustela putorius furo)
- 首先用氯胺酮(20mg / kg,i.m.)麻醉雪貂,然后通过面罩以2:1的二氧化二氮和氧气混合物用1.0%-2.0%的异氟醚通气。进行脚趾捏以验证麻醉程度是否合适。
- 验证后,遵循Popovic等人23中详述的非生存手术程序。进行气管造口术,并在一氧化二氮和氧气的2:1混合物中用1.0%-2.0%的异氟醚为动物通气。将兽医软膏涂抹在双眼上,以防止角膜损伤。
- 使用恒温控制的加热垫将体温保持在37°C。监测心率、潮气末 CO2 水平和呼吸频率。将呼吸速率保持在适当的生理范围内(3.5%-4.0%)。请参阅步骤6.3-6.5(详见下文),了解有关准备颅骨切开术,硬骨切开术和电极植入的说明。
- 持续监测动物的心电图,以确保充分的麻醉,如果心电图显示任何痛苦,则增加异氟醚的百分比。
- 在实验完成后,向雪貂施用1mL戊巴比妥钠和苯妥英钠溶液并监测,直到心率和潮气末CO2测量0。
- 头骨的准备
- 使用0.8 mm钻头毛刺,在所需的位置钻一个4 mm x 4 mm的开颅术以进行植入。对于鼠标,在对侧位置钻一个额外的毛刺孔,用于插入不锈钢接地螺钉。
注意:在电极准备好植入之前,不要进行硬切开术。 - 建立接地/参考。在急性雪貂实验中,使用18 G针刺穿皮肤和动物头部侧面与开颅相反的颅骨周围的肌肉层。将Ag / Cl参比电极的线端插入针尖,然后将针从肌肉/皮肤上缩回,使沉淀现在牢固地位于肌肉和颅骨之间。在鼠标中,将银色地线缠绕在不锈钢接地螺钉上。用紫外线固化的牙科水泥固定。
- 使用一条薄薄的标签胶带将电极连接到电极支架上,并将电极支架固定到显微操作器中。通过鳄鱼夹将地线连接到接地源。将参比线连接到嵌入动物肌肉中的参比电极上。
- 使用0.8 mm钻头毛刺,在所需的位置钻一个4 mm x 4 mm的开颅术以进行植入。对于鼠标,在对侧位置钻一个额外的毛刺孔,用于插入不锈钢接地螺钉。
- 硬脑膜切开术和软脑膜穿透术
- 使用硬脑膜刮刀从开颅手术中取出硬脑膜。
- 在软脑膜上打一个小孔。为此,插入并取出金属微电极(建议在雪貂中)。或者,降低与大脑表面正交的CFEA以避免任何脉管系统。一旦确定了这个位置,抬起电极,用硬脑膜镐轻轻地切开该位置的大脑表面,用镐向上拉(建议在小鼠中)。
- 电极植入
- 将电极尖端降低到相同的位置,并在精细模式下,开始以~2μm / s的速度将电极驱动到大脑中。使用显微镜确保电极顺利进入并且不会弯曲。
注意:如果电极不能顺利进入,请将其抬出大脑并重新调整角度。如果它继续弯曲而没有顺利进入,请调整位置并重复切开大脑表面以用于新进入位置的过程。 - 使用以下步骤进行慢性和急性植入。
- 对于慢性植入:使用紫外线固化的牙科水泥将电极粘合到位。
- 使用5-0手术缝合切口并建立头盖。
- 要建立头盖,请在种植体部位周围添加额外的牙胶。确保盖住夹具的鼻子。
- 将皮肤向上拉并拉到头盖周围。用5-0手术缝合线缝合头盖后面的切口。
- 涂抹利多卡因乳膏和抗生素软膏。
- 停止麻醉并遵循标准的恢复程序。
- 对于急性植入:降低电极并达到所需深度后,等待至少30分钟,然后开始电生理记录,以使电极沉降到位。
- 对于慢性植入:使用紫外线固化的牙科水泥将电极粘合到位。
- 将电极尖端降低到相同的位置,并在精细模式下,开始以~2μm / s的速度将电极驱动到大脑中。使用显微镜确保电极顺利进入并且不会弯曲。
结果
随着该协议的完成,单单元尖峰活动的稳定记录将成为可能。这些微电极阵列可根据研究人员的需求在材料、通道数和头台适配器方面进行定制。电镀金光纤会导致适合记录的阻抗降低(图4 和 图5)。如果用户打算长期记录,则可以在动物从外科手术中恢复后进行测量。慢性手术已导致至少120天的稳定,单单位记录。一个代表性的记录如图 6所示,显示了在行为自由的成年雄性小鼠的脾后皮层中稳定的64通道电生理活动。如果要进行急性准备,可以在植入后不久(约30分钟)开始记录。这将使电极有时间在大脑中沉降。 图7 提供了从成年雌性雪貂的主要视觉皮层获得的急性16通道CFEA记录的代表性示例。使用尖峰分类软件对小鼠和雪貂进行尖峰分类(请参见 材料表)。
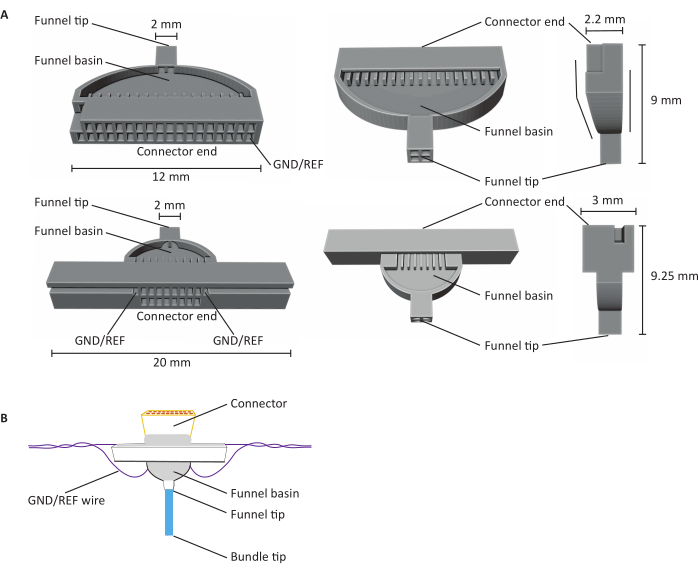
图1:16通道和32通道碳纤维微电极阵列(CFEA)剖析( A)从三个不同角度看32通道(顶部)和16通道(底部)CFEA的原理图。16 通道 CFEA 采用扩展设计,便于操作。32 通道设计具有平面,允许将两个夹具组合在一起,形成 64 通道 CFEA。两个关系图都具有标有尺寸的标识结构。连接器端指示连接器插入的位置,GND/REF 通道指示接地线的插入位置。漏斗盆是指纤维通过以覆盖UV光固化牙科水泥的位置,漏斗尖端表示纤维离开夹具的部位。漏斗尖端被分成多个象限,以尽量减少纤维粘附在一起并造成损坏。纤维随后使用牙科水泥被拉成一束。夹具使用SLA树脂打印机进行3D打印。图表将放大以显示详细信息。(B) 建造CFEA。图中标记了标识结构。蓝色束尖端表示获取记录测量值的碳纤维部分。漏斗盆内和连接器周围的灰色表示紫外线光固化的牙科水泥,该水泥将碳纤维固定在漏斗盆中,并将连接器固定在夹具上。紫色导线表示接地线。 请点击此处查看此图的放大版本。
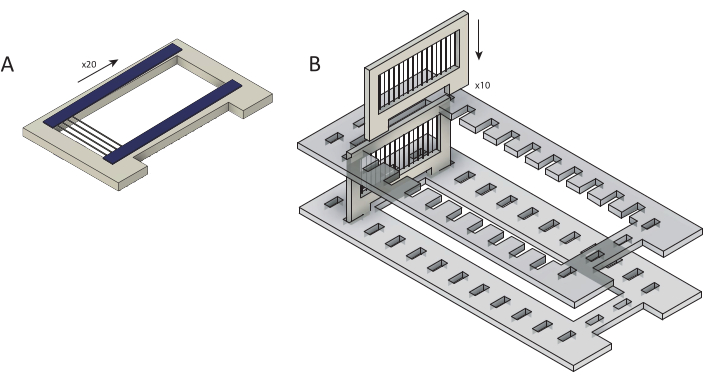
图2:将原始碳纤维装入用于聚对二甲苯C涂层的盒中。(A)碳纤维被装入覆盖有两条双面胶带(蓝色)的墨盒上。每个盒装有约 25 根光纤。(B) 将盒装入激光切割支架(灰色)中,为聚对二甲苯C涂层做准备。每个盒式磁带可容纳十个盒式磁带。请点击此处查看此图的放大版本。
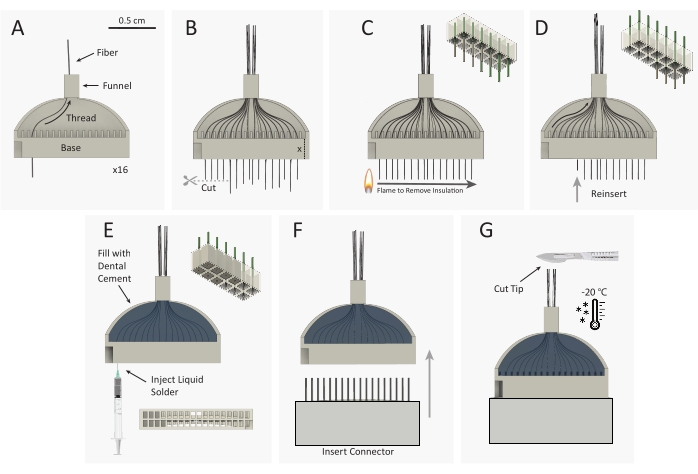
图3:碳纤维微电极阵列(CFEA)束结构示意图(A)16个单独的涂层碳纤维(黑色)穿过32通道3D打印夹具(灰色)。(B) 碳纤维尖端用微型剪刀切割,留下与夹具底座高度相等的多余纤维,从夹具底座延伸出来。(C)标准塑料火花轮打火机迅速通过多余的纤维,以去除Parylene C绝缘层。右上方的示意图显示了从12种纤维中的9种纤维中去除聚对二甲苯的过程。(D) 将纤维重新插入夹具中,直到纤维端与底座齐平。右上方的原理图显示了9根纤维的重新插入,其中未绝缘(灰色)纤维尖端位于夹具底座内。然后将夹具翻转过来,并重复步骤A-D以线程相反的16个通道。(E) 夹具填充牙科水泥以固定纤维。银印被注入夹具底座的每个孔中。(F) 公连接器插入夹具底座。(G)CFEA和手术刀在-20°C的冰箱中冷冻。阵列尖端被切割成所需的长度,留下32根均匀的纤维。请点击此处查看此图的放大版本。
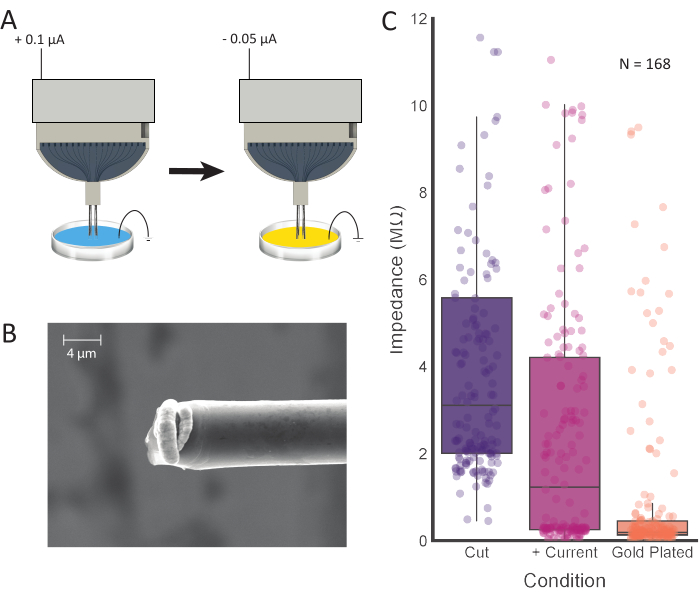
图4:尖端处理和电镀。 (A)电极尖端首先放入0.1 M PBS中,电流通过每个电极。然后将尖端冲洗并转移到镀金溶液中,在那里它们用电流电镀。(B)制备的碳纤维的扫描电镜图像显示镀金溶液集中在尖端。比例尺表示初始切割后168个通道的4 μm.(C)阻抗值(紫色;3.11 MΩ±0.42 MΩ,中位数±SE,n = 168根光纤),正电流注入(粉红色;1.23 MΩ±0.36 MΩ,中位数±SE,n = 168纤维)和电镀(橙色;0.19 MΩ±0.15 MΩ,中位数±SE,n = 168光纤)在每个加工步骤后显示出较低的阻抗值。请点击此处查看此图的放大版本。

图5:适度的电镀金持续时间在碳纤维束尖端上产生小的圆形沉积物。图中的碳纤维尖端均来自不同的微电极阵列,反映了用于阻抗降低或镀金的不同注入电流的持续时间。图像还描绘了Parylene C涂层,该涂层可绝缘碳纤维并防止从纤维尖端以外的位置获取任何信号。(A)冷冻后的碳纤维尖端的扫描电子显微镜图像,并用剃须刀片进行单次切割。(D)与B相同,但随后注入正电流10秒(C)与B相同,但随后用金电镀5秒。(D)与B相同,但随后用金电镀15秒。(E)与B相同,但随后用金电镀30秒。我们发现,在-0.05μA的电流下电镀30秒是电生理记录的最佳选择。请点击此处查看此图的放大版本。
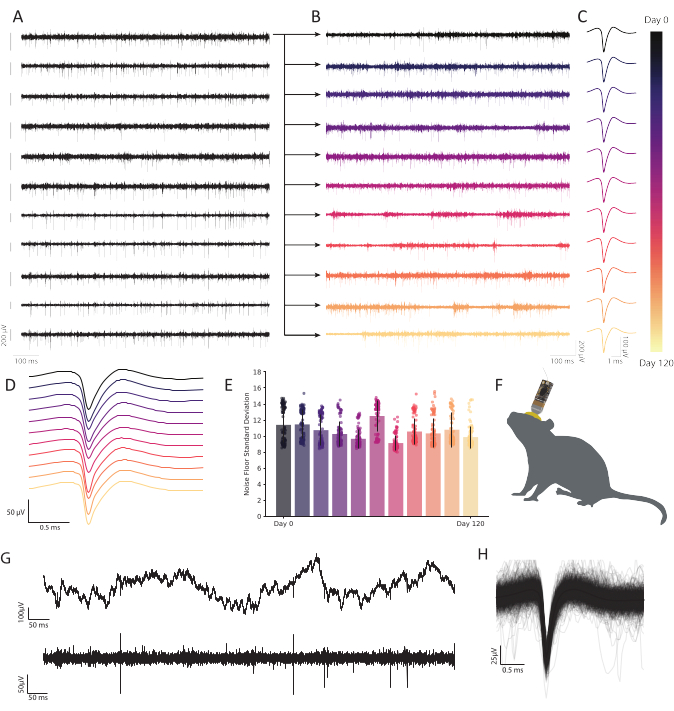
图6:在行为自由的小鼠脾后皮层中,用碳纤维微电极阵列记录的慢性细胞外记录显示出持久,稳定的神经活动。 从第一个通道(顶行)记录的后续迹线以B绘制,以显示随时间变化的持久性。其余十行显示了记录质量的一致性,并显示了整个阵列的可靠活动。每个迹线左侧的比例尺表示200 μV电位。(B) 来自与 A 中顶部迹线相同的光纤的带通数据,扩展以显示 120 天连续记录中的稳健活动。(C) 聚类分析揭示了数月内强大的单单元检测。迹线表示 120 天内连续可观测的代表性单个单元的平均波形,从每个时间点以 B 绘制的光纤中提取。(D) 来自 C 的均匀、非归一化尖峰波形堆叠在一起,以证明随时间推移的一致性。(E) 碳纤维记录显示,在数月内,本底噪声稳定。B中本底噪声(迹线减去尖峰活动)的标准偏差显示噪声没有渐进变化。条形表示平均污染。误差线表示标准偏差。(F) 具有长期植入CFEA和头台的小鼠的比例图。(G) 植入后 11 个月的原始电压迹线(上图)显示出稳健的 LFP。带通电压迹线(底部)显示稳定的神经活动。(H) 神经元的平均尖峰波形记录在C的纤维上,由前1000次尖峰活动发生率覆盖。请点击此处查看此图的放大版本。

图7:来自雪貂初级视觉皮层的碳纤维微电极阵列(CFEA)记录。 (A) 从16通道CFEA记录的尖峰排序单单元的波形。来自单个神经元的动作电位通常在幅度略有不同的多个通道上很明显。(B) 来自选定神经元的方向调谐曲线。颜色对应于 A中记录的单位。箭头指示刺激运动的方向。比例尺表示响应速率。误差线指示具有标准误差的平均响应。水平虚线表示同一细胞在暴露于空白屏幕时的自发放电速率。 请点击此处查看此图的放大版本。
讨论
该协议描述了为急性和慢性使用构建功能性CFEA所需的每个步骤。所描述的过程可根据研究人员的需求进行定制,使其成为在几个月内监测单个神经元的可访问且廉价的选择。该协议证明了在麻醉动物植入后几分钟内记录强大的单单元活动以及在清醒,行为正常的动物中记录四个月的稳健单单元活动的可行性,说明了这些CFEA研究神经反应的短期和长期变化的潜力。
所描述的协议的步骤已经过彻底的测试和改进,以产生一个有效的程序,可以快速完成,以较低的边际成本(<100.00美元),并能够在几个月内密集和稳定地记录明确的单个单元。施工步骤可以在不到一天的时间内完成,并将产生可与任何领先的商业阵列相媲美的电生理信号。与类似的商业阵列相比,CFEA还具有更小的占地面积(16通道纤维束的直径约为26μm),并且它们的生物相容性使其适合长期使用13。重要的是,必须遵循几个关键步骤和说明,才能产生具有可比性能的CFEA。
由于碳纤维的脆弱性,必须非常小心地处理它们。用锋利的镊子或其他工具处理它们可能会导致纤维断裂。此外,重要的是在空气流动有限的空间中构建CFA,以便纤维不会被吹走。当燃烧纤维的后部时,打火机只需要非常短暂地来回移动,大约1秒。去除绝缘层后的步骤对于构建具有工作通道的电极至关重要。火焰尖端应送入夹具中,不要再接触。然后,当用牙科水泥填充盆时,重要的是要小心地涂覆水泥并完全填充通道和漏斗盆,关闭开口而不填充它们。然后,在继续之前,应用紫外线完全固化牙科水泥。一旦完成,银漆应注入每个通道,直到完全填充但不会溢出。这是该过程中变化最大的步骤。任何过度填充都会在通道之间产生串扰,填充不足都可能导致连接失败。如果无法使用25 G针注入银漆,则可能是溶液太粘稠,在这种情况下,可以添加少量的油漆稀释剂以产生更流畅的溶液。一旦所有通道都填满,并且头台连接器入,在用牙科水泥固定连接器之前,让阵列固化 24 小时是很重要的。我们发现,如果不这样做,就会减少连接通道的数量。应用大量的牙科水泥也很重要,这样连接器在与信号采集系统连接时不会断开连接。如果它们脱落,可以尝试用银色油漆反复填充通道重新连接,但用户应测试CFEA的阻抗值以评估连接通道的数量。让牙胶在一夜之间固化也有助于防止潜在的脱落。
测量电极的阻抗将提供对连接通道的准确估计。这可以在将接地和参考线以及碳纤维尖端浸入PBS后完成。我们观察到,高阻抗(>15 MΩ)表示通道开路。在注入电流和电镀之前,连接的通道可以具有一系列阻抗值,这些阻抗值应随此过程而显着降低。每个16通道电极的平均连接通道数(电流注入后阻抗<4 MΩ)为12.96±2.74(平均±SD;N = 48 个电极)。测试了多次电镀时间,30 s在记录站点之间产生了优异的信号隔离(图5)。虽然已经确定PEDOT-pTS 12,24,25,26和PEDOT-TFB 21为制备碳纤维记录位点提供了可靠的选择,但我们发现镀金是一种经过验证的可靠方法,用于长期植入的电镀电极27,28,增加了植入的便利性,并防止电极尖端聚集在一起。在产生平均小于0.2 MΩ的最终阻抗值时,该方法被证明与使用PEDOT-TFB21和PEDOT-pTS26实现的值相当。
当植入微电极阵列时,重要的是在显微镜下目视跟随碳纤维尖端的插入。成功插入应是显而易见的,纤维不会弯曲。如果纤维看起来是屈曲的,它们不太可能成功进入大脑。在这种情况下,应调整探头的角度以进行第二次尝试。此过程可以继续进行,直到探头插入成功。一旦电极达到所需的深度,我们发现等待至少30分钟将使探头稳定下来,以实现最佳信号采集(急性记录)。
所描述的CFA除了占地面积小和生物相容性外,还因其易于构建和低成本而为商业阵列提供了一种强大,可定制的替代方案。该协议中详述的 CFEA 的最大限制是其可扩展性。由于其构造的手动性质,扩展到具有数百个记录站点的设计可能不切实际。此外,使用纳米技术制造微电极阵列的进步将使比这里描述的方法更大规模的群体记录成为可能。然而,该协议为对碳纤维电极的台式制造感兴趣的实验室提供了CFEA的可访问性。在120天的慢性实验期间,我们没有观察到峰值幅度的稳定性损失或鲁棒性降低,正如我们在该时间尺度上观察到的代表性单通道典型所示(图6A-E)。此外,CFEA显示了持续单单元活动的能力,因为在小鼠植入11个月后,四个单单元仍然可识别(图6G,H)。也可以敏锐地获得稳定的单单元记录(图7),这为在短时间内研究单个神经元提供了优于许多其他商业电极的优势。将来,开发这种具有最小直径的柔性,生物相容性探针将使复杂过程的研究成为可能。这些工具将为神经技术的进步提供实质性的实用性,包括脑机接口(BMI)中的应用,这需要连续,长期的稳定性29。
披露声明
作者声明没有财务利益冲突。
致谢
我们要感谢Greg Guitchounts在电极设计和构造方面的指导,并感谢Tim Gardner向我们开放他的实验室和设施。我们要感谢Christos Michas在Bio-Interface and Technology核心设施中使用PDS的协助,以及Neil Ritter,Jon Spyreas和David Landesman在设计16通道夹具的早期版本中的帮助。我们要感谢Tim Cavanaugh在哈佛大学纳米级系统中心的SEM成像方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| #10 scalpel blade | Fisher Scientific | 14-840-15 | Building tool |
| 16-channel CFEA Jig | Realize Inc. | CFMA component | |
| 16-channel Omnetics connector | Omnetics | A79014-001 | CFMA component |
| 25 G needle | Fisher Scientific | 14-840-84 | Building tool - sharp-tipped |
| 30 G needle | Fisher Scientific | 14-841-03 | Building tool |
| 31 G stainless steel 304 hypodermic round tubing | Small Parts Inc | B000FMYN38 | For guide tube |
| 32-channel CFEA jig | Realize Inc. | CFMA component | |
| 32-channel Omnetics connector | Omnetics | A79022-001 | CFMA component |
| 6 in cotton tip applicators | Fisher Scientific | 22-363-156 | Building tool |
| Acetone | Fisher Scientific | A16P4 | Building tool |
| AutoCad 3D printing software | Autodesk | Computer-aided design tool/ 3D modeling software | |
| Autodesk Fusion 360 | Autodesk | Computer-aided design tool/ 3D modeling software | |
| BD disposable syringes | Fisher Scientific | 14-823-30 | 1 mL |
| Carbon fibers | Good Fellow USA | C 005725 | 7 μm epoxy sized |
| Cassettes and cassette holder | For coating fibers | ||
| Clear tape | Scotch | For coating raw fibers | |
| Deionized water | Electroplating component | ||
| Double-sided tape | Scotch | For coating raw fibers | |
| Flowable Dental Composite | Pentron | Flow-It ALC | CFMA component/ UV cured dental cement |
| Gold plating solution | Sifco ASC | 5355 | 10.0-20.0% glycerol, 1.0-5.0% ethylenediamine, 1.0-5.0% acetic acid (ethylenedinitrilo)tetra-, dipotassium salt, 5.0-10.0% butanoic acid, mercapto-monogold(1+) sodium salt, 1.0–5.0% potassium metabisulfite, 55.0-82.0% water |
| Jewelry clamp | Amazon | B00GRABH9K | Building tool |
| JRClust | Ferret spike sorting software | ||
| Lighter | BIC | LCP62DC | Building tool |
| Micromanipulator | Scientifica | PS-7000C | For guide tube |
| Microscissors | Fisher Scientific | 08-953-1B | Building tool |
| MountainSort | Mouse spike sorting software | ||
| NanoZ 16-channel adapter | Multi-channel systems | ADPT-nanoZ-NN-16 | Electroplating component |
| NanoZ 32-channel adapter | White Matter | NZA-OMN-32 rev A | Electroplating component |
| NanoZ multi-electrode impedance tester | White Matter | Electroplating component | |
| Parafilm | Fisher Stockroom | 13-374-10 | Semi-transparent, flexible film with adhesive properties |
| Parylene 'C' Dimer | Specialty Coating Systems | 980130-C-01LBE | For coating raw fibers |
| PEG 8000 | Fisher Scientific | 25322-68-3 | Electroplating component |
| Phosphate-buffered saline | Electroplating component | ||
| Polyimide tubing | MicroLumen | BRAUNI001 | For guide tube |
| Rotary tool | Dremel | 300124 | For guide tube |
| Scalpel handle | Fine Science Tools | 10003-12 | Building tool |
| Silver conductive coating | MG Chemicals | 842AR Super Shield | CFMA component |
| Stereo microscope with range 6.7:1 | Motic | SMZ-168 | Building tool |
| Sticky notes | Post-it | Building tool | |
| Tissue wipes | Kimtech Science | 34155 | Building tool |
| Tungsten wire | A-M Systems | 797550 | CFMA component |
| UV curing wand | Woodpecker | Building tool | |
| Vacuum deposition chamber | Specialty Coating Systems | Labcoter 2 (PDS 2010) |
参考文献
- Galvani, L. . De viribus electricitatis in motu musculari commentarius. , (1791).
- Buzsaki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature reviews. Neuroscience. 13 (6), 407-420 (2012).
- Ledochowitsch, P., et al. On the correspondence of electrical and optical physiology in in vivo population-scale two-photon calcium imaging. bioRxiv. , 800102 (2019).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems and Nanoengineering. 3 (1), 16066 (2017).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nature reviews. Neuroscience. 9 (3), 195-205 (2008).
- Hong, G., Lieber, C. M. Novel electrode technologies for neural recordings. Nature reviews. Neuroscience. 20 (6), 330-345 (2019).
- Chung, J. E., et al. High-density, long-lasting, and multi-region electrophysiological recordings using polymer electrode arrays. Neuron. 101 (1), 21-31 (2019).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Kozai, T. D., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chemical Neuroscience. 6 (1), 48-67 (2015).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Kozai, T. D., et al. Ultrasmall implantable composite microelectrodes with bioactive surfaces for chronic neural interfaces. Nature Materials. 11 (12), 1065-1073 (2012).
- Chen, R., Canales, A., Anikeeva, P. Neural recording and modulation technologies. Nature Reviews Materials. 2 (2), 16093 (2017).
- Szostak, K. M., Grand, L., Constandinou, T. G. Neural interfaces for intracortical recording: requirements, fabrication methods, and characteristics. Frontiers in Neuroscience. 11, 665 (2017).
- Subbaroyan, J., Martin, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2 (4), 103-113 (2005).
- Park, S., et al. One-step optogenetics with multifunctional flexible polymer fibers. Nature Neuroscience. 20 (4), 612-619 (2017).
- Guo, Y., et al. Polymer composite with carbon nanofibers aligned during thermal drawing as a microelectrode for chronic neural interfaces. ACS Nano. 11 (7), 6574-6585 (2017).
- Armstrong-James, M., Millar, J. Carbon fibre microelectrodes. Journal of Neuroscience Methods. 1 (3), 279-287 (1979).
- Garris, P. A., Ciolkowski, E. L., Pastore, P., Wightman, R. M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 14 (10), 6084-6093 (1994).
- Guitchounts, G., Markowitz, J. E., Liberti, W. A., Gardner, T. J. A carbon-fiber electrode array for long-term neural recording. Journal of Neural Engineering. 10 (4), 046016 (2013).
- Guitchounts, G., Cox, D. 64-channel carbon fiber electrode arrays for chronic electrophysiology. Scientific Reports. 10 (1), 3830 (2020).
- Ma, Z., Turrigiano, G. G., Wessel, R., Hengen, K. B. Cortical circuit dynamics are homeostatically tuned to criticality in vivo. Neuron. 104 (4), 655-664 (2019).
- Popovic, M., et al. Development of cross-orientation suppression and size tuning and the role of experience. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 38 (11), 2656-2670 (2018).
- Patel, P. R., et al. Chronic in vivo stability assessment of carbon fiber microelectrode arrays. Journal of Neural Engineering. 13 (6), 066002 (2016).
- Welle, E. J., et al. Ultra-small carbon fiber electrode recording site optimization and improved in vivo chronic recording yield. Journal of Neural Engineering. 17 (2), 026037 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), 046009 (2015).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating low-impedance tetrodes by electroplating with additives. Sensors and Actuators. A, Physical. 156 (2), 388-393 (2009).
- Vafaiee, M., Vossoughi, M., Mohammadpour, R., Sasanpour, P. Gold-plated electrode with high scratch strength for electrophysiological recordings. Scientific Reports. 9 (1), 2985 (2019).
- Lebedev, M. A., Nicolelis, M. A. Brain-machine interfaces: From basic science to neuroprostheses and neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。