Method Article
在胚胎第7.5天通过子宫内纳米注射(NEPTUNE)靶向小鼠神经板
摘要
在该协议中,我们描述了如何在E7.5处用慢病毒注射小鼠羊膜腔,导致整个神经板的均匀转导,对存活或胚胎发育的不利影响最小。
摘要
操纵 子宫内 发育中的小鼠大脑中的基因表达在功能遗传学研究方面具有巨大的潜力。然而,它以前主要局限于神经化后胚胎阶段的操作。开发了一种方案,在胚胎日(E)7.5注射羊膜腔并递送慢病毒,编码cDNA或shRNA,靶向>95%的神经板和神经嵴细胞,有助于未来的大脑,脊髓和周围神经系统。该协议描述了实现成功转导所需的步骤,包括玻璃毛细管针的研磨,妊娠验证,使用超声成像的发育分期以及与胚胎阶段相匹配的最佳注射量。
遵循该协议,可以使用高滴度慢病毒实现>95%的发育中大脑的转导,从而进行全脑遗传操作。相反,可以使用较低的病毒滴度实现镶嵌转导,从而允许进行遗传筛选或谱系追踪。E7.5 注射还针对外胚层和神经嵴,有助于眼睛、舌头和周围神经系统的不同隔室。因此,该技术提供了从前神经形成阶段操纵小鼠神经板和外胚层衍生组织中基因表达的可能性,其好处是减少了实验中使用的小鼠数量。
引言
大脑和脊髓是胚胎发生过程中最早开始形成的器官之一1,2。尽管与神经发育障碍相关的基因正在被鉴定,但对遗传变异的功能询问已经落后于3,4。由于条件敲除小鼠的产生可能需要数月或数年的时间,因此一种快速研究发育中大脑中基因功能的替代技术是有趣的。在小鼠胚胎中,神经形成 - 神经板转化为神经管以产生中枢神经系统(CNS)的形态发生过程 - 发生在受孕后第8天至第10天之间5。在神经形成开始之前,神经板作为外胚层的一部分,由单层柱状细胞组成,这些柱状细胞将增殖并分化为CNS6,7内的众多神经元和神经胶质细胞类型。因此,为了通过实验诱导CNS中基因表达的长期改变,靶向神经板具有明显的优势,包括所有祖细胞的可及性。
在神经科学 中,在卵 电穿孔8,9 和小鼠胚胎的病毒转导已被用于操纵胚胎CNS基因表达。发育中的雏鸡胚胎一直是研究脊髓发育过程中基因功能的首选模型,因为雏鸡胚胎在鸡蛋中的可及性以及由此产生的操纵基因表达的便利性。特别地, 在卵 质粒电穿孔中在每个雏鸡脊髓中产生实验和控制条件。电穿孔引起细胞膜透化,并通过两个电极向胚胎施加电脉冲,将带负电荷的DNA从(负)阴极引导至(正)阳极。在小鼠中, 子宫内的 电穿孔通常仅限于神经化已经完成的胚胎阶段,并且大脑或脊髓已经由几个细胞层组成,导致电穿孔效率低10。质粒电穿孔可产生瞬时基因表达,通常靶向很少的细胞。
子宫内超声引导显微注射已被用于操纵不同的胚胎结构,例如皮肤和大脑11,12,13,14。然而,针对发育中的鼠中枢神经系统的注射显示出低效或对胚胎存活产生负面影响12,13,14。因此,开发了一种改进的方案,用于将高滴度慢病毒递送到羊膜腔(AC)中,E7.5被称为NEPTUNE,用于子宫内晚期与子宫内进行抗音15。注射导致E13.5对整个大脑的>95%的长期靶向功效。此外,在妊娠超声验证期间引入了分期步骤,以按发育阶段对女性和怀孕进行分类,以最大限度地减少对研究动物的不必要程序并最大限度地提高注射成功率。注入效率和存活率与交流电尺寸的增加密切相关。因此,本文描述了如何在注射前测量AC大小,以向AC提供合适的体积,而不会引起胚胎的吸收。NEPTUNE 是子宫内电流方法的可靠替代方案,可以适用于多种用途,包括但不限于功能增益和丧失研究、谱系追踪或筛选15,16。
研究方案
根据欧洲法规饲养CD1野生型小鼠,具有标准的昼夜循环, 随意进食和饮水。CD1雌性与CD1雄配过夜,早晨检查阴道栓(E0.3)。注射时只使用怀孕的女性。此处描述的所有实验的伦理批准均由瑞典农业委员会(Jordbruksverket)授予。
1.玻璃针的制备:拉针和研磨
注意:虽然可以购买预磨针,但在内部拉针可以轻松调整针长、孔和斜角。
- 将玻璃毛细管安装到微量移液器/毛细管拉拔器中。使用指定的设备使用以下设置(请参阅 材料表):加热580单位;速度140个单位;时间200单位;压力500-800单位。
注意: 不同参数的单位由毛细管拉拔器定义。不同设备的单位可能有所不同。 - 按 拉动可 拉开毛细管,产生两个末端锥形的玻璃毛细管。
注意:拉动后,由于微量移液器拉拔器的高温,两个玻璃毛细管的尖端熔断关闭。 - 用手术剪刀切割尖端以获得~7毫米的针长(从针开始变细的地方测量)(图1A)。
注意:对于E7.5注射,细长的针头至关重要,因为注射区域非常小且脆弱。短孔和宽口径针会导致胚胎死亡。 - 研磨切割的针尖以形成锋利的斜面(图1C-F)。
- 以最大速度以20°的角度研磨针头至少30-45分钟。
注意:将超纯水添加到研磨板中以充当润滑剂,减少摩擦/温度并洗掉玻璃颗粒(图1B)。但是,多余的液体会减慢研磨机的速度。 - 确保针尖(图1C)接触磨板表面(图1D)但不弯曲(图1E)。
注意:弯曲研磨会导致斜角不正确的长而脆弱的针尖,在注射过程中很容易折断。断针会伤害胚胎,必须用完整的针头代替。正确的接地尖端如图 1F,G所示。研磨后,所得针孔的内径(ID)预计为~15μm,外径(OD)为~35μm(图1G)。
- 以最大速度以20°的角度研磨针头至少30-45分钟。
- 用矿物油填充 1 mL 注射器并连接 27 G 针头。
- 取下针帽并将注射器针头插入新磨碎的玻璃毛细管中。注入矿物油,直到油从毛细管尖端滴落。在取出27G针头的同时继续注射,直到毛细管针头充满矿物油,然后可以取出注射器针头。
- 将磨碎和矿物油填充的针头存放在封闭的环境中,以防止损坏和灰尘积聚。为了储存,将两卷造型粘土插入普通培养皿中作为支架(图1H)。轻轻地将针架在粘土上,并将它们分开,以便于取回针。
注意:由于针头准备非常耗时,因此最好在注射前至少一天准备针头。最多两窝后丢弃针头,因为它们会变钝。始终准备备用针头,以防在制备或注射过程中针头损坏。
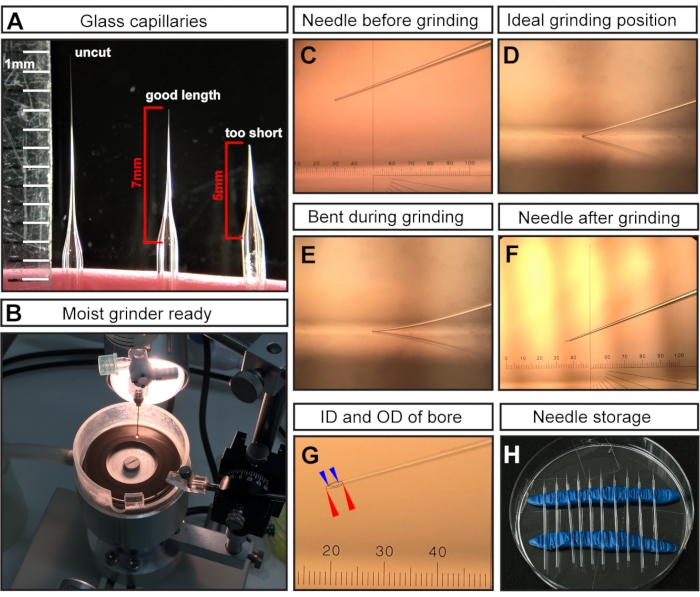
图 1:用于 E7.5 羊膜腔注射的针头制备。 (A) 拉动但未切割的玻璃毛细管针(左)、以最佳长度切割用于 E7.5 注射的毛细管针(中)和毛细管切割太短(右)的代表性示例。(B)水覆盖均匀的研磨机,准备进行针磨。(C-F)不同针尖的代表性示例。(C) 切开但未研磨的针尖安装在研磨机中;(四)理想的磨削位置,针尖刚好接触磨床;(五)磨削过程中针放得太远而弯曲的;(F)用于E7.5交流电注入的理想接地针尖。(G)显示内径~15μm,外径~35μm的孔的研磨针尖,适用于E7.5 AC注入。针孔显示为虚线。外径用红色箭头表示;内径用蓝色箭头表示。(H)针头储存:培养皿中装满拉针和磨针。两排造型粘土用作支架。注意:对于C,F,G的目测千分尺,1厘米分为100个间距;目标是 3 倍;因此,1 间距 = 10,000 μm/(100 × 3) ≈ 33.4 μm。缩写:AC = 羊膜腔;ID = 内径;OD = 外径。请点击此处查看此图的大图。
2.注射前一天:准备工作台进行妊娠超声验证
注意:使用慢病毒时,所有工作都应在通风的生物安全2级(BSL 2)工作台上进行。妊娠超声验证可在通风工作台上进行。
- 打开超声波机、加热台和异氟醚泵的 O2 电源(可能因设备而异)。
注意:检查异氟烷系统,确保异氟烷没有泄漏到空气中。 - 将一个空的废物袋(胶带贴在内壁上以便于取用)、脱毛膏、无菌包装棉签、水、纸巾和手术胶带放在 BSL 2 工作台内。
- 准备四片手术胶带(~7厘米长),以在怀孕的超声检查期间固定小鼠四肢。
3. 超声波检查以确认怀孕
注意:此步骤可以在E7.5注射前一天在E6.5执行。有关胎龄检查的详细信息,请参阅讨论。
- 将时间配对的雌性小鼠放在诱导室中。
- 以~2.1LPM的氧气流量和3-4%异氟醚的初始剂量打开气流以诱导麻醉。
- 通过检查爪反射来验证雌性是否完全麻醉。如果爪反射不存在,将异氟醚降低至1.5-2%。
注意:诱导麻醉大约需要 3 分钟。 - 将气流从感应室切换到加热台鼻锥。
- 将麻醉的女性仰卧位(腹部向上)放在加热台上,并将鼻子放在连接的鼻锥中,以确保在怀孕超声检查期间维持麻醉。
- 用准备好的手术胶带将所有四只爪子固定在桌子上,不要拉伸雌性的身体或困住胡须。
- 在下腹部涂抹豌豆大小的脱毛霜。使用棉签将乳膏涂抹在下腹部(A ~ 3 x 3 cm square),然后来回滚动棉签轻轻按摩。
- 一旦皮毛开始从皮肤上脱落,请弄湿纸巾并去除奶油和毛皮。用湿纸巾清洁去毛的区域,直到所有的乳霜和头发都消失。擦干皮肤。
- 在剃须区域涂抹李子大小的超声凝胶,然后通过以下三种方法中的任何一种使用超声波识别子宫。
- 要手动执行此操作,请将超声探头放在超声凝胶中并移动探头以找到子宫。
- 对于半手动方法#1,通过沿x平面松开和移动导轨的一部分,将超声探头(连接到栏杆系统)放置在女性腹部上方。将超声探头降低到凝胶(z平面)中并扫描下腹部(y平面)(图2A)。
- 对于半手动方法#2,将超声探头(连接到栏杆系统)降低到凝胶中以对下腹部进行成像。在此过程中保持超声探头静止,并沿x和/或y平面移动带有附加轮子的加热台(图2B)。
注意:在这些早期胚胎阶段,内部器官,例如肠道,在超声成像中可能看起来与子宫相似。然而,虽然胚胎和蜕膜显示为一系列球体(类似于项链上的珠子),但肠道具有连续管的外观。可以通过来回扫描感兴趣的结构来评估腔空间(单独的球体与连续管)的连通性,以确定该结构是离散球体(胚胎/蜕膜)(图2C)还是连续管(肠)(图2D)。在这个阶段,没有必要记录胚胎的数量;确认它们的存在与否就足够了。
- 确定怀孕状态后,将超声探头从腹部抬起,用湿纸巾擦拭下腹部以去除超声凝胶。
- 关闭异氟醚泵并取下手术胶带以释放爪子。
- 将雌性置于俯卧位(腹部朝下)放入40°C加热板上的干净笼子中。密切观察女性,直到她恢复意识,这需要 2-6 分钟。
注意:确保一名女性的超声波检查时间为<10分钟,以尽量减少接触异氟醚。 - 清除所有材料和废物,并用70%乙醇清洁所有表面。用干燥、柔软且不起毛的纸巾擦去超声探头上残留的超声凝胶。关闭超声机、通风工作台/ BSL2工作台,加热台和O2 电源。
4. 胚胎分期超声检查
注意:此步骤在手术前进行,用于根据AC大小对怀孕的女性进行分层。这一步在E7.5中至关重要,因为目标是针对发展中的中枢神经系统。在发育的早期阶段,发育中几个小时的差异会显着影响AC的大小和神经形成的进展。
- 按照步骤3.1-3.5中的步骤麻醉第一只怀孕的雌性小鼠。
- 按照步骤3.6中所述将雌性放在桌子上并固定。
- 将李子大小的超声凝胶涂在剃光的腹部,然后降低超声探头以对女性的下腹部进行成像。
注意:此步骤假设女性在前一天接受了超声波检查怀孕,并且已经去除了腹部的皮毛。如果不是这种情况,则必须在按照步骤3.7-3.8添加超声凝胶之前去除皮毛。在E7.5,子宫和蜕膜更大,更容易与内脏区分开来。此外,AC较大,可以与外切体腔(ExC)区分开来。 - 尽可能完整地扫描左右子宫角。
注意:有些胚胎位于女性体内的更深处,可能会被遗漏。 - 记录胚胎的数量和阶段。记下理想大小的羊膜腔,可接受的腔和没有腔的蜕膜的数量(图2E-G)。
- 对所有怀孕进行分期并相应地进行排名。
- 按照步骤4.5-4.7中的说明,在超声检查(步骤4.4)后立即向女性注射大部分理想大小的AC。
- 对于大多数可接受的女性(其中外丝体和羊膜腔尚未明确分为两个腔)或不存在空腔,推迟注射并在几个小时后再次分期。如果大多数腔仍然太小,请将注射推迟10-12小时。
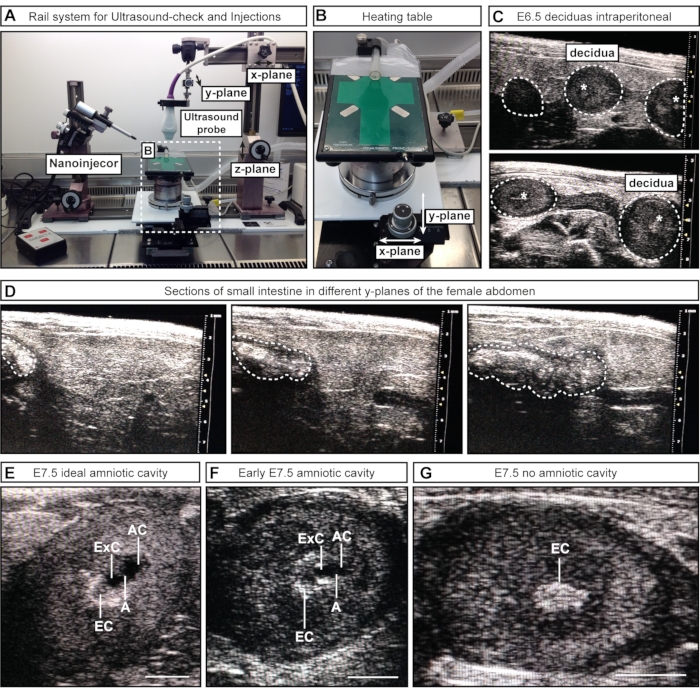
图2:超声检查期间羊膜腔的检查和分期。 (A) 带有超声波探头、纳米注射器和加热台的轨道系统概述。超声探头可以在 x、y 和 z 平面上移动,以实现与女性腹部或 AC 的最佳对齐。(B)加热台可以通过X和/或Y平面上的两个轮子移动,以便精确扫描和评估AC,而超声探头可以保持静止。(C)超声检查期间女性腹部内E6.5蜕膜的代表性超声图像以确认怀孕(白色虚线轮廓)。此时尚未形成空腔;然而,有时,胎盘外锥(白色星号)是可见的。蜕膜可以通过它们的球形来识别,并与肠道区分开来,肠道表现为一个连续的管子。(D)小肠的代表性图像序列(白色虚线轮廓),通过下腹部连续扫描。(E-G)E7.5注射前腔分期期间的代表性超声图像。羊膜腔和外丝体腔已经形成并被羊膜隔开。胎盘外锥是主要的血液供应,在超声检查中是一个亮点。AC位于胎盘外锥最远端。(E)理想大小的AC看起来比外塞体腔大,而中等大小的腔看起来更小(F)。如果没有可见的空腔(G),这意味着胚胎已被再吸收或尚未达到E7.5。比例尺 = 1 毫米。 缩写:A = 羊膜;AC = 羊膜腔;ExC = 外腔;EC = 胎盘外锥。请点击此处查看此图的大图。
5.注射日:准备BSL2手术台
- 将一块弹性膜粘在市售的改良培养皿的圆形中央开口上。确保膜很好地附着在培养皿上以防止泄漏。
注意:如果培养皿泄漏或粘合不充分,可以用胶带进一步固定弹性膜的边缘。 - 在弹性膜的中心做一个1-1.5厘米长的切口。
- 打开超声机、BSL2 工作台、加热板、异氟醚泵的 O2 电源和玻璃珠灭菌器(设置为 300 °C)。
- 在BSL2工作台内,放置一个空垃圾袋(贴在内墙上以便于取用);无菌包装棉签(每次手术/每位女性使用新的棉签);手术工具(剪刀、镊子、夹子、缝合线)和手术胶带;一整瓶室温磷酸盐缓冲盐水 (PBS)、一个用于废物收集的空瓶和一个 25 mL 移液器;一个带有弹性膜的培养皿用于手术;培养皿的盖子,用一滴水固定在盖子上的2 x 2-3 x 3厘米封口膜;造型粘土:4个较大的球或立方体(~3 x 3 x 3 cm3)和一个圆柱形(~4 x 1厘米);带有镇痛剂(例如丁丙诺芬,0.05-0.1 mg / kg体重)和眼部凝胶的注射器注意:一旦将培养皿放在女性腹部顶部,造型粘土的球(或立方体)将用作培养皿的"脚"或支架/支架。圆柱形的粘土片将胚胎固定在培养皿内。如果注入多种溶液,或者在注射过程中需要重新填充针头,如果溶液可以间隔开,则可以使用同一块封口膜。
6. 针头装载
- 用薄纸擦去多余的矿物油,以获得更好的抓地力。
注意:始终清洁远离尖端以防止损坏或受伤。 - 确保所有组件(一个密封O形圈,一个垫片和一个前垫圈 - 全部安装在夹头下方,图 3A)以正确的方向安装(图3B,移除夹头以进行可视化),以将毛细管针固定到位并形成气密连接,避免在推进或缩回针内的金属柱塞时形成气泡。
- 确保纳米注射器的金属柱塞完全缩回。按 Fill 进行验证,然后等待两声蜂鸣音,表示柱塞已完全缩回。
- 连接夹头但略微松动(拧开 45-90 度),将玻璃针滑到金属柱塞上,然后将毛细管针与金属柱塞一起推过前垫圈,直到它到达垫片(图 3C,D,取下夹头以进行可视化)。
注意: 当柱塞穿过垫圈时会出现一些阻力,当它到达垫片时会减小。确保毛细管针牢固地插入垫片中以形成气密连接(图3D)。 - 通过拧紧纳米注射器的夹头来固定针头(牢固地拧回去)。
注意:不要拧得过紧,因为这会压碎针头。 - 按 Empty 将 柱塞推入针中并从针尖排出油。如果玻璃针移动,请缩回柱塞,取出针头,然后重新加载。如果这导致形成气泡,请取下针头并重新填充矿物油。
注意:正确固定的针头不应随柱塞移动。 - 将一滴病毒(~6μL)或其他注射溶液放在一块封口膜1 上(图3E;埃文斯蓝染料用于可视化目的)。
注意:纳米注射器的最大体积为 ~5 μL。 - 按 Fill 产生一个气泡,作为油和溶液之间的分隔器(图 3F)。
注意:这也可以作为填充或清空针头时的定位标记。 - 降低针头,将尖端浸入溶液中,然后按 Fill (图3F,G)。
- 观察气泡后加载溶液时的液位。按 Empty 以排出堵塞物,如果气泡变细而液体没有进入针头,则按 Fill 重新加载。如果这不能解决问题,请更换针头。
- 当针头满载(图3H)时,在z平面上抬起针头,并在尖端吸出少量空气,以防止针尖处的溶液蒸发和针头堵塞。
- 将带有连接针头的纳米注射器转向远离操作员,朝向工作台后部,以防止任何意外损坏或伤害。

图 3:将针头连接到纳米注射器和溶液加载。 (A)针头安装到纳米注射器之前的起始位置:金属柱塞完全缩回并连接夹头。(B)在夹头下方,用于固定和固定针头的所有三个组件按正确的顺序显示(从左到右):密封O形圈(薄而黑),垫片(白色),带大孔的O形圈(黑色)(针必须通过)。为了确保气密连接,玻璃针在金属柱塞 (C) 上滑动并穿过前 O 形圈的开口,直到到达垫片 (D)。(E-H)将溶液装入针中。(E)将一滴溶液放在板盖上的封口膜上。(F)在加载溶液之前按Fill产生气泡,然后将针尖浸入溶液中。(G)溶液正在装入针中。(H)将溶液装入针中。注意:夹头已在(B-D)中取出以进行可视化,但在实验过程中应保持连接。固定针头的最后一步是拧紧夹头。埃文斯蓝染料用于E-H中的可视化。请点击此处查看此图的大图。
7. 注射
注意:此过程中使用的所有器械在手术前和每只小鼠之间都进行了消毒。
- 麻醉第一位具有理想大小空腔的女性(见第4节)。
- 将雌性放在桌子上并固定,如步骤3.1-3.6中所述。
- 将眼凝胶涂抹在眼睛上以防止角膜干燥,并在皮下注射止痛药。
注意:推荐的镇痛药:丁丙诺啡(0.05-0.1毫克/千克体重)或氟尼辛(2.5毫克/千克)或类似药物,符合当地动物福利规定。多模式围手术期镇痛通过注射镇痛药和异氟醚维持。 - 用浸有0.5mg / mL氯己定溶液(或类似溶液)的布擦拭无菌准备下腹部并擦干皮肤。用手术剪刀在下腹部做一个1.5-2.0厘米的垂直中线皮肤切口。
注意:按照当地批准的消毒程序准备手术区域。 - 轻轻抬起皮肤,将皮肤从切口点周围约1cm的底层肌肉层中解放出来,以方便手术后的缝合。
- 在肌肉层上做一个1厘米的垂直中线切口。
- 用一对镊子抬起皮肤和肌肉层的一侧,用另一对镊子寻找子宫角。
注意:蜕膜像项链上的珠子一样排列,而肠是一个长而连续的管子(图4A)。 - 用镊子小心地从腹部拉出两个子宫角。将组织保持在胚胎之间;不要直接挤压它们(图4B)。
注意:子宫在子宫颈处附着在身体上,两个卵巢/输卵管通过韧带连接。不要从这些锚点拉/分离子宫。 - 数数并记下左右两侧的胚胎数量。
- 对从卵巢到子宫颈或从子宫颈到卵巢的胚胎进行编号。
注意:如果在胚胎阶段收集注射的胚胎,这一点尤其重要。 - 用湿棉签轻轻地将所有胚胎推回腹腔,除了前三个要注射的胚胎。
- 将一滴PBS滴在培养皿中的弹性上,并将其保持在胚胎上方。
- 将闭合的镊子插入松紧带的切口并释放镊子以打开弹性切口,使液体滴到胚胎上。
注意:这确保了胚胎的补液,并且弹性膜粘附在女性的湿皮肤上,防止在接下来的步骤中PBS泄漏。 - 用镊子拉出对应于三个胚胎的子宫的一部分,然后轻轻地将培养皿栖息在女性的腹部。
- 用镊子和湿棉签,调整子宫位置和弹性,以确保弹性密封在女性的皮肤上,以防止PBS泄漏。
- 使用四个粘土脚固定并固定紧靠腹部上方的培养皿,减少对女性的压力以及对女性呼吸和心跳成像的敏感性。
- 将造型粘土圆柱体向下按压到胚胎/子宫的右侧以固定子宫(图4C)。
注意:此定向说明假设针头在女性的左侧,并且女性左子宫角的胚胎暴露在外。子宫的一侧(左子宫角或右子宫角)至关重要,因为AC要么面向针头(左角; 图4D)或面向稳定粘土圆柱体(右喇叭; 图 4E)。 - 要从右子宫角注射胚胎,请将粘土圆柱体放在胚胎的左侧(图4F)并将加热台旋转180°(图4G)以实现正确的方向。如果针头可以移动,请根据相关设置进行调整。
- 将PBS添加到培养皿中,直到胚胎和子宫被PBS覆盖。
- 将超声探头降低到PBS中并调整小鼠/手术台,使第一个胚胎与超声探头对齐,以便于记录注射。
注意:"第一"是指胚胎从卵巢到子宫颈的编号。 - 扫描所有三个胚胎并检查AC。按如下方式确定进样量:
- 用超声波机测量空调的直径。如果交流直径为 ≤0.2 毫米,则注入 69 nL;如果交流直径为 >0.2 毫米和 ≤0.29 毫米,则注入 2 x 69 nL (= 138 nL);如果交流直径> 0.29 毫米,则注入 3 x 69 nL (= 207 nL)(图 4H)。
注意:先前的实验表明,在E7.515下,高达207 nL的进样体积具有良好的耐受性。当AC的相对体积增加不超过90%15时,可以成功注射对生存的影响最小。同窝动物或小鼠品系之间的AC大小变化很常见,可能需要进一步优化。
- 用超声波机测量空调的直径。如果交流直径为 ≤0.2 毫米,则注入 69 nL;如果交流直径为 >0.2 毫米和 ≤0.29 毫米,则注入 2 x 69 nL (= 138 nL);如果交流直径> 0.29 毫米,则注入 3 x 69 nL (= 207 nL)(图 4H)。
- 使用注射控制器设置注射体积。
- 将注射速度设置为 慢 速,注射速率为 23 nL/s。
注意:不同的设备型号可能导致不同的注射力。 - 使用导轨系统上的主轮(x和z平面, 图4I)将针头降低到PBS中,然后在纳米注射器控制器上按 空 ,直到液体到达针尖。
注意:如果针头堵塞,按 空 可以溶解堵塞和/或排出堵塞物。 - 将针头从 PBS 中取出并按 注射。验证是否排出了近似所需体积的一滴。
- 通过将纳米注射器与显微操纵器上的y平面轮移动,将针头降低到PBS中,并将其与超声探针和胚胎对齐(图4J)。
注意:当针尖在超声图像上显示为亮点时,针尖完全对齐(图4K,L)。针头可以使用显微操纵器在所有三个方向上移动。 - 用注射角度轮调整针头角度,以确保相对于子宫壁的注射角度接近垂直。使用显微操纵器上的注射轮将针头一次性插入AC(图4J-M)。注意针尖亮度。如果针尖从超声图像中消失,请向前或向后移动超声探头以使针头重新聚焦。
注意:一旦针头进入交流电内部,可以在不伤害胚胎的情况下对针头位置和焦点进行微小的修改(在~0.3毫米内调整)。不要调整针的位置超过此位置。 - 按 注射 (对于 207 nL,将体积设置为 69 nL 并注射三次)。注射后,再等待5-10秒,然后轻轻地将针头缩回。
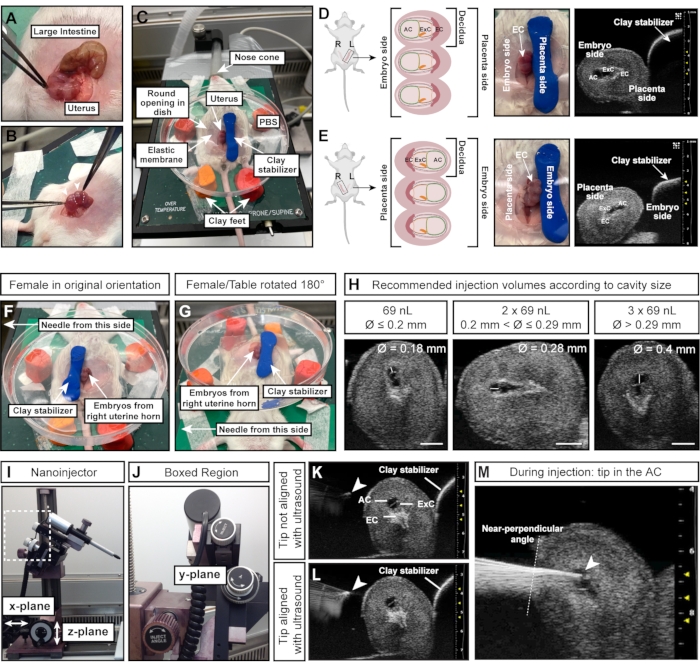
图4:成功注射羊膜腔的最佳大小和方向 。 (A)子宫角,有多个E7.5蜕膜,形状像一串球体(底部),与大肠(顶部)相比。(B)抓住蜕膜之间的子宫组织(白色虚线)。避免用镊子直接挤压蜕膜(白色箭头),因为蜕膜和发育中的胚胎在这个早期阶段很脆弱,并且在过度的外力下容易被吸收。(C)女性仰卧位,蜕膜暴露在充满PBS的培养皿中,并安装在四英尺的造型粘土上。蜕膜由一块形状像圆柱体的附加造型粘土稳定。(D、 E)AC的方向受暴露的子宫角侧面的影响。如果使用来自左子宫角的蜕膜,AC 将背对粘土稳定器,并且易于接近左侧的针头 (D)。但是,如果使用右子宫角,胎盘外锥将面向针头,使接触AC(E)更加困难。因此,当注射到右子宫角时,将粘土稳定器朝向面向针头的一侧(F),并将整个加热台旋转180°(G)。(H) 根据交流大小推荐的注射量。通常,直径≤0.2 mm的腔可以注射最大69 nL。直径> 0.2 mm 和 ≤ 0.29 mm 可承受高达 2 x 69 nL (138 nL) 的体积,0.29 mm >腔可注射 3 x 69 nL (207 nL)。比例尺 = 1 mm. (I, J) 纳米注入器连接到轨道系统,可以在 x 和/或 z 平面上移动。针的角度可以用 注射角度 轮调节。(K, L)针尖(白色箭头)在超声检查中看起来最亮时与AC对齐(L)。(M)显示注射过程的超声图像,其中针尖在AC中并且对齐良好(白色箭头)。缩写:A = 羊膜;AC = 羊膜腔;ExC = 外腔;EC = 胎盘外锥。 请点击此处查看此图的大图。
- 将阶段移动到下一个胚胎,如果其他两个胚胎具有合适的AC尺寸,则对它们重复步骤7.22-7.26。
- 使用显微操纵器将超声探头和针头从PBS中取出。将针头远离操作员,以免损坏和受伤。
- 用镊子将第 1和第 2个胚胎轻轻推入松紧带,将它们引导回雌性的腹部。轻轻抓住与第3个胚胎相邻的组织,并将子宫拉向弹性切口的上端。用镊子轻轻拉起第4-6个胚胎,让第3个胚胎重新进入腹部。
注意:此步骤可以在不更换PBS或移除培养皿的情况下完成。 - 根据需要重复,直到注射所有具有最佳AC的胚胎或达到时间限制。
- 轻轻地将胚胎/子宫推回女性的腹部。
- 吸出PBS并取出培养皿。如果使用了病毒,请作为传染性废物处理。
- 用Vicryl(USP 6-0,针长13毫米,3/8圆)在简单的连续或中断缝合中缝合肌肉层,并用1-2个夹子闭合皮肤(见 材料表)。
- 关闭异氟烷泵。
- 取下手术胶带,将女性置于俯卧位(腹部朝下)在40°C加热板上的干净笼子中。
注意:预计雌性将在 10 分钟内恢复意识并移动。确保该过程在30分钟内完成。女性的遗传背景、年龄和体重可能会影响对麻醉的敏感性。在手术过程中监测小鼠呼吸缓慢(呼吸缓慢意味着麻醉太深)或运动(麻醉太轻)的迹象。丁丙诺啡(0.05-0.1毫克/千克体重)或氟尼辛(2.5毫克/千克)或类似物符合当地动物福利规定,如果需要,可在第一次注射后8小时提供。 - 如果要注射另一名女性,请准备手术区域,同时监测第一个女性的觉醒情况。
- 用70%乙醇擦拭手术工具以去除任何残留的血液或组织,并在预热的玻璃珠灭菌器中消毒10秒。丢弃棉签和用过的纸巾。用薄纸擦干培养皿和粘土片。
- 重复步骤7.1-7.35,直到所有雌性都被注射。
- 清空并丢弃针头。
- 如果针头中残留有病毒或注射液,请按纳米注射器上的 Empty 并将 针头的内容物倒在薄纸上。
- 按 Fill 键完全缩回金属柱塞,直到控制器发出两声蜂鸣音,表示柱塞已完全缩回。
- 松开夹头并将针从金属柱塞上滑下。将针头丢弃到锐器废物容器中。
- 清洁 BSL-2 工作台。
- 如果使用了病毒,请用消毒剂喷洒整个手术区域(见 材料表)。15分钟后,擦去消毒剂并用70%乙醇清洁整个手术区域。如果没有使用病毒,请用70%乙醇清洁所有表面。
- 用干燥、柔软且不起毛的薄纸擦去超声探头上残留的任何 PBS。
- 根据生物安全准则丢弃废物。
- 关闭超声机、加热台、BSL2 工作台和 O2 电源。
结果
在E7.5注射hPGK-H2B-GFP慢病毒11,12的胚胎在E13.5收集并在荧光解剖显微镜下检查(图5A)。神经板的成功转导导致胚胎主要在大脑和其他外胚层衍生组织(例如皮肤)中强烈表达荧光报告基因(图5A,B)。注射过高的体积(大于此处推荐的体积,例如≥500 nL)会增加AC中的压力,并可能导致完全吸收(数据未显示)或神经管缺陷,例如外脑畸形(图5A)。在E7.5成功注射导致从前脑到后脑的均匀转导(图5C-J)。
2×1010感染单位(IFU)左右的慢病毒滴度达到95%以上的靶向,而~1 ×10 9 IFU的滴度达到15%的靶向效率15。此外,以前难以使用电穿孔靶向的结构,例如脉络丛17,18,也被靶向(图5 E,F)。转导效果可以通过调整输送到AC中的病毒滴度来改变。 低滴度的注射导致单细胞克隆的转导(图5C,图5E和图5G,H),而使用高滴度病毒几乎100%的整个大脑(图5D,图5F,图5H和图5J).因此,NEPTUNE可用于克隆转导,谱系追踪和遗传筛选方法,或研究整个大脑中基因过表达或下调的全局影响。
哺乳动物的眼睛发育是胚胎外胚层的三种衍生物之间组织良好的交流的结果:神经视网膜(NR)和视网膜色素上皮(RPE)来源于腹侧前脑的神经上皮,而表面外胚层则产生未来的晶状体和角膜上皮。然而,中央基质和后内皮,角膜的另外两层,来源于眼周间充质的神经嵴细胞19,20。通过E13.5胚胎的冠状切片,在E7.5注射高滴度慢病毒显示,与大脑相似,眼睛神经组织以及晶状体,角膜和间充质的高而均匀转导(图5K)。随着神经形成的进展,在E8.5和E9.5处注射导致晶状体和角膜上皮的持续靶向(图5L和图5N),而眼睛神经外胚层衍生组织的转导在E8.5(图5L,M)或不靶向E9.5(图5N)。
虽然大多数病毒颗粒在注射时感染暴露的组织,但一些颗粒转导后来发育的非外胚层衍生组织(图6A)。唾液腺和导管从口腔上皮21在E11.5 附近发育,并以海王星为目标(图6B)。在E9.5注射后,舌头的舌上皮被很好地转导;然而,下面的间充质是阴性的(图6C;括号表示转导细胞;星号表示自发荧光信号未转导细胞)。此外,舌上皮内有阳性簇,由负部分隔开(图6C,白色箭头),表明表面的转导。神经嵴细胞已在下面的舌间充质和舌上皮内被描述,它们参与味和味蕾的发育22。事实上,E7.5 处的注射导致舌间充质在 E13.5 处的广泛转导(图 6D),这表明早期注射针对神经嵴细胞,有助于舌头中的间充质。
在脊椎动物中,背根神经节(DRGs)是周围神经系统(PNS)的核心组成部分,因为来自身体外围的所有体感输入(温度,疼痛,压力)都通过DRG神经元的激活传递到大脑23。DRG的神经元和神经胶质细胞均来源于躯干神经嵴细胞24。慢病毒注射,其中普遍存在的hPGK启动子控制荧光报告基因的表达,导致中枢和周围神经系统的广泛靶向(图7A),转导脊髓中的神经元和祖细胞(图7B)以及DRG(图7C)。使用双皮质素25的Mini启动子可以将GFP表达限制在仅神经元上(15和图7D,E)。
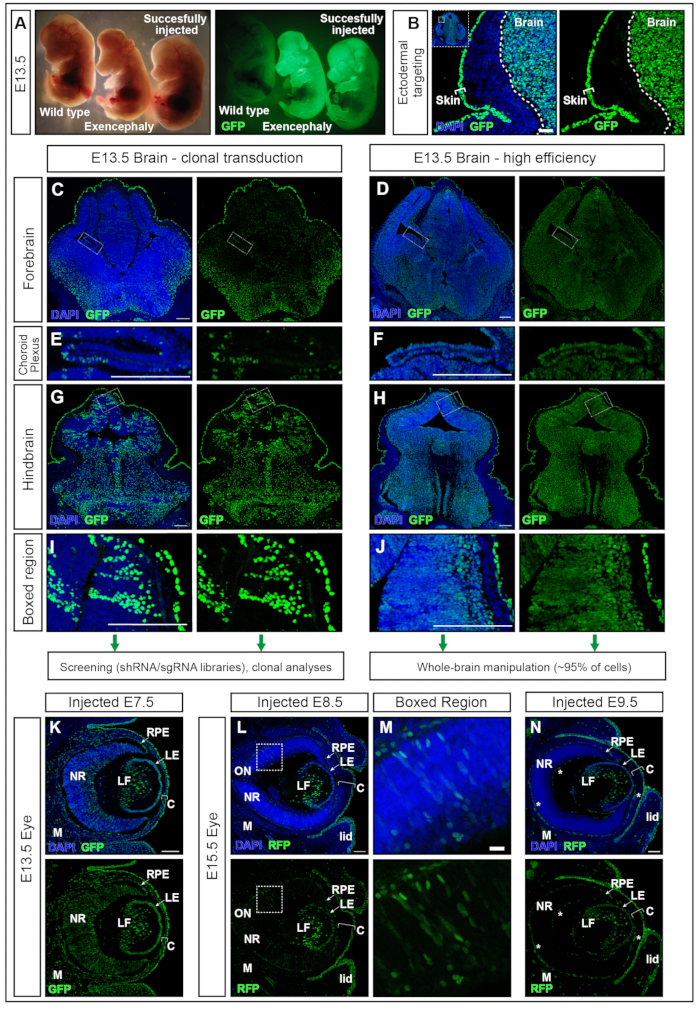
图 5:使用海王星进行高效或克隆转导。 (A)用标准照明照射的解剖显微镜下的E13.5胚胎(左图)和相同的GFP照明胚胎(右图)。最左边是未注射的胚胎,最右边是成功注射的胚胎,在大脑中产生正信号(最右边的胚胎)。由于注射体积过大(中间胚胎)而导致的外脑胚。(B)注射E7.5的皮肤和大脑靶向。比例尺 = 50 μm. (C, D) 具有低克隆转导 (C) 或高效转导 (D) 的前脑 E13.5 共聚焦图像。(C、E、G、I)大脑中不同区域的克隆转导。(D, F, H, J)大脑不同区域的高效转导。比例尺 = 200 μm。不同的转导效率代表了中枢神经系统的其他区域。(东、女)脉络丛靶向,克隆(E)或高效(F)。比例尺 = 200 μm。 (G, H) 克隆靶向 (G) 和高效 (H) 靶向后脑,放大于 (I, J)。比例尺 = 200 μm。 (K) 在子宫内注射后 E13.5 处的 GFP 报告基因在眼睛中的表达 在 E7.5 (L, M) 处注射后,GFP 报告基因在眼睛中的表达 E8.5 (L),框框区域放大 (M) 或 E9.5 (N)。自发荧光血管标有白色星星。比例尺 = 100 μm。缩写: NEPTUNE = neural plate targeting with in uteronano-injection;C = 角膜;LE = 晶状体上皮;LF = 透镜纤维;M = 间充质;NR = 神经视网膜;ON = 视神经;RPE = 视网膜色素上皮;GFP = 绿色荧光蛋白;中枢神经系统=中枢神经系统。请点击此处查看此图的大图。
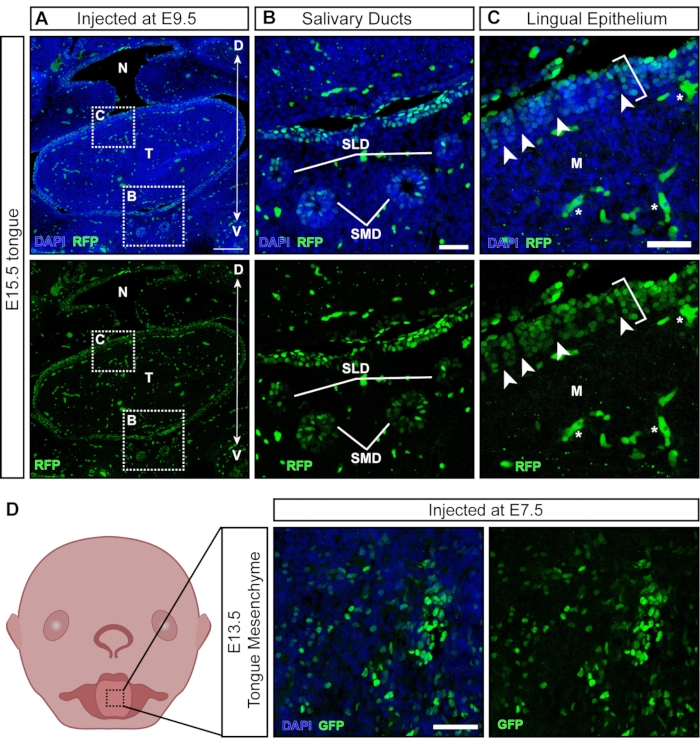
图6:在子宫内非神经组织的转导。 (A)E15.5口腔的共聚焦图像。胚胎在E9.5处注射荧光报告慢病毒。比例尺 = 200 μm。 (B, C) (B) 内嵌板的放大倍率;唾液管上皮被病毒转导。(C) 内嵌面板的放大倍率;用GFP报告病毒转导的舌背上皮(白色括号)。源自神经嵴细胞的潜在间充质为阴性。白色箭头表示神经嵴细胞呈阴性,周围环绕着病毒转导的上皮细胞(自发荧光血细胞/血管用白色星星标记)。比例尺 = 50 μm。 (D) 在 E7.5 注射荧光报告病毒后 E13.5 舌间充质的示意图和共聚焦图像。比例尺 = 50 μm。 缩写:D = 背侧;M = 间充质;N = 鼻咽;SLD = 舌下导管;SMD = 下颌下导管;T = 舌头;V = 腹侧;GFP = 绿色荧光蛋白。请点击此处查看此图的大图。
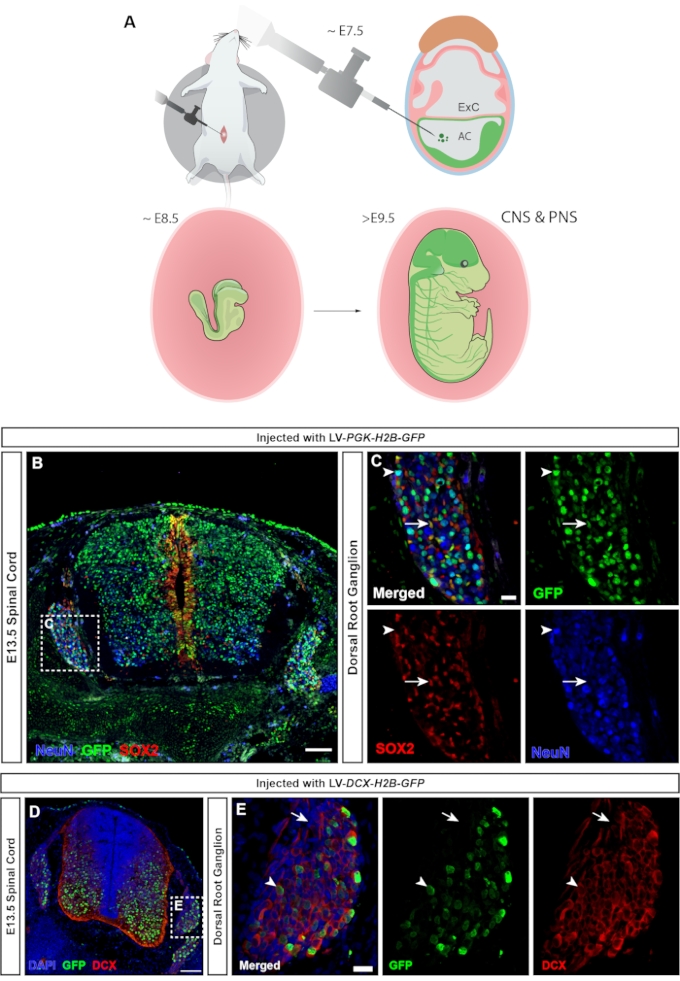
图7:神经嵴衍生的背根神经节细胞的转导。 (A)E7.5的海王星靶向允许靶向CNS和PNS。(B)E13.5脊髓和DRG在E7.5处注射hPGK-H2B-GFP报告慢病毒的共聚焦图像显示SOX2 +神经祖细胞和NeuN +神经元的转导。比例尺 = 100 μm。 (C) B 的框框区域,显示 SOX2+(白色箭头)和 NeuN+(白色箭头)细胞群中具有 GFP 表达的 DRG。比例尺 = 20 μm。 (D) E13.5 脊髓和 DRG 在 E7.5 处注射 DCX-H2B-GFP 慢病毒的共聚焦图像,仅靶向 DCX+ 细胞。比例尺 = 100 μm。 (E) D 的盒装区域显示 DRG,GFP 表达仅限于 DCX+ 神经元(白色箭头)。DCX细胞的GFP呈阴性(白色箭头)。比例尺 = 20 μm。缩写: NEPTUNE = neural plate targeting with in utero nano-injection;中枢神经系统=中枢神经系统;PNS = 周围神经系统;DRG = 背根神经节;GFP = 绿色荧光蛋白。请点击此处查看此图的大图。
讨论
该方案中有几个步骤会影响胚胎存活、注射质量和读数。胚胎的胎龄定义为过夜交配后阴道塞当天中午的E0.5。在下午晚些时候/晚上在E6.5进行怀孕的超声波检查,确保胚胎发育到足以通过超声波识别。检查(1)允许预先筛选有多少栓阳性小鼠实际怀孕,(2)确保在栓子阳性小鼠未怀孕的情况下不会不必要地解冻和浪费病毒,以及(3)减少对小鼠的不必要干预(避免对非怀孕雌性进行手术)。
在E7.5,胚胎对外力敏感,应小心处理。例如,拉扯子宫角或挤压蜕膜会导致胚胎吸收。子宫组织在女性腹部外侧应始终保持湿润,以防止组织干燥。大多数蜕膜应留在女性腹部内,只有3-4个暴露在注射中。针头锋利度是成功注射的另一个关键决定因素。钝或断针尖导致蜕膜在进入AC之前反复戳或压迫造型粘土,从而提高吸收率。因此,研磨良好且锋利的针头应始终安全存放,并在最多 2 个母针后更换。
该协议描述了如何通过一次注射慢病毒来靶向神经板。此外,它还显示了转导功效如何从单细胞克隆适应整个大脑。然而,其他非神经组织,包括皮肤和口腔上皮,也是靶向的。此外,所有细胞类型(祖细胞和分化细胞)都被转导,使这种方法有效但非特异性。在病毒构建体中使用MiniPromoters导致转基因在神经元或星形胶质细胞中的特异性表达15。这样做的好处是避免使用专用的转基因Cre动物,从而减少了劳动力(菌株维持和基因分型)和成本。
海王星的局限性包括其技术难度,以可预测和一致的速度获得怀孕雌性的挑战,以及获得专用仪器的成本。此外,慢病毒对细胞的非选择性靶向可以被视为该技术的益处和局限性。向AC注射较大的体积会导致脑畸形13,尽管此处描述的体积可以避免脑畸形和脑畸形15。因此,子宫 内 纳米注射对大脑发育的负面影响是必须通过注射适应胚胎阶段和AC大小的正确体积来小心避免的。
该技术的未来改编可能侧重于病毒嗜性。腺相关病毒(AAV)具有不同的血清型,已被证明可以稳健地靶向CNS17,26中的不同细胞类型。然而,AAV不会整合到宿主细胞基因组中,因此可能会在分裂率高的细胞中丢失。尽管有几种方法可以提高海王星的特异性,但转基因动物仍然是 体内基因操作的黄金标准。Cas9小鼠和编码sgRNA的慢病毒已被用于胚胎表皮27 的遗传筛选,也可能适应发育中的CNS。
在E7.5处注射到AC中,在神经形成开始之前有效地靶向神经外胚层的细胞,并且比子宫电穿孔 更有效地 靶向发育中的大脑。这允许从较早的时间点研究对大脑发育很重要的遗传线索。与传统的遗传小鼠模型相比,NEPTUNE提供了一种灵活的方法来执行功能基因分析。过表达或基因缺失后的表型可以在几天到几周内研究,而不是几个月或几年。注射多种病毒构建体允许在一个胚胎内操纵多个基因,并避免产生双重或三重敲除动物。因此,海王星不仅可以节省时间,还可以减少研究中使用的动物数量。
披露声明
作者声明没有竞争利益。
致谢
我们感谢Bettina Semsch和Jia Sun(Infinigene)对小鼠的专业护理;来自Biomedicum Imaging Core(BIC)的Florian Salomons和Göran Månsson在图像采集和咨询方面提供帮助。资助:我们感谢以下 资助者对该项目的支持:瑞典研究委员会,卡罗林斯卡学院(KI基金会,职业发展补助金,博士生KID资助和SFO StratNeuro资助,创新医学中心),奥利和埃洛夫爱立信基金会,托恩斯皮兰基金会,Jeansssons基金会,斯文和埃巴-克里斯蒂娜哈格伯格斯奖和研究资助, Knut和Alice Wallenberg项目赠款,Fredrik和Ingrid Thurings基金会,Lars Hiertas Minne,儿童癌症基金会(Barncancerfonden),Åhlen基金会,Åke Wibergs基金会,Tore Nilssons基金会和瑞典基金会开始向ERA提供赠款。 图4D,E 是用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL Syringe | BD Bioscience | 309628 | |
| 27 G Needle | BD Bioscience | 300635 | |
| 3.5 inches capillaries | Drummond Scientific | 3000203G/X | Were used to pull in house needles |
| 70 MHz MS Series transducer | Visual Sonics | MS700 | |
| Aquasonic clear ultrasound gel | Parker Laboratories | Mar-50 | |
| Autoclip Applier 9 mm | Angthos | 12020-09 | |
| CD1 mice | Charles River, Germany | Crl:CD1(ICR) | Females: from age of 8 weeks old Males: from the age of 12 weeks old |
| Cotton Swab | OneMed Sverige AB | 120788 | |
| DPBS | Gibco | 14190094 | |
| Dressing forceps delicate straight 13 cm | Agnthos | 08-032-130 | |
| EG-400 Narishige Micropipette Grinder | Narishige | NA | |
| EZ clips 9 mm | Angthos | 59027 | clips |
| Iris Scissors, Super Cut, straight, 9 cm | Agnthos | 307-336-090 | |
| Isofluorane | Baxter Medical AB | EAN: 50085412586613 | Purchased from Swedish Pharmacy |
| Kimwipes | Kimberly Clarke | 7557 | |
| Membrane Tape | Visual Sonics | SA-11053 | |
| Micropipette Puller | Sutter Instrument | P-97 | |
| Modeling Clay | Sense AB | 10209 | |
| Mouse Handling Table | Visual Sonics | 50249 | |
| Nanoject II Auto Injector Kit | Drummond | 3-000-205A | |
| Parafilm | Bemis | HS234526C | |
| Petri dish with central opening (low wall) | Visual Sonics | SA-11620 | |
| Petri dish, (ØxH): 92 x 16 mm | Sarstedt | 82.1472.001 | |
| Rely+On Virkon | DuPont | 130000132037 | disinfectant |
| Silicone membrane | Visual Sonics | SA-11054 | |
| Steri 250, hot bead sterilizer | Angthos | 31100 | |
| Surgical Tape (1.25 cm x 9.14 m) | Medicarrier | 67034 | |
| Vevo Compact Dual (Med. Air & O2) Anesthesia System | Visual Sonics | VS-12055 | |
| Vevo Imaging Station 2 | Visual Sonics | VS-11983 | |
| Vevo2100 | Visual Sonics | VS-20047 | |
| Vicryl 6-0; C-3 needle, 45 cm purple filament | Agnthos | J384H |
参考文献
- Theiler, K. . The House mouse. Atlas of embryonic development. , (1989).
- Barresi, M. J. F., Gilbert, S. F. . Developmental biology. , (2016).
- Taylor, J. C., et al. Factors influencing success of clinical genome sequencing across a broad spectrum of disorders. Nature Genetics. 47 (7), 717-726 (2015).
- Pizzo, L., et al. Rare variants in the genetic background modulate cognitive and developmental phenotypes in individuals carrying disease-associated variants. Genetics in Medicine. 21 (4), 816-825 (2019).
- Sakai, Y. Neurulation in the mouse: Manner and timing of neural tube closure. The Anatomical Record. 223 (2), 194-203 (1989).
- Schoenwolf, G. C. Shaping and bending of the avian neuroepithelium: Morphometric analyses. Developmental Biology. 109 (1), 127-139 (1985).
- Smith, J. L., Schoenwolf, G. C., Quan, J. Quantitative analyses of neuroepithelial cell shapes during bending of the mouse neural plate. Journal of Comparative Neurology. 342 (1), 144-151 (1994).
- Katahira, T., Nakamura, H. Gene silencing in chick embryos with a vector-based small interfering RNA system. Development Growth and Differentiation. 45 (4), 361-367 (2003).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. I. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and Biophysical Research Communications. 230 (2), 376-380 (1997).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16 (7), 821-827 (2010).
- Pierfelice, T. J., Gaiano, N. Ultrasound-guided microinjection into the mouse forebrain in utero at E9.5. Journal of Visualized Experiments JoVE. (45), e2047 (2010).
- Gaiano, N., Kohtz, J. D., Turnbull, D. H., Fishell, G. A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature Neuroscience. 2 (9), 812-819 (1999).
- Slevin, J. C., et al. High resolution ultrasound-guided microinjection for interventional studies of early embryonic and placental development in vivo in mice. BMC Developmental Biology. 6, 10 (2006).
- Mangold, K., et al. Highly efficient manipulation of nervous system gene expression with NEPTUNE. Cell Reports Methods. 1, 100043 (2021).
- Kameneva, P., et al. Single-cell transcriptomics of human embryos identifies multiple sympathoblast lineages with potential implications for neuroblastoma origin. Nature Genetics. 53 (5), 694-706 (2021).
- Kaiser, K., et al. MEIS-WNT5A axis regulates development of fourth ventricle choroid plexus. Development. 148 (10), (2021).
- Haddad, M. R., Donsante, A., Zerfas, P., Kaler, S. G. Fetal brain-directed AAV gene therapy results in rapid, robust, and persistent transduction of mouse choroid plexus epithelia. Molecular Therapy. Nucleic Acids. 2 (6), 101 (2013).
- Heavner, W., Pevny, L. Eye development and retinogenesis. Cold Spring Harbor Perspectives in Biology. 4 (12), 008391 (2012).
- Swamynathan, S. K. Ocular surface development and gene expression. Journal of Ophthalmology. 2013, 103947 (2013).
- Amano, O., Mizobe, K., Bando, Y., Sakiyama, K. Anatomy and histology of rodent and human major salivary glands: -overview of the Japan Salivary Gland Society-sponsored workshop. Acta Histochemica et Cytochemica. 45 (5), 241-250 (2012).
- Liu, H. X., Komatsu, Y., Mishina, Y., Mistretta, C. M. Neural crest contribution to lingual mesenchyme, epithelium and developing taste papillae and taste buds. Developmental Biology. 368 (2), 294-303 (2012).
- Marmigère, F., Ernfors, P. Specification and connectivity of neuronal subtypes in the sensory lineage. Nature Reviews. Neuroscience. 8 (2), 114-127 (2007).
- Zirlinger, M., Lo, L., McMahon, J., McMahon, A. P., Anderson, D. J. Transient expression of the bHLH factor neurogenin-2 marks a subpopulation of neural crest cells biased for a sensory but not a neuronal fate. Proceedings of the National Academy of Sciences of the United States of America. 99 (12), 8084-8089 (2002).
- Portales-Casamar, E., et al. A regulatory toolbox of MiniPromoters to drive selective expression in the brain. Proceedings of the National Academy of Sciences of the United States of America. 107 (38), 16589-16594 (2010).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367 (6483), 1264-1269 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。