Method Article
由去细胞化肺切片制备的工程肺组织
摘要
该协议描述了一种通过用肺泡上皮2型细胞,成纤维细胞和内皮细胞重新填充去细胞化精密切割的肺切片来产生可重复的小规模工程肺组织的方法。
摘要
需要改进的三维(3D)肺模型,以概括天然肺泡 离体的结构和细胞复杂性。最近开发的类器官模型促进了肺上皮祖细胞 在体外的扩张和研究,但这些平台通常依赖于小鼠肿瘤来源的基质和/或血清,并且仅包含一个或两个细胞谱系。在这里,我们描述了一种基于去细胞化精密切割肺切片(PCLS)的多谱系再细胞化来生成工程肺组织(ELT)的方案。ELT含有肺泡样结构,包括肺泡上皮,间充质和内皮,位于细胞外基质(ECM)底物中,与天然肺非常相似。为了产生组织,用琼脂糖充气,切片成450μm厚的切片,切成条状,去细胞化。然后将所得的无细胞ECM支架与原代内皮细胞,成纤维细胞和肺泡上皮2型细胞(AEC2s)重新播种。AEC2s可在ELT培养中用无血清、化学定义的生长培养基维持至少7天。在整个组织制备和培养过程中,切片被夹入盒式系统中,该系统便于并行处理和标准化多个ELT的细胞接种。这些ELT代表了一个有机细胞培养平台,应该促进研究肺泡内的细胞 - 细胞和细胞 - 基质相互作用以及调节AEC2及其利基质的生化信号。
引言
肺泡是远端肺的功能单元,由肺泡上皮1型细胞(AEC1s)和2型细胞(AEC2s)衬砌的气体交换空气空间网组成。上皮的下方是密集的毛细血管网络以及支撑间充质,所有这些都由细胞外基质(ECM)支架支撑,该支架为这些脆弱的气囊提供强度和柔韧性1。肺泡也是许多肺部病变的损伤部位,包括特发性肺纤维化2、急性呼吸窘迫综合征3 和严重冠状病毒病-19 (COVID-19)4。尽管过去十年的工作已经发现了肺上皮内显着的可塑性,但在某些环境中使远端肺修复的机制 - 以及排除其他环境修复的机制 - 仍然是一个需要深入研究的领域5。开发改进的 体外 平台来模拟肺泡将促进肺泡生物学,再生和治疗的研究。
AEC2s自我更新并分化为AECS1s,因此被认为是远端肺6,7,8的原代干细胞。然而,这些细胞对 体外 研究构成了特殊的挑战,因为与培养原代AEC2s相关的困难而没有表型9的损失。在传统的二维(2D)培养物中,AEC2s变平并采用AEC1样细胞10的一些特征。相比之下,3D培养策略(最常见的是类器官)支持维持原代AEC2s6,11,12 中的差异化特征,并允许长期培养多能干细胞(PSC)衍生的AEC2s13,14。类器官已被用于模拟远端肺发育15,病毒感染11,15和AEC2相关遗传病13,16,17,从而能够对AEC2生物学和再生进行重要见解。然而,这些培养模型通常仅包含一个或两个细胞谱系,并将细胞嵌入凝胶型基质中,这些基质无法概括天然肺泡的结构或ECM底物。
ECM是通过分子,拓扑和机械线索对细胞表型和行为进行的关键调节剂;包括调节干细胞命运的组织特异性生态位的关键组成部分;并作为调节局部分泌生长因子18,19,20,21的可用性的储库。因此,在天然ECM上培养细胞可以增加体外系统的预测能力,以模拟体内组织的生物学。脱细胞化是通过洗涤剂,酶或物理或其他方法从组织中去除细胞物质的过程,当仔细执行时,可以在很大程度上保留天然器官的ECM支架22,23。这种支架可以重新填充细胞以进行3D仿生培养。然而,虽然去细胞化支架广泛用于组织工程应用,但它们在常规细胞培养中的应用受到限制。以前的几项研究已经报道了肺切片或小肺组织节段的脱细胞化和再细胞化。除了概念验证研究24,25,26外,还使用重装肺切片来研究成纤维细胞 - 基质粘附27,28并研究患病肺基质对成纤维细胞表型27,29的影响。随着可用于产生精确切割的组织切片的改进技术,去细胞化的肺切片可以提供一个方便和小规模的平台来培养细胞,同时保留肺泡,气道和血管亚结构。结合多种细胞类型将能够在生理相关的3D环境中研究细胞 - 细胞相互作用。然而,需要改进的策略来促进整个培养过程中组织的处理,并确保具有已知细胞数量的组织的受控和可重复的接种。
在这里,我们提出了一种方案,通过用原代内皮细胞,AEC2s和成纤维细胞重新填充去细胞化精密切割肺切片(PCLS)来生成工程肺组织(ELT)。在我们先前描述的工程心脏组织系统30 和全肺脱细胞化 - 再细胞化策略22,31的改编中,我们描述了从大鼠肺中切割PCLS并将切片夹入可重复使用的组织培养盒中以简化和标准化下游操作的程序。将剪下的切片去细胞化以形成无细胞ECM支架,这些支架在定制的播种浴中重新填充。肺切片支架保留了关键的ECM组件和结构,并支持AEC2在多谱系肺泡样结构内的生长至少7天。ELT代表了生理学相关3D基质中的一种新型肺泡共培养系统,该系统应支持肺组织工程策略的发展,同时促进AEC2s和肺泡的基础生物学研究。
研究方案
本文中描述的所有动物实验程序均已获得耶鲁大学动物护理和使用委员会的批准。
1. 创建组织培养盒和播种浴
注意:一旦制成,组织培养盒和播种浴可以高压灭菌并重复用于重复的ELT培养。
-
组织培养盒
- 使用激光切割机根据 补充文件 1 和补充文件 2 中分别提供的设计,将 3/32 英寸厚的聚四氟乙烯 (PTFE) 切割出组织培养盒框架和夹子。根据 补充文件 3,使用激光切割机从 1/16 英寸厚的 PTFE 中切割出组织培养盒片。使用 80% 的功率和 15% 的速度切割轮廓 3 倍(对于 30 W 激光切割机)。
-
播种浴
- 使用晶种浴CAD文件(补充文件4 和 补充文件5)分别使用透明树脂3D打印播种浴模具的底座和环。
- 使用前将模具浸泡在10%泊洛沙姆407的蒸馏水中过夜,以帮助PDMS释放。让空气干燥,然后将环安装在模具底座上,并用柔性塑料薄膜包裹,以帮助防止泄漏。
- 通过将PDMS弹性体以10:1的比例与固化剂混合,准备每个模具至少60克聚二甲基硅氧烷(PDMS),然后倒入3D打印模具中。在真空干燥器中对PDMS进行脱气30分钟以除去任何气泡。
- 在60°C下烘烤播种浴8小时。
2. 从大鼠肺中制备精密切割的肺切片
- 器官摘取
- 准备一个包含重力和泵驱动的肢体的分裂灌注系统,如图 1所示。将肺动脉 (PA) 套管连接到管子的末端,包括一个 1/16 英寸倒钩 Y 形连接器,该连接器连接到 1/2 英寸长度的 LS 14 硅胶管和一个 3/32 英寸母鲁尔锁连接器(见 图 1)。此时不要将止回阀连接到套管上。
- 分别使用含有 100 U/mL 肝素和 0.01 mg/mL 硝普钠 (SNP) 的 PBS 进行抗凝和血管舒张。将灌注泵预设为 30 mL/min。
注意:将SNP新鲜添加到肝素溶液中,并避免光照。 - 给一只成年(8-12周龄,约300-350g)Sprague-Dawley大鼠腹腔(IP)注射400 U / kg肝素进行抗凝血,然后IP注射氯胺酮(75mg / kg)和甲苯噻嗪(5mg / kg)进行麻醉。通过对有害刺激缺乏反应(脚趾捏合)确认麻醉的手术平面。
- 用理发器修剪胸部和腹部的毛皮。然后用70%乙醇喷洒,并用10%聚维酮碘擦拭3倍。
- 用大鼠牙钳抓住横膈膜水平以下的皮肤。然后用细尖剪刀在皮肤上做一个1/2英寸的横向切口。用镊子抓住暴露的腹筋膜,在筋膜上做一个1/2英寸的横向切口,然后将切口穿过上腹部宽度的皮肤和筋膜。
- 用细剪刀的尖端在前隔膜中心做一个小切口(不超过1/8英寸),使肺部缩回胸部。将横膈肌的切口延伸到胸部的整个宽度。
- 通过肋骨的整个高度朝向颈部做两个垂直切口,小心不要损伤肺部。通过左肋骨延伸切口,穿过锁骨,沿着颈部一侧切到喉部的水平,露出气管。
- 从周围的结缔组织和食道中解剖气管。在靠近喉部的两个软骨环之间的气管前半部分上做一个横向切口。在气管后面,在切口水平下方,将4-0聚丙烯缝合线穿线,并用两个扭曲松散地预先绑住外科医生结的前半部分。
- 通过将Y型接头的一个肢体插入朝向肺部方向的气管切口,将一个套管(包括一个连接到单向止回阀的1/16英寸倒钩Y型接头)和一个1/2英寸长的LS 14硅胶管(见 图1)放入气管中。
- 将预绑好的缝合线环围绕气管放置在插入的套管水平处,并在插入的Y形连接器周围拧紧以将套管固定到位。添加两个单扭缝合线以完成结。
- 用空气填充10 mL注射器,并连接到气管插管的鲁尔锁。
- 使用弯曲的止血器将下腔静脉夹紧靠近膈肌,然后通过右心室(RV)向心脏注射150 U肝素(1000 U / mL)。
- 部分打开重力线旋塞阀,从步骤2.1.1制备的PA套管中产生缓慢但稳定的PBS/肝素/SNP滴落。
- 将 4-0 聚丙烯缝合线的针头穿在 PA 基部后面,从 RV 中取出。使用外科医生结的前半部分在 PA 基部周围预先系上松散的缝合线环。
- 使用细剪刀在RV下方垂直于PA的RV上做一个小切口(不超过1/8英寸),然后将PA套管Y形连接器的一个肢体插入PA的底座。将缝合线固定在PA和插入的连接器周围,并添加单扭扣以完成外科医生的结。
注意:在流动下灌注PA可防止气泡进入脉管系统,从而阻止肺部的充分清除。 - 将单向瓣膜连接到 PA 导管 Y 型接头的另一端,然后切断心脏的顶端,以允许血流流经左心室外流。
注意:在通过泵灌注之前,如果不能切断心脏的顶点,可能会对血气屏障造成损害,导致液体泄漏到空气空间中。 - 使用连接两条管路的旋塞阀将灌注管路切换到泵侧,然后以 30 mL/min 的速度打开泵。在通过 PA 灌注肺部时,通过 10 mL 气管注射器以大约 10-15 次呼吸/分钟的速度手动通气肺部,以方便清除肺部的血液。灌注肺部,直到它们大部分变白,通常需要40毫升PBS /肝素/ SNP或更少。
注意:肺部血液清除不足可能会损害下游的脱皮。 - 切除气管插管水平正上方的后气管,然后切除肺和心脏,使其脱离所有剩余的结缔组织,并整体提取肺和心脏。
- 将10 mL注射器在Hank的平衡盐溶液(HBSS)中加入2%低熔点琼脂糖,不含酚红,预热至42°C。
注意:所需的琼脂糖的确切体积将因肺大小而异。较大的肺(即来自大于400g的大鼠)将需要超过10mL琼脂糖。 - 通过气管套管用 10 mL 空气(即,大约总肺活量)手动将提取的肺充气 3 倍,以帮助招募塌陷的肺实质。
- 通过气管套管以约40 mL / min的速度手动注射琼脂糖,立即用准备好的琼脂糖注射器使肺充气,直到肺叶的最远端尖端充气。如果肺远端区域仍然塌陷,再注射 1-2 mL 琼脂糖。
- 通过将白色盖子从4向旋塞阀连接到气管插管的雌性鲁尔锁上来盖住气管。将肺放在冰上的150毫米培养皿中,以使琼脂糖凝固。
注意:拔牙后不久肺充气对于确保肺实质的均匀填充以及随后成功的组织切片至关重要。如果肺充气非常不均匀,请不要进行肺切片,因为切片质量会很差。
- 肺切片
注意:可能需要根据所使用的振动切片机(振动切片机)调整确切的切片程序;用各种组织切片机制备PCLS的附加实例先前已经发表了32,33,34。- 将金属冷却块在-20°C下预冷,并在整个切片过程中不使用时保持在冰上。
- 使用一小滴氰基丙烯酸酯胶将刀片连接到刀片架上。使用内六角扳手小心地将刀片架连接到振动器上,使其与插入缓冲盘的试样管的末端对齐。
- 准备6孔板,每孔3 mL无菌冰冷HBSS,不含酚红以收集切片。
- 使用手术刀,切一块肺组织约1-1.5厘米3。
注意:来自左叶下部和中间部分以及右中叶和下叶的肺组织最容易产生更大的组织切片,从而最大化肺泡面积。如果存在未充气的组织区域或结缔组织区域,则用剪刀修剪该组织或朝向柱塞向下;这种组织往往不能干净地切割。 - 将一小滴氰基丙烯酸酯胶水滴到试样管的柱塞上。将肺组织轻拍在纸巾上以除去多余的水分,然后立即使用一对镊子将肺组织放在柱塞的顶部。
- 将试样管的金属管向上滑动到组织顶部的水平并保持到位,柱塞后退。移液器将HBSS中的2%琼脂糖预热到管的顶部以完全包围组织。
- 将冰冷的冷却块放在组织周围约1分钟,以使琼脂糖凝固。
- 将试样管插入缓冲液盘中。在托盘上装满冰冷的PBS,以达到组织块的中间位置。将电机箱开关转为快进(FF)以推进电机箱柱塞,使其刚好接触试样管的底部。
- 为切片厚度、切割速度和振荡频率设置所需的设置,例如,450 μm 厚度、速度 4 和振荡频率 5。选择" 连续模式",然后拨 动开关以 开始切片。
- 当组织切片落入缓冲液托盘时,使用接种环或刮刀将它们转移到准备好的6孔板中。
- 当样品管中残留约2毫米厚的组织时,停止切片,以避免损坏刀片或切割含有胶水的组织。
- 根据需要重复上述步骤以切碎其他肺组织。
- 立即对切片进行脱细胞化以制备支架,或速冻并在-80°C下储存长达2个月。要冷冻,将4-6片转移到35毫米的培养皿中,并小心地从切片周围吸取任何多余的液体。将盘子放入干冰和100%乙醇浴中速冻,然后包裹在铝箔中,密封在塑料袋中,并转移到-80°C。
注意:不要将新鲜切片直接放入-80°C冰箱中,因为相对较慢的冷冻速度会导致形成冰晶,从而损坏组织。
3. 肺组织支架的制备
- 材料制备和脱细胞化溶液
- 高压灭菌器框架、剪辑和选项卡。
- 准备 表1中概述的去细胞化溶液。
注意:在使用前立即将苯豆酶核酸酶添加到预热的缓冲液中,并进行无菌过滤。在脱细胞化程序的24-48小时内制备Triton X-100和脱氧胆酸钠(SDC)溶液。提前30 d准备抗生素/抗真菌溶液和苯甲酸酶缓冲液,并在4°C下储存。
- 切割和修剪肺切片
注意:虽然切割和削削可以在台式上以非无菌方式完成,但第3.3节中的去细胞化步骤和组织支架的所有后续处理必须在层流罩中进行。- 用PBS填充约三分之一的100毫米培养皿。使用镊子将盒式磁带(每个帧包含两个剪辑的帧)和标签传输到碟形中。
- 如果使用冷冻切片,通过将室温PBS倒入培养皿中以覆盖切片,一次解冻一个培养皿。将剩余的菜肴放在干冰上。
- 将解冻的切片转移到150毫米培养皿中。如有必要,使用细镊子轻轻展开切片,使其平放,然后小心地从组织周围吸取多余的PBS。
- 使用剃须刀片,以尺子为指导,通过将刀片的整个长度牢牢地压在培养皿上,并在刀片边缘保持在适当的位置的情况下左右稍微摇晃它,从切片上切下3毫米宽的条带。或者,使用带有2个平行刀片的旋转切割机,由3 mm定制的垫片(例如,由乙缩醛[聚甲醛]制成)隔开,以切割组织条。避免任何撕裂、孔洞、大气道或血管,或厚结缔组织。
注意:要成功削波,条带长度必须至少为 9 mm。 - 使用镊子将组织条转移到制备的100mm培养皿中。
- 将组织条夹入盒中:将组织漂浮在盒上方,使组织居中以悬垂两端夹子中的孔。使用细镊子,将卡舌部分放入一端的孔中,轻轻拉直组织,然后放置第二个卡舌。在每只手上使用镊子,完全按压每个卡舌以固定组织。
注意:如果在夹紧之前难以将组织保持在适当的位置,请从培养皿中吸取一些PBS以降低液位。在放置第二个夹子时要小心不要拉伸组织,因为这可能会导致撕裂。 - 重复步骤3.2.2-3.2.6中的解冻,切割和剪切过程,以根据需要对任意数量的组织进行解冻。
- 切片去细胞化
- 切碎所有切片后,将装有盒式磁带的100毫米培养皿转移到层流罩中。
- 开始脱细胞化方案的步骤1(见 表2):使用弯曲的止血剂抓住每个盒的缺口面,将盒转移到每孔中装有3mLPBS +离子+抗生素/抗真菌剂的6孔板(2个组织/孔)中(参见 表1中的溶液配方)。
- 将孔板以30rpm在轨道振荡器上放置10分钟。
- 继续解质方案的步骤2(见 表2):从每个孔中吸取液体,然后用3mL / 孔PBS +离子替换,将板以30rpm放在轨道振荡器上,并孵育5分钟。
- 对 表2中的去细胞化方案中概述的每种溶液和相应的持续时间重复步骤3.3.4。
- 在用PBS +抗生素/抗真菌药进行最后一步冲洗步骤(表2的步骤 20)后,将组织转移到具有新鲜PBS +抗生素/抗真菌药的无菌6孔平板中,并在37°C下孵育48小时。
注意:用抗生素/抗真菌药灭菌后,肺组织支架可以立即接种,或在4°C下储存长达30天。
4. 切片再造粒和培养
注意: 图2 显示了组织接种和培养的拟议时间表,其中切片首先用大鼠肺微血管内皮细胞接种并在低血清内皮培养基中培养;然后用大鼠AEC2s和大鼠肺成纤维细胞接种无血清的AEC2生长培养基(改编自Jacob等人,13 和You等人35);请参阅 表3中有关结果中使用的细胞源和培养基详细信息的其他注释。该策略产生含有AEC2单层的肺泡样结构。
- 准备用于播种的组织支架(第-4天或第-3天)
- 如果使用储存在4°C的组织支架,则在接种前将支架在37°C下用新鲜的PBS +抗生素/抗真菌药(10%青霉素/链霉素,4%两性霉素B,0.4%庆大霉素在PBS中)孵育过夜。
- 用无菌PBS(5毫升/孔)冲洗支架3次,每次5分钟。
- 在相差显微镜下以5倍放大倍率检查支架,以选择用于播种的组织。
注意:用于播种的最佳支架没有撕裂或孔洞,并且不包含大气道或血管。虽然具有这些特征的支架可以成功播种,但再造群体模式可能与在肺泡区域观察到的模式不同。
- 内皮细胞接种(第-3天)
- 使用血细胞计数器计数内皮细胞,并在5×106细胞/ mL的内皮培养基(见表3)中制备内皮细胞悬浮液,具有足够的细胞以每片接种500,000个内皮细胞(例如,对于12片,在1.2mL培养基中重悬6×106个细胞)。
- 将高压灭菌的播种浴置于100毫米培养皿中。将冲洗过的支架倒置转移到播种浴槽中:使用精细弯曲的止血剂抓住缺口侧的盒,使用直的止血器或镊子抓住盒的一端(小心不要接触组织本身)并翻转,然后通过沿着缺口侧的孔再次用细弯曲的止血器的尖端再次抓住盒, 并放入播种浴中。对剩余的盒式磁带重复上述步骤。
注意:正确放置后,脚手架将倒置在每个孔的底部居中。如果需要,用止血器的尖端轻轻按压盒的一角,以确保盒平放在孔中。盒体安装不当会导致组织播种不良。如果油井含有少量PBS,这是可以接受的。 - 轻轻旋转制备的细胞悬浮液以混合,然后使用手动移液器将100μL细胞直接移液到孔基部的每个组织的顶部,小心不要用移液器尖端损坏组织。
- 将接种的组织转移到37°C / 5%CO2下的细胞培养箱中。
- 2小时后,使用手动移液器向每个孔中加入900μL预热培养基,然后返回培养箱。如果加入培养基后盒未就位(漂浮),请用移液器吸头轻轻按压盒的角落,使其平放在孔中。
- 在第-2天更换培养基。通过倾斜培养皿并用移液器吸头轻轻放置在孔的角落中手动移液来去除培养基,以免干扰盒。每孔更换1 mL新鲜内皮培养基。
- AEC2和成纤维细胞接种和组织培养(第0天)
- 使用血细胞计数器计数AEC2s和成纤维细胞。在AEC2生长培养基(上皮基底培养基+ AEC2补充剂;见 表3)中以5 x 106 总细胞/ mL制备AEC2s和成纤维细胞的1:1细胞悬浮液,具有足够的细胞以在每片接种500,000个细胞(250,000 AEC2s和250,000成纤维细胞)(例如,对于12片,重悬3 x 106 AEC2s + 3 x 106 成纤维细胞在1.2mL培养基中)。
- 按照步骤4.2.6所述从播种浴的每个孔中移出培养基。轻轻旋转制备的细胞悬浮液以混合,然后将100μL细胞直接移液到孔基部的每个组织的顶部。
注意:如果在AEC2 /成纤维细胞接种之前,少量内皮培养基残留在孔中,这是可以接受的。 - 将接种的组织转移到37°C / 5%CO2下的细胞培养箱中。
- 2小时后,向每个孔中加入900μL预热的AEC2生长培养基,然后返回培养箱。
- 培养24小时后(第1天),制备12孔板,每个盒中每孔1mL预热的AEC2生长培养基。
- 从播种浴的每个孔中移取800μL培养基。从播种浴槽中取出盒:通过沿着缺口侧的孔,用细弯曲的止血剂抓住每个盒,转移到直的止血器或镊子上以抓住一端的盒并翻转,然后使用弯曲的止血器通过缺口侧抓住盒,并将右侧向上(每孔一个)转移到准备好的12孔板上。
- 每隔一天更换12孔板中的培养基,直到第7天或所需的培养时间:使用玻璃巴斯德移液管从每个孔中吸取培养基,小心不要接触组织;每孔在1 mL新鲜AEC2生长培养基中移液。
注意:在整个培养过程中,可通过相差显微镜以5倍放大倍率监测组织再造块的程度。
5. 组织采集和样品分析
- 为了固定用于组织学和免疫荧光染色的ELT,将组织培养盒转移到10%中性缓冲福尔马林中,并在室温下在摇臂上孵育3-4小时。使用细尖镊子的尖端从盒中取出组织,以切割与标签相遇的组织。根据石蜡包埋和组织学的常规方法处理组织;不需要专门的技术。
- 为了处理用于qRT-PCR的ELT,请在PBS 2x的盒中冲洗组织,然后除去组织并快速冷冻或继续进行裂解以进行RNA提取。
注意:将至少2片接种有1 x 106 个细胞并培养7天的切片合并应产生足够的RNA用于下游PCR分析。
结果
图3概述了产生ELT的过程 - 包括肺切片,切片和去细胞化以及支架再填充 - 如图3所示。这里介绍的ELTs使用原代大鼠肺微血管内皮细胞(见材料表),新生儿大鼠AEC2s和富含脂质成纤维细胞的新生儿大鼠肺成纤维细胞36进行培养。如前所述37,通过基于磁珠的分选对AEC2进行新分离;替代隔离方案已经详细介绍,并在别处进行了讨论38,39,40.分离的大鼠AEC2s的纯度可以通过流式细胞术评估大鼠特异性AEC2表面标记物RTII-7041,或者通过细胞离心细胞样品染色RTII-70或前表面活性蛋白C(pSPC)。根据已发表的方案42的改编,从产后第7-9天大鼠幼崽中分离出大鼠肺成纤维细胞,并在第1-2代使用;替代隔离方案已在其他地方进行了描述43,44。分离的成纤维细胞的纯度可以通过染色培养或细胞离心细胞的间充质标志物维门汀来评估,脂原纤维细胞富集可以通过染色来评估油红O45。
当肺组织用琼脂糖均匀充气,并且有策略地选择和组织片段进行切片以最大化总和实质组织面积时,一个大鼠肺可以产生>100个肺泡ELTs的组织。PCLS条具有足够的机械完整性,可以夹入组织盒中,很少(<5%)撕裂(图3B)。
去细胞化肺切片的方案紧密基于我们先前发表的全肺去细胞化方案,通过定量蛋白质组学证明,该方案保留了许多ECM成分,其水平与天然肺22中没有显着差异。脱细胞化的切片支架保留了肺泡的天然结构,如苏木精和曙红(H&E)染色(图4A,B)和相差显微镜(图4C)所示。我们通常排除含有大气道或血管(图4D)或撕裂的支架,尽管如果研究人员感兴趣,则可以包括前者。通过双链DNA测定法测量,脱细胞化导致组织DNA含量减少96%(参见材料表;0.50μg/ mg±0.073μg/ mg vs 0.018μg/ mg±0.0035μg/ mg,分别平均±SEM)(图5A),通过苏木精染色看不到DNA(图4B)。去细胞化支架的组织学和免疫荧光染色显示ECM蛋白胶原蛋白,弹性蛋白,胶原IV和层粘连蛋白的维持,其结构和数量与天然肺切片相似(图5B-E)。请注意,天然组织的细胞核会用毛状体(用于胶原蛋白)和EVG(用于弹性蛋白)染色蓝色/黑色。免疫荧光染色如前述所述,使用标准方法对组织37进行染色。使用的抗体及其各自的浓度列于表4中。
成功的支架再填充导致7天后高度细胞的ELT,通过光学显微镜可见肺泡样再填充模式(图6A-C)。在某些情况下,具有非常高的细胞性,类器官型结构可能是可见的(图6A,B)。在培养过程中,可以通过相造显微镜观察不成功的组织接种(图6C)。在培养具有AEC2,成纤维细胞和内皮细胞的组织支架后,ELT被包含所有三个细胞谱系的肺泡样结构密集地重新填充(图6D,E)。在第7天或第8天,AEC2s维持长方体形态并表达表面活性剂蛋白B(SPB)和层状体蛋白ABCA3,没有证据表明与AEC1s显着分化(图6E,F)。AEC2s在ELT中具有高度增殖性,如5-乙炔基-2'-脱氧尿苷(EdU)掺入后以10μM的2小时脉冲(图6G)证明的那样。
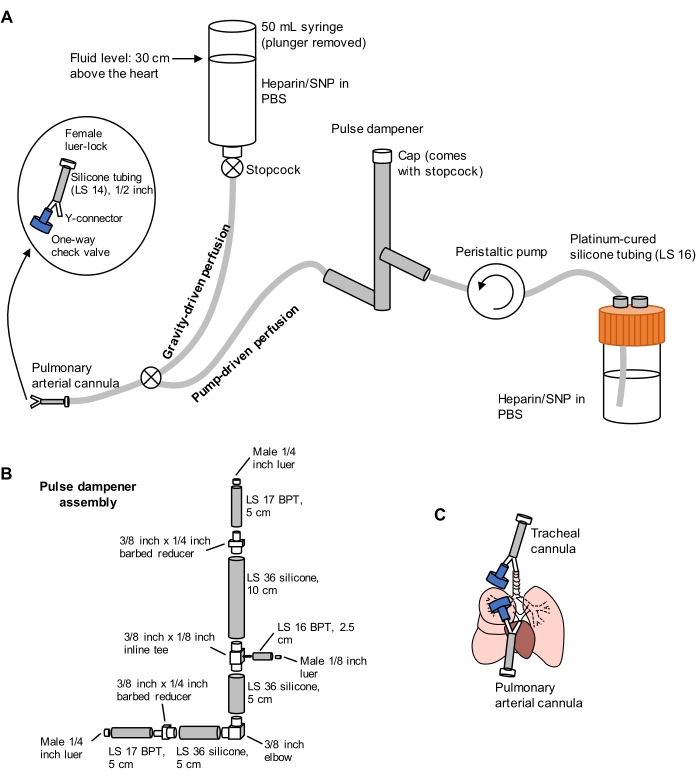
(A)灌注系统包括重力驱动的肢体,用于在流动下对肺动脉进行初始插管;和泵驱动的肢体,用于在初始插管后有效地清除肺部。泵管路包括一个"脉冲阻尼器",可抑制由泵引起的压力尖峰。气管和肺动脉插管的设计详见左图。SNP = 硝普钠。(二)脉冲阻尼器组装细节。BPT和硅胶是指管材的类型。(C)在肺抽取过程中放置的气管和肺动脉插管的位置。请点击此处查看此图的大图。

图2:三系再细胞化的培养时间表。 拟议的三系ELT播种和培养时间表,包括两阶段播种的时间安排。指示用于接种的细胞数和每个阶段的培养基。请参阅 表 3 中的培养基详细信息。AEC2 = 肺泡上皮 2 型细胞。EC = 内皮细胞。FB = 成纤维细胞。 请点击此处查看此图的大图。
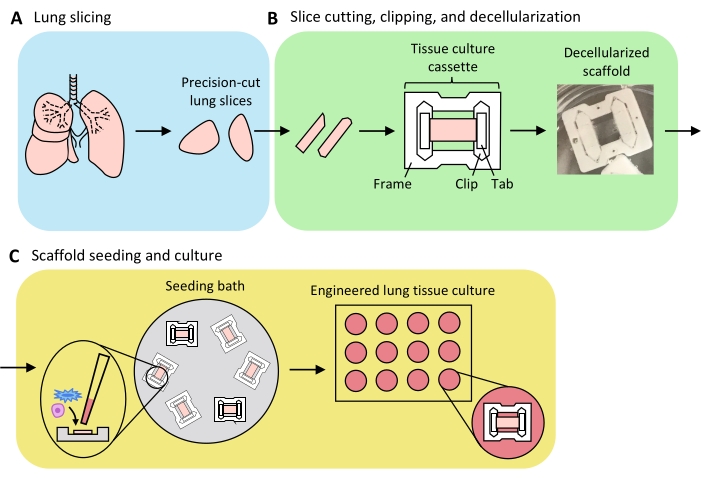
图3:工程肺组织制备示意图。 (A)使用振动切片机将天然肺组织切成薄片。(B)将精密切割的肺切片切成标准化的3毫米宽的条带,夹入聚四氟乙烯(PTFE)组织培养盒中,洗涤剂去细胞化以产生无细胞细胞外基质支架。(C)将支架重新播种在专门的播种浴中,将播种区域限制在组织区域,然后在标准孔板中培养。 请点击此处查看此图的大图。
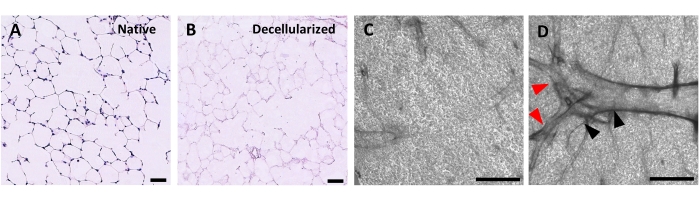
图4:去细胞化肺支架的结构。 天然(A)和去细胞化(B)肺切片的H&E染色显示去细胞化后肺泡结构的保留。(C,D)通过相衬显微镜以5倍放大率观察的去细胞化ECM支架的实例,主要包括肺泡组织(C)或含有大分支气道和血管(D,黑色和红色箭头)。比例尺,50 μm (A,B);500微米(C,D)。 请点击此处查看此图的大图。
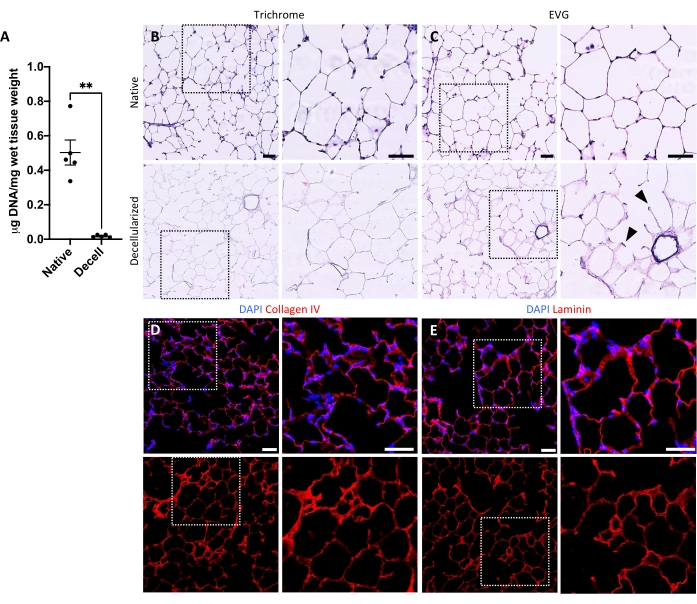
图5:去细胞化肺支架中的DNA去除和基质保存。(A)天然和去细胞化肺切片中DNA的定量(平均值±SEM,n = 5)。韦尔奇 t 检验,**P < 0.01。去绒 = 去细胞化。(乙、丙)天然和去细胞化肺切片的组织学染色,用于胶原蛋白(B)和弹性蛋白(C)。箭头,弹性蛋白保存在去细胞化组织的肺泡入口环中。(D,E)对胶原IV(D)和层粘连蛋白(E)的天然和去细胞化肺切片进行免疫荧光染色。比例尺,50 μm。在所有面板中,虚线框勾勒出在每个相应面板中向右放大的图像区域。请点击此处查看此图的大图。

图6:工程肺组织的细胞再造。 (A-C)培养第7天再造粒的ELT的例子,在培养过程中通过相差显微镜观察。再细胞化模式反映了组织的肺泡结构。在一些具有高细胞性的区域,可能会形成类器官样结构(箭头)。(A)和(B)代表成功的细胞再造,而(C)代表培养7天后再造细胞水平差。(D-G)在培养的第7天或第8天对再造细胞的ELT进行染色。(D)H&E染色显示肺泡隔的细胞再造。(E)免疫荧光染色标记植入前胶原Iα1 + 成纤维细胞,ABCA3 + AEC2s和CD31 + 内皮细胞。(F)在这些条件下,组织含有丰富的SPB + AEC2s,但很少的RTI-40(鬼臼素)+ AEC1s。(G) 许多AEC2在ELT中激增,通过EdU掺入来衡量。比例尺,500 μm (A-C);25微米(D-G)。 请点击此处查看此图的大图。
表1:去细胞化溶液。 脱细胞化溶液的制备细节。 请按此下载此表格。
表2:去细胞化方案。 肺切片去细胞化方案的详细信息。 请按此下载此表格。
表3:培养基。 内皮和AEC2生长培养基的制备细节。 请按此下载此表格。
表4:用于免疫染色的抗体。用于免疫染色的抗体及其浓度的详细信息。 请按此下载此表格。
补充文件 1: 激光切割组织培养盒架设计。 请点击此处下载此文件。
补充文件 2: 激光切割组织培养盒夹的设计。 请点击此处下载此文件。
补充文件 3: 设计用于激光切割组织培养盒片。 请点击此处下载此文件。
补充文件 4: 用于播种浴模架的CAD文件。 请点击此处下载此文件。
补充文件 5: CAD文件用于播种浴模具环。 请点击此处下载此文件。
讨论
本文描述了使用去细胞化精密切割肺切片作为 在体外生成工程肺组织的平台,其包含多谱系肺泡样结构。通过将我们以前开发的用于重新填充用于整个肺工程的高保真无细胞ECM肺支架的策略22,31与我们用于培养小规模工程心脏组织30的强大系统相结合,该协议能够以可重复和中等通量的方式使用生理相关的肺ECM作为组织培养底物。
这里介绍的方法详细介绍了来自大鼠肺的ELT支架制备,这些方法很容易实现,可以整体提取,直接进入完整的气道进行琼脂糖充气,并且比小鼠肺大。然而,任何可以用琼脂糖充气并产生长度至少为9mm的切片的肺组织都可以在该系统中使用。无论组织来源如何,琼脂糖对肺组织的均匀充气是确保下游组织切片、夹落和组织处理成功的最关键步骤。充气不足的肺组织往往不能切开干净,而过度充气的组织在剪裁过程中可能会撕裂。琼脂糖凝胶化后,适当膨胀的组织区域是坚实的,但当用镊子轻轻按压时,可以提供一点给药。对于完整的大鼠肺,我们发现用空气预充气几次,然后在提取后尽快充气琼脂糖,导致最佳的切片结果和最佳质量的组织支架。琼脂糖的适当体积需要根据经验进行优化;对于大鼠肺,将肺充气至总肺活量所需的体积约为30 mL / kg动物质量(例如,350g大鼠的肺为10.5mL琼脂糖)。对于较大的切除肺组织,气道通路不那么直接(例如来自人类供体的肺组织),可能需要一些额外的故障排除来通过支气管使组织充气32。在随后的肺切片过程中,柱塞上组织的选择和取向是另一个重要步骤,1)确保切片足够大以产生可以夹入组织培养盒中的组织条,以及2)最大化实质(肺泡)组织面积,不包括大气道或血管。
最初,将PCLS夹入组织培养盒中可能是一个具有挑战性的步骤,但盒大大简化了去细胞化和接种过程中的组织处理。可能出现的两个潜在问题是组织撕裂(在剪削过程中,或在去细胞化过程中),或者在夹子中的组织定位导致下游播种不良(例如,没有播种,或仅在末端播种)。撕裂可能是琼脂糖过度充气,插入标签时组织过度拉伸,或在插入标签时留下太少的悬垂以提供足够的组织抓地力的结果。请注意,在一个夹子末端撕裂的切片可能成功播种,但是,由于组织不平坦,因此在培养过程中很难在显微镜下可视化它们。组织播种不良(如图 6C所示)可能是由于切片在两个夹子之间不平放,因此在倒置时与播种浴槽的基部接触不良。另一个可能的原因是将盒体正确安装在播种槽的底部。在剪裁方面,在放置第二个夹子时,在组织中施加稍微更大的张力,以帮助其平放。一些切片有轻微的凹陷;在这些情况下,将凸面朝上夹住切片。在实践中,我们通常会遇到少于2%切片的播种失败。
该协议的一个限制是需要一些专用设备- 激光切割机和3D打印机 - 来生成用于ELT制备的初始材料。然而,一旦创建了组织培养盒和播种槽,就不需要额外的特殊材料。ELT支架制备的肺切片和去细胞化步骤相当耗时;然而,这些步骤可以提前进行,也可以以足以同时准备多个实验的数量进行。许多PCLS(如果针对实质区域进行优化,则为>100)可以从单个肺中切除并快速冷冻以备后用。虽然单个冻融循环可能对ECM46造成轻微的超微结构损伤,但即使多次冻融循环也已被证明不会在ECM23,47中造成重大损失。PCLS也可以在实验前进行剪切和去细胞化,以便在一个月内使用。(值得注意的是,所描述的去细胞化方案可以在大约6小时内完成,这代表了比前面描述的需要一天或更长时间的方法27,28的显着优势。一旦支架准备就绪,细胞接种过程简单快捷,ELT的培养不需要专门的技术。
所描述的ELT方法的一个警告是缺乏区域特异性播种,即AEC2特异性递送到肺泡空间,或内皮细胞特异性地递送到血管空间。然而,尽管细胞只是简单地接种在组织支架的顶部,但再细胞化的模式是非随机的,具有一些肺泡样组织的外观,包括上皮环。我们怀疑细胞 - 细胞相互作用以及ECM组成和几何形状20,21的局部差异可能有助于观察到的再细胞化模式。为了支持这一假设,先前发表的一项研究(其中成纤维细胞非特异性地接种到去细胞化的肺切片上)表明,组织再造群体的模式和相关细胞表型因微观组织区域和ECM支架来源(例如,健康与患病)而显着变化27。还观察到成纤维细胞侵入间质 - 它们位于天然肺组织中的位置1,27。我们可以想象以真正的区域特异性方式在肺切片上培养细胞的主要替代方法需要通过气道31,48和血管室49,50接种完整的去细胞化肺,然后切片再生组织。然而,这种替代方案1)的成本,时间和资源密集程度要高得多;2)吞吐量较低;3)需要增加动物数量;和4)与由于全肺培养的挑战和随后的播种肺切片而增加的污染风险有关。虽然ELT平台没有概括天然细胞组织的各个方面,但它能够以更多实验室可以访问的方式在生理相关的ECM底物上进行肺细胞培养。
ELT系统的灵活性是该平台的主要优点,并且应该允许使用任意数量的组织支架,细胞或感兴趣的培养基进行小规模肺组织培养。使用来自病变组织或损伤模型的支架可以允许在疾病改变的ECM27,29,51的背景下研究细胞 - 细胞或细胞 - 基质相互作用。然而,请注意,脱细胞化方案可能需要进行调整,以解释物种52之间的基质差异。所描述的接种策略可用于任何细胞类型,并且培养时间线适应研究人员的需求。作为起点,每个支架1×106 个细胞应在培养后7天内产生高度细胞组织,而1×105 总细胞导致细胞性差。在时间轴的任何调整中,组织培养盒应在最后一次组织播种后24小时从播种浴中取出。在这里,为了模拟肺泡的一些细胞复杂性,我们描述了一种三培养再细胞化策略,该策略支持在肺泡样结构中维持分化的新生儿AEC2至少7天。我们的研究结果还证明了成纤维细胞和内皮细胞在ELT中的成功移植,强调了培养底物的广泛适用性及其对共培养研究的适用性。在ELT中接种成体细胞可能有助于模拟更静止的肺泡结构,而接种人类PSC衍生的AEC2,包括具有遗传修饰的AEC2,可以促进人类疾病的转化研究13,53。一般来说,ELT平台支持的自下而上的方法提供了研究特定细胞类型对感兴趣读数的贡献的机会 - 例如AEC2增殖或分化状态。
总之,该协议概述了一个强大的系统,用于生成工程肺组织,用于无细胞ECM肺切片支架内AEC2s,成纤维细胞和内皮细胞的共培养研究。ELT代表了一种针对原代AEC2的新型3D培养策略,迄今为止,AEC2通常依赖于生理性较差的凝胶型基质来维持分化良好的表型6,11,12。目前的平台建立在以前在去细胞化肺切片24,25,26,27,28,29的再造块工作的基础上,但提供了几个优点:1)组织培养盒系统,以促进脱细胞化,播种和培养过程中的ELT处理;2)定制的接种浴,以在每个切片支架上精确地接种已知数量的细胞;3)三培养再播种策略,使肺泡组织能够用上皮,间充质和内皮细胞再填充。因此,ELT代表了朝着创建可重复的体外模型迈出的重要一步,这些模型可以捕获天然肺泡和AEC2干细胞利基的细胞和底物复杂性。
披露声明
L.E.N.是Humacyte, Inc.的创始人和股东,Humacyte, Inc.是一家再生医学公司。Humacyte从异基因平滑肌细胞产生用于血管手术的工程血管。L.E.N.的配偶在Humacyte拥有股权,L.E.N.在Humacyte的董事会任职。L.E.N.是授权给Humacyte的专利的发明人,这些专利为L.E.N.制作版税,L.E.N.获得了不受限制的研究礼物,以支持她在耶鲁实验室的研究。Humacyte不影响本报告中调查结果的行为、描述或解释。
致谢
作者要感谢Lorenzo Sewanan和Jorge Nunez开发该协议中使用的组织培养盒设计的工作,Kaminski实验室使用他们的振动切片机,Maurizio Chioccioli和Jessica Nouws协助切肺,Allie LaRocco协助初步试点实验,以及Hong Qian仔细阅读方案。这项工作得到了NIH拨款F30HL143880(K.L.L.),医学科学家培训计划培训补助金T32GM136651(K.L.L.)和U01HL145567(L.E.N.)的支持;并由Humacyte Inc.(L.E.N.)提供的不受限制的研究礼物。
材料
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
参考文献
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055 (2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068 (2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465 (2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042 (2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933 (2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。