Method Article
强大且高度可重复的皮质脑类器官生成,用于在体外模拟大脑神经元衰老
摘要
在这项研究中,我们为使用标准无饲养层hPSC培养物的简单而强大的皮质类器官培养系统提供了详细的技术。这是一种快速,高效且可重复的方案,用于生成在 体外模拟大脑衰老各个方面的类器官。
摘要
脑类器官是发育中的人脑的三维模型,为疾病建模和大规模基因组和药物筛选提供了一个引人注目的尖端平台。由于脑类器官中细胞的自组织性质以及它们产生的可用协议的范围不断扩大,已经确定了类器官之间的异质性和可变性问题。在这篇方案论文中,我们描述了一种强大且可复制的方案,该方案在很大程度上克服了这些问题,并在1个月内从神经外胚层祖细胞中产生皮质类器官,并且可以维持超过1年。这种高度可重复的方案可以在标准组织培养室中轻松进行,并产生通常在发育中的人类皮层中发现的具有丰富多样性细胞类型的类器官。尽管它们具有早期的发育组成,但神经元和其他人脑细胞类型在长时间体外培养后将开始在神经元细胞 中 表现出典型的衰老迹象,使其成为研究衰老相关神经元过程的宝贵而有用的平台。该协议还概述了一种使用衰老相关的β-半乳糖苷酶染色来检测皮质脑类器官中这种衰老细胞的方法。
引言
我们目前对人类大脑的了解主要基于动物模型和死后大脑标本。干细胞生物学是一个快速发展的领域,为人脑发育的基本生物学和人脑疾病的病理驱动因素提供了新的见解。人类多能干细胞(hPSCs)是一种宝贵的工具, 用于通过 生成类器官,器官样三维(3D)组织来模拟人脑,这些组织通常概括发育中的人类大脑的发育轨迹,细胞组成和结构。脑类器官是自组装的,由神经干细胞,指定的神经祖细胞,成熟神经元和神经胶质细胞类型组成。因此,类器官为研究早期人类大脑提供了一个独特的机会,早期人类大脑通常无法直接实验,但也具有内在的局限性,例如缺乏脉管系统和免疫系统。
产生大脑类器官的方法以两种不同的方式进行:非引导和引导分化。无引导脑类器官方法依赖于干细胞的自发内在分化能力,这些能力驱动组织形态发生1,2 并允许出现各种细胞谱系身份,从前脑,中脑和后脑到脉络丛,视网膜和中胚层。相反,引导脑类器官方法需要大量使用外部因素来驱动 hPSC 朝着代表一种大脑区域类型的神经元谱系的所需模式发展,例如内侧神经节隆起3、前脑4、中脑5、下丘脑6、小脑7 和脉络丛8。这种产生具有不同细胞谱系的不同大脑区域的能力,以及随意融合这些区域的潜力,使大脑类器官成为研究人脑发育和破译大脑相关疾病潜在机制的绝佳模型。尽管这些产生脑类器官的方法在模拟人脑区域方面提供了突破,但类器官之间的变异性和异质性仍然是系统和定量研究(如药物筛选)的重大限制。
目前的方案基于我们最近的论文9 中开发的方法,涉及使用双SMAD抑制剂(SB-431542和LDN 193189)选择性地将hPSC菌落分化为神经外胚层(NEct)身份,然后具有在FGF2信号传导的影响下在4天内自组织成3D神经上皮球状体的能力。这些神经皮球状体在分化后4周内可靠地产生具有 体内样细胞组成的均质皮质类器官。这里描述的方案建立在我们之前的发现之上,该发现表明抑制双重SMAD(母亲对十五次瘫痪的抑制剂)信号传导促进hPSC向来自神经外胚层祖细胞10 的喙神经干细胞的分化,除其他外,抑制内胚层,中胚层和滋养外胚层细胞的命运选择11.此外,神经上皮球状体嵌入hESC合格的基底膜基质中会触发神经表皮的显着萌芽,形成具有顶基极性的心室。大规模培养显示出独立于细胞系,克隆或批次的皮质类器官的可重复性和同质性,因此代表了一种可靠而稳定的干细胞系统,可以模仿健康和疾病 体外的早期人皮质发育。我们进一步概述了一种方案,用于检测已经培养了很长时间的hPSCs衍生的皮质脑类器官中的衰老神经元细胞标志物。
在接种密度为20%-30%的接种密度接种hPSC后,用双SMAD抑制剂处理细胞3天,以将hPSC菌落分化为神经外胚层菌落。然后将这些菌落用分散酶轻轻抬起,并接种到补充FGF2的超低附着6孔板中。漂浮的2D菌落自组织成3D神经外胚层球体过夜,并在每天补充FGF2的N2培养基中维持4天。一旦球体建立了神经上皮层,它们就可以嵌入基底膜基质中。通过常规添加新鲜的终末分化培养基,研究人员将观察到皮质类器官中神经上皮细胞的进行性扩张和萌芽。研究人员可能希望解离这些类器官以进行转录和蛋白质组学分析。此外,建议使用明场成像来监测皮质类器官的质量。可通过固定、冷冻切片和免疫染色进行分析。这些技术的描述和方法在前面已经描述过了12。最终,该协议允许研究人员快速而稳健地生成均匀的皮质脑类器官,用于以低成本和有限的设备模拟发育中的人类皮质大脑,并用于研究细胞神经元衰老的各个方面,如本文所述。
研究方案
1. 皮质脑类器官的产生
注:除非另有说明,否则议定书本节中的所有步骤都将在第2类生物安全罩中进行。
- 从 hPSC 2D 培养中诱导 2D 神经外胚层菌落(第 -1 至 3 天)
- 在诱导之前,将hPSC菌落以20%-30%的密度在6孔板中的hESC合格基底膜基质上。通过将 hPSC 菌落从 6 孔板的一个孔以 60% 汇合度传递到 6 孔板的三个孔中来实现此密度。
- 对于基底膜基质包衣,在普通基底介质中以1∶50的比例稀释基底膜基质。均匀地沉积1mL /孔的6孔板,在室温(RT)下孵育1小时,然后吸出。
- 分化前在2 mL无血清细胞培养基中维持hPSC菌落1天。
- 在hPSC分化当天,使用明场显微镜以4x至10x放大倍率检查hPSC菌落,以确保没有可检测分化的健康菌落。
注意:健康的hPSC将与具有大细胞核,非常小的细胞质和突出的核仁的细胞形成紧密的边缘菌落。分化的iPSC菌落将与上述hPSC菌落表现出明显的形态学差异,特别是在菌落的外缘周围或中心。 - 加入 表1 中列出的试剂以组成分化所需的N2培养基。使用前将此培养基带到室温。
- 一旦在RT下,从6孔板的每个孔中吸取无血清细胞培养基,并用5mL血清学移液管轻轻加入2mL N 2培养基替换。
- 加入双SMAD抑制剂SB-431542(10μM)和LDN 193189(100nM)。
注意:SMAD抑制剂可以在将培养基放入每个孔中后添加到N2培养基中,或者在更换无血清细胞培养基之前添加到所需量的N2培养基中。抑制剂可以通过轻轻旋转板或倒置含有培养基和抑制剂的管3-4次均匀地掺入培养基中。 - 在接下来的2天内,每天向每个孔中加入补充SB-431542(10μM)和LDN 193189(100nM)的新鲜N2培养基。
注意:加入新鲜的N2培养基以减少细胞长期暴露于DMSO,DMSO用于溶解SB-431542和LDN 193189化合物并防止细胞毒性。
- 从诱导的2D神经外胚层菌落中生成3D神经外胚层球体(第3至7天)
- 按照步骤1.2.2-1.2.8使用分散酶提升诱导的神经外胚层菌落。
- 首先,从6孔板中取出2 mL N2培养基,并用HBSS洗涤1x以确保除去所有N2培养基。
注意:N2培养基会干扰分散酶的酶活性,阻止神经外胚层菌落从孔中充分分离。 - 向每个含菌落的孔中加入 1 mL 2.4 单位/mL 分散酶。
- 将孔在37°C下孵育20-25分钟(最大30分钟)。 定期检查菌落脱离。
注意:小菌落可能会在20分钟内脱落。任何在30分钟后仍然卡住的菌落都应被忽略。 - 孵育后,向孔中加入1 mL N2培养基以停止分散酶的活性,并使用宽口径P1000移液器吸头或用无菌剪刀切割的改良P1000移液器吸头(使其成为宽口径P1000吸头)将菌落转移到15mL管中。
- 让菌落团块在重力作用下沉到管子的底部。
注意:此过程大约需要 1 分钟。 - 一旦团块沉没,用标准P1000移液器吸头小心地除去上清液,并用1 mL新鲜N2培养基代替。重复此洗涤步骤三次,以确保完全去除歧化酶。
注意:任何剩余的去离子酶都会阻止神经外胚层球体的均匀形成并诱导细胞死亡。 - 洗涤后,将细胞团块重悬于3mLN 2培养基中,并转移到6孔板的一个孔中,并加入40ng / mL bFGF。
注意:如果大量神经外胚层菌落脱落,这些菌落可以接种在6孔板的两个或更多孔中,以防止球状体融合。菌落分离后24h,检查球体是否形成。 - 在接下来的3-4天内将球体维持在同一培养基中,但每天向每个孔中加入新鲜的bFGF(40ng / mL),以促进神经外胚层细胞增殖,自组织,并诱导和扩张神经上皮。
注意:如果球状体以更高的密度电镀,培养基可能会变黄,需要每2天更换一次新鲜的bFGF(40 ng / mL)。但是,不建议这样做,相反,应在每个孔中保持较少数量的椭球体以避免此问题。如果神经上皮细胞明显,3 天后可将球状体嵌入基底膜基质中。如果神经上皮不明显或看起来不强壮,则将球状体保持一天并再次检查。
- 皮质脑类器官分化和维持(第8天)
- 使用 表2中列出的试剂制备终末分化培养基(DM)。将此媒体带到 RT。
- 在冰上解冻100%符合hESC标准的基底膜基质。
- 准备一张石蜡膜,在10厘米培养皿中用70%乙醇灭菌的酒窝,并将其放在罩下的立体显微镜上。
注意:一个装有200 μL移液器吸头的空托盘可用于产生凹痕网格。 - 将末端从100μL移液器吸头上切下(使其为宽孔)。这将用于在基底矩阵中嵌入神经球体而不会破坏它们。
- 使用立体显微镜,从6孔板中选择类似大小的神经球体(500μm),并使用宽孔100μL移液器吸头将它们转移到副膜凹陷中,每个凹陷放置一个神经球体。
- 轻轻地取出任何多余的介质,留下刚好足以覆盖球状体。
注意:这是为了在添加基质之前保持球体的质量,并确保它们不会变干。 - 在球体上轻轻加入18μL基质基质,将球体定位在基质液滴的中心。使用10μL移液器吸头的末端将球体在基质中居中。
注:尝试尽快添加基底基质,以避免球体周围的多余介质变干。 - 覆盖10厘米培养皿并转移到培养箱中,并在37°C下用嵌入球状体的基质孵育伞培养皿25分钟。
- 孵育后,使用带有0.5 mL DM培养基的P1000吸头将嵌入的球体冲洗到低附件24孔板中,确保将单个嵌入的球体放置在一个孔中。
注:如果多个嵌入的旋转椭球体落入一个孔中,请使用宽孔径 P1000 尖端将另一个旋转椭球体转移到新孔中。 - 长时间维持DM介质中分化的皮质脑类器官,当类器官变大和变老时,每2天发生一次培养基变化。
注意:在分化的第一周,培养基可以每3天更换一次。
2. 皮质类器官中神经元衰老的表征
- 处理用于冷冻切片的皮质类器官:
注:这些步骤是在2类生物安全罩中执行的。- 准备2 mL管,每个管中充满1.5 mL 4%多聚甲醛(PFA)。
- 切开P1000移液器吸头的末端(使其成为宽孔),并轻轻地将每个类器官转移到上面制备的2 mL管中的一个(每个管一个类器官)。
注意:为防止过量的DM培养基与PFA混合,在移液器移液器移液器之前,让类器官沉入P1000移液器吸头的开口处,并将吸头放在管中PFA顶部的正上方。这将使研究人员能够仅转移类器官和非常少的介质。 - 让固定过程在4°C下进行1小时。
- 使用未切割的 P1000 移液器吸头,小心地吸出多余的 PFA,并加入 1.5 mL 冷的 1x PBS。
- 将管转移到在室温下设置为70 rpm的轨道振荡器10分钟。
- 用冷的1x PBS重复洗涤过程三次,以确保所有PFA都被彻底去除。
注:不要将PFA丢弃在常规废物容器中;相反,为此准备一个特定的化学废物处理容器,因为PFA是一种危险。 - 将类器官浸入含有30%蔗糖的1x PBS中,并在4°C下孵育,直到所有类器官都沉入管底。
注意:允许类器官下沉所需的时间取决于类器官的大小/年龄。3个月大的类器官可能需要长达5小时。 - 使用切口宽孔径 P1000 移液器吸头,以 3:2 的比例将 3 到 5 个类器官轻轻转移到含有由 30% 蔗糖和 100% 最佳切割温度 (OCT) 介质制成的安装溶液的镶样模具中。
- 借助立体显微镜,使用 10 μL 移液器吸头以网格状模式定位和定位类器官。
- 将模具放在干冰上以固化蔗糖OCT溶液,然后使用低温恒温器进行冷冻切片(16-20μm)。
注意:对于衰老相关的β-半乳糖苷酶,所有组织一旦沉没,必须进行切片处理。对于免疫荧光,可以处理组织以进行第二天的切片。所有含有切片的载玻片必须在-20°C下储存,然后才能进行随后的免疫荧光或β-半乳糖苷酶,如果不立即染色。
- 皮质脑类器官衰老分析过程:
注意:可以在常规实验室工作台上执行以下步骤。- 将载玻片转移到带盖的显微镜载玻片染色容器中,并在室温下用1x PBS洗涤切片的类器官组织三次,持续10分钟以除去任何多余的安装溶液。
- 在此之后,将洗涤的组织与新鲜制成的β-半乳糖苷酶染色溶液在37°C下孵育过夜。
注意:β-半乳糖苷酶染色溶液由磷酸盐缓冲液(对于10 mL磷酸盐缓冲液:8.15 mL 1 M NaH2PO4,1.85 mL 1M Na2HPO4)调节pH = 6,100 mM六氰基铁酸钾(III),100 mM六氰基铁酸钾(II)三水合物,5 MNaCl,1 MMgCl2, 20毫克/毫升X-加仑。避免使用含有CO2 的标准细胞培养箱,因为CO2 会改变β-半乳糖苷酶染色溶液的pH值。 - 用1x PBS洗涤染色的组织三次,每次在室温下洗涤10分钟,以除去β-半乳糖苷酶溶液。
- 用玻璃抗淬灭剂安装洗过的组织,并允许安装溶液在室温下固化30分钟,然后在显微镜下观察。
结果
在这里,我们描述了一个强大的协议,允许研究人员在培养的1-3个月内产生均匀的hPSC衍生的皮质脑类器官,模仿 体内 人皮质脑区域。hPSC菌落首先在分化培养基中培养以产生神经外胚层菌落,然后可用于形成神经球体。这些球状体随后被嵌入基底膜基质中并长时间保持以产生可用于模拟神经元衰老的类器官(参见 图1 的方案概述)。值得注意的是,在超未包衣的24孔板中培养这些类器官会引起细胞应激,并在13周的 体外培养中 促进衰老相关的表型。从该方案衍生的类器官也可以维持在搅拌的生物反应器中,以实现皮质板神经细胞或气液界面的最佳生长和分化。
首先,hPSC菌落在神经外胚层分化前培养1天。至关重要的是,这些hPSC菌落仅培养至20%-30%汇合度并且具有最高的质量:紧密扁平的单层,没有分化细胞污染菌落(图2A,B)。hPSC菌落的多能性应通过诸如NANOG之类的标记物的表达来确认(图2C)。然后将经过验证的hPSC菌落暴露于N2神经外胚层分化介质中,SB-431542和LDN 193189。在该培养基中维持3天后,hPSC菌落应已分化为神经外胚层菌落,并且不再显示与hPSCs相同的紧密扁平单层形态(图2B),而是它们将成为更长的柱状细胞(图2B)。这些细胞对于多能性标志物(如NANOG)也将是阴性的(图2C)。
正是在这个阶段,神经外胚层菌落被酶促分离,并且每个健康和成功分离的菌落被允许自我组织并形成一个年轻的神经球体(图2D, 补充视频1)。只有健康,干净的神经外胚层菌落才会在指定的时间范围内分离;所有其他菌落应该被忽略,因为它们会导致球体质量较差。随着每天暴露于N2培养基中的FGF2,这些球状体中的神经干细胞(SOX2 +)(图2D,第1天)将增殖并形成大量神经玫瑰花环(图2D,第4天)。这些玫瑰花将在位于玫瑰花中心内和沿着球体外缘的细胞中表达紧密连接和上皮标记ZO1,显示球体的顶基极性(图2D,第4天)。球体全山3D成像的方法在13之前已经描述过。对球体的每日检查应阐明球体的紧密,黑暗的外缘和明亮的外围的形成,这是神经上皮层。该层应在3-4天后充分形成,直径约为500μm,此时球体可以嵌入基底基质中。如果该层不存在或仅弱形成,则球体未充分发育到足以向前发展。建议再等一天才能观察到任何变化,但如果没有观察到,请忽略这些旋转椭球体。
在 图2D中可以看到培养3天后球体的代表性明场图像。具有紧密神经上皮层的球体,未与其他相邻球体融合,具有半透明组织,并显示出神经玫瑰花形成,被选择嵌入基底基质中。一旦嵌入,球体将迅速增殖并开始萌芽:将出现致密组织的节点,从球体的主体向外扩展。这在基底基质中1-3周之间很明显,并且可以在多个细胞系中观察到(图3A)。对嵌入的球体的定量分析证实了在三种不同细胞系中高达100%的球体中存在上皮细胞,证实了该方案所期望的均匀性和再现性(图3B)。体 外 分化期间类器官直径的定量进一步证实了不同hPSC系的再现性(图3C)。如果未发生萌芽,则球体未正常发育,应丢弃。一旦球体被嵌入基质中,它们的发育就会进展,球体现在被称为类器官。免疫荧光染色还证实了神经祖细胞(PAX6)的存在以及用CTIP2和SATB2染色的皮质层标志物在类器官中具有清晰的分层(图3D,E)。这种分层可以在类器官维持的不同时间点观察到(图3D,E)。组织免疫组织化学的方法在14之前已经描述过。
这些类器官的一个可能应用是研究神经元衰老相关过程如何影响大脑。为了研究这一点,从多个不同的时间点收获成功生成的类器官,用于衰老的标准分子生物标志物(如衰老相关的β-半乳糖苷酶和p21)的切片和染色。 图4A 显示了在包埋在基底膜基质中4周和13周后类器官的衰老相关β-半乳糖苷酶染色的代表性图像。在第 4 周和第 13 周之间,衰老相关的 β-半乳糖苷酶的存在显著增加,这表明细胞衰老是公认的有机体衰老的驱动因素,在培养物中发生了这段时间。第13周对类器官进行免疫荧光染色证实了另一种衰老标志物p21的存在,该标志物与成熟的皮质神经元标志物(CTIP2)共同标记,如图 4B所示。然而,应该注意的是,p21的存在是细胞周期停滞的标志物,本身并不是衰老的明确标志物,建议检测其他衰老标志物,如p16和SASP(衰老相关分泌表型)因子,以明确将细胞识别为衰老。
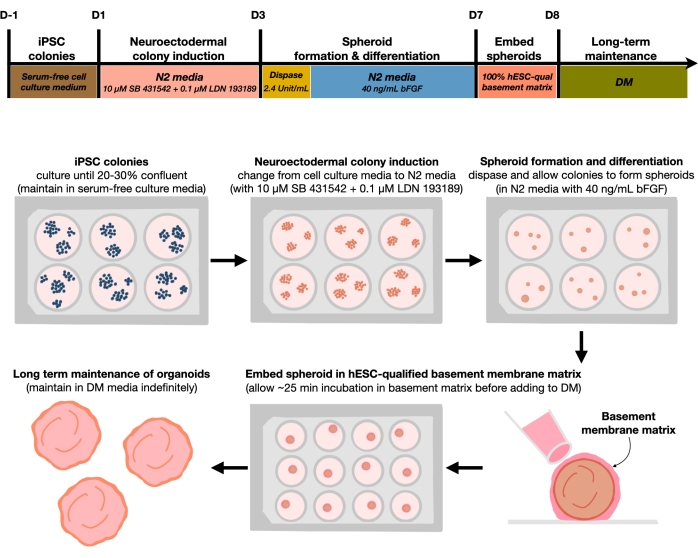
图1:用于生成可重复的皮质脑类器官的示意图。 从维持在无饲养层培养基中的hPSC生成皮质脑类器官的实验程序的工作流程示意图。该工作流程概述了将2D hPSC区分为类器官中3D图案化皮质板人体组织所涉及的六个步骤。 请点击此处查看此图的大图。
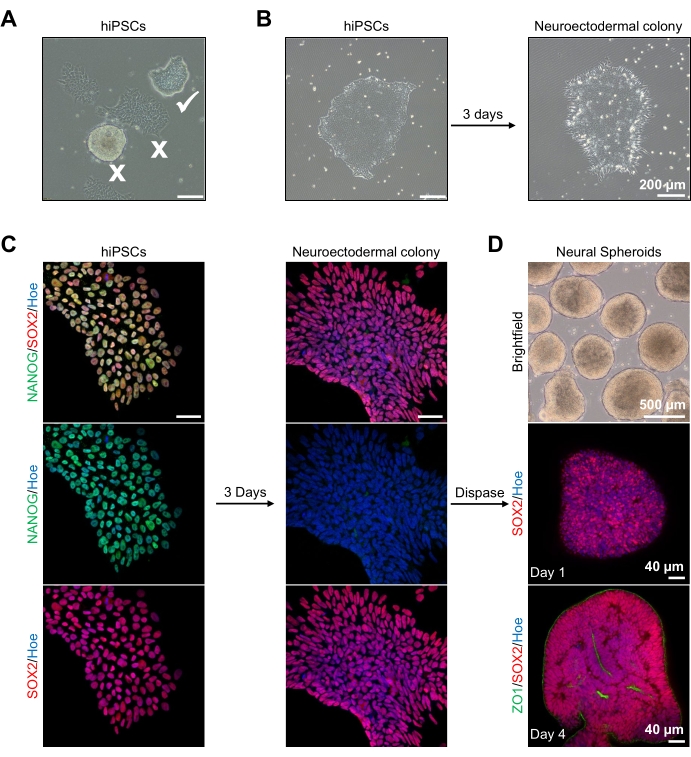
图2:来自神经外胚层菌落的神经球体的生成 - hPSCs. (A)表现出最佳(白色蜱)和分化菌落(白色十字)的人PSC的代表性图像。比例尺:200 μm,4倍放大倍率。(B)双SMAD抑制剂治疗3天后来自hPSC的神经外胚层菌落的代表性图像。比例尺:200 μm,4倍放大倍率。(C)人PSC菌落分化为神经外胚层菌落。图像代表PSC(第1天)和神经外胚层(第3天)菌落的染色,SOX2(红色),NANOG(绿色),所有细胞核都用Hoechst 33342(蓝色)复染。比例尺:40 μm,100倍放大倍率。(D)显示皮质脑球体在明场下 体外 培养物中一段时间内的发育阶段的图像,第1天用SOX2(红色)进行全脂免疫染色,在第4天用SOX2(红色)和ZO1(绿色)进行双重免疫染色。明场图像的比例尺为500μm,放大倍率为4倍,底部图像的比例尺为40μm,放大倍率为20倍。 请点击此处查看此图的大图。
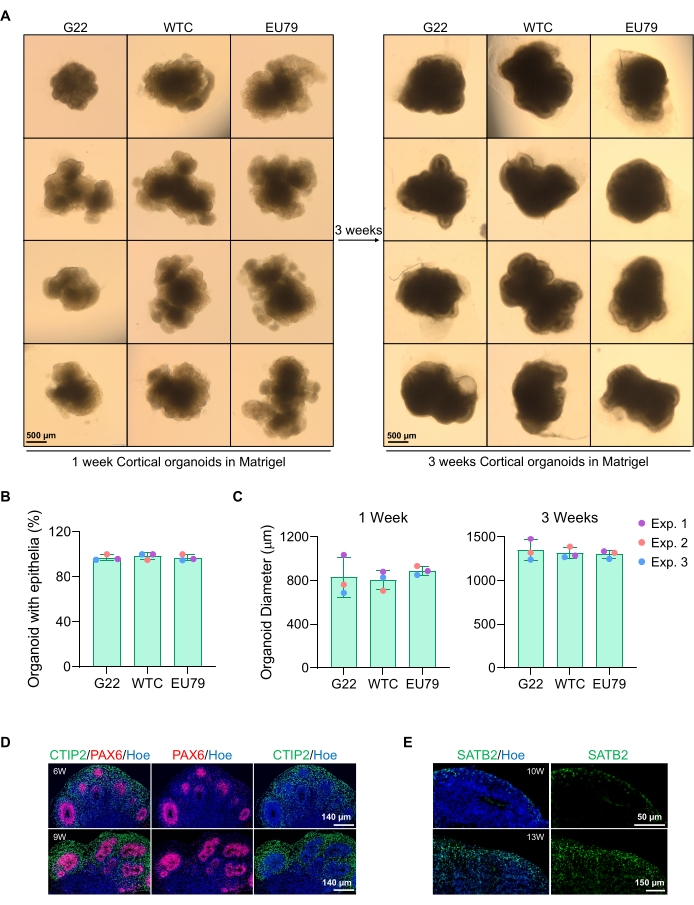
图3:来自不同hPSC系的皮质脑类器官的表征 (A)来自G22,WTC和EU79人iPSC系的皮质脑类器官的代表性图像 在体外培养了3周。所有图像的比例尺均为500 μm,放大倍率为2倍。(B)不同hPSC系(G22,WTC和EU79) 中3周体外 分化时成功产生皮质脑类器官的百分比。N = 3。数据以平均±标准差表示。(C)条形图显示了不同人多能干细胞系(G22,WTC和EU79) 中体外 分化第1周和第3周皮质脑类器官(基于平均直径)的生长。N = 3。数据以平均±标准差表示。(D)来自G22 hPSCs的6周和9周龄皮质脑类器官切片的代表性图像,对心室区PAX6(红色)和皮质板CTIP2(绿色)免疫染色。所有部分都用赫希斯特33342(蓝色)进行了反染色。比例尺 = 140 μm,20 倍放大倍率。W 是周。(E)来自WTC hPSCs的10周和13周龄皮质脑类器官部分的代表性图像,对皮质层IV SATB2(绿色)进行了免疫染色。所有部分都用赫希斯特33342(蓝色)进行了反染色。10周图像比例尺= 50μm,40倍放大倍率。13 周图像比例比 = 150 μm,40 倍放大倍率。W 是周。 请点击此处查看此图的大图。
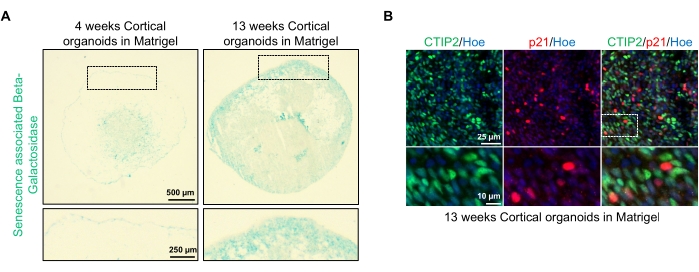
图4:来自hPSCs的皮质脑类器官中衰老的表征 (A)来自WTC hPSCs的人皮质脑类器官切片的代表性图像 ,在体外 培养4和13周并用SA-β-gal染色。比例尺 = 500 μm,缩放图像的比例尺 = 250 μm,4 倍放大倍率。虚线框表示放大的图像。(B)来自人类EU79 hPSCs的13周龄皮质脑类器官切片的代表性图像,对皮质神经元CTIP2(绿色)和p21(红色)进行了免疫染色。所有部分都用赫希斯特33342(蓝色)反染色。比例尺 = 25 μm,缩放图像的比例尺 = 10 μm,40 倍放大倍率。 请点击此处查看此图的大图。
| 媒体组件 | 浓度 |
| 营养混合物 F12 10x 500 毫升 (德国国际橡米/F-12) | |
| N2 补充剂 5 毫升 (100x) | 支持利率为1% |
| B 27 补充剂 10 mL | 补充2% |
| MEM非必需氨基酸溶液(100x) | 补充1% |
| 青霉素-链霉素 (10,000 U/mL) | 补充1% |
| 2-巯基乙醇 50 毫升(1000x ) | 补充0.1% |
表 1:N2 中。下表列出了制备N2培养基所需的试剂。
| 媒体组件 | 浓度 |
| 营养混合物 F12 10x 500 毫升 (德国国际橡米/F-12) | DM 培养基由 DMEM/F12 和神经基础培养基的比例为 1:1 制成 |
| 神经基础介质 | |
| N2 补充剂 5 毫升 (100x) | 支持利率为0.5% |
| B 27 补充剂 10 mL | 补充1% |
| MEM非必需氨基酸溶液(100x) | 补充1% |
| 谷氨酸补充剂 100x | 补充1% |
| 青霉素-链霉素 (10,000 U/mL) | 补充1% |
| 胰岛素溶液人重组 | 12.5 μL/50 mL 培养基 |
| 2-巯基乙醇 50 毫升 (1000x ) | 17.5 μL(50 mL 培养基) |
表2:分化介质 下表列出了制备分化培养基所需的试剂。
补充视频 1.在bFGF治疗下,诱导的hNEct 2D片/菌落转换为3D的实时成像。如上所述,将诱导的hNEct菌落用分散酶轻轻地从培养皿中分离出来,并转移到低附着6孔培养板中。12 h内将2D hNEct菌落转化为3D hNEct球状体。每5分钟捕获一次串行图像。比例尺 = 100 μm .请点击此处下载此视频。
讨论
为了能够在药物筛选和疾病建模中使用hPSC衍生的脑类器官,按照可复制和可靠的方案15制造类器官至关重要。脑类器官通常由来自hPSCs的胚状体产生,然后将其嵌入细胞外基质中,促进组织扩张和神经分化。与兰开斯特的1,16,17和Velasco18等协议相比,这些协议从胚状体开始,并允许发育中的类器官遵循默认的分化途径,我们发现,用人类NEct细胞而不是胚芽体开始皮质脑类器官的产生可以提高皮质脑类器官形成的一致性。因此,这也允许药物和表型筛选所需的缩放。由于人NEct细胞不仅可以扩增到相当数量,而且可以很容易地冷冻保存,这种方法也提高了实验之间的可复制性。还应该注意的是,与采用生物反应器和类似技术的其他协议相比,该协议不需要专用设备,因此适用于任何实验室6。最后,与兰开斯特1和生物反应器方案6,19相比,生成对皮质层标志物(如SATB2)呈阳性的成熟类器官所需的时间减少,使其更适合研究健康和疾病中人类皮质发育的发展轨迹1,6,16。
此外,鉴于与衰老相关的疾病(如痴呆)对全球医疗保健的影响不断增长,这些疾病与大脑中衰老细胞类型的增加有关,这有助于发病机制,因此识别和测试可以改善大脑衰老的化合物的能力引起了人们的极大兴趣。尽管已知hPSCs在重编程过程中具有表观遗传再生20,但我们发现长时间培养的皮质脑类器官中衰老细胞的显着增加。这是一个有希望的发展,现在可以筛选出从大脑中消除这种衰老细胞(senolytics)或减缓这一过程(senostatics)的药物21。由于人类NEct衍生的皮质脑类器官是人类起源的,这种方法可能会缩短这种新型疗法的传统营销路径。
该协议中有两个关键步骤。首先是分化时hPSC菌落的正确汇合水平。hPSC菌落必须最多30%汇合,以确保生成的NEct菌落不会与邻近的菌落融合,并且单个类器官是克隆驱动的。第二个关键步骤涉及正确使用消旋酶来提升NEct菌落并产生神经球体。用dispase孵育的时间对于生成的神经球体的最终质量至关重要。这是因为过度暴露于dispase的菌落对细胞22 有毒,并最终影响生成的类器官的质量。该协议的局限性在于难以控制神经球体的大小,因为它取决于用dispase提升的初始菌落的大小。但是,在进入嵌入阶段时,可以通过选择大小相似的神经球体来克服此问题。
最后,未来的应用可以扩展到这些可重复的皮质类器官在机器人分析和生物制药筛选方法中的使用,这些方法通常用于该行业。我们实验室的初步数据支持了这一点,这些数据表明,从人类NEct细胞中生成皮质脑类器官可以很容易地自动化,使其与这些方法兼容。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了医学研究未来基金加速研究,脑白质营养不良旗舰马西莫使命(EPCD000034),医学研究未来基金 - 干细胞使命(APP2007653)的支持。作者要感谢李菊贤博士(高丽大学)在 补充视频1中生成数据。
材料
| Name | Company | Catalog Number | Comments |
| 16% Formaldehyde (W/V) Methanol-free | Thermo Fisher Scientific | 28908 | 4% of PFA are diluted in 1x PBS |
| 2-Mercaptoethanol 50 mL(1000x) | Life Technologies Australia (TFS) | 21985023 | Used in NM and DM media |
| B 27 Supplement 10 mL | Life Technologies Australia (TFS) | 17504044 | Used in NM and DM media |
| CKX53 microscope with SC50 camera | Olympus | ||
| Corning Costar 6 well cell culture plates | Sigma Aldrich Pty Ltd | CLS3516-50EA | |
| Dispase II powder | Thermo Fisher Scientific | 17105041 | Powder is dissolve in HBSS, filtered through 0.22 µm filter, aliquote at 10 mL and store at -20 °C |
| DMEM Nutrient Mix F12 10x 500 mL (DMEM/F-12) | Thermofisher | 11320082 | Used in NM and DM media |
| DMSO Dimethyl Sulfoxide | Sigma Aldrich Pty Ltd | D2650-100ML | |
| Dulbecco's Phosphate Buffered Saline | Sigma Aldrich Pty Ltd | D1408-500ML | |
| Falcon Matrigel hESC-qualified Matrix | In Vitro Technologies Pty Ltd | FAL354277 | Make aliquotes of 100 µL and stored at -20 °C |
| GlutaMAX Supplement 100x | Thermo Fisher Scientific | 35050061 | Used in NM and DM media |
| Hanks Balanced Salt Solution | Sigma Aldrich Pty Ltd | H8264 | |
| Human induced pluripotent stem cells (EU79) | In-house reporogrammed from skin fibroblast | ||
| Human induced pluripotent stem cells (G22) | Genea Biocells | Obtained from Genea Biocells (San Diego, United States) | |
| Human induced pluripotent stem cells (WTC) | Gift from Professor Bruce Conklin | ||
| InSolution TGF-Β RI Kinase Inhibitor VI, SB431542 | Merck | US1616464-5MG | |
| Insulin Solution Human Recombinant | Sigma Aldrich Pty Ltd | I9278 | Used in NM and DM media |
| LDN193189 Dihydrochloride | Sigma Aldrich Pty Ltd | SML0559-5MG | Used during differentiation |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific | 11140050 | Used in NM and DM media |
| mTeSR Plus | STEMCELL TECHNOLOGIES | 100-0276 | Used to maintain hiPSC colonies prior to differentiation with NM media |
| N2 Supplement 5 mL (100x) | Life Technologies Australia Pty Ltd | 17502048 | Used in NM and DM media |
| Neurobasal Medium | Thermo Fisher Scientific | 21103049 | Used in DM media |
| OCT Embedding Compound Sakura Clear (118 mL/Bottle) | Tissue Tek | 4583 | |
| Parafilm M Roll Size 4 in. x 125 Ft | Sigma Aldrich Pty Ltd | P7793 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | Used in NM and DM media |
| Potassium Hexacyanoferrate (II) Trihydrate | Sigma Aldrich Pty Ltd | CP1087 | |
| Potassium hexacyanoferrate(III) | Sigma Aldrich Pty Ltd | 455946 | |
| Prolong Glass Antifade Mountant | Life Technologies Australia (TFS) | P36980 | |
| Recombinant Human FGF basic | R&D Systems | 233-FB-01M | Aliquotes are made at 20 µg/mL and stored at -20 °C |
| SB431542 | Tocris | 1614 | Used during differentiation |
| Sucrose | Sigma Aldrich Pty Ltd | PHR1001-1G | 30% of sucrose are diluted in 1x PBS |
| Ultra-Low attachment multiwell plates , 24 well plate, polystyrene | Sigma Aldrich Pty Ltd | CLS3473-24EA | |
| X-GAL EA | Life Technologies Australia (TFS) | R0404 | Make aliquotes of 20 mg/mL and storde at -80 °C |
参考文献
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Mansour, A. A., et al. An in vivo model of functional and vascularized human brain organoids. Nature Biotechnology. 36 (5), 432-441 (2018).
- Xiang, Y., et al. Fusion of regionally specified hPSC-derived organoids models human brain development and interneuron migration. Cell Stem Cell. 21 (3), 383-398 (2017).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature Methods. 14 (7), 743 (2017).
- Kwak, T. H., et al. Generation of homogeneous midbrain organoids with in vivo-like cellular composition facilitates neurotoxin-based Parkinson's disease modeling. Stem Cells. 38 (6), 727-740 (2020).
- Qian, X., et al. Generation of human brain region-specific organoids using a miniaturized spinning bioreactor. Nature Protocols. 13 (3), 565-580 (2018).
- Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., Sasai, Y. Self-organization of polarized cerebellar tissue in 3D culture of human pluripotent stem cells. Cell Reports. 10 (4), 537-550 (2015).
- Shaker, M. R., Cooper-White, J., Wolvetang, E. J. Self-organizing 3D human choroid plexus-ventricle-cortical organoids. BioRxiv. , (2020).
- Shaker, M. R., Aguado, J., Chaggar, H. K., Wolvetang, E. J. Klotho inhibits neuronal senescence in human brain organoids. npj Aging and Mechanisms of Disease. 7 (1), 1-12 (2021).
- Shaker, M. R., et al. Anteroposterior Wnt-RA gradient defines adhesion and migration properties of neural progenitors in developing spinal cord. Stem Cell Reports. 15 (4), 898-911 (2020).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shaker, M. R., et al. Rapid and efficient generation of myelinating human oligodendrocytes in organoids. Frontiers in Cellular Neuroscience. 15, 631548 (2021).
- Lee, J. -. H., Shaker, M. R., Lee, E., Lee, B., Sun, W. NeuroCore formation during differentiation of neurospheres of mouse embryonic neural stem cells. Stem Cell Research. 34, 101691 (2020).
- Shaker, M. R., et al. Spatiotemporal contribution of neuromesodermal progenitor-derived neural cells in the elongation of developing mouse spinal cord. Life Sciences. 282, 119393 (2021).
- Shaker, M. R., et al. Neural epidermal growth factor-like like protein 2 Is expressed in human oligodendroglial cell types. Frontiers in Cell and Developmental Biology. 10, 803061 (2022).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- Giandomenico, S. L., Sutcliffe, M., Lancaster, M. A. Generation and long-term culture of advanced cerebral organoids for studying later stages of neural development. Nature Protocols. 16 (2), 579-602 (2021).
- Velasco, S., et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature. 570 (7762), 523-527 (2019).
- Qian, X., et al. Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure. Cell. 165 (5), 1238-1254 (2016).
- Hunter, Z. L., Leeson, H. C., Shaker, M. R., Wolvetang, E. J., Vadlamudi, L. Human induced pluripotent stem cells generated from epilepsy patients for use as in vitro models for drug screening. Stem Cell Research. 60, 102673 (2022).
- Kaur, A., Macip, S., Stover, C. M. An appraisal on the value of using nutraceutical based senolytics and senostatics in aging. Frontiers in Cell and Developmental Biology. 8, 218 (2020).
- Wang, F., et al. Safety and efficacy of dispase and plasmin in pharmacologic vitreolysis. Investigative Ophthalmology & Visual Science. 45 (9), 3286-3290 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。