Method Article
体内 使用大颅窗的小鼠宽场和双光子钙成像
摘要
本协议描述了使用食品包装,透明硅胶和盖玻片制作大型(6 x 3 mm2)颅窗。该颅窗允许在同一只小鼠中进行 体内 宽场和双光子钙成像实验。
摘要
来自小鼠新皮层的宽场钙成像允许人们观察与各种大脑功能相关的皮层范围的神经活动。另一方面,双光子成像可以在单细胞水平上解析局部神经回路的活动。制作一个大的颅窗以在同一只小鼠中使用两种成像技术进行多尺度分析至关重要。为此,必须去除头骨的大部分,并用透明材料覆盖暴露的皮质表面。以前,已经为此目的开发了玻璃头骨和基于聚合物的颅窗,但这些材料不容易制造。本协议描述了一种制造由市售聚偏二氯乙烯(PVDC)包装膜,透明硅胶塞和盖玻片组成的大颅窗的简单方法。为了对整个半球的背表面进行成像,窗口尺寸约为6 x 3 mm2。无论如此大的窗口如何,都没有观察到严重的大脑振动。重要的是,大脑表面的状况没有恶化超过一个月。表达基因编码钙指示剂(GECI)GCaMP6f的小鼠的宽场成像,特别是在星形胶质细胞中,揭示了几毫米的同步反应。同一只小鼠的双光子成像在几秒钟内在单个星形胶质细胞中显示出明显的钙反应。此外,将一层腺相关病毒的薄层施加到PVDC薄膜上,并在颅窗上的皮质神经元中成功表达GECI。该技术对于制作大颅窗是可靠且具有成本效益的,并且有助于研究神经和神经胶质动力学及其在宏观和微观水平上的行为过程中的相互作用。
引言
宽场钙成像有效地研究了动物大脑大面积的时空活动模式1,2,3。宽场成像已被广泛用于观察啮齿动物的整个皮质表面,因为它们的皮层相对平坦2,3,4,5,6,7,8,9,10。转基因小鼠或注射腺相关病毒(AAV)的小鼠,其在神经元和神经胶质细胞等各种细胞中特异性表达GECI,可用于宽场钙成像11,12,13。然而,该技术的空间分辨率通常不足以解析体内单个细胞的活性14。它也不适用于位于更深层的细胞成像。
另一方面,双光子钙成像可以同时以亚细胞空间分辨率观察多个细胞的活性,即使在神经元树突和神经胶质过程中也能观察单个细胞的活性15,16,17,18,19,20,21,22。它还可以观察大脑皮层更深层的细胞23,24。尽管双光子显微镜的最新技术进步能够从毫米宽的皮质区域25,26,27,28,29进行成像,但仍然难以观察到与双光子成像的宽场成像相当的区域。
为了了解从单细胞到全脑的大脑活动的生理相关性,弥合整个皮层上皮层区域的活动与局部神经回路中单细胞分辨率的活动之间的差距至关重要。因此,在同一只小鼠中进行宽场和双光子钙成像的组合特别有效。为了实现这一点,必须创建一个宽而稳定的颅窗,最好是长时间的。
以前,已经开发了几种制作颅窗的技术,以允许在同一只小鼠30,31中进行宽场和双光子成像。梯形盖玻片窗口(水晶头骨)被模制成皮质表面的形状以替换移除的骨骼,允许光学进入整个皮层32。或者,基于聚合物的颅窗可以用聚对苯二甲酸乙二醇酯(PET)33 或聚环氧乙烷包覆的无定形含氟聚合物纳米片34制成。每种方法已被证明可以保持稳定的窗口超过1个月。然而,生产这些窗户并不容易,而且使用的材料和设备往往很昂贵。
本研究描述了一种使用PVDC薄膜(塑料食品包装)制作大颅窗的新方法(图1)。使用该窗口,可以在同一只小鼠中进行 体内 宽场和双光子成像实验。还表明,通过在包裹物上形成含有AAV颗粒的薄膜层,GECIs可以在小鼠皮层的广阔区域的神经元中表达。
研究方案
实验程序得到了山梨大学动物实验委员会的批准。本研究使用在星形胶质细胞中表达膜锚定GECI(Lck-GCaMP6f)的野生型(C57BL / 6J,日本SLC)和转基因小鼠。转基因小鼠是通过杂交AldH1l1-CreERT2小鼠[B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J,商业获得,见 材料表]和Flx-Lck-GCaMP6f小鼠[C57BL/6N-Gt(ROSA)26Sor/J,商业获得]小鼠。转基因小鼠用他莫昔芬(20mg / mL)处理5天(0.05mL / 10g bw,ip)以表达GCaMP6f。所有使用的小鼠都是至少4周大的雄性和雌性。窗口的示意图如图 1A所示,手术过程总结于 图1B中。
1.颅窗手术的准备
- 用异氟醚麻醉小鼠(诱导:3%,手术:1%-1.5%,流速:0.2-0.3L / min)。通过尾部或脚趾捏反射的丧失来确认麻醉深度。使用加热垫(36-38°C)保持体温。用棉签涂抹眼膏,以防止小鼠的眼睛在麻醉下变干。
- 腹膜内注射15%甘露醇溶液(见 材料表)(3mL / 100g体重)。将鼠标头固定在带有耳杆的立体定位框架上。使用剃须刀和脱毛膏去除鼠标头部的毛发。
- 用聚维酮碘和酒精消毒皮肤表面三次。局部应用利多卡因以提供先发制人的镇痛。用手术剪刀去除感兴趣区域的皮肤并露出头骨(尺寸:15 x 15 mm)。如果出血,请使用棉签止血。
注意:在这项研究中,去除皮肤以观察视觉皮层的前额叶皮层。 - 使用微刮匙取出暴露的颅骨上的骨膜,并干燥颅骨表面,用牙科水泥将头板牢固地固定在颅骨上(见 材料表)(图2B)。
注意:定制顶板是使用 3D 打印机创建的。设计文件将存放到 Github 存储库 (https://github.com/Satoshi-Manita/Head-plates)。 - 使用牙科水泥连接顶板(图2C)。等待至少 20 分钟让水泥硬化。用顶板支架35固定顶板。
2. 制作颅窗
- 用牙钻去除颅骨上多余的水泥(见 材料表)。注意不要钻穿骨头并通过钻孔损坏大脑。
- 用笔标记要切割的区域,然后用手术刀切入骨头。使手术刀的尖端变钝,以确保尖端不会穿透颅骨(补充图1)。参考大脑图谱以确定在哪里制作窗口。
注意:对于本研究,从前后轴的bregma和从矢状缝到中外侧轴的+3 mm之间创建了一个窗口,包括运动,躯体感觉和视觉皮质。 - 用手术刀反复刮擦骨头以加深凹槽,直到要修剪的区域的骨头在轻轻触摸时移动良好。
- 用细镊子去除切开的骨头。不要将骨瓣推入大脑,这可能会损害大脑(图1Ba)。
注意:如果在取出骨头后观察到出血,请立即涂抹并吸出人工脑脊液(ACSF,见 材料表)并重复此过程,直到出血停止。或者,将浸泡在ACSF中的止血明胶海绵(约3mm方形立方体)放在出血点上。 - 如果未移除硬脑膜,请继续执行步骤 2.7。
- 按照以下步骤取出硬脑膜。
- 例如,在以下情况下移除硬膜;使用丝心蛋白-AAV薄膜方法36 转染并观察小结构如树突棘。
- 使用拉式玻璃移液管切割硬脑膜,锥形尖端约为10μm。要在整个窗口上扩展此切口,请使用 U 形针。
- 将体视显微镜变焦设置为 60-100 倍,并用超细镊子去除切断的硬脑膜。如果去除硬脑膜导致出血,请用ACSF冲洗或使用明胶海绵止血。
- 切下 PVDC 包装。
- 通过高压灭菌并用70%乙醇对一大块(例如,10 x 15 mm)PVDC包装(约11μm,参见 材料表, 图2Aa)进行灭菌。
- 在体视显微镜下,使用镊子和手术刀切出所需尺寸的包裹物。
注意: 包裹尺寸需要比颅窗尺寸大约 10 毫米,但小于顶板开口。对于 6 x 3 mm 2 颅窗,请准备 15 x 10 mm2 包裹。
- 按照以下步骤准确放置包装。
- 将包裹放在大脑表面,将ACSF留在表面上。从包裹的边缘吸出ACSF,使包裹牢固地粘在大脑表面(图1Bb,c)。
注意:使用的包裹物是抗皱的,因此只需将其放在大脑表面几乎不会产生皱纹。 - 用手术刀和镊子修剪包裹,使颅窗边缘和包裹之间有大约1毫米的余量(图1Bd)。
- 包裹就位后,用生物粘合剂将包裹物的边缘粘在头骨上(见 材料表, 图2D)。让粘合剂干燥约30分钟。
- 将包裹放在大脑表面,将ACSF留在表面上。从包裹的边缘吸出ACSF,使包裹牢固地粘在大脑表面(图1Bb,c)。
- 涂上透明的有机硅弹性体。
- 使用带有混合尖端的分配器将市售的透明有机硅弹性体(见材料表)涂在包装的顶部(图1Be,2Ab-d),并将盖玻片(0.12-0.17毫米厚)放在顶部(图2E)。
- 用防水膜、强力胶或牙科水泥密封盖玻片的周边(图 1Bf)。
- 手术后,监测小鼠直到它恢复意识以保持胸骨卧位。之后,单独饲养小鼠,并让它们在家笼中恢复至少 7 天。
- 为了减轻压力和疼痛,给予抗炎和镇痛药(例如,地塞米松和酮洛芬,各 5 mg/kg,ip)。
- 定期监测小鼠的感染情况。如果确诊感染,在饮用水中给予抗菌药物(例如,10% 恩诺沙星,1.7 μL/mL),直到感染消除(通常少于 4 周)。
3.使用丝心蛋白溶液在保鲜膜上制作AAV薄膜
注意:步骤 3 是可选的。
- 按照先前发表的方法37从蚕茧制备丝心蛋白溶液。
- 简而言之,在碳酸钠溶液(0.02M,2L)中煮沸市售的正常蚕茧(5g,见 材料表)。用超纯水清洗茧并干燥过夜。
- 将干燥的茧溶解在溴化锂溶液(9.3M,20%w / v丝心蛋白)中,同时在60°C的烤箱中加热4小时。透析溶解的茧溶液,离心(两次,12,700× g,4°C下20分钟)37,收集上清液。
- 按照以下步骤准备丝心蛋白-AAV 薄膜。
- 使用微量移液管在小样品管中以1:4的比例混合丝心蛋白和AAV溶液20 。将混合丝心蛋白-AAV溶液的等分试样滴到颅窗的保鲜膜上,并干燥至少3小时。
注意:为了在直径为 3 mm 的区域中表达,涂上 5 μL 滴的丝心蛋白-AAV 溶液。该比率决定了给定区域的溶液量。 - 干燥后,将保鲜膜切成窗户所需的尺寸(例如,10 x 15 毫米),然后将其放在大脑表面。然后,从步骤2.8.1开始按照上述方法进行操作。
注意:在将包裹物放在大脑表面之前,请尽可能去除大脑表面的ACSF。这是因为ACSF有望溶解丝心蛋白-AAV膜并降低AAV颗粒的浓度。 - 在创建AAV处理的窗口后等待约2-4周,直到GECI充分表达。在此过程中,定期检查鼠标和窗口的状况。
- 使用微量移液管在小样品管中以1:4的比例混合丝心蛋白和AAV溶液20 。将混合丝心蛋白-AAV溶液的等分试样滴到颅窗的保鲜膜上,并干燥至少3小时。
4. 钙成像和分析
注意:有关成像和分析的详细信息,请参阅先前发布的报告1、2、38。
- 按照以下步骤执行宽场成像。
- 使用头部固定装置在串联透镜荧光宏观镜下固定鼠标(见 材料表)。
- 用来自 465 nm LED 光源的激发光通过激发滤光片、二向色镜和物镜照亮小鼠的大脑皮层。
- CCD相机通过物镜(1.0x),二向色镜,发射滤光片和成像透镜(2.0x)收集大脑皮层的荧光图像。这些镜头的组合可提供约0.5倍的总放大倍率。
- 以 50 Hz 的采样频率采集图像。数据采集后,使用ImageJ软件分析图像。手动选择感兴趣区域 (ROI)。计算每个ROI中的荧光变化为ΔF / F = (Ft - F0) / F0,其中Ft是每帧的原始荧光值,F0是从所有帧的平均图像中获得的平均荧光值。
注意:ImageJ 的宏程序被存放到 GitHub (https://github.com/Satoshi-Manita/ImageJ-macro),它根据钙成像数据计算 ΔF/F 图像。
- 按照以下步骤执行双光子成像。
- 使用头部固定装置将鼠标固定在双光子显微镜下。使用显微镜在明场模式下使用低倍率(5x)物镜识别要成像的区域。
- 切换到双光子成像。使用高倍率物镜(16x或25x)并照亮激光以进行双光子激发。
注意:绿色Lck-GCaMP6f22 和红色XCaMP-R36 分别在920nm和1070nm的激发波长下被超快激光激发。 - 采集30 Hz的荧光图像。数据采集后,通过suite2p软件39的配准功能纠正运动伪影。使用相同的广场成像方法从图像中获得ROI和ΔF/F。
- 使用python使用以下库绘制数据:NumPy,Matplotlib和Pandas(参见 材料表)。
结果
评估使用 PVDC 包裹方法制成的大颅窗
手术后,可以通过皮质表面的状况一目了然地检查成功或失败,例如由于损伤或缺血引起的出血和颜色变化。手术后很长时间,由于感染,皮质表面可能被不透明的白色膜覆盖,或者由于出血,血液可能覆盖窗户(图2G)。在这些情况下,皮层可能不处于健康状态,并且可能无法成像。这些可能是由于部分切断的包装或粘合剂对包装的固定不足引起的。如果反复观察到感染,在放置窗口时在脑表面涂抹抗生素可能是有效的,例如硫酸庆大霉素(10 μL,50 mg/mL)。当皮质表面和包裹之间的垂直间隙较大时,也可以看到脑膜或骨骼的再生。为了防止这种情况,在窗口准备期间将包裹尽可能紧密地贴在大脑表面至关重要。这可以通过在大脑表面放置保鲜膜并尽可能多地吸出ACSF来实现。在没有ACSF的情况下,只需将保鲜膜放在大脑表面即可完成。大脑和血管被确定为未受损,因为大脑的颜色没有变色,血管没有被切断。
窗口的寿命很大程度上取决于手术的质量。当病情良好时,手术后1个月以上没有感染,出血或再生的迹象(图2F和图3B)。在10只小鼠中的8只中,窗口可以保持畅通长达10周或更长时间。由于感染或出血,其中两只小鼠的窗口无法正确维护。虽然大窗户可能容易受到机械应力或冲击,但没有观察到窗户破碎或破裂。
为了评估使用包裹、硅胶和玻璃的新颅窗的成像质量,通过在琼脂中对0.1μm荧光珠进行成像,将新窗口下的点扩散函数与传统玻璃窗下的点扩散函数进行比较(见 补充文件1)。结果显示,两种条件下半峰全宽(FWHM)没有差异。[X 轴 (μm):仅玻璃,1.99 ± 0.07,包裹,1.76 ± 0.13,Y 轴 (μm):仅玻璃,2.11 ± 0.27,包裹,1.90 ± 0.15,Z 轴 (μm):仅玻璃,25.29 ± 0.71,包裹,26.64 ± 1.02,N = 7 个珠子,p > 0.05,曼-惠特尼 U 检验, 补充图 2A,B]。 因此,添加的新元素(包裹和硅胶)不会降低成像质量。
由呼吸、心跳和身体运动引起的振动伪影存在于宽场和双光子成像中。为了确定新颅窗的振动程度,从 体内 双光子成像数据中选择一个小荧光颗粒,并检查其图像在60秒内移动了多少。结果发现,该荧光颗粒的质心标准偏差约为0.3μm,与传统玻璃窗下的标准偏差相当(补充图2C)。这表明,由于大脑被透明的硅胶塞和盖板玻璃压住,振动与传统的较小窗户中观察到的振动相当,离线图像配准足以消除振动伪影。
在宽场钙成像中,可以观察到皮质活动在感觉刺激诱导的皮层中传播(图3A-D,K-N)。双光子成像允许观察神经元和神经胶质细胞特异性的单细胞荧光图像(图3E,O)。可以在单个细胞中观察到由感觉刺激诱导的荧光变化(图3E-J,O-T)。
使用 PVDC 包裹和 AAV 在大脑皮层大面积表达基因编码钙指示剂 (GECI)
窗口的PVDC包裹可用于表达皮层大面积的功能蛋白。这是使用AAV和丝心蛋白实现的,丝心蛋白是家蚕茧的一种成分蛋白,已被广泛用作生物材料37。之前的一项研究表明,丝心蛋白可以与AAV混合,形成植入大脑的薄膜以表达功能蛋白,如光活化视蛋白或GECIs36。本研究将表达GECI的AAV和丝心蛋白混合干燥在包膜上干燥,颅窗采用AAV包衣包膜。这导致手术后2-4周在皮层的广阔区域表达GECI(图3K-M)。由于窗口很大,可以对同一鼠标的不同皮质区域进行成像(图3M-T)。
为了确认该方法的表达效率,在固定脑中计数表达GECI的细胞数量(补充图2D)。结果发现,使用丝心蛋白-AAV包裹的当前策略导致GECI在表层和深层中的表达效率约为20%(L2 / 3:20.78%,XCaMP-R表达细胞:32个细胞,DAPI:154个位点,L5:20.08%,XCaMP-R表达细胞:51个细胞,DAPI:254个位点)。因此,这种方法不仅在细胞中表层中,而且在更深层中表达GECI。
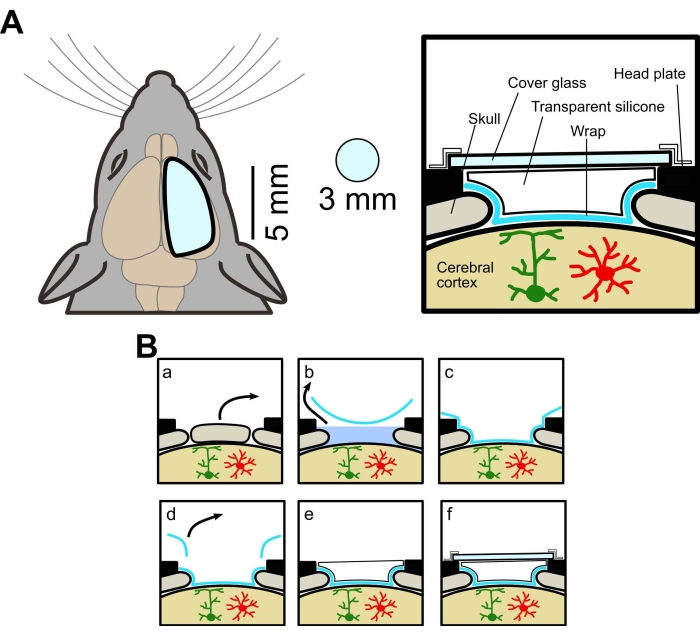
图 1:大颅窗的概念图。 (A) 左,新颅窗示意图。它比传统窗口(直径3毫米)大。右,横截面图。制作大颅窗的方法使用食品包装、透明有机硅弹性体和盖玻片,允许来自同一只鼠标的宽场和双光子成像。(B)颅窗制造程序:(a)骨切除。(b) 取消ACSF的包裹。(c)通过去除ACSF将包裹粘附在大脑表面。(d) 切掉多余的包装。(e) 使用透明硅胶。(f) 贴上盖玻片。请点击此处查看此图的大图。
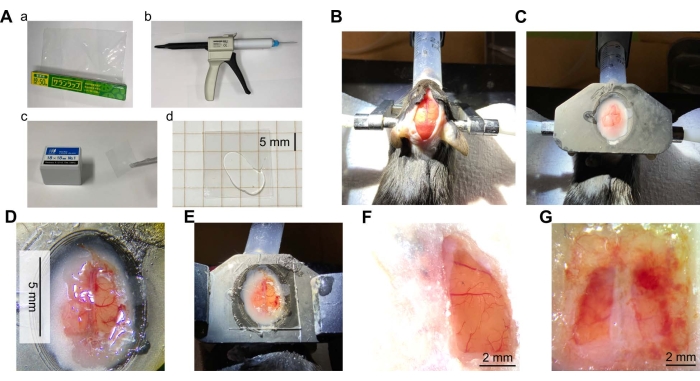
图2:颅窗手术概述 。 (A)颅窗所需的材料和设备。(a) 聚偏二氯乙烯(PVDC)包装膜。(b) 带有混合尖端的透明有机硅弹性体分配器。(c) 盖板玻璃。(d) 将透明硅胶放置在两块盖玻片之间。(B)切开以暴露头骨的小鼠头部皮肤的照片。麻醉小鼠,用耳条固定小鼠头部。然后将头部脱毛,用局部镇痛治疗,并切开皮肤。(C) 安装顶板后的照片。用牙科水泥将顶板(由3D打印机的树脂制成)连接到鼠标的头部。(D) 颅窗照片。颅窗是在小鼠大脑右半球的皮层中创建的。硬脑膜被移除,包裹物被粘合到位。(E) 由包装制成的窗户照片,顶部有透明硅胶和盖玻片。(F)成功窗口的典型例子(右半球,手术后7周)。(G)失败窗口的例子(两个半球,手术后5周)。 请点击此处查看此图的大图。
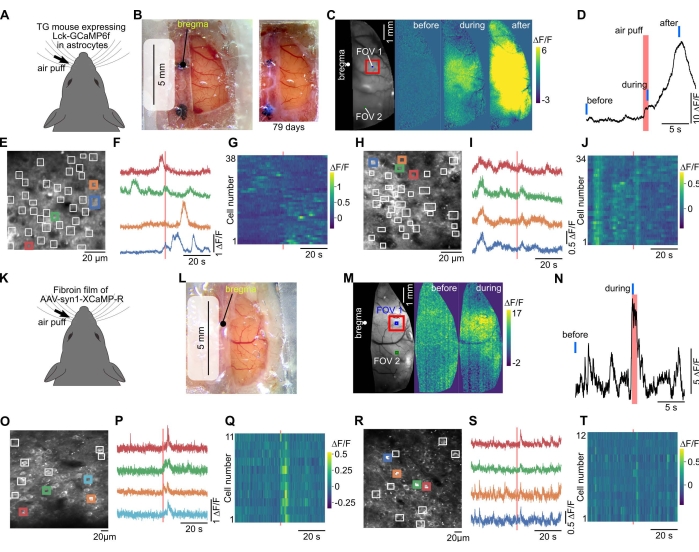
图 3:大窗口允许来自同一鼠标的宽场和双光子钙成像。 (A)在星形胶质细胞40中表达膜锚定GECI(Lck-GCaMP6f)的转基因小鼠中进行钙成像。(B)左边,用保鲜膜、透明硅胶和盖玻片制作了一个大窗户。通过该窗口进行宽场成像。右图,一张照片是在颅窗安装79天后拍摄的。(C)当对对侧晶须施加空气吹气刺激时,观察到荧光变化。(D)绘制躯体感觉皮层(C中的红色方块)荧光变化的时间过程。红色和蓝色条分别表示 (C) 中的"之前"、"期间"和"之后"时间。(E)双光子钙成像的视场(C中的FOV 1)。由于GCaMP6f表达为定位于膜,因此手动放置感兴趣的区域(白色方块)以检测星形胶质细胞过程中的局部反应。(F)绘制(E)中彩色方块的荧光变化。(G)绘制(E)所有平方的荧光变化。水平轴和垂直轴分别指示时间和单元格编号。(H-J)显示了(C)中FOV 2(在视觉皮层中)的数据。FOV 2在FOV 1中成像后成像。(K)红色GECI,XCaMP-R,在野生型小鼠中通过丝心蛋白-AAV方法在神经元中表达。(L)手术后两周拍摄的照片,其中使用丝心蛋白薄膜创建窗口。(M)对该小鼠进行宽场钙成像。(N)从最突出的部位(躯体感觉皮层,(M)中的红色方块)绘制由晶须刺激引起的荧光变化。红线和蓝线分别表示吹气计时以及 (M) 中的"之前"和"期间"计时。(O)300μm深度的双光子钙成像的视野(体感皮层,FOV 1在(M)中)。ROI被手动放置在神经元体细胞处。(P)绘制(O)中彩色方块的荧光变化。(Q)(O)所有正方形的荧光变化都用颜色绘制。(R-T)显示了位于顶叶皮层 (M) 中的 FOV 2 的数据。请点击此处查看此图的大图。
补充图1:手术刀的提示。 新手术刀的尖端(顶部)与用于用钝尖端切割头骨的手术刀(底部)相比。 请点击此处下载此文件。
补充图2:新颅窗和丝心蛋白-AAV表达方法的验证。 (A)琼脂中0.1μm荧光珠的荧光强度曲线。顶行显示仅将盖玻片放在琼脂中混合的荧光珠上的条件的数据,底行显示放置包裹、透明硅胶和盖玻片的条件的数据。灰色迹线显示每个磁珠与荧光强度曲线的高斯拟合,红色迹线显示其平均值(n = 7)。(B) (A)中的数据摘要。每个图形显示 XYZ 轴上点扩散函数的半峰全宽 (FWHM)。灰色图显示每个磁珠的数据,红色图显示其平均值和标准误差。(C)从2,000帧(60秒记录)的 体内 成像数据中,选择一个小的荧光颗粒并检查图像在60秒内的移动量。中间的荧光图像代表2,000帧的平均值。通过在X轴和Y轴方向上平均投影图像。直方图显示质心在每个帧中的分布。质心的标准偏差为X:0.36和Y:0.315μm。 (D)通过丝心蛋白-AAV方法表达GECI的示例。左:一片大脑皮层应用了丝心蛋白-AAV表达方法。红色和蓝色分别表示XCaMP-R和DAPI的荧光;XCaMP-R不仅在第2/3层细胞中表达,而且在第5层细胞中表达。居中和右边。图层 2/3 和左图中图层 5 的放大视图(青色正方形)。 请点击此处下载此文件。
补充文件1:(A)用丝心蛋白-AAV薄膜法包裹的表达效率和(B)评估双光子成像过程中的点扩散函数。请点击此处下载此文件。
讨论
本文介绍了一种使用 PVDC 保鲜膜、透明硅胶和盖玻片创建大型颅窗的廉价方法。使用这种方法,我们表明可以在大脑皮层的宽区域进行宽场钙成像。双光子钙成像可以从经过宽场成像的同一只小鼠的几个不同皮质区域进行。此外,已经表明,用于窗户的保鲜膜上的丝心蛋白-AAV薄膜可以在皮层的广阔区域表达GECI。
关键步骤
使用保鲜膜制作颅窗时,避免感染和对大脑的损害很重要。在这些条件下,无法观察到神经和神经胶质活动,并且不可能对更深的区域进行成像。血管损伤也会导致出血,使血液无法成像。为避免感染,通过吸出ACSF使大脑表面和包裹尽可能紧密地附着至关重要。甘露醇给药对于通过防止手术期间脑压升高来避免大脑和血管损伤很重要。这维持了大脑表面和硬脑膜之间的空间,并防止在切除颅骨和硬脑膜期间触摸大脑和血管。具有高放大倍率的体视显微镜和带有锋利尖端的镊子对于精确手术也很有效。
在丝心蛋白-AAV方法中,必须使用肉蚕茧,不要冷冻丝心蛋白溶液,充分干燥丝心蛋白-AAV溶液,并施用足够体积的溶液(每3mm直径5μL)。当使用较老的茧时,表达效率较低。这是因为来自旧茧的丝心蛋白可能很容易变性。当丝心蛋白溶液在-80°C冷冻并在使用时解冻时,表达效率较差。这可能是由于冷冻和解冻导致蛋白质变性。由于储存在4°C的丝心蛋白溶液可以有效地使用直到凝胶化,因此建议将丝心蛋白溶液冷藏并在凝胶化后再次从茧中纯化。丝心蛋白-AAV溶液应干燥至少3小时,因为不到3小时后表达不良。最后,表达面积取决于使用的丝心蛋白-AAV溶液的量。在 图3M的示例中,量很小(5 μL);因此,丝心蛋白-AAV膜仅覆盖窗口的上半部分,导致窗口上表达不均匀。如果使用足够量的丝心蛋白-AAV,则表达将在整个窗口中均匀。
技术的修改
新颖的颅窗技术允许人们在同一只小鼠中检查皮质回路的宏观活动及其潜在的单细胞水平活动。因此,该方法可以应用于各种神经科学研究。例如,它可用于观察决策任务、运动学习以及脑损伤和疾病的小鼠模型中的皮质活动。我们还认为,该方法不仅可以应用于啮齿动物,还可以应用于非人类灵长类动物。
本文表明,大颅窗对转基因小鼠和注射AAV表达功能蛋白的小鼠是有效的。特别是,表明包裹上的丝心蛋白-AAV膜比传统的AAV注射方法更容易在皮层的宽区域表达GECI。使用编码不同颜色GECI的两种AAV的混合物41,神经元和神经胶质细胞活动之间的相关性可以在皮层的宽阔区域同时成像。此外,丝心蛋白-AAV薄膜法还可以应用于其它基因编码的生物传感器42,43,44,45,46,47。
较大的颅窗也可以对两个半球进行成像。最近开发了具有更宽视场(~25 mm2)的双光子显微镜25,26,27,28,29。将这种双光子成像技术与使用此处描述的宽颅窗的单光子宽场成像相结合,将使我们能够从前所未有的规模检查群体活动与单细胞活动之间的关系。
局限性
食品包装不允许任何物质通过。这使得该方法难以用于药理学实验。取下包装也很困难,因此无法插入玻璃移液管或电极。因此,很难实施与其他方法相结合的实验,例如同时进行钙成像和电生理记录,以及使用玻璃移液管局部给药。针对这些限制的可能解决方案是使用带孔的包装和玻璃窗。这允许通过玻璃移液管或记录电极 进入 大脑,同时长时间保持颅窗无菌48。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了变革性研究领域补助金(A)"神经胶质解码"(JP21H05621至SM),JSPS KAKENHI(JP19K06883至SM,15KK0340至ES,JP22H00432,JP22H05160,JP17H06312至HB和JP17H06313至KK),疾病研究综合神经技术脑图谱资助(Brain/MINDS)(JP19dm0207079h0002至SM,JP19dm0207079至HB,JP19dm0207080至KK),成重神经科学研究基金会(至SM), 山梨县(SM)和武田科学基金会(SM)的青年研究员补助金,部分由山梨大学的前沿脑研究基金资助。
我们感谢N. Yaguchi和K. Okazaki的动物护理和技术援助,以及Kitamura实验室成员的有益讨论。
材料
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde phosphate buffer solution | NACALAI TESQUE, Kyoto, Japan | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| 50 mL beaker | |||
| Acquisition software | Brain vision | BV_Ana | For wide-field calcium imaging of GCaMP6f |
| Acquisition software | Hamamatsu photonics | High speed recording software: HSR | For wide-field calcium imaging of XCaMP-R |
| Acquisition software | Vibrio Technologies | scanImage | For two-photon calcium imaging |
| ACSF (artificial cerebrospinal fluid) | 150 mM NaCl, 2.5 mM KCl, 10 mM HEPES, 2 mM CaCl2, 1 mM MgCl2, pH = 7.4 with 1M NaOH | ||
| ACSF aspiration needle | |||
| Adeno-associated virus | VectorBuilder | custom-made | AAV-DJ/8-Syn1-XCaMP-R |
| Adhesives for biological use | Daiichi Sankyo | Aron Alpha-A | |
| Anesthesia machine | Shinano seisakusho | SN-487 | |
| Anesthetic | Kyoritsu Seiyaku Corporation | pentobarbital | Expression efficiency of the wrap with the fibroin-AAV film method |
| Auxiliary ear bar | Narishige | EB-5N | |
| CCD camera | Brain vision | MiCAM02-HR | For wide-field calcium imaging of GCaMP6f |
| Clear vinyl polysiloxane | GC | Exaclear | |
| CMOS camera | Hamamatsu photonics | ORCA-spark | For wide-field calcium imaging of XCaMP-R |
| Cotton swab | |||
| Cover glass | Matsunami | 18 x 18 NO.1 | Size: 18 x 18 mm, Thickness: 0.13-0.17 mm, Borosilicate glass |
| DAPI | Thermo Fisher | D1306 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Ddialysis cassette | 3.5K MWCO, Slide-A-Lyzer | ThermoFisher | |
| Dental adhesive resin cement | SUN MEDICAL | Super-Bond | |
| Dental drill | Nakanishi | VOLVERE Vmax | |
| Digital scale | Dretec | KS-243 | |
| Filters | Brain vision | EM: BP466/40-25, DM: DM506, EX: BP520/36-50 | |
| Filters | Olympus | U-MRFPHQ, EM: BP535-555HQ, DM: DM565HQ, Ex: BA570-625HQ | |
| Fluorescence microscope | Keyence | BZ-X810 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Fluorescent beads | Fluoresbrite YG Carboxylate Microspheres | 0.1 µm | Evaluation of the point spread function under the conventional and the new cranial windows in two-photon imaging |
| Forceps | FST | No. 11252-20 | thin-tipped, for removal of dura mater |
| Forceps | KFI | K-7, No.J 18-8 | for general use |
| Gelatin for hemostasis | Johnson & Johnson | Spongostan | |
| Gentamicin sulfate | Iwaki seiyaku | ||
| Glass pipette | custom-made | ||
| Hair remover | Reckitt Japan | Veet | |
| Head fixing device | custom-made | Craniotomy for Cortical Voltage-sensitive Dye Imaging in Mice. Suzuki, T., and Murayama, M. Bio-protocol 2016 6:e1722. | |
| Head plate | custom-made | aluminum or resin, size: 40 x 25 mm, thickness: 1.5 mm or 2 mm, hole in the center: 15 x 10 mm (head_plate_06 v3.f3d) | |
| Heating pad | |||
| Image processing software (for calcium imaging data analysis) | ImageJ | https://imagej.net | |
| Isoflurane | Pfizer | ||
| Light source | Hayashi-repic | LA-HDF108AA | |
| Light source | Brain vision | LEX2-LZ4-B | For wide-field calcium imaging of GCaMP6f |
| Light source | Olympus | U-HGLGPS | For wide-field calcium imaging of XCaMP-R |
| Mannitol solution (15% with saline) | Sigma-Aldrich (Merck) | M4125 | |
| Micro curette | FST | No. 10080-05 | |
| Microscope | Brain vision | For wide-field calcium imaging of GCaMP6f | |
| Microscope | Olympus | MVX10 | For wide-field calcium imaging of XCaMP-R |
| Microscope | Sutter Instruments | MOM | For two-photon calcium imaging |
| Microslicer | Dosaka EM | DTK-1000N | Expression efficiency of the wrap with the fibroin-AAV film method |
| Mixing tip | GC | ||
| Needle (30 G) | |||
| Polyethylens spoids | AS ONE | 1-4656-01 | |
| Polyvinylidene chloride (PVDC) film | Asahi Kasei | Asahi Wrap (or Saran Wrap) | |
| Povidone-iodine | Mundipharma | Isodine | |
| Python libralies | NumPy | package for scientific computing, https://numpy.org/doc/stable/index.html# | |
| Matplotlib | library for visualizations, https://matplotlib.org/stable/index.html# | ||
| pandas | data analysis and manipulation tool, https://pandas.pydata.org | ||
| Scalpel | Kai | No. 11 | |
| Shaver for animal | |||
| Silicone dispensers | GC | ||
| Silkworm cocoon | Satoyama Craft News | https://sato-yama.jp/ | |
| Stereomicroscope | LEICA | MZ6 | objective lens: 0.63x, eyepiece: 25x |
| Surfactant | NACALAI TESQUE | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| Surgical Scissors | FST | No. 91460-11 | |
| Syringe for mannitol injection | Terumo | 1mL | |
| Transdermal anesthetic | AstraZeneca | Lidocaine | |
| Transgenic mice used for calcium imaging of astrocytes | The mice were obtained by the following method. AldH1l1-CreERT2 mice: B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J (The Jackson laboratory, strain #: 031008) Tamoxifen-inducible Cre recombinase expression directed at high levels to the vast majority of astrocytes Flx-Lck-GCaMP6f mice: C57BL/6N-Gt(ROSA)26Sor[tm1(CAG-GCaMP6f)Khak]/J (The Jackson laboratory, strain #: 029626) Cre-dependent expression of a plasma membrane-targeted GCaMP6f. A mouse born from crossbreeding these mice were treated with tamoxifen (20 mg/mL) for 5 days (0.05 mL/10g bw, i.p.) to express GCaMP6f. | ||
| Tunable ultrafast lasers | Spectra-Physics | InSight X3 | For two-photon calcium imaging |
| Waterproof film | Nichiban | BFR5 | |
| Wild-type mice | Japan SLC | C57BL/6J | Male and femalek, >4 weeks old |
参考文献
- Ren, C., Komiyama, T. Wide-field calcium imaging of cortex-wide activity in awake, head-fixed mice. STAR Protocols. 2 (4), 100973 (2021).
- Couto, J., et al. Chronic, cortex-wide imaging of specific cell populations during behavior. Nature Protocols. 16 (7), 3241-3263 (2021).
- Kauvar, I. V., et al. Cortical Observation by Synchronous Multifocal Optical Sampling Reveals Widespread Population Encoding of Actions. Neuron. 107 (2), 351-367 (2020).
- Clancy, K. B., Orsolic, I., Mrsic-Flogel, T. D. Locomotion-dependent remapping of distributed cortical networks. Nature Neuroscience. 22 (5), 778-786 (2019).
- MacDowell, C. J., Buschman, T. J. Low-dimensional spatiotemporal dynamics underlie cortex-wide neural activity. Current Biology. 30 (14), 2665-2680 (2020).
- Makino, H., et al. Transformation of cortex-wide emergent properties during motor learning. Neuron. 94 (4), 880-890 (2017).
- Murphy, T. H., et al. Automated task training and longitudinal monitoring of mouse mesoscale cortical circuits using home cages. eLife. 9, 559654 (2020).
- Rynes, M. L., et al. Miniaturized head-mounted microscope for whole-cortex mesoscale imaging in freely behaving mice. Nature Methods. 18 (4), 417-425 (2021).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Ren, C., Komiyama, T. Characterizing cortex-wide dynamics with wide-field calcium imaging. The Journal of Neuroscience. 41 (19), 4160-4168 (2021).
- Hamodi, A. S., Martinez Sabino, A., Fitzgerald, N. D., Moschou, D., Crair, M. C. Transverse sinus injections drive robust whole-brain expression of transgenes. eLife. 9, 53639 (2020).
- Michelson, N. J., Vanni, M. P., Murphy, T. H. Comparison between transgenic and AAV-PHP.eB-mediated expression of GCaMP6s using in vivo wide-field functional imaging of brain activity. Neurophotonics. 6 (2), 025014 (2019).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Fan, J. T., et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nature Photonics. 13 (11), 809-816 (2019).
- Stuart, G. J., Spruston, N. Dendritic integration: 60 years of progress. Nature Neuroscience. 18 (12), 1713-1721 (2015).
- Grienberger, C., Chen, X., Konnerth, A. Dendritic function in vivo. Trends in Neurosciences. 38 (1), 45-54 (2015).
- Takahashi, N., et al. Locally synchronized synaptic inputs. Science. 335 (6066), 353-356 (2012).
- Kitamura, K., Hausser, M. Dendritic calcium signaling triggered by spontaneous and sensory-evoked climbing fiber input to cerebellar Purkinje cells in vivo. The Journal of Neuroscience. 31 (30), 10847-10858 (2011).
- Manita, S., et al. A top-down cortical circuit for accurate sensory perception. Neuron. 86 (5), 1304-1316 (2015).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Srinivasan, R., et al. Ca(2+) signaling in astrocytes from Ip3r2(-/-) mice in brain slices and during startle responses in vivo. Nature Neuroscience. 18 (5), 708-717 (2015).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the complexities of astrocyte calcium signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proceedings of the National Academy of Sciences of the United States of America. 112 (36), 11377-11382 (2015).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839 (2017).
- Demas, J., et al. cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods. 18 (9), 1103-1111 (2021).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife. 5, 14472 (2016).
- Stirman, J. N., Smith, I. T., Kudenov, M. W., Smith, S. L. Wide field-of-view, multi-region, two-photon imaging of neuronal activity in the mammalian brain. Nature Biotechnology. 34 (8), 857-862 (2016).
- Yu, C. H., Stirman, J. N., Yu, Y., Hira, R., Smith, S. L. Diesel2p mesoscope with dual independent scan engines for flexible capture of dynamics in distributed neural circuitry. Nature Communications. 12 (1), 6639 (2021).
- Barson, D., et al. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nature Methods. 17 (1), 107-113 (2020).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. Journal of Neurophysiology. 115 (6), 2852-2866 (2016).
- Kim, T. H., et al. Long-term optical access to an estimated one million neurons in the live mouse cortex. Cell Reports. 17 (12), 3385-3394 (2016).
- Ghanbari, L., et al. Cortex-wide neural interfacing via transparent polymer skulls. Nature Communications. 10 (1), 1500 (2019).
- Takahashi, T., Zhang, H., Otomo, K., Okamura, Y., Nemoto, T. Protocol for constructing an extensive cranial window utilizing a PEO-CYTOP nanosheet for in vivo wide-field imaging of the mouse brain. STAR Protocols. 2 (2), 100542 (2021).
- Suzuki, T., Murayama, M. Craniotomy for cortical voltage-sensitive dye imaging in mice. Bio-Protocol. 6 (3), 1722 (2016).
- Jackman, S. L., et al. Silk fibroin films facilitate single-step targeted expression of optogenetic proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Jia, H., Rochefort, N. L., Chen, X., Konnerth, A. In vivo two-photon imaging of sensory-evoked dendritic calcium signals in cortical neurons. Nature Protocols. 6 (1), 28-35 (2011).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , 061507 (2017).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Inoue, M., et al. Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell. 177 (5), 1346-1360 (2019).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Sun, F., et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell. 174 (2), 481-496 (2018).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nature Methods. 10 (2), 162-170 (2013).
- Feng, J., et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Sabatini, B. L., Tian, L. Imaging neurotransmitter and neuromodulator dynamics in vivo with genetically encoded indicators. Neuron. 108 (1), 17-32 (2020).
- Roome, C. J., Kuhn, B. Chronic cranial window with access port for repeated cellular manipulations, drug application, and electrophysiology. Frontiers in Cellular Neuroscience. 8, 379 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。