Method Article
使用微创方法评估老年人的燃料利用率和昼夜节律
摘要
提出了一种新的微创方案,以利用外周血单核细胞评估燃料利用和昼夜节律对老年人的协同影响。
摘要
衰老与多种生理变化有关,这些变化协同且独立地导致身体残疾和慢性病风险。尽管与年龄相关的身体残疾的病因复杂且多因素,但线粒体功能的下降似乎与许多老年人功能下降的进展相吻合。线粒体功能随衰老而下降的原因仍然难以捉摸,但新兴科学表明,燃料代谢和昼夜节律都会影响线粒体功能。
最近的研究已经确定,昼夜节律会随着年龄的增长而紊乱,而昼夜节律的紊乱会产生影响线粒体功能的病理后果,并与许多与年龄相关的慢性疾病重叠。目前直接评估线粒体功能的定量方法是侵入性的,通常需要肌肉活检,考虑到感知到的潜在疼痛和风险水平,这可能会给参与者招募和研究依从性带来困难。因此,采用了一种创新且相对无创的方案来评估老年人细胞水平线粒体功能和昼夜节律模式的变化。具体来说,实时代谢通量分析仪用于评估底物可用性差异下白细胞的线粒体生物能量功能。
还分析了白细胞中昼夜节律基因的表达与线粒体生物能量学和昼夜节律结果交叉相关。据信,这些创新的方法将通过提供微创方法来研究老年人的线粒体底物偏好和昼夜节律,从而帮助未来的临床试验。
引言
上个世纪的进步导致预期寿命和老年人口的增加。展望未来,从 2020 年到 2050 年,美国 65 岁及以上的成年人比例预计将增加 5%1。预期寿命的增加并不意味着健康寿命的增加——与独立功能相关的寿命。现实情况是,衰老伴随着无数影响细胞新陈代谢和生理机能的生物变化,导致认知和身体机能逐渐下降 2,3。随着人类预期寿命的不断延长,更需要在4 岁时保持功能能力和独立性。
众所周知,随着年龄的增长,身体机能和独立性的下降是多因素的,尽管它经常与慢性病的发作和急性刺激事件有关5。相反,研究表明,这些身体机能和肌肉特征的下降与随着年龄的增长而残疾的发展有关,与单一疾病没有明确的联系6。由于难以了解慢性病和身体残疾的确切病因,线粒体功能的损害被认为与慢性病的发作和进展以及老年人身体机能的丧失相吻合 7,8。
线粒体提供许多细胞过程所必需的大部分三磷酸腺苷 (ATP)9。高度氧化的组织依靠线粒体产生足够的能量;随着年龄的增长,氧化能力和线粒体 ATP 合成下降。这种下降部分是由于线粒体 DNA (mtDNA) 的氧化损伤,这导致 mtDNA 突变和缺失的增量积累10。mtDNA 突变和缺失的积累导致功能性电子传递链蛋白的形成减少,从而导致细胞产生 ATP 的能力降低。与年龄相关的线粒体功能下降在高氧化组织中最为明显,例如心脏和骨骼肌11。研究表明,与年轻大鼠样本相比,老年大鼠样本中的腓肠肌线粒体的 ATP 产生和含量减少了约 50%12。此外,已经表明,人类骨骼肌中线粒体 ATP 的产生能力每十年下降约 8%13。这些发现表明,与年龄相关的线粒体功能下降可能导致生物体能量产生减少。
线粒体活性的关键调节因子被认为是过氧化物酶体增殖物激活受体 γ (PPARγ) 共激活因子-1 (PGC-1α)14。PGC-1α 活性的恶化或其丰度的下降导致线粒体氧化活性降低,从而损害能量产生。此外,线粒体质量下降可能会影响骨骼肌质量,并随后导致肌肉减少症、肌力减少和功能能力下降的发展或恶化15,16。与年龄相关的线粒体功能和骨骼肌质量同时下降的证据表明,线粒体损伤与功能下降的发病机制之间存在联系17。最近,这已在功能性社区居住的老年人中得到证实,表明骨骼肌线粒体代谢的减少预示着该人群的活动能力下降18。尽管导致线粒体随年龄增长而下降的确切机制尚不清楚,但最近的证据表明,生物钟和线粒体功能之间存在相互相互作用,这对线粒体燃料利用和生物发生有影响19。
燃料利用率
线粒体功能似乎受燃料代谢和骨骼肌组织中细胞水平使用的燃料类型的影响11。在燃料消耗期间,特别是人类的碳水化合物消耗期间,(线粒体)能量产生的燃料偏好会发生变化。在低葡萄糖水平下,燃料偏好从葡萄糖转向脂肪酸和酸衍生的酮体。这种代谢转变的特点是脂肪细胞中脂质代谢的上调,然后酮体释放到血液中的增加4。生酮饮食将燃料利用从葡萄糖转变为酮体似乎对线粒体活性氧的产生、抗氧化防御、ATP 合成和生物发生20 有有益影响。
从碳水化合物到脂质代谢的代谢转变发生在环境营养物质可用性低和糖原储存耗尽的时期。当这种转换开始时,储存的甘油三酯被分解成甘油(糖异生的底物)和游离脂肪酸,它们被运输到肝脏, 通过 β氧化氧化成乙酰辅酶 A(乙酰辅酶 A)。酮体主要在肝脏中通过三个乙酰辅酶 A 分子的两步缩合合成为 β-羟基-β-甲基戊二酰辅酶 A,然后进一步加工成酮体,包括乙酰乙酸和 3-βeta 羟基丁酸酯21。这些酮体分布到全身的组织中,其中心脏、大脑和骨骼肌的消耗量最高21。随着年龄的增长,线粒体脂肪酸氧化受损,从而影响代谢开关22。有人提出,线粒体燃料利用的损害会导致进一步的线粒体功能障碍,进而导致与年龄相关的疾病和功能下降23。
已经研究了外周血单核细胞 (PBMC) 线粒体耗氧量的变化,以评估与功能障碍和血管形成相关的模式。Hartman 等人 进行了一项研究,旨在确定耗氧量与不同介导的扩张之间的相关性,发现该研究表明线粒体功能障碍与血管平滑肌细胞功能障碍之间存在联系24。关于其他器官,PBMC 与更高的认知和大脑功能相关,由呼吸测定法确定25。因此,PBMC 生物能量学和呼吸能力可以作为评估全身器官或组织功能能力的潜在生物标志物。
生理节律
影响线粒体健康的另一个重要因素是昼夜节律。昼夜节律是在没有环境线索的情况下发生的行为和生理学的 ~24 小时振荡26。这些节律以预测方式发挥作用,以支持系统和组织稳态。昼夜节律的基础机制是一个称为昼夜节律时钟27 的转录-翻译反馈回路。在过去的 15 年中,已经证明昼夜节律机制几乎存在于全身的所有细胞中28。除了保持时间外,分子钟机制还有助于基因表达的日常程序,称为昼夜节律时钟输出29。时钟输出基因对于每种组织类型都是独一无二的,并且在功能上与细胞代谢、自噬、修复和体内平衡的重要途径相关。最近的证据表明,线粒体健康取决于生物钟功能并影响线粒体功能,包括线粒体生物发生、燃料利用和线粒体自噬30。
临床前和临床研究中的新证据表明,在整个衰老过程中,昼夜节律会受到干扰31。这些包括正常睡眠和觉醒周期的中断、核心体温节律的振幅减小以及适应第31 阶段变化的能力延迟。例如,一项研究通过将光照时间表改变 6 小时来挑战成年和老年(20+ 个月)小鼠的昼夜节律系统。结果发现,老小鼠需要更长的时间才能将它们的活动模式重新带入新的光照时间表32。与昼夜节律行为的变化一致,对组织时钟的分析发现,在衰老队列中,中央和外周组织时钟都受损。
最近,几个小组对33 岁不同组织的昼夜节律和时钟输出进行了转录组学分析。这些研究的结果强调,随着年龄的增长,昼夜节律时钟输出存在大规模的重编程。这意味着即使核心时钟保持计时功能,靶向日常表达的基因也大不相同。例如,两项研究在 24 小时内每 4 小时收集一次人类受试者的肌肉活检,结果确定时钟基因表达的高峰和谷值在夜间啮齿动物和昼夜人类之间颠倒 34,35,36。这表明,当仅根据活动期与静止期(而不是明暗相)比较时钟基因表达时,肌肉中时钟基因表达的模式在物种之间几乎相同。有人提出,这种与年龄相关的时钟输出变化会导致包括已知衰老标志的通路调节受损,例如线粒体功能、DNA 损伤和修复以及自噬37。
研究依据
线粒体功能与身体功能下降之间的联系已得到充分证实。然而,线粒体功能障碍的根本原因仍然是一个争论的话题。最近的研究表明,细胞燃料利用和昼夜节律可能在此过程中发挥作用。评估线粒体功能的传统方法,例如测量肌肉活检样本中的线粒体耗氧量,通常被认为是痛苦和侵入性的,这可能会阻碍参与,尤其是在肌肉质量低的人群中,例如虚弱和肌肉减少的成年人38。
鉴于这些限制,需要一种侵入性较小的方法来评估老年人细胞燃料利用和昼夜节律的变化。本研究旨在评估一种新颖的微创方案,该方案可用于评估该人群的燃料代谢和昼夜节律。这项研究的结果将有助于更好地了解与年龄相关的变化以及对医疗或行为干预的反应,为该领域的未来研究提供模型。
研究方案
涉及人类参与者的程序已获得研究伦理委员会(佛罗里达州伦理政策 1.0104)和佛罗里达大学机构审查委员会的批准。
1. 线粒体功能
- 外周血单核细胞 (PBMC) 的分离
- 使用特殊的 8 mL 采血管(16 mm x 125 mm;含有 0.1 M 柠檬酸钠抗凝剂或肝素钠抗凝剂)收集 PBMC(参见 材料表)。
注:采血管包含由触变性聚酯凝胶和梯度介质(参见 材料表)组成的血液分离介质,以增强白细胞的分离。 - 收集后 2 小时内处理 8 mL 细胞制备管以获得可行的结果。
- 将采血管充满血液后混合采血管(通过温和倒置或在混合器上),并在室温 (RT) 下保持最多 2 小时。
- 在 RT 下,将采血管在合适的水平转子中以 2,000 × g 离心 15 分钟(或相当于 30,000 G-min;不超过 2,000 × g)。
注:这些离心管比普通的 15 mL 离心管高;因此,必须特别注意使用正确的转子。 - 吸出并丢弃到生物危害性废物容器中 ~80% 的血浆层,并在 15 mL 离心管中从采血管中收集细胞层(使用移液管)。
注:使用 15 mL 试管时,加入 7 mL 细胞层,并用无菌磷酸盐缓冲盐水 (PBS) 填充至 14 mL。细胞与 PBS 的比例应为 1:1。如有必要,使用多根试管。倒置轻轻混合。 - 在 RT 下,在水平转子中以 900 × g 离心 5 分钟(或相当于 4,500 G-min)。
- 在不干扰细胞沉淀的情况下,吸出 PBS 溶液并将其丢弃到生物危害性废物容器中。
- 轻轻研磨,将细胞沉淀重悬于 1 mL 基础培养基(BM;参见 材料表)中。将 BM 加入至总共 10 mL,然后倒置轻轻混匀。进行细胞计数。
- 在 RT 下,将细胞悬液在水平转子中以 900 × g 离心 5 分钟。
注意:当细胞在同一天用于生物能量评估时,请继续执行步骤 1.1.10;如果细胞被冻结以进行存储,请继续执行步骤 1.1.13。 - 计算用于重悬下一个细胞沉淀的检测培养基的体积(AM;参见 材料表),以达到所需的细胞浓度。
注:例如,对于 50 μL 中 150,000 个细胞/孔的接种密度,所需的细胞悬液浓度为 300 万个细胞/mL。 - 在不干扰细胞沉淀的情况下,吸出上清液并将其丢弃到生物危害性废物容器中。
- 将细胞沉淀轻轻重悬于 1 mL 或更少的 AM 中。将 AM 添加到所需细胞浓度的总计算体积中。细胞现在已准备好接种到包被的细胞培养板中(参见 材料表)。
注意:以下步骤用于冷冻细胞以进行储存 (1.1.13-1.1.16),不适用于当天程序。 - 对于冷冻细胞,在不干扰细胞沉淀的情况下吸出上清液,并将其丢弃到生物危害性废物容器中。
- 将细胞轻轻重悬于所需浓度(5-1000 万个细胞/mL)的冻存培养基中(参见 材料表)。在标记的冷冻管中分装所需的体积。
- 使用冷冻容器(参见 材料表)将细胞悬液缓慢冷冻至少 4 小时或在 -80 °C 下过夜。
- 4 小时后或第二天早上,将冻存管转移到液氮储存中,它们应位于气相中。
- 测量前一天,用细胞粘合剂(参见 材料表)涂覆细胞培养微孔板的孔底(参见 材料表)。根据制造商的说明制备粘合剂,推荐浓度为 22.4 μg/μL,方法是在 0.1 M 碳酸氢钠 (pH 8.0) 中稀释适当体积的粘合剂储备溶液。将 25 μL 粘合剂涂在细胞培养微孔板的每个孔中。
- 20 分钟后,从每个孔中吸出剩余的液体,并用 200 μL 无菌纯净水洗涤孔两次。让板在生物安全柜中干燥(~2 小时)。
- 用铝箔包裹板或将其置于密闭的辅助容器中,并将其存放在 4 °C 的冰箱中。
- 使用特殊的 8 mL 采血管(16 mm x 125 mm;含有 0.1 M 柠檬酸钠抗凝剂或肝素钠抗凝剂)收集 PBMC(参见 材料表)。
- 使用实时代谢通量分析仪对 PBMC 进行生物能量评估
注意:使用磁通量分析仪和多模式阅读器(请参阅 材料表),最佳接种密度为每孔 150,000 个 PBMC,最终解偶联剂羰基氰化物-4(三氟甲氧基)苯腙 (FCCP) 浓度为 2 μM,Hoechst 33342 最终浓度为 4 μM(注射后孵育时间至少 20 分钟)。- 要使用 hydrobooster 对传感器探针板进行水合,请从包装盒中取出带有工具板的传感器探针板,然后将探针板“向上”放在工作台上。将 200 μL 校准液(参见 材料表)移液到工具板的每个孔中,然后将 hydrobooster 牢固地放在工具板上,然后放在传感器柱上。检查并去除任何残留的气泡,并置于 37 °C 非 CO2 培养箱中过夜。
- 打开助焊剂分析仪,然后打开分析软件(参见 材料表)。将温度设置为 37 °C。 将仪器打开过夜以稳定设定温度。
注意:以下编程步骤 (1.2.4-1.2.10) 可以在实验前一天或当天完成 - 要对分析分析软件(参见材料表)文件进行编程,请打开底物氧化应力测试的模板。转到组定义,打开注射策略选项卡,将抑制剂 + 亚牛应激测试编辑为 Etomoxir + 亚牛应激测试,然后添加另外两个注射策略:UK5099 + 亚牛应激试验和 BTPES + 亚牛应激试验。在每种进样策略中,在“进样条件”窗口中,单击端口 A 并输入相应抑制剂的最终浓度(依托莫西:4 μM;UK5099:2 μM;BTPES:3 μM)。
- 单击端口 B、C 和 D,然后输入相应的最终浓度(端口 B:寡霉素浓度 [1.50 μM],端口 C:FCCP [2.0 μM];端口 D:鱼藤酮 + 抗霉素 A [0.5 μM])。将 Hoechst 33342, 4 μM 添加到端口 D 的化合物窗口中。
- 打开 Pretreatments 选项卡并选择 pretreatments (如果适用)。例如:对照、实验或惯常(例如,基线和随访)。如果需要,请在下面的窗口中添加描述。
- 打开 “检测培养基”选项卡,从“ 培养基 ”下拉菜单中选择“ RPMI 培养基,pH 7.4”,输入 批号、 培养基制备人员、 制备时间以及 添加到培养基中的添加剂 (10 mM 葡萄糖、2 mM 谷氨酰胺、1 mM 丙酮酸;参见 材料表)。
- 打开 “细胞类型 ”选项卡,输入 PBMC-主题 ID 作为 名称, PBMC 作为 细胞类型, 150000 作为 接种密度,主题 ID 作为 来源, 准备细胞的人员、 制备日期和 细胞解冻日期(如果适用)。
- 单击 Generate Groups,转到 Plate Map,然后将 96 孔板的孔分配给相应的组。将孔 A1、 A12、 H1 和 H12 指定为 背景孔。
- 转到 协议,选中 平衡 框(默认设置),然后输入以下信息: 基线:五个测量周期:3 分钟混合、0 分钟等待和 3 分钟测量; 培养基或抑制剂(端口 A):六个测量周期:3 分钟混合、0 分钟等待和 3 分钟测量; 寡霉素(端口 B):三个测量周期:3 分钟混合、0 分钟等待和 3 分钟测量; FCCP(端口 C):三个测量周期:3 分钟混合、0 分钟等待和 3 分钟测量; 鱼藤酮 + 抗霉素 A + Hoechst 33342(端口 D):三个测量周期:3 分钟混合、0 分钟等待和 3 分钟测量。
- 在生物能量评估当天,从冰箱中取出包被的细胞培养微孔板,使其在生物安全柜中预热至 RT。
- 通过混合 97 mL 预热的 BM 和补充剂来制备检测培养基 (AM):1 mL 丙酮酸(终浓度:1 mM)、1 mL 葡萄糖(终浓度 10 mM)和 1 mL 谷氨酰胺(终浓度:2 mM)。将 AM 置于 37 °C 的非 CO2 培养箱中直至使用。
- 要接种细胞,向每个孔中加入 50 μL 含有 150,000 个 PBMC 的细胞悬液(来自 1.1.12),但 A1、 H1、 A12 和 H12 (指定为 背景孔)除外。
CRITICAL:之前已确定最佳接种密度。 - 用盖子盖住细胞板,并在生物安全柜中让细胞在 RT 下静置 60 分钟,以促进细胞的均匀分布。
关键:在显微镜下观察细胞,以确保细胞在整个孔中均匀分布。 - 对于细胞成像,在第一次细胞孵育前几个小时打开多功能阅读器(参见 材料表);在打开成像软件之前,请等待 reader 的启动协议完成(参见 材料表)。打开成像软件,将 预热温度 设置为 37 °C。
- 要制备检测试剂,请按照检测试剂盒的说明重新配制试剂,如 表 1 所示进行轻微修改。
关键:最佳最终 FCCP 和 Hoechst33342 浓度之前已经确定。 - 细胞休息 60 分钟后,用细胞培养显微镜检查孔,并记录任何视觉异常,例如细胞聚集。
- 在带有微孔板摆动转子的离心机中,在 RT 下以 60 × g 的速度离心细胞培养板 1 分钟,以最小的加速度和最小的断裂;转动板并再次以 40 × g 离心 1 分钟。将 acceleration 和 break 设置为最小值。将细胞在 37 °C 下在非 CO2 培养箱中孵育 25-30 分钟。
注:进行细胞成像时,将细胞板在预热的多功能读数仪中孵育(参见 材料表),并在此孵育期间(第一次细胞孵育)拍摄每个孔的明场图像。 - 使用条形码扫描仪扫描细胞培养板的条形码(参见材料表),选择开始明场扫描,将细胞培养板放在板托盘上,然后开始托盘缩回。选择包含细胞的孔进行扫描并开始扫描。
- 在第一次细胞孵育期间,将试剂 装入传感器盒的端口 ,如 表 1 所示:端口 (A):20 μL AM(对照)、依托莫昔(长链脂肪酸转运到线粒体的抑制剂)、UK 5099(2-氰基-3-(1-苯基-1H-吲哚-3-基)-2-普碳烯酸;线粒体丙酮酸载体抑制剂)或 BPTES(Bis-2-(5-苯基乙酰氨基-1、3,4-噻二唑-2-基)乙基硫化物;谷氨酰胺转化为谷氨酸的抑制剂); 端口 (B):22 μL 寡霉素(ATP 合酶抑制剂); 端口 (C):25 μL FCCP(解偶联剂羰基氰化物-4(三氟甲氧基)苯腙); 端口 (D):27 μL 鱼藤酮/抗霉素 A/Hoechst 33342(分别为线粒体复合物 I 和 III 的抑制剂以及核染料)。将传感器盒放回 37 °C 非 CO2 培养箱中再放置 5 分钟。
注意: 请遵循制造商的端口加载说明。 - 在第一次细胞孵育后和细胞成像完成(如果适用)后,将细胞培养板从培养箱或读板器中取出,并向每个孔中加入温 AM,使最终体积为每孔 180 μL。将细胞板置于 37 °C 的非 CO2 培养箱中再放置 15-25 分钟(第二次细胞孵育)。
- 通过在第二次细胞孵育期间开始传感器校准来启动 代谢测定 。当检测准备好开始校准传感器探针板时,单击 Run Assay 。出现提示时,将传感器探针板从 37 °C 非 CO2 培养箱转移到通量分析仪托盘中,然后开始校准。校准完成后,按照分析软件提示更换细胞板的实用程序板。
注意:校准大约需要 20 分钟。 - 代谢分析后,按照软件提示从仪器中取出传感器卡盒和细胞板。从细胞板上取下传感器盒,并用盖子盖住细胞板。
- 在初步实验中确定 Hoechst 染料孵育时间后,扫描板的条形码并按照软件提示使用多功能酶标仪获取每个细胞包含孔的荧光图像。
注:成像和分析软件是接口,允许将细胞计数数据导入分析分析数据文件,以便将数据标准化为细胞计数。
2. 生物钟基因表达
注意:参与者对 PBMC 时钟基因的表达将通过使用 RNA 血液试剂盒分离 RNA 来审查(参见 材料表)。
- 将 3 mL 参与者的血液直接抽取到 RNA 管中(参见 材料表),其中含有 6 mL 稳定剂。涡旋 10 秒以充分混合。
注意:如果稳定试剂未与参与者的血液样本充分混合,则会增加研究错误的风险。 - 将 1.0 mL 稳定血样转移到装有 5 mL 红细胞裂解缓冲液的 15 mL 试管中。在冰上孵育 10-15 分钟。在孵育过程中将试管涡旋 2 次。将试管在 4 °C 下以 400 × g 离心 10 分钟。
- 识别沉淀并小心倒出含有裂解红细胞的上清液。加入 2 mL 红细胞裂解缓冲液(参见 材料表),重悬细胞,短暂涡旋,并在 4 °C 下以 400 × g 离心 10 分钟。
- 倒出上清液,将试管倒置在吸水纸上 1-2 分钟。在下一步之前,用干净的纸吸干管边缘周围的任何液体。
- 小心加入 600 μL RNA 裂解缓冲液(参见 材料表)。按照制造商的方案,加入 β-巯基乙醇并重悬沉淀。
- 将裂解物直接移液到一次性细胞裂解物匀浆器(参见 材料表)离心柱中,置于 2 mL 收集管中,并以最大速度离心 2 分钟以匀浆。丢弃一次性细胞裂解物匀浆器离心柱并保存匀浆裂解物。
- 向匀浆裂解物中加入 1 体积 (600 μL) 的 70% 乙醇,并通过移液混合。小心地将样品(包括可能形成的任何沉淀物)移入 2 mL 收集管中的新离心柱中,但不要弄湿边缘。以 >8,000 × g 离心 15 秒。
- 将离心柱(参见 材料表)转移到新的 2 mL 收集管中。将 700 μL 严格的洗涤缓冲液(参见 材料表)涂在离心柱上,并以 >8,000 × g 离心 15 秒以洗涤。丢弃流通件。
- 小心打开离心柱并加入 500 μL 温和洗涤缓冲液(参见 材料表)。盖上盖子,全速离心 (20,000 × g) 3 分钟。
- 将离心柱转移到 1.5 mL 微量离心管中,将 30-50 μL 不含 RNase 的水直接移液到硅胶膜上。以 >8,000 × g 离心 1 分钟以洗脱 RNA。再重复一次。
注意:RNA 可以储存在 -80 °C 下。 - 根据制造商的方案,使用不含 RNase 的 DNase 组(参见 材料表)在色谱柱上进行 DNase 处理。
- 根据制造商的方案,使用 500 ng 总 RNA 和实时聚合酶链反应 (PCR) 系统生成 cDNA(参见 材料表)。用不含 RNase 的水以 1:25 的比例稀释所有 cDNA 样品,并使用 4 mL 进行定量逆转录 PCR (qRT-PCR)。
- 使用引物添加方法(参见 材料表)用表 2 中所示的每种引物 10 mM 完成 qRT-PCR。使用实时系统完成 qRT-PCR(参见 材料表)。
- 使用 Rpl26 mRNA 水平对所选基因的 mRNA 水平进行标准化。使用 2-DDCt 方法计算相对定量。
- 为了确定给定 mRNA 的表达是否表现出昼夜节律振荡,请使用基于 LR_rhythmicity39 可能性的检验(使用 p≤ 0.01)来检测一种实验条件下的昼夜节律40。
3. 数据分析计划
注意:医疗清单将用于根据药物使用情况对参与者进行分类43.
- 使用混合效应线性模型,其中年龄、性别、体重、身高、血压、心率和其他风险因素应作为协变量包括在内。
- 应包括一个随机效应项来解释受试者内数据相关性。
- 对于模型拟合,应实现具有分层原则的向后变量选择。
- 从拟合模型中,给定拟合模型中的所有协变量,测量从时间点 1 到时间点 2 的变化。
结果
拟议的协议包括作为方法验证的初步数据。该方案结合了实时代谢通量分析仪来检查线粒体功能和细胞燃料利用率,以及 RNA 提取和 qRT-PCR 来分析昼夜节律基因(例如,BMAL1、CLOCK、Nfil2、Nr1d1、Dbp、Cry1、Per2)。
初始分析后 10 天,来自 5 名对照参与者的分离人 PBMC 的耗氧率 (OCR) 如图 1 所示。该数据用于比较前后值,并显示注射对照、依托莫昔、UK5099 和 BPTES 后基础呼吸、急性反应、最大呼吸和备用容量的平均值。值得注意的是, 图 1C 显示 etomoxir 注射后有显着的负急性反应,但对基础呼吸、最大呼吸或备用容量没有观察到显着影响。
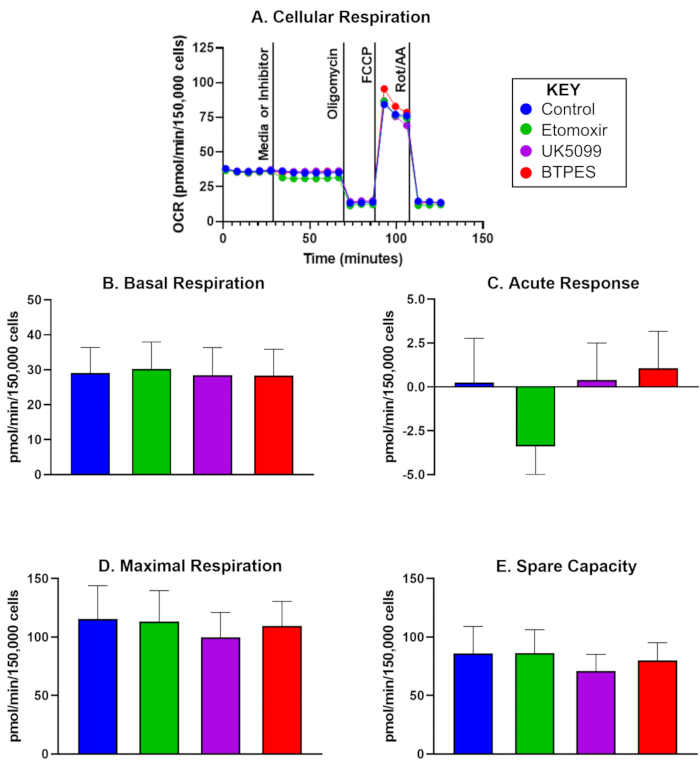
图 1:分离的人外周血单核细胞 (PBMC) 的耗氧量。(A) 从对照受试者中分离的 PBMC 的实时耗氧率 (OCR;pmol/(min∙150,000 个细胞),用通量分析仪测量,并用底物氧化测定进行评估。以 150,000 个细胞/孔的密度接种细胞。第一次注射是培养基(对照)或抑制剂(依托莫西、UK5099 或 BPTES;详见正文),在测量基础细胞呼吸率后进行。对线粒体底物限制的急性反应被确定为抑制剂注射前后基础 OCR 的差异。寡霉素是 ATP 合酶抑制剂,可抑制 ATP 产生的耦合呼吸并产生质子泄漏呼吸。FCCP,解偶联剂,诱导最大的、非耦合的呼吸;鱼藤酮和抗霉素 A (分别为复合物 I 和 III 的抑制剂) 抑制除非线粒体呼吸外的所有 (详见正文)。(B-E)细胞呼吸的定量 (n = 5;数据表示为 SD ±平均值)。(B) 抑制剂注射前的基础 OCR,(C) 对抑制剂的急性反应(OCR 相对于抑制剂注射前的基础速率的变化),(D) 最大 OCR,以及 (E) 备用容量(第一次注射后最大 OCR 和基础 OCR 之间的差异)。对依托莫昔注射的急性反应 (C) 可能表明与其他底物组相比,在基础条件下 OCR 对脂肪酸作为能量底物的依赖性更高,在高能量需求期间对 OCR 没有明显影响 (D)。请单击此处查看此图的较大版本。
| 复合 | 添加到化合物中的 AM (μL) | 原液 (μM) | 库存 (μL) 用于工作库存 | 用于工作库存的 AM (μL) | 工作储备液 (μM) | 工作储备液 (μL) [端口] | 最终浓度 (μM) |
| 依托莫西 | 700 | 160 | 500 | 1500 | 40 | 20 [美] | 4 |
| UK5099 | 700 | 80 | 500 | 1500 | 20 | 20 [美] | 2 |
| BPTES 系列 | 700 | 120 | 500 | 1500 | 30 | 20 [美] | 3 |
| 寡核苷酸 | 420 | 150 | 300 | 2700 | 15 | 22 [B] | 1.5 |
| FCCP (英语) | 720 | 100 | 600 | 2400 | 20 | 25 [C] | 2 |
| 腐烂/AA/H | 540 | 50 | 300 | 2700 | 5 | 27 [深] | 0.5 |
表 1:用于底物氧化测试的试剂的制备以及储备液、工作液和最终溶液的浓度。 所有试剂都是细胞线粒体压力测试或底物氧化压力测试试剂盒的一部分。缩写:oligo = oligomycin;FCCP = 解偶联剂羰基氰化物-4(三氟甲氧基)苯腙;Rot/AA/H = 鱼藤酮/抗霉素 A/Hoechst 33342。依托莫昔,UK5099,BTPES:分别是脂肪酸、葡萄糖和谷氨酰胺氧化的抑制剂。
| Bmal1 | 转发 – GCACGACGTTCTTTCTTCTGT |
| 反向 – GCAGAAGCTTTTTCGATCTGCTTTT | |
| 时钟 | 转发 – CGTCTCAGACCCTTCCTCAAC |
| 反向 – GTAAATGCTGCCTGGGTGGA | |
| 哭泣1 | 前进 – ACTGCTATTGCCCTGTTGGT |
| 反向 – GACAGGCAAATAACGCCTGA | |
| Per1 | 转发 – ATTCGGGTTACGAAGCTCCC |
| 反向 – GGCAGCCCTTTCATCCACAT | |
| Per2 | 转发 – CATGTGCAGTGGAGCAGATTC |
| 反向 – GGGGTGGTAGCGGATTTCAT | |
| Rev-erb α | 正向 – ACAGATGTCAGCAATGTCGC |
| 反向 – CGACCAAACCGAACAGCATC |
表 2:生物钟基因引物。
讨论
线粒体功能的下降和昼夜节律的调节随着年龄的增长而越来越被视为导致年龄相关疾病的因素。通过改变生活方式(例如饮食和体育活动)来改变昼夜节律,代表了促进健康老龄化和减少与衰老相关的活动能力下降的潜在策略。然而,目前直接评估线粒体功能的方法具有侵入性,通常需要肌肉活检,由于感知到的疼痛和风险,这可能会对参与者的招募和保留构成挑战。
通过侵入性较小的方法(例如采血)评估昼夜节律和代谢健康的标志物,将为未来研究中探索和测试治疗靶点提供有价值的结果。这些微创方法通过为昼夜节律和代谢健康之间的复杂相互作用及其对功能的影响提供新的见解,有可能极大地推动该领域的发展。本研究的目的是评估细胞能量代谢与昼夜节律之间的关系。特别是,生物能量通量分析用于评估各种底物可用性条件下的线粒体功能,以及参与者白细胞中一组昼夜节律基因的基因表达监测。通过采用生物能量和基因表达这两个分析分支,可以全面了解这两个基本过程之间的关系。
从昼夜节律的角度对这些时间序列数据进行统计分析,可以深入了解昼夜节律的强度、范围和时间。总之,基因表达分析、细胞生物能量学和生物体水平代谢测量的整合构成了一种新的创新方法,它将阐明人类能量代谢和昼夜节律之间的相互作用。
在一项初步研究中,我们检测到 PBMC 的 OCR 对脂肪酸利用限制的急性反应(注射肉碱棕榈酰转移酶 1a 的抑制剂依托莫西后)。这一发现表明,在来自这组特定参与者的 PBMC 中,在基础呼吸过程中可能依赖于脂肪酸作为能量底物。然而,最大呼吸作用没有受到影响,这表明替代能源,如葡萄糖和谷氨酰胺,可以补偿在高能量需求期间脂肪酸利用的减少。未来的研究应调查 a) PBMC 的生物能量学是否反映了全身能量学,以及 b) 限时进食等干预措施是否会影响能量底物偏好。
PBMC 的通量分析有几个关键步骤。首先,在评估实验样品之前,应通过确保每个孔内和每个板内的细胞连续均匀分布来优化细胞接种密度(每孔细胞数),应通过使用浓度 0、0.125、0.25、0.5、1.0 和 2.0 μM 运行浓度测试运行来优化最终的 FCCP 浓度, 并且,如果适用,应按照制造商的说明优化 Hoechst 33342 染色。其次,代谢数据与细胞参数的标准化对于实验之间数据的可比性至关重要。在本方案中,描述了使用 Hoechst 33342 染色细胞和细胞成像设备的通量分析仪测定结束后的细胞计数。如果没有合适的设备,可以采用其他归一化方法,例如每孔的总细胞蛋白或核 DNA 含量。与已提议的修改相比,协议中可以使用一个值得注意的修改。具体来说,与此处提出的两个试剂盒相比,可以使用三种抑制剂中每一种的单独检测试剂盒来完成该方案(参见 材料表)。
使用 PBMC 作为替代物来研究老年人能量代谢和昼夜节律之间的相互作用,受到以下假设的限制:它们对治疗的反应可以准确反映其他组织和器官的反应。虽然这种方法新颖且微创,但重要的是要承认不同的组织和器官,例如大脑、肝脏和骨骼肌,在不同条件下可能会有不同的反应。一项临床前研究表明,进食和禁食小鼠的时钟基因表达发生改变,导致肝脏和肌肉组织中 BMAL1 靶基因部分上调,但其他基因下调41。这些外周组织和器官高度代表代谢过程,并可能受到影响时钟基因表达机制的环境线索的影响42。需要进一步的研究来充分了解外周组织、器官和中央生物钟之间的关系。
另一个限制是参与者不会被取消服用任何处方的资格,这可能会对统计分析造成限制。为了抵消这一限制,在未来的研究中,将使用医疗清单,该清单已在服用药物的老年人群中得到验证43。参与者将根据方案数据审查部分中记录的推荐药物进行分类。就已证明可以加速功能下降、2) 减缓功能下降和 3) 影响骨骼肌功能的药物而言,共有三类。
最后,人体骨骼肌线粒体氧化能力确实表现出昼夜节律,在下午 06:00 至晚上 11:00 之间达到峰值,在上午 08:00 至上午 11:00 之间下降44。目前尚不清楚这是否适用于 PBMC 的线粒体氧化能力。然而,初步数据表明 PBMC 和线粒体代谢相关45。鉴于肌肉活检和 PBMC 改变的信息并不那么清楚,因此在分析结果时必须谨慎。鉴于这一限制,在评估和制定方案时牢记这些信息非常重要,因为它可能提供有价值的背景和见解,有助于确保方案的有效性和有效性。
据我们所知,之前没有研究通过本项目中提出的方法评估燃料利用模式或昼夜节律。我们的目标是检查线粒体燃料利用和昼夜节律健康标志物对变化的响应性。本研究提出了一种测量高灵敏度生物标志物的微创方法,可作为未来肌肉活检不可行的介入研究的替代方案。
披露声明
作者没有需要披露的利益冲突。
致谢
这项研究由美国老年人独立中心 (NIH/NIA P30AG028740) 资助,并得到了临床和转化科学研究所 (NIH/NCRR UL1TR000064) 的协助。
材料
| Name | Company | Catalog Number | Comments |
| Agilent Technologies Cell Imaging | Agilent Technologies | Cell image software | |
| Agilent/Seahorse Wave desktop program | Agilent Technologies | 5994-0039EN | Software used to analyse data from the celluar analyser and stress test assay |
| Agilent/Seahorse XFe96 Flux Analyzer | Agilent Technologies | S7800B | Real-time cellular flux analyzer; flux analyser |
| Bar Code Reader | Agilent Technologies | G2615-90007 | |
| Seahorse Wave Desktop Software | Agilent technologies | Data acquisition software; assay analysis; wave program | |
| Seahorse XF 1.0 M Glucose solution | Agilent Technologies | 103577-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 100 mM Pyruvate solution | Agilent Technologies | 103578-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 200 mM Glutamine solution | Agilent Technologies | 103579-100 | Supplement to basal medium to make assay medium |
| Seahorse XF Cell Mito Stress Test | Agilent Technologies | 103015-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF Mito Fuel Flex Test | Agilent Technologies | 103260-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF RPMI Medium | Agilent Technologies | 103576-100 | Basal medium for PBMCs |
| Seahorse XFe96 FluxPak mini | Agilent Technologies | 102601-100 | Sensor cartridges and cell culture microplates |
| Cytation 1 Cell Imaging Multi-Mode Reader | Agilent/BioTek | Multimode reader to image cells | |
| CPT Sodium Heparin Tube, 16 x 125 mm x 8.0 mL | Becton Dickinson | 362753 | Blood collection tubes for isolation of peripheral blood mononuclear cells |
| CellTak Cell and Tissue Adhesive | Corning | 354240 | Cell adherent to coat cell culture microplate |
| Phosphate Buffered Saline | Corning | 21-040-CV | Buffer to wash blood cells |
| Ficoll Paque Plus | Cytiva | GE17-1440-02 | Gradient medium |
| Lunar Prodigy DXA scanner | General Electric | EN 60601-2-7 5.1 | Whole body lean mass and fat/lean tissue mass ratio |
| Freezing container, Nalgene Mr. Frosty | MilliporeSigma | C1562 | Freezing container used to slow-freeze cell suspension |
| Buffer EL. | Qiagen | 79217 | Erythrocyte lysis buffer |
| Buffer RLT | Qiagen | 79216 | RNA lysis buffer |
| Buffer RPE | Qiagen | 1018013 | Mild washing buffer |
| Buffer RW1 | Qiagen | 1053394 | Stringent washing buffer |
| QIAamp DNA Micro Kit | Qiagen | 56304 | DNA preps: QIAamp MinElute Columns, Proteinase K, Carrier RNA, Buffers, Collection Tubes (2 ml) |
| QIAamp RNA Blood Mini Kit | Qiagen | 52304 | RNA blood kit; Used to isolate RNA |
| QIAshredder | Qiagen | 79656 | disposable cell-lysate homogenizers |
| RNase-Free DNase Set | Qiagen | 79254 | Used to perform DNA digest |
| 2-Mercaptoethanol (Reagent) | Thermo Fisher Scientific | MFCD00004890 | |
| 2-mL collection tubes, 100 count | Thermo Fisher Scientific | AM12480 | |
| Fast SYBR Green Master Mix | Thermo Fisher Scientific | 4385612 | Primers are added to this and used to carry out qRT-PCR |
| Microcentrifuge Tubes, 1.5 mL | Thermo Fisher Scientific | 69715 | Used to hold RNA purification filter during RNA purification |
| Narrow p1000 pipette tips | Thermo Fisher Scientific | 02-707-402 | |
| QuantStudio 3 Real-Time PCR System, MiniAmp Plus Thermal Cycler, and 96-Well Plates Package | Thermo Fisher Scientific | A40393 | |
| Tempus Blood RNA Tube | Thermo Fisher Scientific | 4342792 | RNA Tube |
| Tempus Spin RNA Isolation kit | Thermo Fisher Scientific | 4380204 | RNA extraction and isolation |
参考文献
- UN Department of Economic and Social Affairs. Population Division 2019, World Population Prospects. UN Department of Economic and Social Affairs. , (2019).
- Anton, S., Leeuwenburgh, C. Fasting or caloric restriction for healthy aging. Experimental Gerontology. 48 (10), 1003-1005 (2013).
- Dziechciaż, M., Filip, R. Biological psychological and social determinants of old age: Bio-psycho-social aspects of human aging. Annals of Agricultural and Environmental Medicine. 21 (4), 835-838 (2014).
- Anton, S. D., et al. Flipping the metabolic switch: understanding and applying the health benefits of fasting. Obesity. 26 (2), 254-268 (2018).
- Fried, L. P., Guralnik, J. M. Disability in older adults: evidence regarding significance, etiology, and risk. Journal of the American Geriatrics Society. 45 (1), 92-100 (1997).
- Manini, T. Development of physical disability in older adults. Current Aging Science. 4 (3), 184-191 (2011).
- Chung, H. Y., et al. Molecular inflammation: underpinnings of aging and age-related diseases. Ageing Research Reviews. 8 (1), 18-30 (2009).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Tarasov, A. I., Griffiths, E. J., Rutter, G. A. Regulation of ATP production by mitochondrial Ca2. Cell Calcium. 52 (1), 28-35 (2012).
- Chistiakov, D. A., Sobenin, I. A., Revin, V. V., Orekhov, A. N., Bobryshev, Y. V. Mitochondrial aging and age-related dysfunction of mitochondria. Biomed Research International. 2014, 238463 (2014).
- Boengler, K., Kosiol, M., Mayr, M., Schulz, R., Rohrbach, S. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue. Journal of Cachexia, Sarcopenia, and Muscle. 8 (3), 349-369 (2017).
- Drew, B., et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. American Journal of Physiology Regulatory, Integrative and Comparative Physiology. 284 (2), R474-R480 (2003).
- Short, K. R., et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proceedings of the National Academy of Sciences. 102 (15), 5618-5623 (2005).
- Musci, R. V., Hamilton, K. L., Miller, B. F. Targeting mitochondrial function and proteostasis to mitigate dynapenia. European Journal of Applied Physiology. 118 (1), 1-9 (2018).
- Picca, A., et al. Targeting mitochondrial quality control for treating sarcopenia: lessons from physical exercise. Expert Opinion on Therapeutic Targets. 23 (2), 153-160 (2019).
- Fernandez-Marcos, P. J., Auwerx, J. Regulation of PGC-1α, a nodal regulator of mitochondrial biogenesis. The American Journal of Clinical Nutrition. 93 (4), 884-890 (2011).
- Kim, Y., Triolo, M., Hood, D. A. Impact of aging and exercise on mitochondrial quality control in skeletal muscle. Oxidative Medicine and Cellular Longevity. 2017, 3165396 (2017).
- Wang, H., Hiatt, W. R., Barstow, T. J., Brass, E. P. Relationships between muscle mitochondrial DNA content, mitochondrial enzyme activity and oxidative capacity in man: alterations with disease. European Journal of Applied Physiology and Occupational Physiology. 80 (1), 22-27 (1999).
- Tian, Q., et al. Muscle mitochondrial energetics predicts mobility decline in well-functioning older adults: The baltimore longitudinal study of aging. Aging Cell. 21 (2), e13552 (2022).
- Sardon Puig, L., Valera-Alberni, M., Cantó, C., Pillon, N. J. Circadian rhythms and mitochondria: connecting the dots. Frontiers in Genetics. 9, 452 (2018).
- Gano, L. B., Patel, M., Rho, J. M. Ketogenic diets, mitochondria, and neurological diseases. Journal of Lipid Research. 55 (11), 2211-2228 (2014).
- Liesa, M., Shirihai, O. S. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metabolism. 17 (4), 491-506 (2013).
- Lesnefsky, E. J., Chen, Q., Hoppel, C. L. Mitochondrial metabolism in aging heart. Circulation Research. 118 (10), 1593-1611 (2016).
- Hartman, M. L., et al. Relation of mitochondrial oxygen consumption in peripheral blood mononuclear cells to vascular function in type 2 diabetes mellitus. Vascular Medicine. 19 (1), 67-74 (2014).
- Mahapatra, G., et al. Blood-based bioenergetic profiling is related to differences in brain morphology in African Americans with Type 2 diabetes. Clinical Science. 132 (23), 2509-2518 (2018).
- Moore-Ede, M. C. Physiology of the circadian timing system: predictive versus reactive homeostasis. The American Journal of Physiology. 250 (5), R737-R752 (1986).
- Young, M. W. Life's 24-hour clock: molecular control of circadian rhythms in animal cells. Trends in Biochemical Sciences. 25 (12), 601-606 (2000).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences. 101 (15), 5339-5346 (2004).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences. 111 (45), 16219-16224 (2014).
- de Goede, P., Wefers, J., Brombacher, E. C., Schrauwen, P., Kalsbeek, A. Circadian rhythms in mitochondrial respiration. Journal of Molecular Endocrinology. 60 (3), R115-R130 (2018).
- Hood, S., Amir, S. The aging clock: circadian rhythms and later life. The Journal of Clinical Investigation. 127 (2), 437-446 (2017).
- Sellix, M. T., et al. Aging differentially affects the re-entrainment response of central and peripheral circadian oscillators. The Journal of Neuroscience. 32 (46), 16193-16202 (2012).
- Sato, S., et al. Circadian reprogramming in the liver identifies metabolic pathways of aging. Cell. 170 (4), 664-677 (2017).
- Lundell, L. S., et al. et al. feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nature Communications. 11 (1), 4643 (2020).
- Perrin, L., et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle. eLife. 7, e34114 (2018).
- Gutierrez-Monreal, M. A., Harmsen, J. -. F., Schrauwen, P., Esser, K. A. Ticking for metabolic health: the skeletal-muscle clocks. Obesity. 28, S46-S54 (2020).
- Wolff, C. A., et al. Defining the age-dependent and tissue-specific circadian transcriptome in male mice. bioRxiv. 42 (1), 111982 (2023).
- Wilson, D., Breen, L., Lord, J. M., Sapey, E. The challenges of muscle biopsy in a community based geriatric population. BMC Research Notes. 11 (1), 830 (2018).
- Ding, H., et al. Likelihood-based tests for detecting circadian rhythmicity and differential circadian patterns in transcriptomic applications. Briefings in Bioinformatics. 22 (6), 224 (2021).
- Ding, Z., Lamb, T. M., Boukhris, A., Porter, R., Bell-Pedersen, D. Circadian clock control of translation initiation factor eIF2α activity requires eIF2γ-dependent recruitment of rhythmic PPP-1 phosphatase in Neurospora crassa. mBio. 12 (3), e00871 (2021).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Kalfalah, F., et al. Crosstalk of clock gene expression and autophagy in aging. Aging. 8 (9), 1876-1895 (2016).
- Psaty, B. M., et al. Assessing the use of medications in the elderly: methods and initial experience in the cardiovascular health study. Journal of Clinical Epidemiology. 45 (6), 683-692 (1992).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Molecular Metabolism. 5 (8), 635-645 (2016).
- Janssen, J. J. E., et al. Extracellular flux analyses reveal differences in mitochondrial PBMC metabolism between high-fit and low-fit females. American Journal of Physiology. Endocrinology and Metabolism. 322 (2), E141-E153 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。