Method Article
原代恒河猴B细胞的基因编辑
摘要
我们提出了一种使用CRISPR / Cas9和重组腺相关病毒血清型6培养和基因编辑原代恒河猴B细胞的方法,用于B细胞疗法的研究。
摘要
B细胞及其后代是高表达抗体的来源。它们的高蛋白表达能力、丰度、易于通过外周血 获得 以及简单过继转移的适应性,使其成为表达重组抗体或其他治疗性蛋白的基因编辑方法的有吸引力的靶标。小鼠和人类原代B细胞的基因编辑是有效的,用于 体内 研究的小鼠模型已经显示出希望,但迄今为止尚未证明大型动物模型的可行性和可扩展性。因此,我们开发了一种在 体外 编辑恒河猴原代B细胞的方案,以使此类研究成为可能。我们报告了使用CRISPR / Cas9对来自外周血单核细胞或脾细胞的原代恒河猴B细胞进行 体外 培养和基因编辑的条件。为了实现大型(<4.5 kb)盒的靶向整合,纳入了一种快速有效的方案,用于使用启用四环素的自沉默腺病毒辅助载体制备重组腺相关病毒血清型6作为同源性定向修复模板。这些协议能够研究恒河猴的前瞻性B细胞疗法。
引言
B细胞是体液免疫的基础。在被同源抗原和二级信号激活后,幼稚 B 细胞产生生发中心 B 细胞、记忆 B 细胞和浆细胞1。后者是分泌抗体的来源,这些抗体介导目前大多数可用疫苗的保护功能2。浆细胞被描述为抗体工厂,因为它们向血清中分泌大量抗体 - 约2 ng /天/细胞3,总计7-16 g / L血清,使抗体成为血清4中最丰富的三种蛋白质之一。B细胞在血液中含量丰富,因此可以很容易地获得并注入个体。
这些性状使B细胞成为细胞治疗工作的靶标,以基因编辑B细胞受体(BCR)并表达针对人类免疫缺陷病毒(HIV)的广泛中和抗体(bNAb)5,6,7,8,9,10,11,12,13,14,15和其他蛋白质16,17,18,19,20,21.这种方法在体内7,8,10,11,16,22的许多小鼠研究中显示出潜力。然而,临床转化仍然需要克服几个障碍9,15,23,其中包括治疗效果的安全性,持续时间和程度,以及扩展到更大的动物,如非人灵长类动物(NHP)。事实上,非人灵长类,特别是恒河猴,在抗体和HIV研究方面有着悠久的历史24,25,是测试这些参数的最合适模型。
在这里,我们开发了能够解决这些问题的协议。迄今为止,很少有研究试图在体外培养恒河猴B细胞,并且仅报道使用CD20进行正选择纯化恒河猴B细胞26,27,28。我们已经建立了一个方案,用于通过其他细胞类型的负消耗来分离未触及的恒河猴B细胞。此外,还定义了恒河猴B细胞靶向基因编辑的培养条件。该协议概述了使用CRISPR / Cas9核糖核蛋白(RNP)和重组腺相关病毒血清型6(rAAV6)作为同源定向修复模板(HDRT)来基因编辑培养的恒河猴B细胞。使用该协议,大(~1.5 kb)插入的编辑效率高达40%。我们还提出了一种快速且具有成本效益的方法来使用启用四环素的自沉默腺病毒辅助因子29来生产rAAV6,以快速测试这种格式的HDRT。综合起来,这些协议描述了恒河猴B细胞基因编辑的有效工作流程(图1),从而能够在NHP模型中评估B细胞疗法。
为了开始实验,可以从商业来源订购供体材料,或通过放血术或脾切除术获得。在这项研究中,使用抗凝剂EDTA进行静脉切除术和采血,如前所述30 次。为了获得脾脏,原代恒河猴B细胞,使用先前报道的技术进行了部分(25%-50%)或全脾切除术31。这些动物在手术前禁食过夜。简而言之,在手术过程中,腹部被夹住并用氯己定和70%异丙醇交替擦洗三次制备。在腹部切开一个切口(5-10厘米)以识别和隔离脾脏。脾脏的脉管系统用缝合线或血管夹结扎。切口用4-0 PDS聚二恶烷酮缝合线缝合两层。对单个动物进行了一次脾切除术。通过细胞过滤器浸渍从猕猴脾脏制备单细胞悬浮液。使用密度梯度离心法制备来自血液和脾细胞悬浮液的单核细胞并储存在液氮中。
研究方案
所有动物程序和实验均按照美国国立卫生研究院国家过敏和传染病研究所机构动物护理和使用委员会批准的协议进行。 图 1 总结了以下协议。2-8岁印度遗传起源的雄性和雌性恒河猴(Macaca mulatta)按照实验动物护理和使用委员会的指导方针在生物安全二级设施中饲养和照顾。
注意:所有实验均按照血源性 病原体的通用预防措施,在层流罩中使用无菌/无菌技术和适当的生物安全2级设备进行。
1. rAAV6生产
- 准备用于rAAV6生产的试剂。
- 使用标准技术在载体pAAV中AAV2的倒置末端重复序列(ITR)之间设计和克隆同源定向修复模板。确保两侧的同源臂至少为 ~250 bp,但只要 60 bp 就足够了,但如果结构设计允许,则首选更长的同源臂。如果HDRT中存在任何使用的sgRNA的靶序列,则使用沉默突变将其去除,这在靶位点的原间隔相邻基序或种子区域中最有效。
注意:可以进行基因合成与Gibson组装相结合以实现高效克隆32 。准备正确克隆的Maxiprep进行转染。对于sgRNA设计,建议使用CHOPCHOP33 ,更多工具的列表可以在 https://zlab.bio/guide-design-resources 中找到。包括 ITR 在内的 AAV 的最大封装容量为 ~4.7 kb。AAV6是编辑造血细胞,特别是B细胞最常用的血清型9。用于恒河猴B细胞基因编辑的AAV的其他血清型尚未经过测试,但AAV28 和AAV-DJ10,11 已用于小鼠研究。 - 根据表 1 和 表2制备293AAV培养基和生产培养基。通过 0.2 μm 聚醚砜 (PES) 膜过滤装置进行无菌过滤。储存在4°C。
- 制备 1x 聚乙烯亚胺 (PEI) 溶液(1 毫克/毫升,100 毫升)。
- 在250mL玻璃烧杯中,在微波炉中加热~70mL的H2O~30秒,然后加入100mgPEI。加入磁力搅拌器,搅拌至PEI大部分溶解。
- 用 1 M HCl 将 pH 值调节至 7,然后用 H2O 加至 100 mL,等待 10 分钟,再次检查 pH 值,必要时进行调整。
- 通过0.2μm PES膜过滤单元无菌过滤PEI溶液,等分试样,并储存-20°C。 解冻后,溶液可在4°C下储存长达2个月。
- 准备5x聚乙二醇(PEG)/NaCl溶液。
- 称取 400 克 PEG 8,000 和 24 克氯化钠。
- 将磁力搅拌器加入2L玻璃烧杯中,加入称出的PEG 8,000和NaCl,并用~550mL去离子水冲洗。
- 加热搅拌,煮沸或80-90°C直至完全溶解。
- 用1M NaOH将pH调节至~7.4,然后使用测量筒将体积调节至1L,并用磁力搅拌器将其转移到2L玻璃瓶中。
- 将瓶子,磁力搅拌器和溶液在121°C的水浴中高压灭菌30分钟。
- 高压灭菌后,在使用磁力搅拌器搅拌的同时,在冷室中冷却溶液,以防止分离成不同的相。必要时等分,并储存在4°C。
- 准备配方缓冲液。
- 将 500 mL DPBS 与 50 μL 10% 冥王星 F-68 混合。通过0.2μm PES膜过滤单元无菌过滤,并在室温(RT)下储存。
- 使用标准技术在载体pAAV中AAV2的倒置末端重复序列(ITR)之间设计和克隆同源定向修复模板。确保两侧的同源臂至少为 ~250 bp,但只要 60 bp 就足够了,但如果结构设计允许,则首选更长的同源臂。如果HDRT中存在任何使用的sgRNA的靶序列,则使用沉默突变将其去除,这在靶位点的原间隔相邻基序或种子区域中最有效。
- 用于 rAAV6 生产的细胞培养、转染和转导
- 按照制造商的说明,使用上述293AAV培养基和胰蛋白酶-EDTA进行解冻,培养和冷冻293AAV细胞进行分裂。建议冷冻一些早期传代,并在细胞达到第40代之前使用细胞进行AAV生产。
- 对于 rAAV6 生产,用 5 x 106 个细胞接种四个 15 cm 细胞培养皿,每个培养皿 30 mL。细胞通常在接种后1-2天达到80%-90%汇合时准备转染。
- 解冻含有HDRT的pAAV质粒Maxiprep,以包装成AAV6。将 85.6 μg pAAV 质粒重悬于 3 mL 纯 DMEM 培养基中。
- 将 342 μL 的 1 mg/mL PEI 溶液溶解在 3 mL 纯 DMEM 培养基中。将两种溶液在室温下孵育10分钟。
- 将两个 3 mL 管混合到一管 ~6.4 mL 转染混合物中,并在室温下孵育 20 分钟。
- 同时,在37°C水浴中解冻-80°C冰箱中的启用四环素的自沉默辅助载体RepCap6。为了转导293AAV细胞,使用中位组织培养感染剂量(TCID 50)并以25的感染多重性(MOI)添加辅助载体,并假设1.15 x10 7 个细胞/培养皿;通常,每 15 cm 培养皿使用 2-10 μL。轻轻摇晃并旋转盘子以分发。
- 转染混合物孵育后,在四个 15 cm 培养皿中逐滴加入 1.6 mL。在37°C和5%CO2 下孵育过夜。
注意:或者,如果感兴趣的rAAV6载体已经可用,则这些载体可用于提供要包装的病毒基因组,这消除了该系统对任何质粒的需求,并产生相当的rAAV6滴度。对于这种方法,293AAV细胞与所需的rAAV6共转导,MOI为50(基于rAAV6基因组拷贝[GC]/mL)以及辅助载体。 - 第二天,小心吸出并丢弃培养基,并用30 mL预热的生产培养基替换。收获前再孵育96小时。不建议进一步更换培养基以最大限度地提高产量。
- 从培养基中收获和纯化重组AAV6
- 在不从培养皿中移开细胞的情况下,将所有细胞上清液收集到具有0.2μm PES膜的过滤单元中,该膜至少比要过滤的培养基体积大50%。然后,过滤上清液。
注意:如果需要更高的rAAV6产量,则可以使用商业试剂盒或已建立的方案34,35收获细胞并从细胞沉淀中提取rAAV。由于AAV6主要分泌到培养基36中,因此仅使用上清液,从而减少了劳动力,成本和时间。 - 以收集体积的25%向过滤的上清液中加入5x PEG / NaCl溶液;如果使用四个 30 mL 的 15 cm 培养皿,则通常为 30 mL。
- 通过倒置充分混合,然后在4°C孵育过夜以沉淀病毒颗粒。
注意:AAV 颗粒在此溶液中可稳定长达 2 天。 - 将装有250mL管插件的平移式桶离心机预冷至4°C。 通过在室温下用 2 mL 10% Pluronic F-68 预处理每个膜至少 1 小时,制备具有 100 kDa 截止值的 4 mL 离心过滤单元和 0.22 μm 亲水性 PES 注射器过滤器。
- 将AAV-PEG / NaCl混合物转移到250mL管中,在4°C下以2,500× g 离心1小时,然后通过抽吸小心地除去整个上清液。
- 通过在 4 mL 的 1 M HEPES 中涡旋,将米色重悬至白色病毒沉淀,直到完全重悬。如有必要,静置5分钟,然后再次涡旋。使用 5 mL 血清移液器重悬,并将总体积转移到 15 mL 管中。
- 在通风橱中,向病毒悬浮液中加入等体积的氯仿 - 通常为 4 mL。
- 剧烈涡旋2分钟,然后在室温下以1,000×g离心5分钟。
- 将顶层(含AAV的上清液)收集在新的50 mL管中,并丢弃底层(氯仿)。
注意:含氯仿的溶液是危险废物。遵循机构准则进行处置。 - 将含AAV的上清液置于通风橱下,让剩余的氯仿蒸发30分钟。
- 同时,清洗预处理的离心过滤单元和注射器过滤器。
- 向预处理的离心过滤装置中加入 1.5 mL 配方缓冲液。在15°C下以3,500× g 离心10分钟,置于水平桶转子中。用 4 mL 配方缓冲液重复此步骤以洗涤膜。
- 使用 5 mL 注射器用 5 mL 配方缓冲液冲洗注射器过滤器两次。
- 将来自氯仿提取的~4 mL含AAV的上清液装入5 mL注射器中,连接洗涤后的注射器过滤器,并直接过滤到离心过滤单元中。
- 在15°C下以3,500× g 离心25分钟,然后确认过滤器中的AAV溶液在50-100μL之间。如果溶液体积为>100μL,请继续离心。
- 除去滤液后,在离心过滤单元的杯内加入4 mL配方缓冲液,并通过移液将溶液均匀混合。在15°C下以3,500× g 离心25分钟,然后确认过滤器中的AAV溶液在50-100μL之间。如果溶液体积为>100μL,请继续离心。重复此步骤进行另一次洗涤。
- 最终离心后,确认溶液体积为50-70μL;如果没有,请继续离心。将制剂转移到 1.5 mL 管中。如果需要,等分试样,并储存在-80°C。
- 在不从培养皿中移开细胞的情况下,将所有细胞上清液收集到具有0.2μm PES膜的过滤单元中,该膜至少比要过滤的培养基体积大50%。然后,过滤上清液。
- 通过qPCR测定重组AAV6滴度
注意:qPCR引物在ITR区域退火,因此应适用于克隆到pAAV中的所有构建体。- 解冻待滴定的rAAV6等分试样和AAV6参考物质的等分试样。AAV6 参考物质应接近 4 x 1011 GC/mL;否则,请相应地调整稀释度。
- 将 2.0 μL 样品或 AAV6 参考物质与 15.6 μL 无核酸酶 H 2 O、2.0μL 10x DNase I 缓冲液和 0.4 μL DNA 酶 I 混合,进行 DNase I 酶解,以去除 rAAV6 制备中任何剩余的游离质粒 DNA。
- 轻轻混合并在37°C下孵育30分钟,然后转移到冰上。这是稀释度1(见 表3)。
- 用水制备所有样品和AAV6参考物质的五倍系列稀释液,如下 表3 所示。
- 准备SYBR绿色qPCR预混液。每孔将 4.7 μL 无核酸酶水与 10 μL SYBR Green 预混液、0.15 μL ITR 引物在 100 μM 下向前混合,在 100 μM 下反向混合 0.15 μL ITR 引物。
注意:每个样品一式两份,参考标准品16孔,每个样品8孔,无模板对照2孔。多准备10%的预混液以解决移液错误。 - 在光学 96 孔或 384 孔反应板中,上样 15 μL/孔的 SYBR Green qPCR 预混液。
- 接下来,上样 5 μL 样品和 AAV6 参考物质或无核酸酶水用于无模板对照。对于AAV6参考标准,加载稀释液2至稀释液9。对于样品,上样稀释液5至稀释液8。一式两份测量每种稀释液。避免气泡。
- 用光学透明膜密封加载的板,在室温下以800× g 离心1分钟,然后用适当的96孔或384孔设置将板加载到qPCR仪器中。
- 使用SYBR检测设置并运行qPCR仪器,具有以下循环条件:98°C3分钟,然后40个98°C循环15秒和58°C30秒,然后是熔解曲线。
- 使用仪器软件分析数据,使用AAV6参考物质的基因组拷贝/毫米浓度(GC / mL)作为标准曲线(见 表3)。通过乘以稀释因子来计算样品的最终浓度。
- 确保标准曲线R2接近1.0,PCR效率为90%-110%,基线已去除,熔解曲线显示单个峰,C t值随稀释液变化,重复次数在0.5 Ct以内;否则,请排除异常值。预期收益率如图 2 所示。
2. 制备B细胞培养基和刺激物
- 准备解冻培养基:将RPMI-1640与20%食品接触物质混合。通过 0.2 μm PES 膜过滤单元进行无菌过滤。储存在4°C。
- 制备B细胞培养基:合并 表4中的试剂,然后通过0.2μm PES膜过滤单元进行无菌过滤。储存在4°C。
- 将 表5 中的每种B细胞兴奋剂以原液浓度重悬于B细胞培养基中,但CpG ODN除外,CpG ODN应重悬于无核酸酶水中。储存在-80°C。
- 如果进行非B细胞负耗竭(可选步骤4),则用2%FCS(DPBS 2%FCS)制备DPBS(无钙,无镁)。通过 0.2 μm PES 膜过滤单元进行无菌过滤。储存在4°C。
3. 恒河猴B细胞的制备与培养
注意:冷冻保存的恒河猴PBMC或脾细胞用于建立细胞培养物30,31。
- 在37°C水浴中预热解冻培养基和B细胞培养基。将 表5 中的B细胞兴奋剂在冰上解冻。
- 准备一个适当大小的管子,其中包含预热的解冻介质。理想情况下,这应该是解冻细胞体积的10倍以上。
- 在37°C水浴中一次解冻一到两个PBMC或脾细胞的冷冻管,并用预热的培养基倒入制备的管中。冲洗冷冻管以收集所有细胞。
- 在室温下以200× g 离心细胞10分钟。
注意:这些离心设置可减少血小板污染,同时保持PBMC产量。可以使用更高的速度,例如 350 x g 5 分钟。 - 将细胞重悬于10 mL解冻培养基中进行洗涤。
- 重复步骤3.4和步骤3.5,共三次离心以除去冷冻介质。最后一次离心后,将细胞以估计的~5 x 106 个细胞/ mL重悬于B细胞培养基中。
注意:上述方案培养整个PBMC或脾细胞制剂,并受到其他细胞的污染。如果需要更纯的B细胞培养物,尽管总B细胞产量显着降低,请继续步骤4。两种方法之间的编辑效率没有差异。 - 根据需要用 B 细胞培养基稀释 10 μL 细胞的等分试样进行计数。使用血细胞计数器和台盼蓝染色计数,将等体积的重悬细胞和台盼蓝0.4%溶液混合。
- 根据细胞计数,用B细胞培养基将细胞浓度调节至3 x 106 个细胞/ mL。然后,根据 表5将B细胞兴奋剂加入至其最终浓度,并混合。
- 将细胞转移到适当的细胞培养皿中。总体而言,建议使用 0.6 x 10 6-0.7 x 106 细胞/cm2。将细胞在37°C与5%CO2孵育48小时±2小时。
4. 非B细胞的可选负耗竭
注意:产量和纯度取决于PBMC中B细胞的输入百分比,在单个恒河猴27之间可能有很大差异。预计 80%-95% 纯度、60% 效率和 1 x 10 6-1.5 x 106 来自 1 x 107 PBMC 的 6 个电池。
- 最后一次洗涤(步骤3.6)后,将细胞重悬于DPBS 2%FCS中的1 x 108 细胞/ mL和人Fc块1:200稀释。细胞计数基于解冻细胞的数量。
- 在冰上孵育15分钟以阻断Fc受体,然后加入 表6中的生物素化抗体。在冰上再孵育20分钟。
- 用DPBS 2%FCS加满试管,并在4°C下以200× g 旋转10分钟。
- 将细胞重悬于DPBS 2%FCS中,为步骤4.1体积的80%(即,每1 x 107 个细胞80μL)。
- 将磁性链霉亲和素珠以步骤4.1体积的20%添加到细胞悬液中(即,每1 x 107 个细胞20μL磁珠)。
- 将细胞在冰上孵育15分钟,并偶尔搅拌。
- 同时,每1 x 108 个细胞,制备具有大型磁力耗尽柱和预分离过滤器的磁选机。通过重力流用 2 mL DPBS 2% FCS 冲洗预分离过滤器和色谱柱,并丢弃流通物。安装 15 mL 收集管。
注意:使用其他色谱柱(如正向选择柱或其他磁珠纯化系统)可能会大大降低纯度。 - 孵育后,如果体积为 <0.5 mL,则用 DPBS 2% FCS 将细胞加满至 0.5 mL。如果体积为 ≥0.5 mL,只需继续即可。
- 将细胞悬液装入制备柱上的预分离过滤器中,并将流出物收集到15 mL管中。
- 通过将 1 mL DPBS 2% FCS 加入预分离过滤器中,洗脱未结合的富集 B 细胞两次。通过重力流将未结合的细胞收集到同一管中。
注意:额外的洗脱可能会略微提高产量。纯度和效率可以通过输入细胞、富集细胞和保留在色谱柱上的细胞的流式细胞术来评估。要获得保留在色谱柱上的细胞,请从磁体上取下色谱柱,并使用提供的柱塞用3 mL DPBS 2% FCS冲洗。如果需要,使用表7中的试剂通过流式细胞术评估纯度,如图3所示。 - 将富集的B细胞在4°C下以200× g 离心10分钟。
- 将细胞以估计的~5 x 106 个细胞/ mL重悬于B细胞培养基中,并继续步骤3.7。
5. 原代恒河猴B细胞基因编辑
- 激活恒河猴B细胞48小时±2小时后,准备用于电穿孔和转导的试剂。
- 将DMSO、无核酸酶双链缓冲液、缓冲液T和缓冲液E(10 μL电穿孔试剂盒)或E2(100 μL电穿孔试剂盒)从电穿孔试剂盒预热至室温。
- 在冰上解冻 表5 中的rAAV6 HDRT和B细胞兴奋剂。
- 将 CRISPR-Cas9 sgRNA 重悬于 100 μM 的双链缓冲液中。在室温下复溶10分钟,并通过涡旋和轻弹混合。将重组的sgRNA放在冰上直到使用。储存在-80°C。
注意:CRISPR-Cas9 sgRNA可以使用各种在线工具进行设计(见1.1.1),并且其切割效率可能会有很大差异。建议使用 TIDE37 或 ICE38 等测定方法对切割效率进行实证测试。 - 每 10 μL 电穿孔,用表 5 中的所有兴奋剂制备 550 μL B 细胞培养基,并加入 1% DMSO。将体积放大 10 倍,用于 100 μL 电穿孔。可选地,可以在没有抗生素 - 抗真菌剂的情况下制备10%的该培养基,这略微增加了转染后的细胞活力。
- 每 10 μL 电穿孔,准备一个 48 孔细胞培养板的孔,其中含有 50 μL 含有兴奋剂且不含抗生素 - 抗真菌剂的 B 细胞培养基(如果使用)。对于 100 μL 电穿孔,将 500 μL 移液到 6 孔板的孔中。
- 将rAAV6 HDRT添加到孔中的培养基中,最高可达孔中体积的20%。根据每次转染的细胞数(10 μL 电穿孔:5 x 105 个细胞;100 μL 电穿孔:5 x 10 6 个细胞)和 rAAV6 制备中的 GC,瞄准 1 x 105-1 x 10 6 的 MOI。建议使用5 x 1013 GC/mL至5 x 1014 GC/mL的高rAAV6储备浓度,以在低体积下实现高MOI。
注意:较低的 MOI 可能会导致编辑效率降低,5 x 105 的 MOI 通常接近我们看到的最大编辑效率。尚未观察到不同MOI对B细胞活力的影响。建议包括不含rAAV6 HDRT、不进行RNP转染和不进行两者的对照。 - 通过将准备好的培养皿和剩余培养基转移到37°C的培养箱中,用5%CO2预热。
- 每 10 μL 电穿孔制备 1.15 μL 核糖核蛋白 (RNP):在双链缓冲液中将 0.4 μL 61 μM Cas9 与 0.75 μL 100 μM sgRNA 混合。由于移液错误,请额外准备(建议单次电穿孔多准备30%),并避免在加载电穿孔吸头时产生气泡。100 μL 吸头的刻度 10 倍。
- 在与细胞混合之前,将RNP在室温下孵育至少15分钟。孵育后,如果要同时靶向多个位点,则可以组合多个RNP。同时使用多达三个位点时,没有观察到效率的显着差异。
- 同时,准备细胞进行电穿孔。始终将细胞保持在室温下,以避免温度冲击。培养48小时±2小时后将细胞收获到适当的容器中。用DPBS冲洗培养皿以收集最大数量的细胞。
- 在室温下以200× g 离心细胞10分钟。 弃去上清液,并以~2 x 106 个细胞/ mL将细胞重悬于DPBS中。
- 将 10 μL 台盼蓝 0.4% 溶液与 10 μL 细胞悬液混合,并使用血细胞计数器计数。
注意:此时,由于收获和洗涤过程中的损失,预计约60%的细胞在48小时±2小时前放入培养中。 - 同时,在室温下以200× g 离心细胞10分钟。 弃去上清液,确保尽量减少任何剩余的DPBS。根据上述细胞计数,将细胞重悬于预热(RT)缓冲液T中,浓度为5.55 x 107 个细胞/mL。
- 通过打开机器并将其设置为1,350 V、15 ms和1脉冲来设置转染系统。将移液器站放在层流罩内
- 对于每组 10 次电穿孔,准备含有 3 mL 缓冲液 E(用于 10 μL 转染)或 E2(用于 100 μL 转染)的转染管。将试管插入移液器站。
- 每 10 μL 电穿孔,将 1.15 μL RNP 与 9 μL 细胞混合。确保有足够的体积(+30%),以避免将空气吸入电穿孔尖端。在电穿孔前在室温下孵育1-2分钟。
- 将 10 μL 或 100 μL RNP 和细胞混合物吸入电穿孔移液器上适当大小的电穿孔吸头中,将装载的移液器插入移液器站,然后开始电穿孔。确保吸头完全没有气泡,以防止电弧。在电穿孔过程中观察以验证没有发生电弧。
- 立即将电穿孔细胞喷射到48孔(10 μL转染)或6孔板(100 μL转染)内的制备的预热小体积培养基中,有或没有rAAV6。对剩余的样本重复步骤5.15-5.17。将对照样品不转染添加到培养孔中。
- 将细胞在37°C下用5%CO2 孵育4小时±2小时,然后加入含有兴奋剂,DMSO和抗生素/抗真菌剂的制备的预热B细胞培养基:450μL转染10μL转染或4.5mL转染100μL转染。
- 继续在37°C下用5%CO2 孵育12-24小时。然后,如果需要延长培养,将培养基更换为含有兴奋剂和不含DMSO的抗生素/抗真菌剂的B细胞培养基。基因组DNA的分析可以在24小时后进行。使用同源臂外的引物和插入片段内的引物进行数字微滴PCR可用于量化编辑效率39。进行PCR以扩增插入位点和Sanger测序以验证正确的编辑。
- 为了分析蛋白质水平,在电穿孔后将细胞培养40-48小时以允许蛋白质表达变化,并使用 表7中的试剂通过流式细胞术进行分析。
结果
使用启用四环素的自沉默腺病毒辅助剂生产rAAV6,平均产生4 x 1010 GC/mL细胞培养基,因此比使用标准的无辅助三重转染生产高出30-40倍(图2)。
恒河猴B细胞的可选纯化导致绝大多数CD3 + T细胞和CD14 +和/或CD16 +髓细胞的消除,常规获得80%-95%的CD20 + B细胞纯度(图3)。基于我们之前在鼠B细胞7中的设计,我们开发了一种编辑恒河猴B细胞B细胞受体特异性的方法,同时通过破坏其恒定区域来删除内源性抗体轻链,同时保持绝大多数B细胞中的等位基因排斥。我们构建了一个无启动子的HDRT,将其插入恒河猴B细胞的最后一个IGHJ基因和Eμ增强子之间的IGH位点(图4)。该构建体利用成熟B细胞中自然重排的上游VDJ区域的内源性VH启动子,因此不由游离体AAV基因组表达。此外,该构建体需要剪接到下游抗体重链常数区域以在细胞表面表达。因此,流式细胞术显示的细胞表面特异性抗原结合表明正确的靶位点整合,并且插入的序列是功能性的。
我们将这种编码抗体Ab1485(恒河猴衍生的抗HIVbNAb 40)的构建体包装到rAAV6中,并用它来编辑活化的原代恒河猴脾细胞或PBMC培养物,如上所述(图5A)。该方案保持高细胞活力(~90%),同时删除~80%B细胞中的轻链表达。大多数B细胞仍然表达同种型IgM(图5B)。添加编码 Ab1485 HDRT 的 rAAV6 导致 16%-21% 的 B 细胞中的基因编辑和 Ab1485 表面表达(图 5A),尽管抗体链的荧光强度低于未编辑的 B 细胞(图 5A 右图,图 5C)。 这可能是抗原染色剂与流式细胞术中用于检测表面BCR的单克隆细胞之间的表位竞争的结果,以及由于HDRT的多顺反子性质和剪接效率较低而导致的实际蛋白质表达降低。添加 1% DMSO 并使用 rAAV6 HDRT 进行扩展的浓缩孵育通常会提高编辑效率(图 6A-C)。使用这种特定方法(通常为 5%-20%,最高可达 40%),编辑效率取决于单个恒河猴(图 5A、图 6A-E)和 rAAV6 HDRT 批次的质量(图 6E)。 总体而言,我们提出了高效rAAV6生产以及恒河猴B细胞的培养,纯化和基因编辑的方案。
| 试剂 | 卷 | 股票 | 最终浓度 |
| DMEM, 高葡萄糖 | 500毫升 | 1 x | ~ 88.5% |
| 食品接触物质,热灭活 | 50毫升 | 1 x | ~ 8.85% |
| 抗生素/抗真菌药 | 5毫升 | 100 x | 1 x |
| 谷氨酰胺 | 5毫升 | 200 毫米 | 2 毫米米 |
| 丙酮酸钠 | 5毫升 | 100 毫米 | 1 毫米米 |
表1:293AAV细胞培养基。
| 试剂 | 卷 | 股票 | 最终浓度 |
| DMEM, 高葡萄糖 | 500毫升 | 1 x | ~ 95.2% |
| 食品接触物质,热灭活 | 10毫升 | 1 x | ~ 1.9% |
| 抗生素/抗真菌药 | 5毫升 | 100 x | 1 x |
| 谷氨酰胺 | 5毫升 | 200 毫米 | 2 毫米米 |
| 丙酮酸钠 | 5毫升 | 100 毫米 | 1 毫米米 |
表2:293AAV电池生产培养基。
| 稀释系列 | 样品体积(μL) | 稀释剂和体积 | 稀释因子 | 总稀释度 | 参考 AAV6 |
| 气相气/毫升 | |||||
| 稀释度 1 | 2 μL 样品或 AAV 参考标准品,4.1 x10 11 GC/mL | 18 μL 脱氧核糖核酸酶 I 缓冲液和酶 | 10 x | 10 x | 4.1 x10 10 |
| 稀释度 2 | 15 μL Dil. 1 | 60 μL H2O | 5 x | 50 倍 | 约8.2 x 109 |
| 稀释度 3 | 20 μL 二 | 80 μL H2O | 5 x | 250 x | 约1.6 x 109 |
| 稀释 4 | 20 μL Dil. 3 | 80 μL H2O | 5 x | 1250 x | 约3.3 x 108 |
| 稀释 5 | 20 μL Dil. 4 | 80 μL H2O | 5 x | 6250倍 | 约6.6 x 107 |
| 稀释度 6 | 20 μL Dil. 5 | 80 μL H2O | 5 x | 31250 x | 约1.3 x 107 |
| 稀释度 7 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 156250 x | 约2.6 x 106 |
| 稀释度 8 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 781250 x | 5.24 x 105 |
| 稀释度 9 | 20 μL Dil. 7 | 80 μL H2O | 5 x | 3906250 x | 1.05 x 105 |
表3:qPCR稀释表。
| 试剂 | 卷 | 股票 | 最终浓度 |
| RPMI-1640 | 420毫升 | 1 x | 84% |
| 食品接触物质,热灭活 | 50毫升 | 1 x | 10% |
| 抗生素/抗真菌药 | 5毫升 | 100 x | 1 x |
| 谷氨酰胺 | 5毫升 | 200 毫米 | 2 毫米米 |
| 丙酮酸钠 | 5毫升 | 100 毫米 | 1 毫米米 |
| 赫佩斯 | 5毫升 | 1 米 | 10 毫米 |
| 2-B-巯基乙醇 | 550 微升 | 55 毫米 | 55微米 |
| 非必需氨基酸 | 5毫升 | 100 x | 1 x |
| 胰岛素转铁蛋白硒 | 5毫升 | 100 x | 1 x |
表4:B细胞培养基。
| 试剂 | 稀释 | 股票 | 最终浓度 |
| 超级CD40L | 1:1000 | 100微克/毫升 | 100 纳克/毫升 |
| CpG ODN | 1:300 | 1毫克/毫升 | 3.33微克/毫升 |
| 人类巴夫 | 1:1000 | 40微克/毫升 | 40 纳克/毫升 |
| 人IL-2 | 1:1000 | 50微克/毫升 | 50 纳克/毫升 |
| 人类IL-10 | 1:1000 | 50微克/毫升 | 50 纳克/毫升 |
表5:B细胞兴奋剂。
| 抗体 | 克隆 | 稀释 | 最终会议 |
| 抗人类CD3 | FN-18 | 1:40 | 2.5微克/毫升 |
| 抗人类CD8a | RPA-T8 | 1:200 | 2.5微克/毫升 |
| 抗人类CD14 | M5E2 | 1:200 | 2.5微克/毫升 |
| 抗人类CD16 | 3G8 | 1:200 | 2.5微克/毫升 |
| 抗人类CD33 | AC104.3E3 | 1:50 | 1 次测试 |
| 抗人类CD64 | 10.1 | 1:800 | 0.625微克/毫升 |
| 抗人类CD66 | TET2 | 1:11 | 1 次测试 |
| 抗人类CD89 | 答59 | 1:800 | 0.625微克/毫升 |
表6:用于选择性去除非B细胞的抗体。
| 试剂 | 类型/克隆 | 工作稀释/浓缩 |
| 抗人类CD14亚历克萨荧光647 | M5E2 | 1:50 |
| 抗人类CD16亚历克萨荧光700 | 3G8 | 1:50 |
| 抗人类CD20 PECy7 | 2H7 | 1:50 |
| 抗人类CD3 PE | SP34-2 | 1:50 |
| 僵尸-近红外 | - | 1:500 |
| 抗人类 HLA-DR BV605 | L243 | 1:200 |
| 抗人类Ig轻链λAPC | MHL-38 | 1:50 |
| 反人类河童轻链 FITC | 多克隆 | 1:500 |
| 抗人类免疫球蛋白酶BV421 | MHM-88 | 1:50 |
| RC1抗原,随机生物素化 | - | 5 微克/毫升 |
| 链霉亲和素-PE | - | 1:500 |
表7:用于分析的流式细胞术试剂。
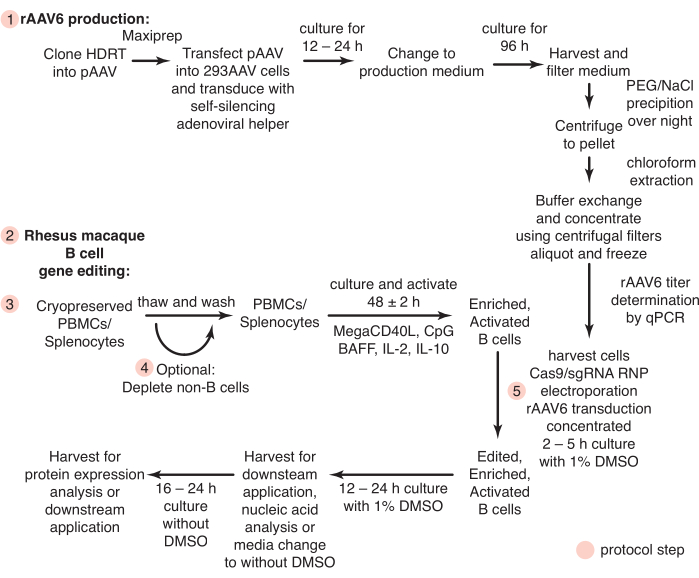
图1:rAAV6产生和原代恒河猴B细胞基因编辑的示意图。 协议分为rAAV6生产(步骤1)和恒河猴B细胞的基因编辑(步骤2-5),包括非B细胞消耗的可选步骤(步骤4)。协议中的步骤用红色圆圈表示。 请点击此处查看此图的大图。
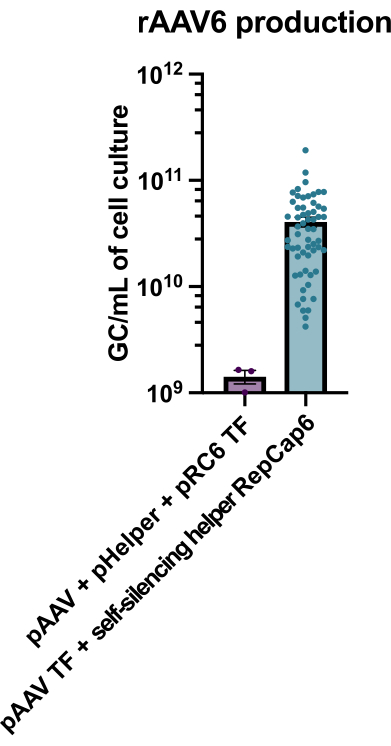
图 2:使用自沉默腺病毒辅助剂的高 rAAV6 产量。 rAAV6 是使用此处描述的方法(pAAV 转染 [TF] + 自沉默辅助 RepCap6、自沉默腺病毒辅助)或 pAAV、pHelper 和 pRepCap6 (pRC6) 的典型无辅助三重转染制备的。rAAV6仅从细胞上清液中纯化。如上所述,使用自沉默腺病毒辅助载体的方法产生的rAAV通过qPCR滴定率增加了30-40倍。每个点代表使用2到20个独立实验的各种pAAV构建体的单个rAAV生产。绘制 SEM ±平均值。请点击此处查看此图的大图。
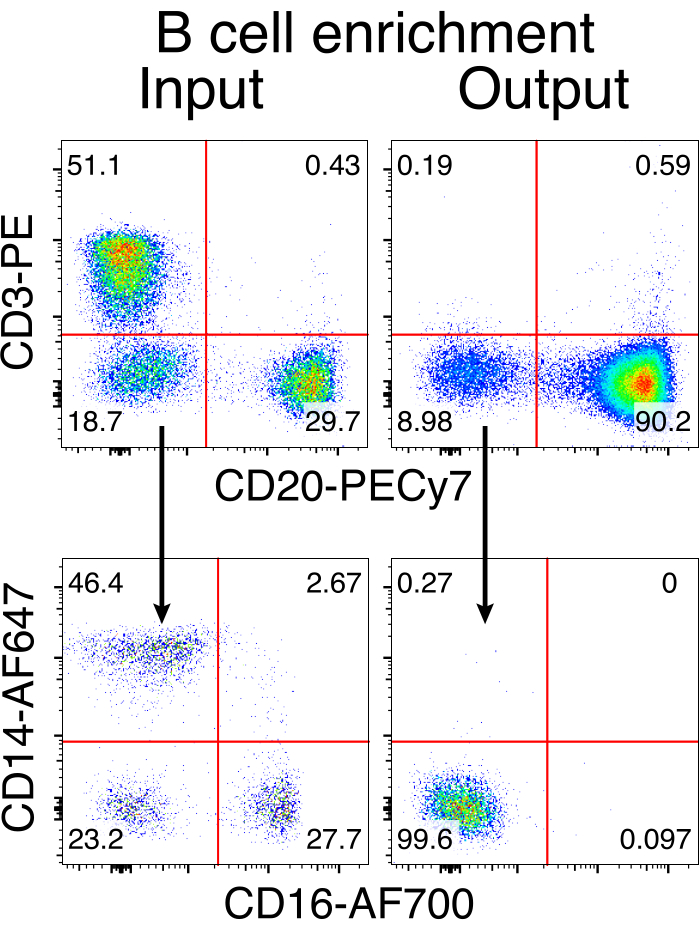
图3:非B细胞负耗竭的B细胞富集。 使用所述方案从PBMC富集恒河猴B细胞并富集至90%纯度。将显示预富集输入和富集后的输出。在现场,单线PBMC上设门。 五个独立实验的代表。 请点击此处查看此图的大图。
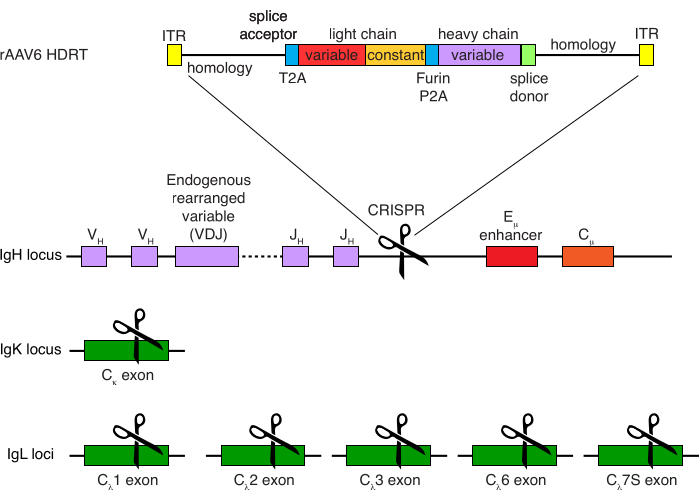
图 4:用于编辑恒河猴 B 细胞 B 细胞受体特异性的靶向策略。 rAAV6 被生产出来,其中包含所描绘的 HDRT。HDRT 由一个 266 bp 5' 同源臂组成,然后是 111 bp 的恒河猴 IGHM 外显子 1 剪接受体,然后是具有 Thosea asigna 病毒自裂解 2A 肽序列 (T2A) 的 GSG 接头,然后是先导序列和恒河猴抗体 Ab1485 的完整轻链,作为恒河猴 IGLC1。接下来是弗林切割位点、GSG 接头和猪特科病毒自裂解 2A 肽序列 (Furin-P2A),然后是另一个先导序列和 Ab1485 重链变量,然后是恒河猴 IGHJ4 剪接供体序列的 52 bp,以允许剪接到下游抗体重链恒定区域,以及 514 bp 同源臂。该构建体使用sgRNA靶序列GAGATGCCAGAGCAAACCAG靶向到最后一个IGHJ基因和Eμ增强子之间的IGH位点。两个同源臂都设计为在该sgRNA的切割位点结束,从而去除靶序列并实现最佳整合效率。同时,为了维持等位基因排除和单个B细胞受体的表达,我们使用靶向恒河猴IGKC的sgRNA删除内源性轻链,靶序列GGCGGGAAGAGAGAAGAGAGAGAGAGAGAGAGAGAGAGAGAGAGA和IGLC1,IGLC2,IGLC3,IGLC6和IGLC7S使用靶序列CTGATCAGTGACTTCTACCC。HDRT包括沉默突变,阻止该sgRNA切割IGLC1序列。 请点击此处查看此图的大图。
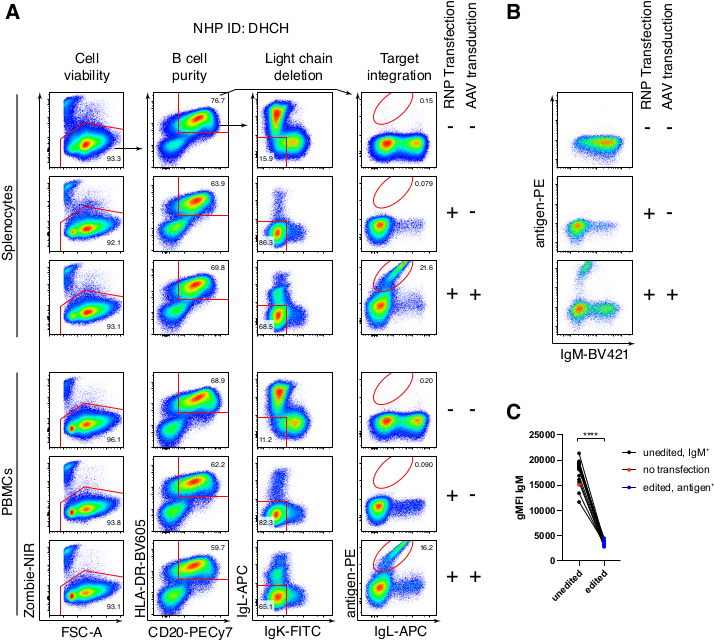
图5:原代恒河猴B细胞的基因编辑 。 (A)来自同一恒河猴的原代脾细胞(上图)或PBMC(下图)在不消耗非B细胞的情况下进行培养,并如上所述进行编辑。定位策略如图 4 所示。电穿孔两天后,收获细胞并进行表面染色以进行流式细胞术分析。左列在单重细胞上设门,然后对其他列进行门控,如顶行所示。细胞的活力、B 细胞的纯度、轻链的缺失效率以及 Ab1485 通过特异性抗原 RC141 染色的敲入效率在未处理、RNP 转染或 RNP 转染 + rAAV6 转导样品中均显示(MOI = 5 x 105)。代表来自不同恒河猴的细胞的六个独立实验。(B)培养的恒河猴B细胞对照或编辑后IgM表达,以及(C)IgM在B细胞上的几何平均荧光强度(gMFI),这些B细胞没有因IgLC和IgKC靶向(未编辑)或结合预期抗原的B细胞而失去Ig表达(编辑)。红点表示培养的未转染对照B细胞的gMFI。在配对 t 检验中指示 p < 0.0001。 请点击此处查看此图的大图。
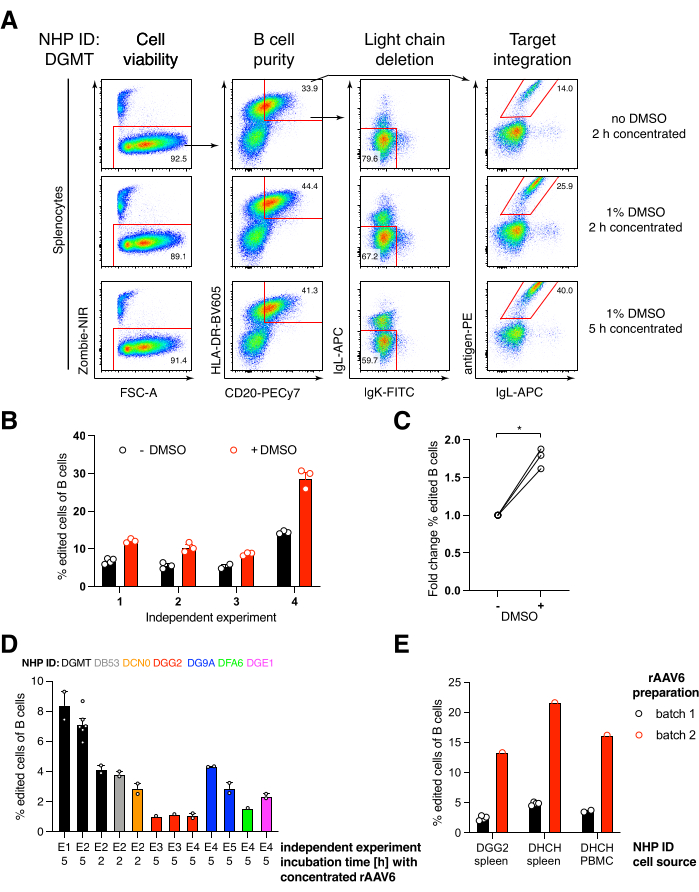
图 6:DMSO、使用 rAAV6 HDRT 长时间集中孵育、rAAV 批次质量和不同供体 NHP 之间的可重复性对原代恒河猴 B 细胞基因编辑效率的影响。 (A)脾细胞按描述进行培养和编辑。电穿孔后,将5 x 10 5个细胞在含有或不含有1% DMSO的培养基中培养,并在含有rAAV6 HDRT的50μL培养基中以5 x 105的MOI孵育2小时或5小时,然后加入另外450μL培养基。电穿孔后2天通过流式细胞术分析细胞,如图5所示。代表四个独立实验。(B)在四个独立实验中量化(A)。这些点表示转染设置为1,350 V、10-20 ms和1脉冲电穿孔持续时间和DMSO浓度范围为0.75%-1.25%的技术重复。(C)编辑效率的平均倍数变化(B)。* p > 0.05 在曼-惠特尼 U 检验中。(D)使用效率较低的商业rAAV6批次对不同猕猴进行独立实验的编辑效率。(E)在同一实验中使用两个不同的商业批次的rAAV6的编辑效率,其中相同的构建体被包装在两个不同非人灵长的B细胞中。这些点表示转染设置为1,350 V、10-20 ms和1脉冲电穿孔的技术重复。请点击此处查看此图的大图。
讨论
这里介绍的方案提供了一种快速有效的方法来产生高产量和滴度的rAAV6作为HDRT,以及体 外有效基因编辑原代恒河猴B细胞的新方法。
rAAV6生产方案相对简单快捷,允许同时生产和测试许多不同的结构,而无需过多的劳动。如果需要,rAAV6可以在缓冲液交换和浓缩之前使用已建立的方案进一步纯化,例如碘二醇梯度超速离心34 或水性两相分配35 。
虽然它降低了总产量,但我们选择仅使用血清减少的细胞培养基进行rAAV6纯化,而不是从细胞沉淀中纯化,因为大部分rAAV6被释放到培养基36中,并且从细胞沉淀中纯化会增加更多的成本和劳动力。使用自灭活腺病毒辅助剂将产量平均提高了30-40倍,允许在单个15厘米培养皿中测试包装成AAV6的结构。虽然我们的纯化方法是基本的,但使用这种方法,我们在使用各种细胞系或其他原代细胞转导后,在基因编辑效率或细胞活力方面获得的批次间差异相对较小(数据未显示)。
我们开发了一种恒河猴B细胞纯化方案,以利用不良群体的负消耗获得未触及的原代B细胞。虽然基因编辑这些细胞不是必需的,但它提供了一种获得相对纯净的原代恒河猴B细胞群的方法,用于其他细胞类型干扰实验目标的这种或其他应用。然而,纯度是以降低整体B细胞产量为代价的。值得注意的是,对于富集和未富集的B细胞培养物,初始PBMC或脾细胞制剂中B细胞的比例至关重要。特别是对于PBMC,我们建议为外周血中B细胞百分比高的个体筛选不同的猕猴,以获得大量的B细胞进行实验,因为该值在个体之间可能有很大差异27。PBMC可以通过常规出血或白细胞去除术获得42。
基因编辑方案导致有效的基因编辑,通常在60%-80%的敲除和5%-20%的敲入B细胞之间,尽管我们已经实现了高达90%的BCR敲除和40%的BCR敲入B细胞(图5 和 图6)。
恒河猴B细胞高效编辑的主要参数是sgRNA的切割效率、电穿孔参数、MOI和rAAV6制备的质量。候选sgRNA的切割效率应根据经验确定,以便对HDRT进行最佳编辑和设计。这里介绍的电穿孔参数平衡了效率和活力,以获得最大编辑B细胞总数,而不是编辑B细胞的最高百分比。如果需要更高百分比的编辑细胞,建议增加电压(高达1,750 V)或改变脉冲长度(10-30 ms),尽管可能会观察到更多的细胞死亡。我们还注意到,与来自同一个体的PBMC的B细胞相比,脾B细胞的编辑效率略高(图5);然而,其根本原因目前尚不清楚。
我们发现,电穿孔后添加1%的DMSO显着提高了恒河猴B细胞的基因编辑效率~40%,而不影响细胞活力(图6A-C),与其他细胞的报告一致43。然而,应避免在1%DMSO中进行扩展培养,这可能会影响细胞活力。如果需要,可以完全省略DMSO。
电穿孔数小时后与rAAV6一起以小体积培养细胞导致更高的编辑效率,这可能是由于rAAV6对HDRT的更好转导,因此,在Cas9活跃的相关时间HDRT的细胞内浓度更高。我们发现,以这种方式培养细胞长达8小时不会影响细胞活力,但编辑效率在5小时后没有显着提高(图6)。如果只需要敲除而不是敲入,则可以省略此步骤。
总之,我们提出了体 外 恒河猴B细胞基因编辑和有效敲入所需构建体所需的rAAV6 HDRT生产的综合方案。这些协议能够对包装为rAAV6的许多构建体进行快速,经济高效的测试,并能够在更相关的非人灵长类动物模型中对B细胞疗法的可行性和可扩展性进行临床前测试。
披露声明
没有宣布任何竞争利益。
致谢
我们要感谢Harry B. Gristick和Pamela Bjorkman提供RC1抗原,并感谢整个Nussenzweig和Martin实验室进行批判性讨论。这项工作得到了比尔和梅林达·盖茨基金会拨款INV-002777(致M.C.N.)和美国国立卫生研究院国家过敏和传染病研究所的校内研究计划的支持。(R.G.和M.A.M.)。M.C.N. 是一名 HHMI 调查员。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
参考文献
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. . Protein Electrophoresis - Serum., 6th edition. , 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850 (2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851 (2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995 (2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630 (2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934 (2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144 (2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973 (2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855 (2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182 (2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686 (2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991 (2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。