拟南芥的高分辨率、单粒、体内花粉水合生物测定
摘要
本文介绍了一种测量拟 南芥 花粉水合曲线的改进方法。新方法提供更高的分辨率,非侵入性,并且高度可重复。该协议代表了更精细地解剖调节授粉早期阶段的过程的新工具。
摘要
开花植物的有性繁殖需要花粉粒和柱头表面之间的初始相互作用,其中相互作用的伙伴之间建立了分子对话。对一系列物种的研究表明,一系列分子检查点调节花粉 - 柱头相互作用,以确保只有兼容的,通常是种内花粉才能成功实现受精。在具有“干柱头”的物种中,例如模式植物 拟南芥,授粉后的第一个合子前相容性检查点是花粉水合的建立。
授粉的这一阶段受到严格调节,来自花粉粒的信号从柱头释放出水分,从而允许花粉水合作用。随着时间的推移,准确测量和跟踪花粉水合作用的能力是设计旨在了解生殖中这一关键步骤的调节的实验的关键。已发表的方案经常使用已从亲本植物中切除的花朵,在液体或固体培养基上保持,并大量授粉。
本文描述了一种非侵入性的 体内 授粉生物测定,该测定允许以高分辨率对单个 拟南芥 花粉粒进行每分钟水合跟踪。该测定具有高度可重复性,能够检测花粉水合曲线的非常细微的变化,因此适用于分析影响调节授粉途径的突变体。尽管该协议比描述的批量授粉方案更长,但它提供的精度和可重复性以及其 体内 性质使其成为详细解剖授粉表型的理想选择。
引言
被子植物的成功有性繁殖通常依赖于种内花粉粒从花药转移到柱头,无论是在个体内部还是在个体之间(即授粉)。花粉粒向接受性花的这种转移通常是由传粉媒介或非生物因素介导的;因此,这也经常导致异种花粉在自然条件下的沉积。除了少数例外,异种花粉授粉的进展在进化上是不利的,通过失去交配机会来降低生殖适应性,大多数由此产生的杂交后代要么不能正常发育,要么是不育的1。因此,已经进化出阻止“不相容”异种花粉授粉的机制2。因此,快速识别相容的花粉可以说是许多开花植物有性生殖早期阶段最重要的过程。
在芸苔科家族中,柱头是“干燥”型的,一系列分子检查点在繁殖过程中的多个阶段起作用,调节授粉,因此只有相容的花粉才能成功。花粉水合作用是最重要的检查点之一(图1),因为无法水合的花粉不能进展产生花粉管并随后将精子输送给雌配子体。通常,不相容的谷物无法通过第一个授粉检查点,因此无法获得污名水3。在芸苔科的成员中,花粉的识别发生迅速,在花粉粒附着到雌蕊4,5的几分钟内就建立了相容性。近年来,已经取得了很大进展,我们现在开始了解调节关键授粉检查点的分子机制。
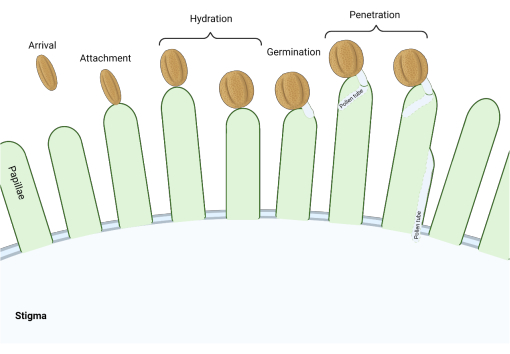
图1:相容授粉期间的关键事件概述。 这些阶段,如花粉水合和花粉管萌发,也是授粉“检查点”,必须成功导航才能实现相容的授粉。该图代表一种“干燥”型柱头,这是芸苔科物种的典型特征2,20。 请点击此处查看此图的大图。
对芸苔属自不相容性(SI)系统的开创性研究,其中“自”花粉被识别和排斥,建立了芸苔科6,7,8,9,10的花粉柱头识别范式。芸苔及其亲属中的SI由驻留在花粉表面和柱头质膜上的“识别”蛋白介导,在相互作用时导致花粉排斥。SI花粉排斥通过破坏基础花粉 - 柱头相容性系统起作用,当被相容花粉的感知完全激活时,导致柱头的靶向分泌,从而驱动花粉水合作用(有关花粉相容性机制的综述,请参阅11,12)。在SI的例子中,花粉携带的配体是一种富含半胱氨酸的小蛋白,富含S位点半胱氨酸(SCR/SP11),柱头受体是S位点受体激酶(SRK)。
最近,在 拟南芥中,另一组富含半胱氨酸的小花粉携带蛋白,花粉外壳蛋白B类(在PCP-Bs),被发现是通过激活花粉水合作用来接受花粉的重要调节因子13。最近也描述了 atPCP-B 的柱头受体和下游调节途径的各个方面14,15.有趣的是,编码花粉水合潜在花粉传播和柱头信号介质 (包括PCP-Bs)的基因的突变研究未能产生完全阻断花粉水合检查点的植物。这强烈表明,多种其他尚未发现的因素在花粉水合的调节中发挥作用。基于Wang等人首次描述的方法13,我们在这里描述了一种改进的高分辨率 体内 生物测定法,适用于鉴定候选突变拟 南芥 系中微妙的花粉水合缺陷。
研究方案
1.植物生长和花的准备
- 在4°C下将0.1%琼脂糖或无菌水分层A . thaliana 种子3天,或在-20°C下作为干燥种子16-24小时(uNASC,个人通信)。
- 将分层的种子转移到堆肥盆中,并放置在环境控制的生长室中。用荧光灯管(130μmolm-2 s-1)提供的16:8小时,光:暗光周期繁殖植物。将温度保持在21±2°C,相对湿度约为40%。
- 确保花粉供体和受体植物以及任何其他适当的“对照”植物系一起播种,以确保同步开花。将植物繁殖约6周,直到花序完全建立。
- 在进行阉割16,17的生物测定前1天在花粉受体植物上选择阶段12花蕾-这些是未开放的花蕾,将在第二天完成开花和花药裂开18。
注意:避免在主花序上产生的前三朵花,因为这些花通常表现出不寻常的繁殖行为。如果可用且适合研究,请使用雄性不育植物系,例如拟 南芥 (加入Col-0)pA9-barnase系,其中花药无法成熟19。 - 要阉割花粉接受者的花朵,请将植物侧放在花盆中。将植物茎在靠近将被阉割的花朵的区域粘在在立体解剖显微镜下就位的载玻片上。
- 使用一对细尖镊子,小心地挑开花蕾,去除所有花瓣和花药。确保雌蕊未损坏,柱头没有污染花粉。
注意:雄性不育植物系不需要阉割。 - 将植物放回生长室,确保阉割的花朵不会与其他植物或异物接触。
2. 花粉水合测定-原始数据采集
- 第二天早上,从生长室中取出植物。将花粉受体植物侧放,并将花放在倒置显微镜的载物台上(图2),以便可以清楚地对柱头进行成像。
- 通过使用遮蔽胶带将茎固定在载玻片上来固定要成像的花的位置。保持温度在18°C至25°C之间,相对湿度在60%以下。
注意:对于pA9-barnase雄性不育植物系,最好在早晨花朵开放且花瓣不妨碍视野时进行测定。 - 接下来,从花粉供体植物中取出一朵健康且刚开放的花。置于解剖显微镜下,轻轻触摸花药,在干净的细尖镊子的尖端收集一些花粉粒(图3A)。贴在短杆上的睫毛也是收集和转移花粉的有效工具(图3C)。
- 通过轻轻触摸从收获花粉粒的花瓣上来去除镊子中多余的花粉,直到在镊子的尖端形成单层花粉粒。
注意:细尖镊子尖端的单层花粉粒将显着促进后续步骤中的单粒转移。通过这种技术也可以在镊子上获得一个花粉粒(补充视频S1)。 - 返回花粉受体植物,并使用低倍物镜(例如,10倍物镜; 图3B),将倒置显微镜聚焦在要授粉的柱头上。
- 沿着镊子臂之间的开口握住镊子(图4),小心地接近未授粉(“处女”)柱头细胞。
注意:我们发现这种握住镊子的方法有助于灵活性并减少握手的影响。显微操纵器可用于经验不足或难以手动精确施用单个花粉粒的用户。 - 在镊子上选择适当位置的花粉粒以转移到柱头上。继续接近未授粉的柱头细胞,直到选定的花粉粒与其表面轻接触。慢慢抽出镊子并确认花粉附着(图5)。
注意:补充视频 S1 和补充视频 S2 演示了这一步骤,镊子上同时存在单个和多个花粉粒。 - 确保花粉粒的方向使其赤道轴清晰可见且聚焦清晰。立即切换到更高倍率的物镜(例如,20x)并捕获花粉粒的图像。第一个图像是 T = 0。继续以 1 分钟的间隔捕获更多图像,总共 10 分钟。
- 根据需要调整焦点,以适应花粉粒或柱头的微小移动。每2分钟记录一次房间的环境温度和相对湿度,以便将来在实验重复之间进行比较。
- 捕获所有图像后,将它们保存为无损格式,例如制造商的专有格式或TIFF。
注意:每个花粉粒采样将有11个图像(补充图S1)。大多数专有图像采集软件中的自动/手动延时采集设置是便于组织每个时间序列的有用功能。 - 对其他花粉粒重复步骤2.4至2.9。获取几乎相等数量的对照(野生型 [WT])和实验授粉的数据。

图2:用于花粉水合生物测定的设备设置。 在本例中,pA9-barnase雄性不育植物系是花粉受体。将植物放在花盆内,侧放,茎贴在显微镜载物台上的载玻片上。为了减少机械应力并帮助植物定位,使用可调节的平台来支撑花盆。 请点击此处查看此图的大图。
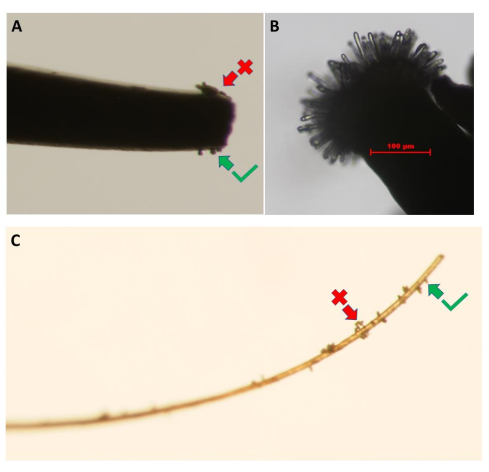
图3:从花粉供体花中收集花粉粒。 图像显示了(A)细尖镊子和(C)睫毛的使用。花粉团(红色箭头)应通过轻轻触摸供体花的花瓣来去除,直到获得单层花粉粒(绿色箭头)。(B)未授粉的拟 南芥 (Col-0)pA9-barnase雄性无菌系柱头的高分辨率图像,该柱头已达到花粉水合生物测定的适当发育阶段。比例尺 = 100 μm (B)。 请点击此处查看此图的大图。
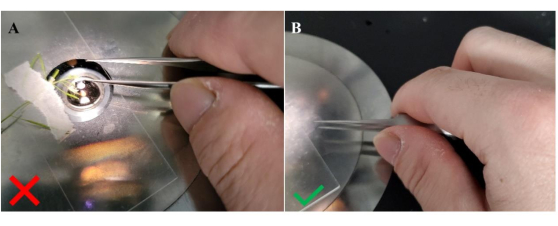
图4:将花粉转移到受体柱头时握住镊子的方法。 (A)握住镊子的方向不正确;(二)握住镊子的正确方向。在这种配置中侧向握住镊子,如拇指在镊子臂之间的位置所示,可提供更大的稳定性,以促进花粉粒转移到未授粉的柱头上。 请点击此处查看此图的大图。
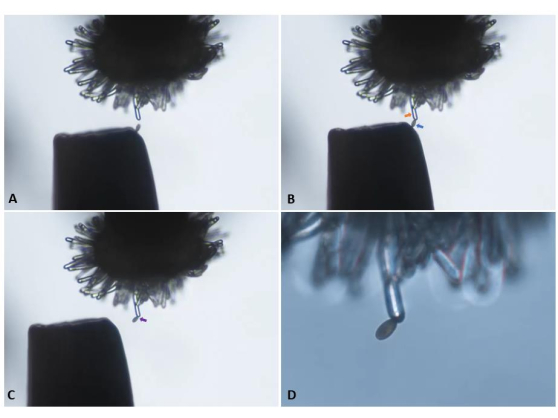
图5:将单个花粉粒从一对镊子的尖端转移到pA9-barnase雄性不育植物的未授粉(“处女”)柱头细胞。 (A)小心接近细胞。(B)将适当定位的花粉粒(蓝色箭头)附着在细胞(橙色箭头)上。(C)抽出镊子和目视确认花粉附着(紫色箭头)。面板A-C使用10倍物镜(10.5毫米工作距离;0.25数值孔径)成像,并且是从补充视频S1中呈现的视频剪辑中获得的快照。(D)过渡到20倍物镜(2.1毫米工作距离;0.5数值孔径),以启动时间序列中的图像捕获。请点击此处查看此图的大图。
3. 花粉水合测定-测量
- 将花粉水合速率定义为花粉粒(即赤道半径)的半短轴(图6)长度随时间的变化,并将其表示为百分比变化(等式[1]):
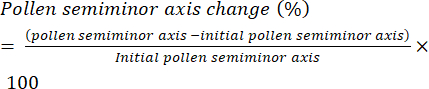 (1)
(1) - 使用图像分析软件,记录实验系列中每个花粉粒的半短轴值。
注意:此测量选项的名称取决于软件,例如“旋转椭圆”或“5点椭圆”。 - 对要测量的所有其他花粉粒重复步骤3.1-3.2。为了保持一致性,请应用相同程度的数字变焦和相同的方法来定义数据集中 所有 测量值的“花粉边界”。
- 完成时间序列的所有测量后,将每个图像堆栈的原始半短轴值导出到电子表格,并以每个图像堆栈的列形式显示数据。确保在每个植物品系的分析中包括至少15个水合花粉粒的数据(补充表S1)。
- 少量花粉粒未能水合或水合速度明显慢于预期的情况并不罕见。这些“哑弹”颗粒可能是谷物与细胞接触不良的结果,或与花粉活力有关。从数据集中查找并排除这些,除非在实验设计中需要这些。
- 计算每条植物线每个时间点的平均值。使用非配对 t 检验和单因子方差分析对每个时间点 WT 和突变线的水合数据进行统计分析。使用多重 t 检验同时比较多个时间点的 WT 和突变线之间的均值。
注意:XY图对于可视化所比较的植物系之间花粉水合的总体趋势也非常有用。
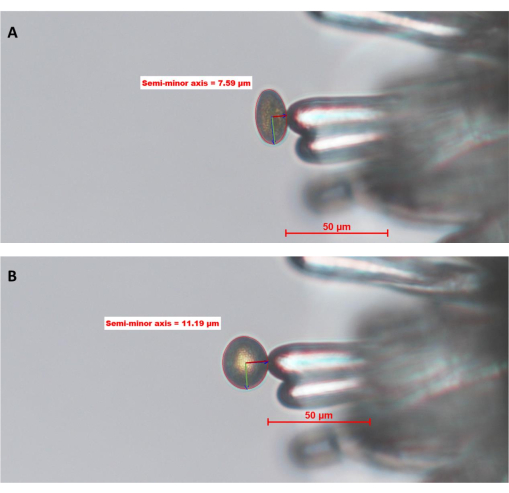
图 6:南 芥 柱柱状细胞上的 WT 花粉粒水合(Col-0; pA9-barnase 雄性不育系)。 (A) 时间点零点、0 (0 MAP) 和 (B) 10 MAP。花粉粒周围的红色圆圈是操作员使用图像分析软件定义和绘制的“花粉边界”。花粉内的绿色和深红色线分别代表半长轴和半短轴。半短轴的长度用于计算花粉的水合作用程度。该数据集的完整时间序列可在 补充图S1中找到。图像是用20倍物镜(工作距离2.1毫米;0.5数值孔径)拍摄的。比例尺 = 50 μm。缩写:MAP = 授粉后最小值。 请点击此处查看此图的大图。
结果
本节介绍了两组花粉水合数据示例,如上所述收集,用于 拟南芥。第一组数据由WT植物的花粉水合时间序列的三个重复组成,每个重复在不同的日期收集。每个重复包含不少于18个单独的花粉粒值,在所有三个重复中总共包含55个花粉粒。所有时间点的重复间均值的最小值和最大值均在3%以内(图7 和 补充表S1)。WT授粉的这些代表性数据清楚地表明,使用此处详述的方法可以获得高度的一致性,用于相对较少的样本数量和不同日期。
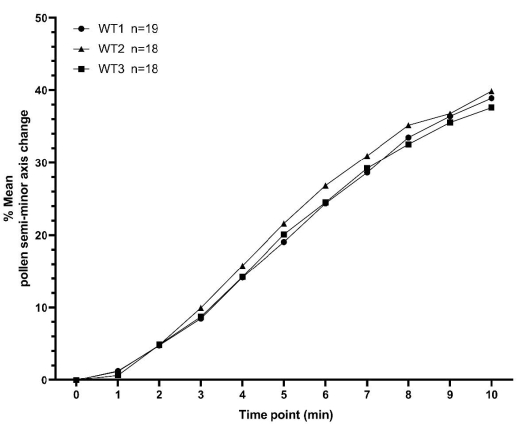
图 7:XY 图显示了拟南芥野生型花粉在 10 分钟内水合曲线的一致性。花粉亲本是拟南芥的Col-0加入,雌蕊亲本是pA9-barnase雄性不育拟南芥(Col-0)系。这些数据代表了在不同日期收集的三个独立数据集,并表现出高度的一致性。补充图S2提供了箱须图以及这些数据集均值的统计分析。每个独立数据集的测量花粉数量('n')显示在图上的语法(WT1/WT2/WT3)旁边。缩写:WT = 野生类型。请点击此处查看此图的大图。
第二组数据是在花粉外壳蛋白编码基因中携带T-DNA插入的植物系获得的,该基因产生“敲低”突变,此处称为“KD突变”。如协议中所述,将突变花粉沉积到pA9-barnase雄性无菌柱头上进行水合分析。从结果数据(图8)可以看出,突变体和WT花粉在前5分钟内具有难以区分的水合曲线。然而,授粉(MAP)后5-10 min,突变花粉的平均半短轴变化开始落后于WT花粉,差异在10 MAP时具有统计学意义。这一结果不仅表明这种花粉外壳蛋白在介导花粉水合作用方面发挥作用,而且还很好地说明了这种高分辨率单粒生物测定法在跟踪花粉水合作用方面的效用。在这个特殊的例子中,它的灵敏度能够检测到花粉外壳蛋白编码基因的“敲低”的微妙影响。
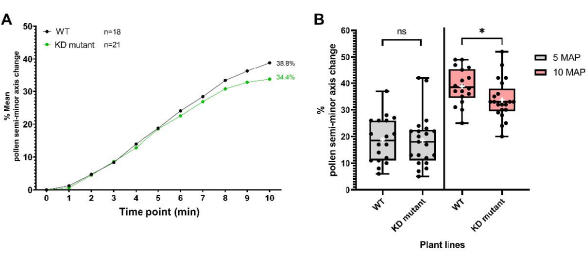
图 8:WT 和“敲低”花粉外壳蛋白突变系(KD 突变体)的 花粉水合曲线。 (A)WT和突变花粉在10分钟内的水合曲线。花粉亲本是 拟南芥 的Col-0加入和花粉外壳蛋白KD突变体(也在Col-0背景中)。在这两种情况下,雌蕊亲本都是pA9-barnase雄性不育拟 南芥 (Col-0)系。(B)箱形图和晶须图,显示WT和突变花粉数据集在5 MAP和10 MAP下的花粉水合程度(以半短轴的百分比变化表示)。晶须表示样品最小值和最大值。框表示数据集的下四分位数、中位数和上四分位数。白色叉号表示数据集的平均值。非配对 t检验分析表明,在10 MAP下,两种植物系的花粉水合平均百分比存在显著差异。一个星号表示 p < 0.05(未配对 t 检验)。缩写:WT = 野生类型;KD = 击倒;MAP = 授粉后最小值。 请点击此处查看此图的大图。
补充图S1:在pA9-barnase雄性不育植物的柱头细胞上水合WT花粉粒水化的裁剪花粉水合生物测定时间序列,持续10分钟。 图像以1分钟间隔拍摄。 图6 中使用了0 MAP和10 MAP的图像(单独附)。比例尺 = 50 μm。缩写:WT = 野生类型;MAP = 授粉后最小值。 请点击此处下载此文件。
补充图S2:箱须图,显示 图7中描述的三个WT花粉数据集在10分钟时间段内的花粉水合程度(以半短轴的百分比变化表示)。 雌蕊亲本是pA9-barnase雄性不育拟 南芥 (Col-0)系。晶须表示样品最小值和最大值。框表示数据集的下四分位数(下铰链)、中位数(中铰链)和上四分位数(上铰链)。将显示各个数据点。单因素方差分析显示,在10分钟时间段内,三个数据集之间花粉水合值的平均百分比在统计学上没有显着差异。显著阈值为 p < 0.05(单因子方差分析)。缩写:WT = 野生类型。 请点击此处下载此文件。
补充表S1:用于构建图7的原始花粉水合数据(拟南芥WT Col-0花粉在pA9-barnase雄性无菌柱头上)。请点击此处下载此文件。
补充视频S1:演示将一对镊子尖端的单个WT(Col-0种质)花粉粒转移到“原始”柱头细胞(pA9-barnase雄性无菌系)的视频。 为了方便视频的可访问性,故意降低了图像质量。 请点击此处下载此文件。
补充视频S2:演示单个WT(Col-0种质)花粉从一对镊子尖端的单层花粉粒转移到“原始”柱头细胞(pA9-barnase雄性不育系)的视频。 为了方便视频的可访问性,故意降低了图像质量。 请点击此处下载此文件。
讨论
对于开花植物来说,有性生殖的早期阶段可以说是最重要的。在花粉-柱头相互作用的水平上,做出分子决策,确定相互作用伙伴的“兼容性”。如果做出正确,这些决定可以避免可能影响生殖健康的资源浪费21.因此,只允许相容的花粉进行受精是维持适应性良好的基因型的重要组成部分,从而是物种进化成功的重要组成部分。用模式植物拟 南芥 进行的研究对于加深我们对这一过程的理解非常有价值。过去几十年的许多研究表明,花粉外套中存在一些因素,这些因素在第一个相容性“检查点”起作用,花粉可以进入柱头水,允许花粉水合作用13。尽管对调节花粉柱头相容性的机制有了初步的了解,但我们对这一过程的理解仍然存在许多差距。迄今为止,已知影响花粉水合作用的花粉携带配体或柱头受体的突变体不能完全阻断相容的授粉,这表明存在其他未发现的花粉水合决定因素。通过能够轻松观察感兴趣的表型,这里描述的花粉水合生物测定是研究调节授粉的潜在突变体的最直接技术之一。
测量花粉水合的现有方法通常利用批量授粉并报告较少的时间点14,22,23,因此可能会错过重要的微妙水合特征表型。例如,Wang等人的研究13,以及我们实验室中对其他花粉外壳蛋白突变体的研究(未发表的观察结果),揭示了突变体之间水合特征的有趣差异。这种微妙的差异可能为相容授粉背后的调节机制提供了重要线索。
这里描述的方法侧重于获取突变株系和WT植物系之间相对较少的测量值,重点是方法学精度以减少数据集内的变化。虽然这种方法具有高度可重复性(如图 7所示),但假设温度和湿度得到充分控制,重要的是在同一天收集几乎相等数量的WT和突变花粉的水合数据,以进一步减少变异的可能性。如果需要,可以在不同日期汇集数据。此外,选择合适的WT控制设备对于正确解释水合结果至关重要。对于花粉接受者,应使用相同的植物系来接收WT对照和突变花粉粒。
例如,在研究T-DNA花粉突变株系(例如 图8中描述的“KD”突变体)时,我们使用pA9-barnase雄性不育植物系(视频协议中也有特色)作为WT(对照)和突变(实验)花粉的花粉受体。应避免将来自这种不需要阉割的男性不育系的数据与从手动阉割的对照系收集的数据混合,因为这些柱头的行为可能会有所不同。同样,阉割的突变系应尽可能与阉割的WT(对照)系结合使用。在考虑所研究植物的遗传背景时,也应采取同样的谨慎措施。虽然大多数流行的T-DNA突变体集合是在Col-0背景中生成的,但其他收集,例如国家农艺研究所(INRA)的FLAG收集,可以在Wassilewskija(WS)遗传背景24,25中获得。在这种情况下,建议使用相应生态型的WT植物线作为对照。
虽然在这里我们专注于花粉 - 柱头相互作用的前10分钟的花粉水合作用,但这种方法也可以适应涵盖更长时间段的水合曲线。该方案的一个关键特征是花朵仍然附着在母体植物上 - 当前发表的方案通常需要切除雌蕊并放置在培养基中以在实验期间维持组织14,18,26。虽然没有直接证据表明这种半体内方法会影响花粉水合作用或确实改变该过程的体内调节,但可以想象,从亲本植物中切除花可能会影响授粉。因此,该协议为研究花粉 - 柱头相互作用实现了真正的体内环境,其中植物的结构完整性得以保留。
将单花粉粒转移到“原始”柱头可以说是本协议中描述的最具挑战性的手术之一。错误地转移花粉粒簇的情况并不少见。然而,通过确保镊子上仅存在单层花粉(图3A)(甚至仅存在单个花粉粒; 图5),和/或利用已经定向的花粉粒,使得它们从镊子尖端的其他花粉粒“突出”。我们发现,经验丰富的操作员可以在大约 3 分钟内成功完成将单个花粉转移到柱头细胞,并在 1 小时内记录多达五个花粉粒的数据。因此,在2-4天的时间内,可以积累足够的数据,对所研究的植物系进行有意义的统计分析。
人为错误可能是分析来自使用该协议的研究的数据集的最大变化来源。例如,图像分析过程中“花粉边界”的定义归结为个体研究人员的判断。因此,不同研究人员所做的测量,即使是在同一个数据集上,也有可能产生差异。在可能的情况下,应由一名研究人员进行测量,以尽量减少采样误差。此外,将同一操作员对WT和突变数据集的分析结合起来,否定了“花粉边界”和操作员间变异的潜在主观定义。
总之,描述了一种复杂而准确的方法来测量模式生物拟 南芥 中的花粉水合曲线。我们已经证明,通过利用该协议,可以很容易地获得拟 南芥 的高度一致的花粉水合数据。在不同日期获得的三批独立WT授粉数据显示,所有时间点的偏差一致,为<3%(图7 和 补充表S1)。尽管这里介绍的生物测定比大多数现有方案略复杂,但生成的数据的分辨率更高,适用于鉴定和表征影响调节相容授粉途径的新型突变体。
披露声明
作者没有利益冲突需要声明。
致谢
这项研究得到了巴斯大学(英国巴斯巴斯大学,BA2 7AY)Y.-L.L.研究生奖学金的支持。和 L.W. 图 1 是用 BioRender.com (https://biorender.com/) 创建的。
材料
| Name | Company | Catalog Number | Comments |
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
参考文献
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O'Malley, R. C., Barragan, C. C., Ecker, J. R. A user's guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。