Method Article
筛分果肉以检测田间未成熟的破蝇果蝇
摘要
在田间增加对未成熟果蝇的检测可以引发及时的努力,以消除这些破坏性害虫的种群。与手工切割和目视检查相比,将寄主水果糊在袋子中并将果肉通过一系列筛子时,检测晚龄幼虫更快、更准确。
摘要
Tephritidae家族的果蝇是世界上最具破坏性和入侵性的农业害虫之一。许多国家开展了昂贵的根除计划,以消除初期人口。在根除计划期间,将齐心协力检测幼虫,因为这强烈表明繁殖种群并有助于确定感染的空间范围。发现未成熟的生命阶段会触发额外的控制和监管行动,以遏制和防止害虫的任何进一步传播。传统上,幼虫检测是通过切割单个寄主果实并目视检查来完成的。这种方法是劳动密集型的,因为只能加工有限数量的水果,并且错过幼虫的可能性很高。测试了一种提取技术,该技术结合了i)在塑料袋中糊状的宿主水果,ii)通过一系列筛子过滤果肉,iii)将保留的果肉放入红糖水溶液中,以及iv)收集漂浮到表面的幼虫。该方法在佛罗里达州进行了评估,使用由 Anastrepha suspensa自然感染的现场收集的番石榴。为了模仿更能代表果蝇根除计划的低种群,夏威夷的芒果和木瓜被已知数量的少量 背蝇幼 虫感染。该方法的适用性在被 背蝇芽孢杆菌 自然感染的番石榴上进行了现场测试,以评估该方法在紧急果蝇计划期间工人经历的条件下。在田间和实验室试验中,糊化和筛分果肉比切割水果更有效(需要更少的时间)和更敏感(发现更多的幼虫)。将果肉漂浮在红糖水溶液中有助于检测早期的龄幼虫。对重要绒毛蚴宿主的果肉进行捣碎和筛分可能会增加在紧急项目期间检测到幼虫的可能性。
引言
蝇果蝇是最具破坏性的农业害虫之一,其中蝇属、芽蝇属和蝇属的风险最大1。许多地区处于外来果蝇建立的高风险中,基于1)历史入侵和相关划界和根除计划,2)果蝇寄主材料到达入境口岸的高到达率,以及3)有利于建立繁殖种群的气候条件。加利福尼亚州每年经历多次入侵和发现火山灰炎2。在过去的一个世纪里,全球已经有200多次针对火山炎的入侵和根除计划,近几十年来这一过程显着加速3。尽管这些计划中的绝大多数都成功地消灭了入侵的果蝇3,4,但这些入侵的经济和环境负担仍然很高,并且建立的可能性始终存在;最近的一个灾难性例子是非洲大陆背侧芽孢杆菌感染5。
在紧急果蝇计划期间,将齐心协力地检测和控制入侵物种的繁殖种群。例如,佛罗里达州对绒毛虫入侵的反应是施用土壤淋水(在果实寄主植物的滴灌线下),并在发现交配雌性和/或幼虫的地点周围200米半径内去除寄主果实6。这些行动和策略有助于杀死土壤中的幼虫和蛹,并从该地区的水果中去除任何卵和幼虫。在一些根除计划中,大量的寄主果实被去除。2015年,在佛罗里达州6的背 背双歧杆菌 根除计划中,超过100,000公斤的水果被摧毁。据估计,仅在隔离区,种植者和相关行业的经济损失就超过1070万美元7。
为了在检疫区发现蝇科幼虫,一小队昆虫学家在雌蝇检测区周围200米半径内收集寄主果实,并切割并目视检查每个果实的幼虫6。由于人力资源有限,可能拥有数百个宿主,这项任务变得困难,特别是在商业生产区和住宅场的植物多样性很高的地区。此外,切割寄主果实时可能会漏掉幼虫。在一项评估入境口岸水果切割的研究中,发现与将受感染的水果保持数周并计算化蛹基质中发现的幼虫和蛹相比,切割水果在检测悬念A. suspensa方面没有那么有效8。
有水果切割的替代品来检测感染 9,10,11,12,13。例如,红糖漂浮法和热水法都是用于检测收获樱桃中西方樱桃果蝇的公认程序9,10。红糖法包括将压碎的水果放入糖水溶液中并收集漂浮到顶部的幼虫。红糖漂浮法是专门为满足出口樱桃的监管规则而开发的,这些规则要求包装厂监测检疫果蝇害虫。还有一个经批准的美国-加拿大蓝莓认证计划,包括红糖水漂浮、盐水漂浮或煮沸以支持植物检疫14。在测试糖和热水漂浮的准确性时,研究人员使用筛分方法来确定遗漏了多少幼虫9,10,11,12,13。一项研究表明,将压碎的蓝莓混合在盐溶液中并通过可重复使用的咖啡过滤器过滤溶液在检测铃木果蝇幼虫方面比目视检查盐和糖溶液表面要好四倍14。此外,气相色谱法用于检测柑橘15中的悬蚴幼虫。这些方法尚未在实地调查中检验其适用性。
我们的目标是开发和测试一种使用筛分和糖水漂浮在田间发现蝾螈幼虫的方法。与传统的水果切割方法相比,这种方法可以更有效地检测未成熟的果蝇,支持在果蝇根除计划期间及时控制繁殖种群。
研究方案
1. 水果选择
- 确定要调查的区域有哪些水果可用。
- 根据目标蜥蜴属的已知宿主列表选择寄主果实。
- 选择软肉、成熟的水果,如芒果、木瓜和番石榴。未成熟或坚硬的果肉水果,如热带杏仁,应使用不同的方法进行检查,例如水果切割。
- 选择掉落、过熟的水果或有损坏迹象、产卵疤痕和软点的树上的成熟水果。
- 一次处理大约 2 L 水果(例如,5 个番石榴或 5 个中等大小的芒果构成了此方法的足够样品)。一次可以加工的水果数量取决于水果的大小(图1A)。
2. 糊涂
- 将水果切成大块,放入4 L拉链锁储物袋中(图1B)。
- 向袋中加水,直到水覆盖切碎的水果25-50毫米(图1C)。
- 用手轻轻挤压水果,直到所有果肉从果皮上脱落并具有光滑的稠度(即没有大块)(图1D)。
3.筛分晚龄收集
- 堆叠筛子。使用大筛(直径457毫米)处理大量水果(一次~5个水果),使用较小的筛子(直径305毫米)处理单个水果或较小的样品(<5个水果)。
- 将筛子与大网(8号;2.36毫米)筛子堆叠在小网(20号;0.85毫米)筛子上。为了检测早期幼虫,在堆栈底部放置第三个筛子(No. 45; 0.35 mm)(图1E)。
- 将纸浆倒入顶筛中(图1F)。
- 使用水龙头,软管或瓶子中的水通过筛子堆彻底清洗纸浆,直到细纸浆通过筛子(图1G)。
- 目视扫描顶部筛子,寻找可能与果皮或任何大块水果一起保留的晚龄幼虫(图1H)。
- 仔细检查第二个筛子是否有晚龄幼虫。对于大量的细纸浆,可能需要额外的冲洗。
- 用幼虫镊子从筛子中收集幼虫,并将它们放入含有70%EtOH的小瓶中。
4. 糖浮解,用于早期摄入
- 通过将 453 g(1 盒)深红糖溶解在 2 L 自来水中来预混合糖溶液,产生 19°10 的白利糖度读数。
- 用自来水将纸浆从较细的网筛(例如20号和45号)清洗到筛子的边缘,然后将材料移动到塑料盘(11升)中。
- 加入红糖溶液,直到它覆盖果肉25-50毫米,然后加入2滴消泡剂。让果肉在红糖溶液中静置约5分钟。
- 用幼虫镊子收集漂浮到溶液表面的幼虫,放入含有70%EtOH的小瓶中。
5. 幼虫管理
- 在小瓶上贴上收集位置、日期、水果类型和收集器,以便以后检查和识别。
结果
早龄和 晚龄 从 田间采集的果实中提取
在这个实验中,我们比较了水果切割和捣碎,筛分和漂浮(MSF)方法在检测到幼虫的比例和检测它们所需的平均时间方面。番石榴受到 Anastrepha suspensa幼虫的高度感染,是从位于佛罗里达州霍姆斯特德的佛罗里达大学食品和农业科学研究所,热带研究和教育中心的植物中收集的。将果实随机分为5组,并分配到2种幼虫提取方法中的1种:1)手工切割或2)MSF方法。记录使用每种提取方法收集所有肉眼可见的幼虫的时间。
手工切割方法遵循了根除计划目前使用的方法。5名工人(n = 5)中的每一个被分配5个水果,通过将水果切成小块并目视检查果肉来搜索幼虫的所有阶段。为了确定目视检查中是否遗漏了幼虫,使用解剖显微镜(10x)重新检查手工切割的果块。
对于MSF方法,将5个水果切成大块(50-80厘米),放入拉链袋中,用手轻轻挤压,直到所有果肉从果皮中脱落并且果有光滑的稠度(即没有大块)。糊状水果通过一系列大(45.7厘米)黄铜筛过滤。最大的网眼(8号)堆放在顶部,其次是20号和45号筛。负责此处理的工作人员使用连接到水槽水龙头的软管中的水通过网状清洗纸浆。晚龄幼虫在筛子中很明显。较小的幼龄与果肉混合,使其难以看到和去除。因此,将筛子中的纸浆/幼虫混合物放入装有1L红糖水溶液的桶中。幼虫立即浮出水面。轻轻搅拌溶液,5分钟后,从桶中取出幼虫并计数。处理水果的时间是糊化,筛分和从糖水溶液中去除幼虫的组合。使用Kruskal-Wallis非参数检验(p = 0.05)16分析通过手工切割或筛分和漂浮方法发现的幼虫数量数据。
与手工切割相比,MSF方法产生更多的幼虫(图2A)和每分钟更多的幼虫(图2B)。虽然在这项研究中没有量化对不同龄的检测,但我们观察到所有龄(第一、第二和第三)都是用筛子发现的,而只有后来的龄人(第二和第三)是用手切发现的。当用解剖显微镜镜重新检查先前切割和目视检查的样品时,40%的晚龄幼虫感染了果实。然而,早期的幼崽主要是在重新检查时发现的。
本实验表明,使用MSF方法在高度受感染的水果中寻找幼虫更有效和高效。然而,在根除计划中更有可能遇到幼虫数量较少的水果,其中入侵物种非常罕见。因此,我们进行了一项实验室研究,其中宿主果实被已知数量的少量幼虫感染。
手动侵扰芒果和木瓜以模拟背 侧芽孢杆菌 侵扰
该实验比较了水果切割和无国界医生方法在检测到幼虫的比例以及感染相对较低时检测它们所需的时间。人工感染被用作评估每种方法功效的实验工具,因为存在的幼虫数量是确定的。
使用软木螟(直径1.0厘米)在单个芒果和木瓜果实上打5个孔,这些果实没有果蝇幼虫。将单个晚二至初三龄背 芽孢杆菌 幼虫放入果实子子集的5个孔中的每一个孔中。使用从果实上钻出的碎片盖住孔,其余果实在不插入幼虫的情况下盖上,以直观地模拟人工侵扰。将果实在27°C下保持48小时,以允许幼虫发育。该实验在夏威夷岛希洛的ARS实验室(n = 5名工人)和夏威夷瓦胡岛的APHIS-PPQ实验室(n = 4名工人)进行。
为了切果,每个工人被给予5个芒果(1个被1个幼虫感染,4个没有被感染)和4个木瓜(一个被感染,3个没有被感染)。一名工人将每个水果单独切成越来越小的块,并不断检查果肉是否有任何未成熟的果蝇。当对纸浆进行彻底检查后,搜索停止了。记录发现的幼虫总数以及每个工人通过切割处理所有果实所花费的时间(图3)和(图4)。
每个工人都收到了另一组类似的水果(5个芒果和4个木瓜)用于糊状或筛分(不涉及水果切割),如前所述,有2块被感染。将纸浆倒入顶筛中,并使用水龙头中的水冲洗筛子堆并去除幼虫,如协议中所述。该实验进行了两次,有糖漂浮和没有糖漂浮,以确定去除漂浮步骤是否会在不失去灵敏度的情况下提高过程的速度(即,发现所有或大多数幼虫)(图3)。记录发现的幼虫数量以及每个工人通过切割,MSF或MS方法处理果实所花费的时间。
对于芒果和木瓜,全MSF方法(包括漂浮)导致更多的幼虫检测,并且比水果切割更快(表1)。使用传统水果切割方法的工人分别错过了芒果和木瓜中的32%和35%的幼虫(表1)。使用MSF技术加工散装水果所需的时间比切割单个芒果的时间少30%,比切割单个木瓜的时间少35%(图3)。与水果切割方法相比,使用MSF方法对木瓜(图3C)和芒果(图3D)每分钟发现更多的幼虫。所有发现的幼虫都是活的。
幼虫形态学鉴定仅适用于晚龄。我们重复上述实验,但省略了漂浮程序,以确定幼虫的恢复率是否保持高水平,果实加工速度是否提高。与切割和目视检查相比,MS方法(省略浮选)导致木瓜(图4A)和芒果(图4B)的幼虫检测更多。此外,该技术比切割和目视检查木瓜(图4C)和芒果(图4D)更快。从MSF方法中去除漂浮步骤可将木瓜发现晚龄幼虫的时间缩短了90%,芒果减少了48%(表2)。两种方法的幼虫百分比都很高,MS的发现幼虫百分比始终较高(省略漂浮)。对于木瓜,分别从MSF和MS方法中回收了80%和85%的幼虫(表1 和 表2)。对于芒果,MSF和MS方法分别回收了88%和95%(表1 和 表2)。
水果切割和MSF方法的现场比较
该实验的目的是比较田间条件下的水果切割和MSF方法,模仿紧急果蝇计划。水果加工是在没有实验室的便利和基础设施的情况下进行的,以测试两种幼虫提取方法的田间准备情况。工作是在位于希洛附近的USDA-ARS热带植物遗传资源和疾病研究单位种质的番石榴园进行的。共收集了40只有侵扰迹象的番石榴,并分为2组。总共对20个番石榴进行了切割/目视检查,然后进行了MSF(包括漂浮),从而可以评估切割方法与MSF方法相比的灵敏度。解剖按上述方式进行。检测到后,取出幼虫并计数。四名工人每人解剖5个番石榴,并记录了每个工人切割和检查所需的时间。切割后MSF如上所述进行,除了8号和20号筛外,还使用了第三个较小的筛子(40号,0.420毫米)来收集较小的幼虫。第二组20个番石榴被放置在2个拉链袋(每袋10个水果)中,并且仅进行MSF(即不切割),这样可以比较水果切割与MSF所需的时间。如上所述,在此过程中使用了三个筛子。记录发现的幼虫数量和处理水果的总时间(将水果糊化并保持在袋中5分钟/筛分/漂浮在糖溶液中)。
正如在实验室中发现的那样,水果切割低估了水果侵扰,并且变化很大,检测到的幼虫比使用MSF方法可以回收的幼虫少25%-83%(表3)。此外,在幼虫数量较少的样本中,无国界医生回收的幼虫增加了500%,提供了更高的测定灵敏度和更大的机会来识别感染生物。与切割相比,使用MSF方法加工水果的速度要快得多;切割和检查 5 个水果所需的时间与通过 MSF 加工 10 个水果所需的时间大致相同。

图1:果蝇幼虫提取方案的步骤。 (A)一次处理约2升体积的水果(例如,5个番石榴或5个中等大小的芒果构成该方法的足够样品)。(B)将水果切成大块,放入4升拉链锁储物袋中。(C)向袋子中加水,直到水覆盖切碎的水果25-50毫米。 (D)用手轻轻挤压水果,直到所有果肉从果皮上脱落并具有光滑的稠度(即没有大块)。(E)将筛子与大网(8号;2.36毫米)筛子堆叠在上面,然后是小网(20号;0.85毫米)筛子。对于早期的龄人,在堆栈的底部放置第三个筛子(No. 45; 0.35 mm)。(F)将纸浆倒入顶筛中。(G)用水龙头,软管或瓶子中的水通过筛子堆彻底清洗纸浆,直到细纸浆通过第一个筛子。(H)目视扫描顶部筛子,寻找可能与果皮或任何大块水果一起保留的晚龄幼虫。 请点击此处查看此图的大图。
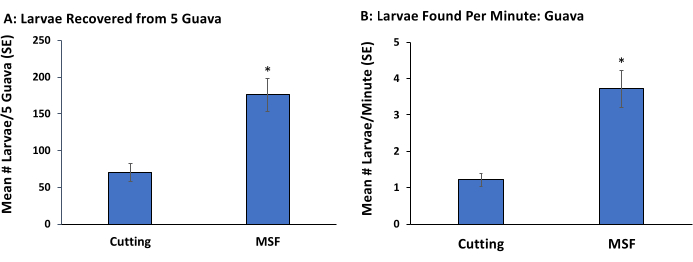
图2:从田间采集的果实中提取早龄和晚龄的Anastrepha sususpensa。通过切割和目视检查(切割:70.4 ± 11.9)或通过一系列三个筛子清洗果肉,然后将果肉浸泡在糖水溶液中(MSF:175.6 ± 21.91)(A)从五种番石榴果实中收集的Anastrepha sususpensa幼虫的平均数(±标准误差)。通过切割(1.21±0.16)和MSF(3.71±0.50)处理的5个番石榴每分钟收集的平均幼虫数(±SE)(B)。每种方法重复5次,条形上方的星号表示基于Kruskal-Wallis检验的幼虫数量(χ 2 = 6.81,p < 0.01)和处理时间(χ2 = 6.80,p < 0.01 )的显着差异。 请点击此处查看此图的大图。
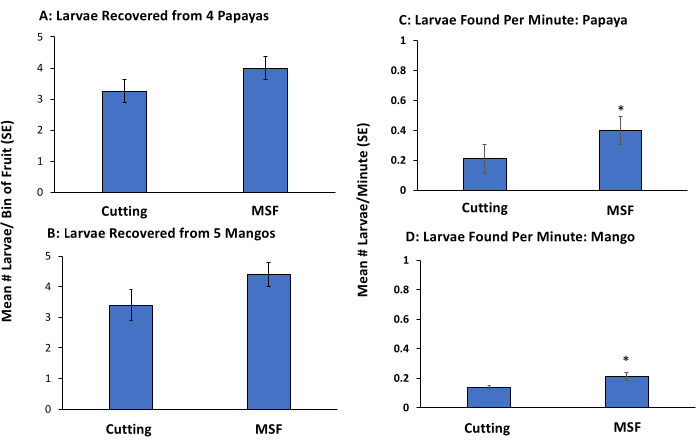
图 3:使用手动侵扰芒果和木瓜来模拟低背芽孢杆菌侵扰的全糊化-筛分-漂浮方法的验证。在木瓜(切割:3.25±0.51,MSF:4.0±0.4)(A)和芒果(切割:3.4±0.51,MSF:4.4±0.4)中发现的果实和平均数量的背侧芽孢杆菌幼虫(±±SE)(切割:0.21±0.1,MSF:0.4±0.15)(C)和芒果(切割:0.14±0.01,MSF:0.21±0.03)(D).使用切割或MSF方法(包括漂浮,n = 5)手工感染5个第三龄幼虫的水果。条形上方的星号表示与基于Kruskal-Wallis测试的水果切割相比,木瓜(χ2 = 5.39,p = 0.02)和芒果(χ2 = 3.94,p = 0.05)中发现的幼虫数量存在显着差异。 请点击此处查看此图的大图。
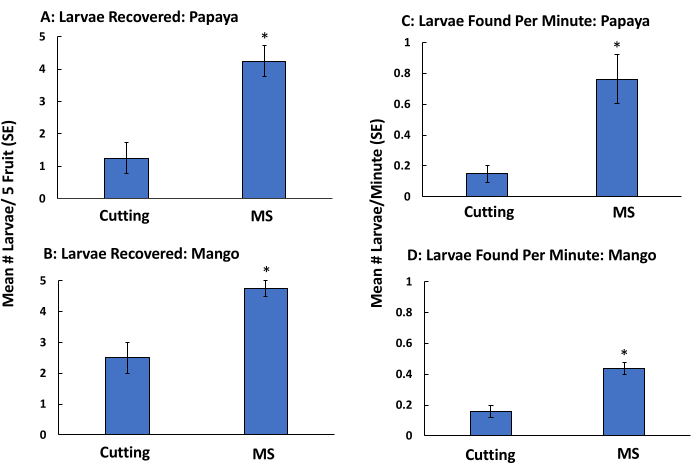
图 4:使用芒果和木瓜的手动侵扰来模拟低背蝽侵扰的糊化-筛分方法(去除浮选)的验证。 木瓜(扦插:1.25±0.48,质谱:4.25±0.48)(A)和芒果(扦插:2.5±0.5,质谱:4.75±0.25)(B)果实的平均幼虫数(±±SE)和木瓜(扦插:0.15±0.05,质谱:0.76±0.15)(C)和芒果(扦插:0.16±0.04,质谱:0.44±0.04)(D)。用5个三龄背蝇幼虫人工侵染果实,通过切割和目视检查(切割)或糊装在袋子中并通过筛子清洗(仅糊状和筛分,不漂浮,n = 4)。条形上方的星号表示在木瓜(χ 2 = 5.46,p = 0.02)和芒果(χ2 = 5.25,p = 0.02)中发现的幼虫数量以及加工木瓜(χ 2 = 5.39,p = 0.02)和芒果(χ 2 = 5.39,p = 0.02)与果实切割相比的显着差异,基于Kruskal-Wallis测试。 请点击此处查看此图的大图。
| 水果 | # 水果加工 | #Larvae 已添加 | 加工方法 | 找到 #Larvae | 处理时间(分钟)* | 回收率百分比 |
| 芒果 | 25 | 25 | 切削 | 17 | 158 | 68% |
| 芒果 | 25 | 25 | 无国界医生 | 22 | 113 | 88% |
| 木瓜 | 16 | 20 | 切削 | 13 | 62 | 65% |
| 木瓜 | 16 | 20 | 无国界医生 | 16 | 40 | 80% |
| *总时间加起来超过5名工人。 | ||||||
表1:通过切割和目视检查(切割)或全糊化,筛分和漂浮(MSF)方法回收的幼虫数量和加工果实的时间。 测试果实被5个三龄幼虫与无聊和加盖的水果混合(5个芒果中的1个,4个木瓜中的1个)手动感染。
| 水果 | # 水果加工 | #Larvae 已添加 | 加工方法 | 找到 #Larvae | 处理时间(分钟)* | 回收率百分比 |
| 芒果 | 20 | 20 | 切削 | 10 | 66 | 50% |
| 芒果 | 20 | 20 | 女士 | 19 | 44 | 95% |
| 木瓜 | 16 | 20 | 切削 | 5 | 38 | 25% |
| 木瓜 | 16 | 20 | 女士 | 17 | 25 | 85% |
| *总时间加于 4 名工人。 | ||||||
表2:回收的幼虫数量和仅通过切割或糊化和筛分处理果实的时间,省略漂浮(MS)。 测试果实被五种三龄幼虫与无聊和加盖的果实混合(五分之一的芒果,四分之一的木瓜)手动感染。
| 工作器/方法 | 已处理 #Fruit | 处理时间(分钟) | #Larvae 发现切割 | #Larvae 找到无国界医生* | 通过切割发现的幼虫总数的百分比 |
| 工人1:切割 | 5 | 18 | 33 | 14 | 70% |
| 工人2:切割 | 5 | 18 | 1 | 5 | 17% |
| 工人3:切割 | 5 | 26 | 9 | 11** | 75% |
| 工人4:切割 | 5 | 20 | 24 | ||
| 工作人员 5:无国界医生 | 10 | 22 | 那 | 22 | 那 |
| 工人 6:无国界医生 | 10 | 18 | 那 | 37 | 那 |
| * 纸浆从切割和目视检查再次处理使用MSF方法确定晚2-3龄幼虫漏诊的数量 | |||||
| ** 在使用MSF方法加工之前,工人2和3水果的果肉汇集在一起 | |||||
表3:通过切割和目视检查果实(切割)或通过捣碎,筛分和漂浮(MSF)水果在田间收集的番石榴中发现的幼虫数量。
讨论
我们的目标是开发一种高效且有效的方法来在田间寻找蝾螈幼虫。启动根除计划或建立隔离区的动机是检测交配的雌性或幼虫6,这表明繁殖种群。目前切割和目视搜索水果的方法在寻找幼虫方面效率低下,因为通常存在的寄主果实比单独检查的要多得多。此外,在新入侵的地区,蜥蜴的数量可能很低,这使得在大量水果中发现幼虫的机会非常困难。例如,在佛罗里达州2015年根除背侧芽孢杆菌的计划中,确定了54种不同的宿主物种,并切割了4,000多个水果。在这次根除计划中,芒果中只发现了少数幼虫,没有发现其他宿主被感染6。我们发现,与水果切割相比,MSF/MS方法在处理含有大量果肉(芒果、番石榴和木瓜)的水果时,在检测悬蚴和背侧双歧杆菌幼虫方面更灵敏、更快。使用糊状和筛分方法可以检查的宿主果实数量较大,再加上稀有幼虫检测的增加,可能会增加早期发现侵扰的可能性。早期发现繁殖种群可以增加根除的可能性并降低该计划的成本。
我们的实验表明,切割和目视检查水果的工人检测到的幼虫数量差异很大。切割水果的工人分别错过了芒果和木瓜中50%和75%的 背蝾螈 幼虫。相比之下,使用MS方法分别加工芒果和木瓜果实时,只有5%和15%的幼虫被遗漏。同样,一项评估入境口岸水果切割情况的研究表明,检查员发现的受感染水果和幼虫的数量差异很大8。研究表明,经验丰富的港口检查员在切割和目视检查水果时遗漏了64%-99%的悬 蚧 幼虫和16%-82%的受感染水果8。我们的研究结果表明,糊涂和筛分方法可以降低工人错过检测受感染水果的可能性。
糖和热水漂浮是确保樱桃和蓝莓不含果蝇的系统方法中的公认方案14.将货物的一部分压碎到溶液中,然后检查员目视检查糖溶液表面是否存在卵和幼虫。尽管与切割单个水果相比,可以加工更多的水果,但使用这些技术发现幼虫的概率仍然受到检查员的能力、存在的幼虫的阶段和数量以及水果类型的影响8.我们发现,像其他背炎一样,背侧双歧杆菌和悬苣苔从果肉中脱落并漂浮到表面。有趣的是,我们发现,对于较大的晚龄幼虫,这是紧急和根除计划的目标,因为它们可以通过形态学识别,包括糖漂浮并没有提高方法的准确性。事实上,添加漂浮方法使木瓜的加工时间增加了90%,芒果的加工时间增加了48%。增加的处理时间加上额外的材料(即水、垃圾箱、糖等)在操作上不支持在野外搜索大量 instar 时添加此步骤。当目标是检测包括早期龄期在内的所有阶段时,例如在入境口岸和包装厂,糖浮法可能是合适的。用细网筛过滤糖溶液很可能提供最准确的卵和早期幼虫11,12。
MS 和 MSF 技术适用于易于糊化且果肉量大的水果。铁皮状幼虫倾向于钻入果肉中,这使得视觉检测变得困难。MS和MSF方法的一个关键方面是将幼虫与果肉分离。筛分过程去除纸浆,从而将幼虫暴露在筛网上。同样,糖水法通过使幼虫漂浮,而果肉沉到锅底,将幼虫与果肉分开。很容易观察到通过MS或MSF方法从纸浆中分离的幼虫在筛网或水面上移动。尽管捣碎、筛分和任选漂浮法大大提高了检测重要寄主果实中蝾螈幼虫的速度和准确性,但该过程可能不适用于所有果实。例如,具有硬果肉的寄主水果,如绿色鳄梨或种子/果核较大且果肉相对较少的水果,如热带杏仁,可能更容易通过手工切割和目视检查进行加工。
我们发现,当加工相对较少的水果(5-10)时,MS和MSF方法更快。如果加工更多的水果,差异可能会更大,这可能是紧急果蝇计划所必需的和典型的。去除浮选步骤进一步提高了检测速度,而不会影响发现大型蝴蝶幼虫(>3 mm)的准确性。我们展示了这些技术可以带到现场,模拟工人在紧急果蝇计划期间所经历的条件。我们的研究表明,MS方法可以更及时地检测晚龄幼虫,并随后根除蜥蜴繁殖种群。无国界医生可用于检测目前未被根除计划针对的卵和早期幼龄。
披露声明
提交人声明他们没有利益冲突。
致谢
我们要感谢Silvia Durand,Teri Allen,Jose Alegria和Alejandra Canon在佛罗里达大学处理番石榴方面的帮助,感谢Rick Kurashima,Jean Auth和Bruce Inafuku帮助评估夏威夷人工感染的水果,以及Michael Stulberg对手稿早期版本的有益评论。该项目部分由美国农业部APHIS和佛罗里达大学合作协议资助,部分由美国农业部-ARS(项目2040-22430-027-00D)支持。本初步出版物中的调查结果和结论尚未由美国农业部正式传播,不应被解释为代表任何机构的决定或政策。本出版物中提及的商品名称或商业产品仅用于提供特定信息,并不意味着美国农业部的推荐或认可。美国农业部是一个机会均等的提供者和雇主。
材料
| Name | Company | Catalog Number | Comments |
| Anti foamer | MicroLubrol | ML200-50-4 | MicroLubrol 2000 Fluid Pure Silicone Oil, https://www.microlubrol.com |
| Brown Sugar | Dominos | 1 lb Box Dark Brown Sugar Crystals, https://www.dominosugar.com/products/dark-brown-sugar | |
| Cutting Boards | KitchenAid | KE703NOSMGA | KitchenAid Classic Nonslip Plastic Cutting Board, 12x18-Inch, https://www.amazon.com/KitchenAid-Classic-Nonslip-Plastic-11x14-Inch/dp/B09117L774/ref=sxin_24_ac_d_mf_brs?ac_md=2-1-S2l0Y2hlbkFpZA%3D%3D-ac_d_mf_brs_brs&content-id=amzn1.sym.1ad31f34-ba12-4dca-be4b-f62f7f5bb10d%3Aamzn1.sym.1ad31f34-ba12-4dca-be4b-f62f7f5bb10d&crid=UXMLNC72BL0 M&cv_ct_cx=cutting%2Bboards&keywords=cutting%2Bboards &pd_rd_i=B091118V8T&pd_rd_r= 4c48b4ad-4d4d-4b4b-8799-fc7313 2f8e34&pd_rd_w=li862&pd_rd_wg =KogbB&pf_rd_p=1ad31f34-ba12-4dca-be4b-f62f7f5bb10d&pf_rd_r=9ATJD6W QBF9DVRY889MP&qid=1673911 429&refresh=1&sprefix=cutting%2Bboards%2Caps%2C198&sr=1-2-8b2f235a-dddf-4202-bbb9-592393927392&th=1 |
| Dish Pans | Sterilite | 06578012 | White 12 qrt Dishpan, https://www.amazon.com/STERILITE-06578012-Sterilite-White-Dishpan/dp/B0039V2G5E/ref=sr_1_1?crid=2SMBMLFJF18U&keywords= white+12+qt+dishpan+sterilite&qid=1673911729&s=home -garden&sprefix=white+12+qr+dishpan+sterlite%2Cgarden%2C184&sr=1-1 |
| EthOH | Fisher Scientific | BP8202500 | Ethanol Solution 96%, Molecular Biology Grade, https://www.fishersci.com/shop/products/ethanol-solution-96-molecular-biology-grade-fisher-bioreagents/BP8202500 |
| Glass Vials | Fisher Scientific | 0333921H | Fisherbrand Class B Clear Glass Threaded Vials With Closures, https://www.fishersci.com/shop/products/class-b-clear-glass-threaded-vials-with-closures-packaged-separately/0333921H |
| Knives | Zyliss | 31380 | 5.25" Utility Knife, https://www.amazon.com/ZYLISS-Utility-Kitchen-5-5-Inch-Stainless/dp/B00421ATJK/ref=sr_1_7?crid=2U27KE1HTG5N1&keywords= fruit%2Bcutting%2Bknives&qid=1673911609&s= home-garden&sprefix=fruit%2Bcutting%2Bknives%2Cgarden%2C145&sr=1-7&th=1 |
| No. 20 Mesh sieves | Hogentogler & Co. Inc. | 4221 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| No. 45 Mesh sieves | Hogentogler & Co. Inc. | 4226 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| No. 8 Mesh sieves | Hogentogler & Co. Inc. | 4215 | U.S. Standard Testing Sieves, https://www.hogentogler.com/sieves/18-inch-sieves.asp |
| Soft Forceps | DR Instruments | DRENTF01 | DR Instruments Featherweight Entomology Forceps, https://www.amazon.com/DR-Instruments-DRENTF01-Featherweight-Entomology/dp/B008RBLO8Q |
| Zipper Lock Storage Bags | Ziploc | 682254 | Ziploc brand 2 gal Clear Freezer Bags, https://www.amazon.com/Ziploc-Freezer-Bag-Gallon-100/dp/B01NCDWR8A/ref=sr_1_1_sspa?crid=3SQFBT64Z76ES&keywords= ziploc+freezer+bags+2+gallon&qid=1674504602& |
参考文献
- White, I. M., Elson-Harris, M. M. . Fruit Files of Economic Significance: Their Identification and Bionomics. , (1992).
- Papadopoulos, N. T., Plant, R. E., Carey, J. R. From trickle to flood: the large-scale, cryptic invasion of California by tropical fruit flies. Proceedings of the Royal Society B: Biological Sciences. 280 (1768), 20131466 (2013).
- Suckling, D. M., et al. Eradication of tephritid fruit fly pest populations: outcomes and prospects. Pest Management Science. 72 (3), 456-465 (2016).
- Mcinnis, D. O., et al. Can polyphagous invasive tephritid pest populations escape detection for years under favorable climatic and host conditions. American Entomologist. 63 (2), 89-99 (2017).
- Mutamiswa, R., Nyamukondiwa, C., Chikowore, G., Chidawanyika, F. Overview of oriental fruit fly, Bactrocera dorsalis (Hendel) (Diptera: Tephritidae) in Africa: From invasion, bio-ecology to sustainable management. Crop Protection. 141, 105492 (2021).
- Steck, G., et al. Oriental fruit fly eradication in Florida 2015-2016: program implementation, unique aspects, and lessons learned. American Entomologist. 65 (2), 108-121 (2019).
- Alvarez, S., Evans, E., Hodges, A. W. Estimated costs and regional economic impacts of the oriental fruit fly (Bactrocera dorsalis) outbreak in Miami-Dade County, Florida. University of Florida Institute of Food and Agricultural Sciences Extension. , (2016).
- Gould, W. Probability of detecting Caribbean fruit fly (Diptera: Tephritidae) infestation by fruit dissection. Florida Entomologist. 73 (3), 502-507 (1995).
- Yee, W. L. Detection of Rhagoletis indifferens (Diptera: Tephritidae) larvae using brown sugar flotation and hot water methods. Journal of Applied Entomology. 136 (7), 549-560 (2012).
- Yee, W. L. Comparison of the brown sugar, hot water, and salt methods for detecting western cherry fruit fly (Diptera: Tephritidae) larvae in sweet cherry. Florida Entomologist. 97 (2), 422-430 (2014).
- Van Timmeren, S., Diepenbrock, L. M., Bertone, M. A., Burrack, H. J., Isaacs, R. A filter method for improved monitoring of Drosophila suzukii (Diptera: Drosophilidae) larvae in fruit. Journal of Integrated Pest Management. 8 (1), 23 (2017).
- Van Timmeren, S., Davis, A. R., Isaacs, R. Optimization of a larval sampling method for monitoring Drosophila suzukii (Diptera: Drosophilidae) in blueberries. Journal of Economic Entomology. 114 (4), 1690-1700 (2021).
- Balagawi, S., et al. Evaluation of brown sugar flotation for detecting Queensland and Mediterranean fruit fly (Diptera: Tephritidae) infestation in Australian cherries. Crop Protection. 151, 105823 (2022).
- CFIA (Canadian Food Inspection Agency). Directive D-02-04: The Blueberry Certification Program and domestic phytosanitary requirements to prevent the spread of blueberry maggot (Rhagoletis mendax) within Canada. 2 Revision 10. CFIA (Canadian Food Inspection Agency). , (2020).
- Kendra, P. E., et al. Gas chromatography for detection of citrus infestation by fruit fly larvae (Diptera: Tephritidae). Postharvest Biology and Technology. 59 (2), 143-149 (2011).
- SAS Institute Inc. SAS 9.4 Guide to Software Updates and Product Changes. SAS Institute Inc. , (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。