工程肌腱组件以探测疾病和修复中的细胞串扰
摘要
在这里,我们提出了一个组合体模型系统来模拟承重肌腱核心组织与包含由疾病和损伤激活的细胞群的外在隔室之间的肌腱细胞串扰。作为一个重要的用例,我们展示了如何部署该系统来探测外源性内皮细胞的疾病相关激活。
摘要
肌腱通过将肌肉力传递到骨骼来实现运动。它们依赖于由胶原纤维和基质细胞群组成的坚韧肌腱核心。这个承重核心被由外肌腱隔室组成的滑膜样组织层包围、滋养和修复。尽管有这种复杂的设计,但肌腱损伤很常见,临床治疗仍然依赖于物理治疗和手术。现有实验模型系统的局限性减缓了新型疾病修饰疗法和预防复发临床方案的发展。
体内 人体研究仅限于将健康肌腱与修复手术期间取样的终末期病变或破裂组织进行比较,不允许对潜在的肌腱疾病进行纵向研究。 体内 动物模型在不透明的生理复杂性、动物的伦理负担以及与使用它们相关的巨大经济成本方面也存在重要的限制。此外, 体内 动物模型不太适合系统探测药物和多细胞、多组织相互作用途径。更简单的 体外 模型系统也存在不足。一个主要原因是未能充分复制有意义地研究肌腱细胞及其功能所需的三维机械载荷。
这里介绍的新3D模型系统通过利用小鼠尾腱核心外植体来缓解其中一些问题。重要的是,这些外植体很容易从单个小鼠大量获得,在细胞水平上保留了 3D 原位 加载模式,并具有类似 体内的细胞外基质。在该方案中,给出了有关如何用富含肌肉来源的内皮细胞、肌腱来源的成纤维细胞和骨髓来源的巨噬细胞的胶原蛋白水凝胶增强肌腱核心外植体的分步说明,以替代外源性肌腱隔室内的疾病和损伤激活细胞群。它展示了如何通过机械或通过定义的微环境刺激来挑战由此产生的肌腱组合体,以研究疾病和损伤期间出现的多细胞串扰。
引言
肌腱将肌肉力传递到骨骼以实现运动的功能中,肌腱面临着人体中发生的一些最极端的机械应力1,2,3。由于社会老龄化、肥胖患病率的增加以及对机械要求高的体育活动的日益普及,预计发达国家肌腱疾病和损伤的患病率将攀升 4,5,6。目前可用的模型系统的局限性阻碍了新型循证和疾病修饰治疗方案的开发,以应对这种增加1,7,8。
理想情况下,疾病和损伤修复模型将允许研究靶器官如何将一组定义的输入参数(模仿疾病触发因素,表1)处理成可测量的输出参数(代表疾病标志,表2),同时控制混杂因素。然后,使用这种模型系统的研究将能够识别疾病和损伤修复背后的(病理)生理过程,并获得可用于预防或减少临床疾病和伤害特征的知识。将这一原理应用于肌腱,一个有用的模型系统应该概括体内肌腱对疾病和损伤反应的中心部分,其中包括以下特征:微损伤、炎症、新生血管形成、细胞增生、加速基质更新和去区室化 9,10,11,12,13,14,15.以这些标志为基础,可以推断出成功的肌腱疾病和损伤修复模型系统的以下要求。
据推测,机械超载是肌腱损伤和疾病发病机制的核心因素,因此是造成微损伤的常用实验方法16。因此,可控的机械载荷是肌腱疾病和损伤修复模型的首要先决条件。理想情况下,模型系统支持三种主要模式:单拉伸损伤载荷、疲劳载荷和卸载8、17、18。在机械变形时,组织驻留细胞会经历拉力、剪切力(由于细胞周围胶原纤维的滑动)和在卸载期间或附着点附近发生的压缩力的复杂组合19,20。模型系统应尽可能接近地再现这些复杂的加载模式。
引入基质微损伤的另一种方法是利用模拟肌腱疾病和损伤全身易感性的生化应激源,例如(促)炎性细胞因子、氧化应激或高葡萄糖浓度21,22,23。因此,可控的生态位微环境有利于肌腱疾病和损伤修复模型系统。
模型系统能够概括炎症、新生血管形成和细胞增生的一个常见先决条件是驱动这些过程的细胞群的选择性存在24。对于炎症过程,这些群体包括中性粒细胞、T 细胞和巨噬细胞,而内皮细胞和周细胞则需要研究新生血管形成 25,26,27,28,29。肌腱成纤维细胞不仅对肌腱修复至关重要,而且作为增殖和迁移细胞,也部分负责在肌腱疾病中观察到的局部细胞增生 30,31,32,33,34,35,36。
除了常驻细胞群的变化外,肌腱基质组成在肌腱疾病和损伤中也发生了变化7,37,38,39,40。为了呈现正确的与疾病相关的微环境线索,模型系统应该能够整合与目标疾病或损伤阶段相匹配的细胞外基质组成,例如,通过启用胶原蛋白-1、胶原-3和细胞纤连蛋白的相关比例组合41。
健康肌腱分为肌腱核心和外在隔室(即内腱、外皮腱和副腱)是其功能的核心,并且经常在患病或受伤的肌腱中受到干扰 1,42,43,44,45,46,47 .因此,将 3D 肌腱区室化纳入肌腱模型系统不仅需要更紧密地模拟去区室和重区室化的过程,还有助于建立细胞因子和营养物质的正确时空梯度48,49。
最后,模块化是模型系统的另一个核心资产,使研究人员能够在研究过程中将先前描述的压力源的正确相对贡献和相互作用结合起来8,17。
除了选择最佳输入模式外,一个重要的步骤是能够测量、观察和跟踪结果输出的变化。模型系统的力学性能(即脚趾区域长度、线弹性模量、最大拉伸应变、最大拉伸应力、疲劳强度和应力松弛)是这里的核心,因为它们表征了肌腱的主要功能50,51,52。为了将这些功能变化与组织水平的变化联系起来,重要的是启用检测(胶原)结构基质损伤的方法,并跟踪疾病和修复相关细胞群的增殖和募集30,53,54,55,56,57,58,59,60。
为了研究新出现的细胞间和细胞基质串扰,应该能够分离或标记足够量的蛋白质进行定量(即 ELISA、蛋白质组学、免疫组化、流式细胞术)14,21,61,62。群体或至少是区室特异性基因表达分析也应该是可能的(即荧光激活细胞分选 [FACS]、单细胞/批量 RNA 测序和实时定量聚合酶链反应 (RT-qPCR))21,24,27,63。模型系统应允许以足够快的速度测量同一试样和多个试样上尽可能多的上述输出参数,以解锁高通量研究。
在目前可用于研究人体肌腱疾病和损伤修复的模型系统中,人体本身当然是最具代表性的。它也是与实验干预最不相容的。虽然急性肌腱损伤患者可用于临床研究,但早期肌腱病(最常见的肌腱疾病)患者基本上没有症状,并且在临床上通常未被发现,直到出现更严重的变化 14,64,65。这使得很难确定肌腱稳态脱轨的关键时刻以及这种脱轨背后的机制16,66,67,68,69。此外,从健康的肌腱中提取活检在伦理上具有挑战性,因为它可能导致持续的损伤。前交叉韧带重建手术的腘绳肌腱残余通常用作健康对照,但与通常受肌腱疾病和损伤影响的肩袖、跟腱和髌腱相比,可以说在功能、机械性能、细胞群和基质组成方面有所不同70,71,72,73。
体内 动物模型更容易获得和处理,但它们的使用给动物带来了巨大的道德负担,并给研究人员带来了经济成本。此外,大多数流行的模式动物要么不会自发发生肌腱病变(即大鼠、小鼠、兔子),要么缺乏追踪其中涉及的多细胞通讯途径所需的引物和转基因菌株(即马、兔子)。
简单的 2D 体外模型系统位于复杂性/可处理性谱的另一端,并且可以更好地对特定的细胞间通讯通路进行受控、省时的研究,以响应一组更可控的触发因素 8,74。然而,这些简化的系统通常无法概括肌腱功能的核心多维机械载荷(即拉伸、压缩和剪切)。此外,组织培养塑料的(太)高刚度往往会覆盖由旨在模拟感兴趣的疾病状态的涂层提供的任何基质线索75,76。
为了克服这一缺点,已经开发了越来越复杂的组织工程3D模型系统,以提供可加载的基质,其组成至少可以部分匹配到所需的疾病状态77,78,79。尽管如此,这些系统不仅难以准确复制复杂的体内细胞外基质组成和细胞负荷模式,而且通常缺乏长期负荷性和研究协调肌腱疾病和损伤修复的跨室通讯途径所需的室室接口48,49,80。
离体肌腱外植体模型系统具有内置体内样基质组成的明显优势,该基质组成包括细胞周生态位、跨室屏障以及时空细胞因子/营养梯度,并在拉伸时概括复杂的负载模式8。由于大小依赖性营养扩散限制,来自大型动物模型(即马)的外植体很难在肌腱疾病和损伤修复的长期研究中保持活力81,82,83。同时,来自小鼠物种(即跟腱、髌腱)的较小外植体难以重复夹紧和机械载荷。它们的大小还限制了可以收集用于细胞、蛋白质和基因水平读数的材料量,而不会合并样本并降低通量。从这个意义上说,小鼠尾腱束提供了解锁肌腱疾病和损伤修复的高通量研究的潜力,因为它们很容易从单个小鼠中大量获得,保留了复合体内细胞周基质组成,并概括了细胞负荷模式。然而,在提取过程中,它们失去了大部分外在隔室,其中含有血管、免疫和成纤维细胞群,这些群现在被认为可以驱动肌腱疾病和修复 8,18。
为了弥合这一差距,已经开发了一种模型系统,将小鼠尾腱衍生的核心外植体的优点与基于3D水凝胶的模型系统的优点相结合。该模型系统由在尾腱外植体周围铸造的充满细胞的(胶原蛋白-1)水凝胶组成84,85。在本文中,详细介绍了必要的制造步骤以及有用的读数,这些读数可以通过在内皮细胞负载的 1 型胶原水凝胶(外在隔室)内共培养核心外植体(内在隔室)来获得。
研究方案
这里描述的所有方法都得到了主管当局的批准(苏黎世州许可证号ZH104-18和ZH058-21)。 概述如图 1 所示。
1. 从 12-15 周龄小鼠(即 B6/J-Rj)中分离肌腱组装体成分
- 通过CO2 气体诱导的窒息对小鼠实施安乐死。为了最大限度地提高产量,一次不要处理超过3只小鼠,并在安乐死后立即进行细胞分离。
- 确保双侧气胸诱导死亡。
- 用80%乙醇对小鼠皮肤进行消毒,并将小鼠移至无菌生物安全罩中。
- 分离尾腱核心外植体。
- 使用手术刀(21号)将尾巴与老鼠分开,方法是在老鼠的底部切开尾巴。
- 从尾巴的尖端开始,用镊子抓住它并摆动它以破坏皮肤。然后,轻轻地将镊子从尾巴上拉开,露出肌腱核心外植体。
- 将肌腱核心外植体放入标准培养基(DMEM/F12 + 10%FBS + 1%青霉素/链霉素+ 1%两性霉素+ 1%非必需氨基酸)中,并使用新鲜的手术刀刀片(21号)将它们与拉开的尾部分开。
- 重复步骤 1.4.2。和 1.4.3.直到整个尾巴被处理并且肌腱外植体变得短于 25 毫米。
- 使用新鲜的手术刀刀片(21 号)将分离的核心外植体切成 25 毫米长的块。
- 使用光学显微镜测量核心外植体的平均直径,该光学显微镜通过可连接的数字C接口相机连接到图像分析软件。
- 使用点并单击选择右侧的线测量工具。
- 测量三个不同位置的外植体直径并计算其平均直径。
- 为了便于以后的夹紧和机械测试,仅对平均直径大于 100 μm 的核心外植体进行。
- 卸载结合暴露于标准培养条件(37°C,20%O2,血清补充剂)在分离后6小时内改变基因表达,并在7天内导致降解21。从准稳态状态开始,产生肌腱组合体,并在肌腱核心分离后立即开始实验。
- 根据实验设置,需要失活的肌腱核心外植体作为对照组。要使肌腱核心外植体失活,请使用镊子将它们冷冻在装满液氮的小容器中 5 秒,然后在室温 (RT) 下解冻 5 秒。重复此冻融循环 3 次,然后继续执行步骤 4(“夹紧核心外植体”)。
注意: 液氮会导致冷灼伤、窒息,并使许多普通材料变脆。仅使用专为低温液体设计的容器并穿戴防护服(即面罩、适当的手套、闭合鞋)。
- 分离肌腱成纤维细胞。
- 使用手术刀(21号)在老鼠脚的中间做一个横向切口。沿着后腿的两侧垂直于脚,从切口的两端一直切到臀部。
- 用镊子将切开的皮瓣固定在脚部,剥去覆盖小腿肌肉的皮肤。从同一只小鼠中分离内皮细胞时,请去除所有皮肤。
- 用新鲜的手术刀刀片(21号)将跟腱与跟骨分开。用镊子固定跟腱的松散端,并将另一端与腓肠肌分开。
- 在PBS中清洗一次跟腱,然后用手术刀(21号)去除所有剩余的肌肉组织,直到只剩下白色肌腱组织。如果从同一只小鼠中分离出内皮细胞,则将跟腱留在PBS中并继续步骤1.6。第一。
- 将一只动物的跟腱集中到含有10mL肌腱消化培养基(DMEM / F12 + 1%青霉素/链霉素+ 1%两性霉素+ 2mg / mL胶原酶1)的15mL塑料管中,并在37°C下使用15rpm的低速轨道振荡器在缓慢,恒定的搅拌下消化6-8小时。
- 将消化的肌腱溶液在室温下以500× g 离心5分钟,吸出上清液,并重悬于8mL标准培养基(DMEM / F12 + 10%FBS + 1%青霉素/链霉素+ 1%两性霉素+ 1%非必需氨基酸)中,并在标准培养条件(37°C,20%O2)下在T25培养瓶中培养7天,不更换培养基。之后,每周更换一次介质。
- 将细胞以 80% 汇合度分离到 T150 培养瓶 (1:6) 中。在分配到两个 1.5 mL 冷冻管的 2 mL 无菌过滤冷冻培养基(70% DMEM/F12 + 20% FBS + 10% DMSO)中冷冻第 2 代的细胞,并将它们保持在 -80 °C 直至进一步使用。使用胰蛋白酶从组织培养塑料中去除细胞。
- 分离肌肉来源的内皮细胞。
- 如果未从同一只小鼠中分离出肌腱成纤维细胞,请从步骤 1.5.1 和 1.5.2 开始。
- 用剪刀剪开髋关节,将后腿与身体分开。
- 在冷PBS(~4°C)中清洗后腿一次,用手术刀(21号)去除肌肉(股四头肌,趾长伸肌,比目鱼肌和腓肠肌),然后将肌肉放入冰上的培养皿中。
- 使用新鲜的手术刀刀片(21号)将肌肉组织切成小于1mm3 的碎片,同时将培养皿放在冰上。
- 将来自两条后腿的碎肌肉组织汇集到含有 12.5 mL 肌肉消化培养基(PBS + 2 mg/mL 胶原酶 IV + 2 mg/mL 分散酶 II + 2 mM CaCl2)的 50 mL 塑料管中。
- 将塑料管放入37°C水浴中10分钟。用力摇晃溶液,再放回原处10分钟。重复直到溶液看起来均匀,只剩下(白色)肌腱和筋膜碎片(约 4 x 10 分钟)。同时,继续进行肌腱成纤维细胞分离或巨噬细胞分离。
- 向塑料管中加入 12.5 mL 冷 PBS + 10% FBS 以停止消化。
- 使用配备 50 mL 移液器的电池驱动移液器支架从塑料管中抽出悬浮液。为塑料管配备 400 μm 的电池过滤器并过滤悬浮液以去除碎屑。用100μm细胞过滤器重复该过程。
- 将过滤的悬浮液在室温下以400× g 离心5分钟,重悬于10mL冷PBS + 10%FBS中并再次离心。
- 重悬于 8 mL 内皮培养基(DMEM/F12 和 endopan 3 试剂盒的 1:1 混合物 + 10 U/mL 肝素 + 20% FBS + 1% 青霉素/链霉素 + 1% 两性霉素 + 30 mg/mL 内皮生长添加剂)中,补充有嘌呤霉素 (4 mg/mL) 用于群体选择。
- 将一只小鼠的细胞接种到一个T25培养瓶中,该培养瓶先前在37°C下用2mL无菌0.2%明胶溶液包被2小时,然后在除去多余的溶液后在室温下干燥过夜。在隔离前一天准备烧瓶。
- 在标准培养条件(37°C,20%O2)下24小时后,除去嘌呤霉素补充培养基,用PBS洗涤附着的细胞一次,并在8mL内皮培养基中培养。
- 将细胞以 1:5 的比例以 80% 的汇合度传入明胶包被的烧瓶中,并在实验中使用它们直到 P2。使用胰蛋白酶以外的细胞分离溶液(材料表)从组织培养塑料中取出细胞,不要冷冻它们。
- 分离骨髓来源的巨噬细胞。
- 如果未从同一只小鼠中分离出肌腱成纤维细胞或内皮细胞,请先执行步骤 1.5.1、1.5.2、1.6.2 和 1.6.3。
- 去除皮肤,肌腱和肌肉组织后,在冷PBS(~4°C)中清洗剩余的骨头(股骨和胫骨)一次。
- 将骨头放在新鲜的冷PBS(~4°C)中,并使用手术刀(21号)逐渐切掉骨骺,直到骨髓暴露。它在骨头的两侧显示为一个红点。
- 用 0.4 mm x 25 mm (G27) 注射针头装填注射器,并用 10 mL 巨噬细胞培养基(DMEM/F12 + 10% FBS + 1% 青霉素/链霉素 + 1% 两性霉素 + 1% 非必需氨基酸)填充。
- 将一块又一块的骨头放在 50 mL 塑料管上,将注射针插入顶部暴露的骨髓约 1 毫米深,然后清空注射器冲洗骨髓。当悬浮在培养基中时,冲洗出的骨髓呈现为淡红色的管状结构。
- 使用 1 mL 移液器吸头轻轻上下移液,反复移液骨髓,溶解骨髓。使用配备有 50 mL 移液器的电池驱动移液器支架,通过 100 μm 细胞过滤器将细胞悬液过滤回 50 mL 塑料管中,并在室温下以 350 x g 离心 5 分钟。
- 除去上清液,将沉淀重悬于10mL红细胞(RBC)裂解缓冲液中,并在室温下再次以350×g离心10分钟。
- 将沉淀重悬于5mL巨噬细胞培养基(DMEM / F12 + 10%FBS + 1%青霉素/链霉素+ 1%两性霉素+ 1%非必需氨基酸)中,并将其接种到直径为100 mm的未经处理的培养皿中(每个培养皿5-8 x 106 个细胞)。
- 4 小时后,向不含 m-CSF(1:1 混合物)的细胞培养基中加入 5 mL 补充有 40 ng/mL 巨噬细胞集落刺激因子 (m-CSF) 的巨噬细胞培养基,以达到 20 ng/mL m-CSF 的终浓度。
- 6天后,在实验中使用细胞或冷冻细胞直至进一步使用。使用胰蛋白酶以外的细胞分离溶液(材料表)从组织培养塑料中除去细胞。
注意:一旦分离,细胞就不再扩增。这里描述的细胞分离方法也适用于指定年龄范围之外的小鼠和大鼠。
- 要使用流式细胞术验证分离细胞群的表型,请继续步骤6.3.4。
2. 从Wistar或Sprague-Dawley大鼠中分离胶原蛋白
- 遵循其他地方详细描述的隔离协议86.它也适用于小鼠,尽管产量要低得多。
- 用羟脯氨酸测定法测定所得溶液的浓度,用SDS-page评估纯度,并将溶液储存在4°C直至在实验中使用。
3.培养系统组件的生产
- 3D 打印夹具支架、安装站和腔室模具。
- 将夹具支架、安装站和腔室模具的附加 .stl 文件(补充文件 1)加载到切片软件中。要根据需要调整对象编号,请使用指向并单击选择对象,然后复制并粘贴以将它们相乘。
- 按 导出 G 代码 (Ctrl-R) 生成 G 代码,然后导出 (Ctrl-G)。
- 将 G 代码加载到 3D 打印机中。
- 在印刷过程中使用未着色的生物相容性长丝(即聚乳酸)。
- 将 3 毫米的螺纹切入夹具支架的孔中,该夹具将使用螺纹刀固定螺钉(补充文件 2 和 补充文件 3,孔 1 和 3)。
- 将不锈钢定位销放入夹具支架背面的孔中(补充文件 2 和 补充文件 3,孔 4)。
- 使用前用紫外线对夹具和安装站进行消毒至少 1 小时。不要重复使用 3D 打印的夹具支架。
- 或者,使用随附的图纸(补充文件 2、补充文件 3 和补充文件 4)生产带有聚醚酰亚胺的夹具支架和安装站,这更昂贵,但可以采用更好的灭菌方法(即高压灭菌)和重复使用。
- 使用3D打印模具铸造腔室。
- 用硅胶填充腔室模具。
- 在真空室(90mbar)中对硅胶脱气30分钟。
- 让溶液在室温下聚合过夜或在70°C的加热板上聚合1小时,具体取决于用于模具的长丝的耐热性。
- 小心地从模具中取出聚合腔室,并用手术刀(21号)切掉多余的硅胶。
- 可选:如果要机械加载组件和周围腔室,请用不锈钢制成的空心管加固硅胶腔室中的孔。
- 使用随附的平面图(补充文件 5)用不锈钢加工金属夹具。
- 每次使用前,请清洗不锈钢夹具、聚醚酰亚胺夹具支架、螺钉和硅胶室。
- 在80%乙醇(EtOH)和20%反渗透水(ROW)中超声处理10分钟。
- 在50%EtOH和50%异丙醇中超声处理10分钟。
- 用 ROW 冲洗 3 次。
- 在 0.5% 碱性清洁浓缩液(即 600 mL ROW 中的 3 mL)中超声处理 10 分钟。
- 在0.5%碱性清洁浓缩液中超声处理10分钟。
- 在摇动1小时50分钟的同时留在0.5%碱性清洁浓缩液中。
- 用 ROW 冲洗 3 次。
- 在 ROW 中超声处理 10 分钟。
- 风干组件并高压灭菌。
4. 夹紧核心外植体
- 将匹配的夹具与每个金属夹放在一起放入安装站。
- 将湿的高压灭菌纸片(4 mm x 25 mm)放在金属夹的顶部,然后用手术刀(21号)沿夹子的内边缘切割纸张。从另一张纸上剪下另外 2 张较小的纸片 (4 mm x 1.5 mm) 并保持湿润。
- 使用尖头镊子将 8 个核心外植体放在金属夹之间的纸上,其端点在金属夹上。
- 用准备好的小纸片(4 mm x 1.5 mm)覆盖核心外植体的端端,然后将金属夹子放在它们上面。使用螺丝刀和小螺钉 (M3 x 6 mm) 将芯外植体固定在金属夹和夹具支架之间。
- 小心地将夹紧的核心外植体转移到硅胶培养室中,并用 2 mL 标准细胞培养基(DMEM/F12 + 10% FBS + 1% 青霉素/链霉素 + 1% 两性霉素 + 1% 非必需氨基酸)填充这些腔室。
- 可选:如果要机械加载组件/周围腔室,请用额外的螺钉 (M3 x 16 mm) 将它们固定在孔 3(补充文件 2 和补充文件 3,孔 3)中。
5.胶原水凝胶制备和铸造
- 用细胞分离溶液从组织培养塑料中取出目标细胞,在室温下以 400 x g 离心 5 分钟,并将它们重悬于 1 mL 标准培养基中。
- 对于一个组装体,需要 10 μL PBS (20x)、1.28 μL 1 M NaOH (125x)、8.72 μL 双蒸水(ddH2O,23x)、80 μL 胶原蛋白-1(2.5 x 或 1.6 mg/mL 最终)和 100 μL (2x) 标准培养基(用于核心//无细胞组装体)或细胞悬液。在两个单独的溶液中制备这些组分,并在铸造前立即混合它们。
- 交联溶液:将 PBS、NaOH、ddH20 和多达 12 个组装体(+10% 安全裕度)的细胞悬浮液汇集到交联溶液中,并将其保存在 15 mL 塑料管中的冰上。混合两种溶液后,调整细胞悬液的浓度以达到以下最终浓度:250,000 个细胞/mL 肌腱成纤维细胞、500,000 个细胞/mL 肌肉来源的内皮细胞或 370,000 个细胞/mL 骨髓来源的巨噬细胞。
- 胶原蛋白-1 溶液:将多达 12 个组装体所需的胶原蛋白 1 溶液(+10% 安全裕度)汇集在另一个 15 mL 塑料管中,并将其放在冰上。
- 一旦交联溶液和胶原蛋白-1溶液在冰上准备好,从含有夹紧的核心外植体的培养室中吸出细胞培养基。
- 用 1000 μL 移液管将胶原蛋白-1 溶液加入交联溶液中,并通过快速上下移液混合两种溶液而不会产生气泡。用 200 μL 混合溶液覆盖单个肌腱核心外植体,将其移液到硅胶室提供的凹槽中。
- 让水凝胶在37°C下聚合50分钟。
- 将 1.5 mL 相应的共培养基小心地填充硅胶培养箱,方法是将其移液到腔室的角落。
- 对于核心//成纤维细胞共培养,填充DMEM / F12,10%FBS,1%非必需氨基酸,1%青霉素/链霉素,1%两性霉素,200μM L-抗坏血酸,20ng / mL巨噬细胞集落刺激因子。
- 对于核心//巨噬细胞共培养,填充DMEM/F12、10%FBS、1%非必需氨基酸、1%青霉素/链霉素、1%两性霉素、200μM L-抗坏血酸、20ng/mL巨噬细胞集落刺激因子。
- 对于核心 // 内皮细胞共培养,填充 DMEM/F12 和 endopan 3 试剂盒 + 10 U/mL 肝素 + 20% FBS + 1% 青霉素/链霉素 + 1% 两性霉素 + 30 mg/mL 内皮生长补充剂的 1:1 混合物。
- 在适合假设的培养条件下培养集合体。例如,为了模拟病变样生态位环境,将它们在37°C和20%O2下培养。在 1 周内更换培养基两次。为防止感染,在放入培养箱之前,将腔室放入大培养皿或无菌箱中。
注意:培养时间取决于假设和共培养设置。例如,在病变样生态位环境中的核心//成纤维细胞组合体在大约 3 周后变得机械不稳定。
6. 可用的读出方法
- 进行荧光显微镜检查,包括活力和形态学测定。
- 通常,组件可以成像为完整安装座。为此,用剪刀将集子从夹子上取下夹子,然后将它们转移到 12 孔板上。
- 用PBS清洗一次组装物。
- 如果进行活力分析,则在37°C下在黑暗中用100μL的PBS(EthD-1)中的4×10-6M 乙锭同型二聚体对每个组合体进行20分钟染色。
- 用PBS洗涤组装体3次,然后用500μL4%甲醛在室温下固定20分钟。
注意:4%甲醛具有致敏、致癌和致突变作用,对生殖有毒,并可引起发育毒性(生殖毒性)或器官损伤。穿戴防护服和手套、护目镜、面罩或其他呼吸防护装置。 - 用PBS洗涤组装体3次,并继续选择染色方案。前面已经描述了一系列染色84,85。
注意:避免使用发射波长接近胶原自发荧光(约 480 nm)的荧光团的染色。
- 根据制造商的说明,对 RT-qPCR 或全基因组 RNA 测序进行区室特异性 RNA 分离。
- 用剪刀从夹子上取下组件夹子。
- 可选:使用镊子将核心外植体与外在水凝胶隔室分离。
- 池 20-24 个 20 mm 核心外植体或 2 个充满细胞的胶原蛋白水凝胶,以分离足量的 RNA。
- 使用 1 mL 冷三唑和机械破碎(即金属珠或低温研磨)破坏合并的核心外植体或合并的胶原水凝胶的细胞外基质。
注意:口服、皮肤和吸入毒性。引起皮肤和眼睛刺激。只能戴手套和在化学安全柜中处理。 - 继续使用标准RNA提取试剂盒从细胞裂解物中分离RNA,如前所述或制造商说明书84,85中的描述。
- 房室特异性流式细胞术。
- 用剪刀从夹子上取下组件夹子。
- 可选:使用镊子将核心外植体与外在水凝胶隔室分开。
- 在37°C下,在恒定搅拌下,用胶原酶I(3mg / mL)和分散酶II(4mg / mL)在1mL PBS中消化隔室4小时。
- 在室温下以500× g 离心酶解溶液5分钟并吸出上清液。
- 将沉淀重悬于含有所选荧光团偶联抗体的 100 μL FACS 缓冲液(PBS 中的 1% FBS)中。先前已描述过一系列有效的荧光团偶联抗体84,85。
- 将染色溶液在室温下孵育30分钟。
- 用 1.4 mL FACS 缓冲液稀释染色溶液,并在室温下以 500 x g 离心 5 分钟。
- 将沉淀重悬于350μL FACS缓冲液中,并通过100μm尼龙网状过滤器盖过滤溶液,然后根据制造商的说明使用所选的流式细胞仪进行分析。
- 分析上清液。
- 在上清液收集前 3 天用无血清共培养基替换共培养基。
- 使用酶联免疫吸附测定 (ELISA) 和中尺度发现 (MSD) 测定试剂盒对富集的未稀释上清液进行即时和延迟分析。对于延迟分析,将上清液储存在-80°C的1.5mL塑料管中。
- 评估组件机械性能。
- 使用定制的拉伸装置施加机械力并测量机械性能22.不锈钢销钉和不锈钢螺钉使夹具也可以连接到其他拉伸设备上。
- 由于组件的机械性能很大程度上取决于嵌入的核心外植体 18的机械性能,因此在将核心外植体嵌入水凝胶之前测量其机械性能,以降低在测量过程中破坏新浇铸的水凝胶的风险。
代表性结果
组件隔离(图 1 和 图 2)
在组合体共培养中使用核心外植体和细胞群之前,应在显微镜下检查这些成分(图1)。核心外植体应具有均匀的直径(100-200μm),并且没有可见的扭结或皱纹。内皮细胞在与其他细胞接触时应呈现细长形状,由于分离的初始产量低,当以太低的密度接种时,它们不会呈现细长形状。在这种情况下,内皮细胞呈现出更圆润的形状,细胞骨架延伸,增殖明显较慢。7-10 天后将它们按 1:5 分开。从跟腱分离的成纤维细胞在1-2次传代(每次10-14天)内以1:6的比例分裂时,与人类成纤维细胞相比,呈现出更圆润的形态。巨噬细胞比成纤维细胞或内皮细胞小得多,并且在分离后不会增殖。根据批次的不同,它们的形状可以从金字塔形到圆形不等。
通过流式细胞术验证细胞成分的表型。偶联的CD31抗体用作内皮细胞的标记物(图2A)。基于未染色的对照样品(灰色)设置荧光阈值,90.1% 的第 1 代 (P1) 和第 2 代 (P2) 内皮细胞的 48.7% 被鉴定为 CD31 阳性。使用共表达肌腱成纤维细胞标志物 Scleraxis 以及绿色荧光蛋白 (ScxGFP) 和偶联 CD146 抗体的转基因小鼠品系来表征肌腱成纤维细胞 (图 2B)35,60。1次传代(P1)后,成纤维细胞37.3%为ScxGFP+CD146-,0.2%为ScxGFP+CD146+,4.3%为ScxGFP-CD146+,58%为ScxGFP-CD146-。两次传代(P2)后,ScxGFP+CD146-细胞百分比降至27.6%,ScxGFP+CD146+细胞百分比上升至6.9%,ScxGFP-CD146+细胞百分比上升至10.6%,ScxGFP-CD146-细胞百分比下降至54.9%。为了鉴定和表征巨噬细胞,将 F4/80 抗体与 CD86 和 CD206 抗体联合使用(图 2C)。分离培养后,96.4%的骨髓来源细胞为F4/80阳性。在这些F4/80阳性细胞中,CD206+CD86-占8.6%,CD206+CD86+占23.6%,CD206-CD86+占28.3%,CD206-CD86-占39.4%。胶原蛋白交联速度可能因批次而异,在开始实验之前要进行测试。
组合体外观(图3)
在病变样培养条件(36°C,20%O2)中,核心外植体保持机械可拉伸,外观不改变,并且在至少21天内继续在视觉上可区分和物理上与周围的水凝胶分离(图3A,B)。周围的水凝胶随着时间的推移被压实,压实速度取决于接种到其中的细胞群。跟腱衍生的成纤维细胞收缩其周围的水凝胶最快,并且在围绕核心外植体浇注的水凝胶中呈放射状收缩,而在未围绕核心外植体施注的水凝胶中,则向各个方向收缩(图3B,C)。最初,放置在核心外植体周围的无细胞水凝胶也被压实。这种收缩可能是由从核心外植体迁移的细胞引起的,表明存在动态的跨室界面。由于没有嵌入核心外植体的无细胞水凝胶无法检测到压实,因此水分流失引起的收缩的贡献似乎可以忽略不计(图3B和补充文件6)。
因此,缺乏水凝胶压实可用于检测组装体组装中的错误(即低细胞浓度),并且应在继续使用更昂贵的读出方法之前进行检查。在建立这种方法时,降低细胞浓度的常见错误包括外源性水凝胶中死亡的细胞,因为它们在相对苛刻的交联溶液中放置时间过长(高pH值,低温)和干燥核心外植体,因为介质抽吸和水凝胶注射之间的时间太长,或者因为核心外植体被夹得太高而无法嵌入胶原蛋白中。
共聚焦荧光显微镜:活力和形态分析(图3)
一旦用剪刀从夹子上取下(图3B),就可以将组合体固定,染色并用共聚焦显微镜整体成像,而无需切片。在这里,用DAPI(NucBlue)和乙锭同型二聚体(EthD-1)染色核心//内皮细胞,核心//巨噬细胞和核心//成纤维细胞组合体以分析活力,DAPI和F-肌动蛋白以分析3D胶原水凝胶中的形态和细胞扩散(图3D)。对核心//内皮细胞集合体(图3E)的活力进行了量化,发现在组装体组装后通常低于先前报道的核心//巨噬细胞和核心//成纤维细胞集合体84。然而,在组装体培养期间,活力保持稳定,直到至少第 7 天。
机械引起的微损伤和机械性能的测量(图4)
连接到夹具支架的螺钉和销钉允许将夹紧的组件固定到单轴拉伸装置上。这里使用的定制拉伸装置配备了一个 10 N 称重传感器,并在以前的出版物中进行了描述(图 4A)22。在测量之前,所有样品都经过五次拉伸循环预处理,达到 1% 的应变。
记录核心外植体或集合体的完整应力-应变曲线(图4B)将允许量化线弹性模量(α),最大应力(β)和最大应变(у)。然而,它也会不可逆地损坏核心外植体或组装体,这使得无法评估相同样品的最大应力(β)和最大应变(у)的纵向发展(图4B)。在这里,线性弹性模量被用作样品承受力的能力的量度,因为这种测量需要将样品拉伸到仅 2% 的应变,这在之前已被证明不会导致线性弹性模量的永久性降低18。特别是,将核心//内皮细胞集合体暴露于2%应变(大约线性弹性区域的末端)或6%应变(大约最大应变)的夹紧程序中。通过测量手术前后的线弹性模量来评估由此产生的微损伤(图4C)。
与先前利用单培养核心外植体进行的实验一致,核心//内皮细胞集合体在准稳态生态位条件(29°C,3%O2)中培养并暴露于不高于2%的菌株时,其线性弹性模量至少保持14天18,21。关于机械基线刺激,通过夹具施加的静态拉伸似乎充分模拟了肌腱核心单元在体内经历的天然应变水平,以防止通常与基质卸载相关的分解代谢过程87。事实上,在暴露于 6% 应变的核心//内皮细胞集合体中观察到的线性弹性模量的渐进性和统计学显着下降可归因于机械诱导的基质微损伤引起的基质卸载。
在进行这些实验时,重要的是要防止组装体的干燥。在这里,它们被包裹在高压灭菌和湿纸中,但其他方法也可能是可行的,这取决于它们与所用拉伸装置的兼容性。由于金属夹和芯外晶体之间的摩擦力有限,在夹紧时在金属和芯外晶体之间添加小纸片以防止滑移,并密切监测拉伸过程以检测和排除滑脱的芯外晶体和骨灰体。
区室特异性转录组和组装特异性分泌组分析(图5 和 图6)
在这里介绍的第一组核心单一培养实验中,评估了外植体分离后核心基因表达的稳定性,以将分离与实验效应分离(图5A)。尽管需要更高的重复数才能得出精确的结论,但当在病变样生态位条件(37°C,20%O2)中培养时,在外植体分离后数小时内,新分离的核心外植体中Vegfa和Mmps的表达强烈增加。
新生血管形成是肌腱疾病和修复的核心标志,在一定程度上可能是由肌腱核心在缺氧下分泌的促血管生成因子(即血管内皮生长因子,Vegfa)激活的内皮细胞驱动的 88。检查这种潜在串扰的第一步(图5B),发现在低氧张力(3%O2)下单培养的外植体中,Vegfa和缺氧标志物碳酸酐酶9(Ca9)的表达在统计学上显着增加,而在高氧张力(20%O2)下单培养的外植体中).同时,较低的氧张力似乎没有引起肌腱成纤维细胞标志物如巩膜(Scx)和胶原蛋白-1(Col1a1))表达的变化。总之,这些结果将核心驻留细胞确定为缺氧生态位中促血管生成信号传导的合理贡献者。
接下来,在高 (20% O2) 和低 (3% O2) 氧张力下,在核心//内皮细胞组装体共培养中评估促血管生成核心信号对内皮细胞的激活。幸运的是,通过物理分离核心外植体与外源胶原水凝胶,组装体的模块化组成允许在培养后进行区室特异性转录组分析(图6A)。在核心外植体(图6D)中, Vegfa 表达再次被证实在低氧张力下增加,尽管对其他缺氧标志物( 如Fgf2 )的影响不太清楚,并且需要更高的重复数才能得出精确的结论。此外,在低氧张力下,促炎标志物( 如Tnf-α )和细胞外基质降解标志物(如 Mmp3 )的表达降低。在最初接种内皮细胞的外源性水凝胶中(图6E),活芯外植体(aC)的存在在低氧张力下降低 了Vegfa 的表达,但在高氧张力下则没有。此外,在低氧张力下,失活(dC)核心外植体的存在也没有降低 Vegfa 的表达。在低氧张力下,外源性水凝胶中 Tnf-α 表达在aC/dC附近相当,但在活芯外植体周围的高氧张力下增加。与在高氧张力下围绕失活的核心外植体培养的外源性内皮细胞负载水凝胶相比, Fgf2 在所有条件下的表达均降低,但大多数在低氧张力下。在高氧张力下, Mmp3 在活核外植体周围最高,在低氧张力下,在失活的核心外植体周围表达最低。总体而言,共培养的内皮细胞似乎对活性核心外植体都有反应,活性核心外植体能够引发串扰和氧气水平的变化。更全面的转录组分析将有助于阐明它们各自的贡献。
组装体系统的模块化允许整合含有荧光报告基因的转基因细胞。在这里,将从 Pdgfb-iCreER mG 小鼠89 中分离的内皮细胞接种到水凝胶区室中。这些细胞与增强的绿色荧光蛋白 (EGFP) 共同表达内皮细胞标志物血小板衍生生长因子亚基 b (Pdgfb),这使得表达 Pdgfb 的内皮细胞在显微镜下呈绿色(图 6C)。使用这种方法,确认表达Pdgfb的内皮细胞的存在在培养物(37°C)中维持超过7天,并且似乎与氧张力无关(20%O2 与3%O2相比)。
为了分析集合体的分泌组,分别用于核心//无细胞和核心//成纤维细胞,核心//巨噬细胞或核心//内皮细胞共培养的培养基在抽吸和冷冻现在富含分泌组的上清液前三天替换为无血清对应物(图6A)。这种富集时间足以用MSD测定法检测细胞因子,如血管内皮生长因子(VEGF),如图所示,用于在病变样生态位条件下培养的核心外植体和核心//成纤维细胞集体(图6B)。
在分析核心外植体和集合体的分泌组和转录组时,重要的考虑因素涉及使用适当的对照。新鲜分离的核心外植体的价值有限,尤其是它们在分离后数小时内对 Vegfa 和 Mmps 的表达强烈增加(图 5A)。被初始无细胞水凝胶包围的时间匹配外植体更适合作为核心区室基因表达的对照。对于外在水凝胶,与在失活的核心外植体周围培养的载细胞水凝胶相比,没有核心外植体的载细胞水凝胶的对照较差(补充文件7),主要是因为它们压实成圆形而不是细长的水凝胶,这极大地改变了细胞形态(图3A)。
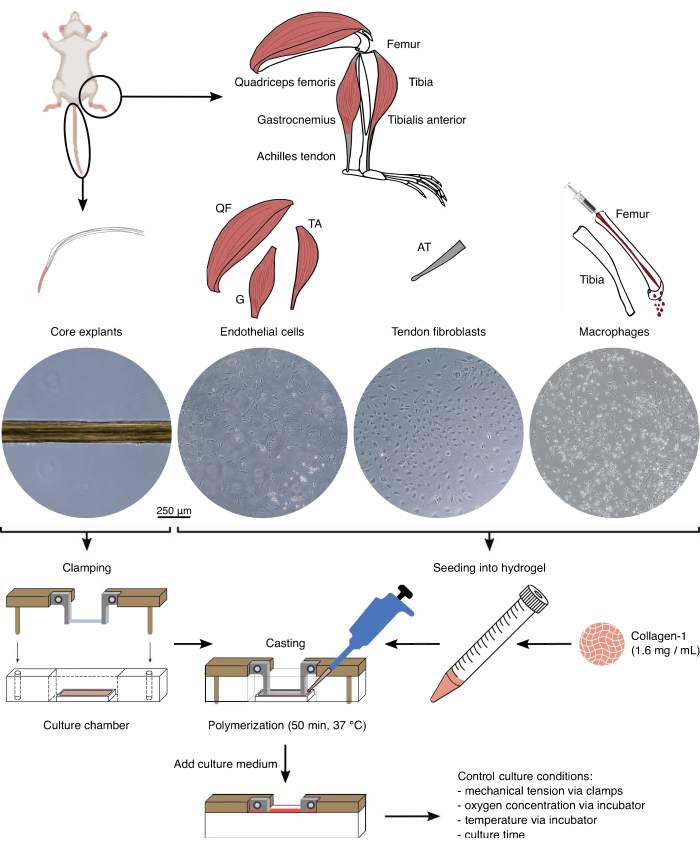
图 1:组装组件分离和组装以模拟 体内 串扰。 从小鼠尾巴中提取肌腱核心外植体,切割并夹紧。消化小鼠腿部肌肉(即股四头肌 (QF)、腓肠肌 (G) 和胫骨前肌 (TA))以分离内皮细胞,然后在组织培养塑料上培养。跟腱(AT)也被消化以分离肌腱成纤维细胞,然后在组织培养塑料上培养。胫骨和股骨的骨髓从骨头中冲出。然后,将分离的单核细胞在组织培养塑料上培养并分化为幼稚巨噬细胞。光学显微镜图像 (10x) 描绘了核心外植体、内皮细胞、肌腱成纤维细胞和巨噬细胞在整合到集合体之前的外观。在组装过程中,将培养在塑料上的细胞悬浮液中,然后接种到胶原蛋白-1溶液(1.6mg / mL)中。然后,将细胞-水凝胶混合物浇铸在夹紧的核心外植体周围,并在加入培养基之前在37°C下聚合50分钟。通过夹具(机械张力)和培养箱设置(氧浓度、温度)控制培养条件。 请点击这里查看此图的较大版本.
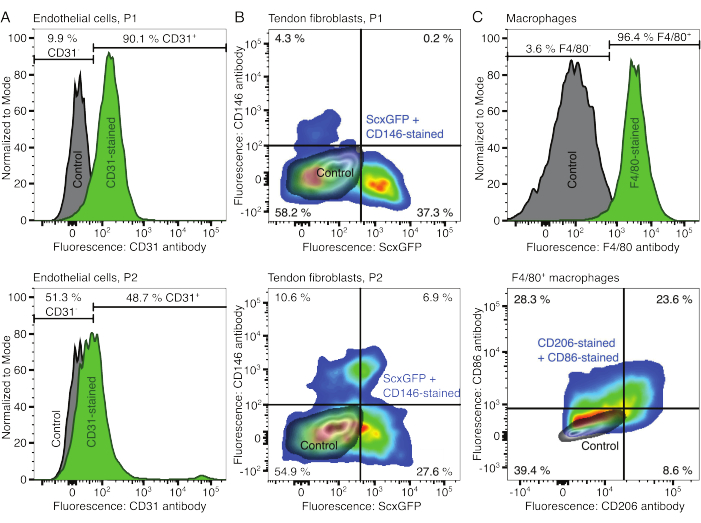
图 2:细胞组合体组分的表征。 (A) 一次传代(P1,顶行)和两次传代(P2,下行)后肌肉来源的内皮细胞的代表性流式细胞术分析。未染色(灰色)和 CD31 染色(绿色)细胞的计数归一化为模态。给出了 CD31 染色组的百分比。(B) 一次传代(P1,顶行)和两次传代(P2,下行)后跟腱衍生成纤维细胞的代表性流式细胞分析。轴报告未染色细胞(灰色)和表达 ScxGFP 并用 CD146 抗体染色(彩虹色)染色的细胞的荧光强度。(C)培养后骨髓来源的巨噬细胞的代表性流式细胞术分析。在第一行中,未染色(灰色)和 F4/80 染色(绿色)细胞的计数归一化为模态。给出了 F4/80 染色组的百分比。底行的图表报告了未染色细胞(灰色)和用 CD206 抗体和 CD86 抗体染色的细胞的 F4/80+ 子集(彩虹色)的荧光强度。 请点击这里查看此图的较大版本.
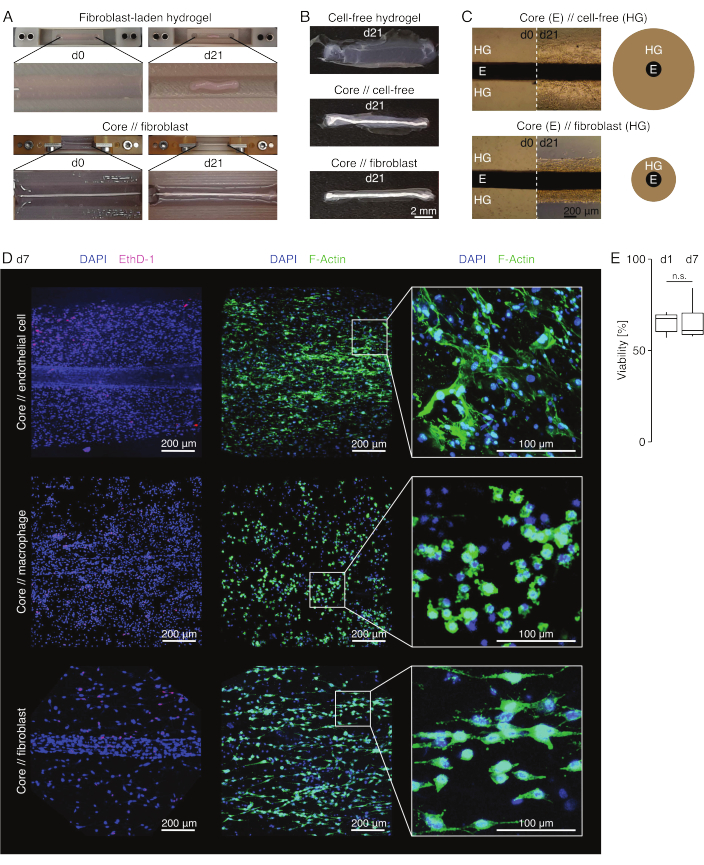
图 3:组装体成像和外观。 (A)在培养的第0天(d0)和第21天(d21)(37°C,20%O2)拍摄的代表性照片显示,含有外源性成纤维细胞的水凝胶的多维收缩,没有嵌入的核心外植体,并且含有外源成纤维细胞的水凝胶在核心外植体周围具有强烈的径向压实。(B) 在培养第 21 天 (d21)(37 °C,20% O2) 拍摄的代表性照片显示,无细胞水凝胶、在核心外植体周围铸造的无细胞水凝胶和在核心外植体周围铸造的富含肌腱成纤维细胞的水凝胶之间的压实速度存在差异。(C) 在培养的第 0 天 (d0) 和第 21 天 (d21)(37 °C,20% O2) 拍摄的代表性光学显微镜图像 (10x) 表明细胞群的存在和核心外植体 (E) 周围的胶原水凝胶 (HG) 的压实速度的纵向变化核心 // 无细胞和核心 // 成纤维细胞组合体共培养。示意图描述了核心//无细胞组合体和核心//成纤维细胞组合体共培养之间水凝胶压实的差异。(D) 核心//内皮细胞、核心//巨噬细胞和核心//成纤维细胞组合共培养(37°C,20%O2)第 7 天 (d7) 拍摄的代表性共聚焦显微镜图像。左行的图像描绘了细胞核染成蓝色 (DAPI) 和死细胞染成粉红色 (Ethidium homodimer-1) 的集合体。另外两行描绘了细胞核染成蓝色 (DAPI) 和肌动蛋白丝染成绿色 (F-肌动蛋白) 的集合体。(E) 描述共培养第 1 天 (d1) 和第 7 天 (d7) 核心//内皮细胞集合体的量化活力的箱线图。N = 5。上铰链和下铰链对应于第一和第三个四分位数(第 25个 和第 75个 百分位数),中间铰链对应于中位数。晶须从上/下铰链延伸到最大/最小值,不超过四分位距的 1.5 倍。P 值: n.s.p > 0.05。 请点击这里查看此图的较大版本.
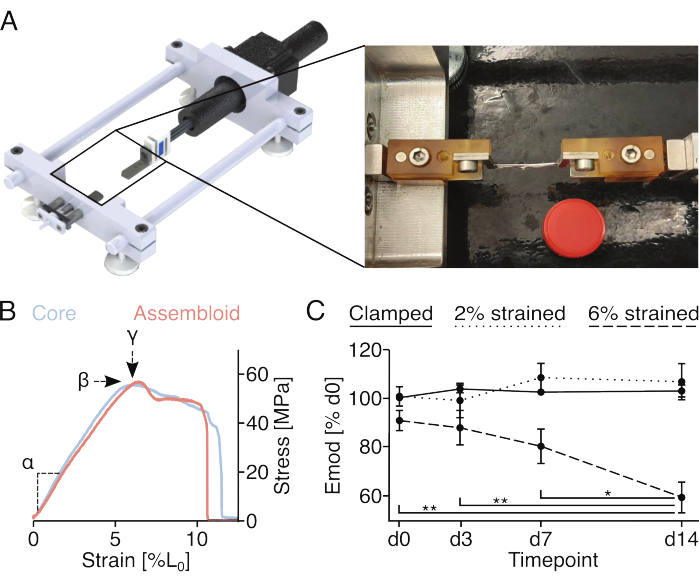
图 4:组件的机械刺激和组件机械性能的测量。 (A) 定制拉伸装置的图形描述,包括夹具支架平台、力传感器和步进电机。摄影图像显示了一个带有夹具的组件安装在拉伸装置上。用于刻度的 15 mL 塑料管 (Ø: 17 mm) 的盖子。(B) 描绘核心外植体(浅蓝色)和集合体(浅红色)的代表性应力/应变曲线的图表。可以从数据中提取线弹性模量 (α)、最大应力 (β) 和最大应变 (у),以机械表征核心外植体或组合体。(C) 显示在实验开始时被夹紧(实线)、夹紧并拉伸至 2% L0 应变(虚线)或夹紧并拉伸至 6% L0 应变(虚线)后,共培养的核心//内皮细胞集合体(29 °C,3% O2)的线弹性模量 (Emod) 的图表。N = 5。将数据点归一化为拉伸前的初始模量线弹性模量,并全部显示为平均值(±sem)。P 值:*p < 0.05,**p < 0.01。请点击这里查看此图的较大版本.
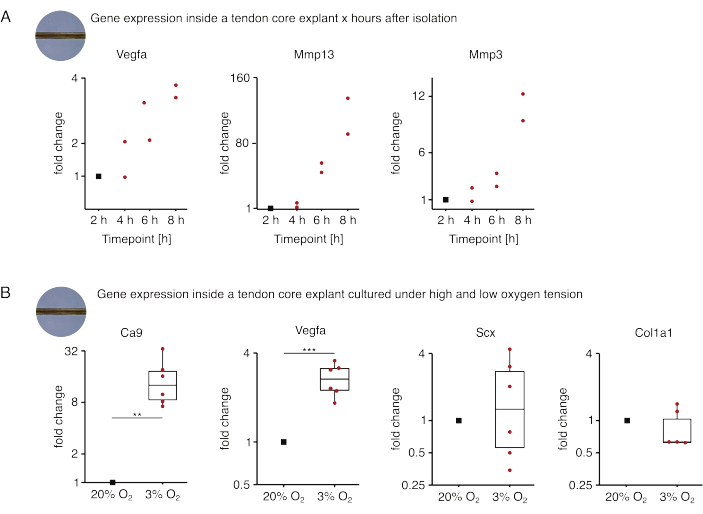
图5:不同生态位条件下分离和培养后核心转录组的变化。 (A) 从尾部分离出 Vegfa、Mmp13 和 Mmp3 基因表达在单培养(37 °C、20% O2)小鼠核心外植体 2 h、4 h、6 h 和 8 h 中的倍数变化的散点图。分离后 2 小时,将相应时间点的折叠变化归一化为基因表达。N = 2。(B) 描述在低氧张力 (3% O2) 下单培养的核心外植体中 Ca9、Vegfa、Scx 和 Col1a1 基因表达的倍数变化的箱线图,并与在高氧张力 (20% O2) 下单培养的外植体进行比较。N = 5-6。箱线图的上铰链和下铰链对应于第一和第三个四分位数(第 25个和第 75 个百分位数),中间铰链对应于中位数。晶须从上/下铰链延伸到最大/最小值,不超过四分位距的 1.5 倍。用于归一化的数据点表示为黑点,单个数据点表示为红点。P 值:**p < 0.01,***p < 0.001。请点击这里查看此图的较大版本.
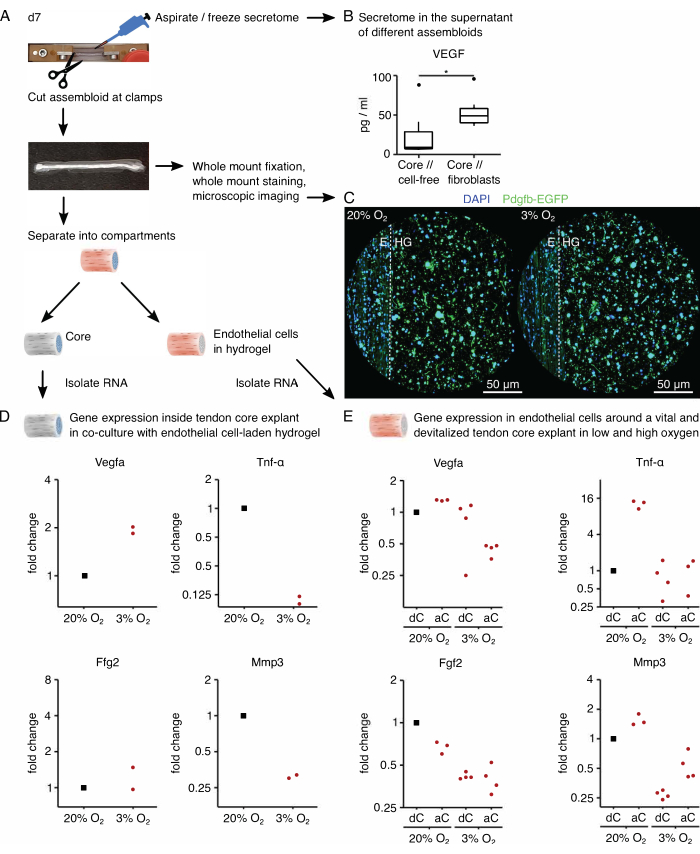
图 6:组装特异性分泌组和隔室特异性转录组分析。 (A) 在第 7 天 (d7) 采集分泌组和转录组样品时显示组装体的代表性照片,并描述了基础工作流程。(B) 共培养 7 天(37 °C,20% O2)后核心 // 无细胞和核心 // 成纤维细胞集合体上清液中的 VEGF 浓度 (pg/mL) 如箱图所示。N = 6。(C)在高氧张力(20%O2)和低氧张力(3%O2)下共培养7天(37°C)后核心//内皮细胞集合体的代表性共聚焦显微镜图像。细胞核染成蓝色 (DAPI),包埋的内皮细胞与内皮细胞标志物血小板衍生生长因子亚基 b (Pdgfb) 共表达增强绿色荧光蛋白 (EGFP)。虚线表示核心外植体 (E) 和内皮细胞负载水凝胶 (HG) 之间的隔室界面。(D) 散点图描绘了在低氧张力 (3% O2) 下共培养的核心// 内皮细胞集合体的核心区室中 Vegfa、Tnf-α、Fgf2 和 Mmp3 基因表达的倍数变化,并与在高氧张力下共培养的内皮细胞集合体 (20% O2) 进行比较。N = 2。(E) 在高氧张力(20% O2)和低氧张力(3% O2)下共培养的内皮细胞集合体外在区室中Vegfa、Tnf-α、Fgf2和Mmp3基因表达的倍数变化的散点图).将各自条件下的倍数变化归一化为核心//内皮细胞组合体的外在区室,该内皮细胞组合体具有在高氧张力(20%O2)下共培养的失活核心(dC)。N = 3-4。在 B 中,箱线图的上铰链和下铰链对应于第一和第三个四分位数(第 25个和第 75个百分位数),中间铰链对应于中位数。晶须从上/下铰链延伸到最大/最小值,不超过四分位距的 1.5 倍。异常值被描绘为黑点。P 值:*p < 0.05。在 D 和 E 中,用于归一化的数据点表示为黑点,单个数据点表示为红点。请点击这里查看此图的较大版本.
表1:肌腱疾病和损伤模型系统的输入要求。 与选定的输入参数相匹配的原发性肌腱疾病触发因素和次要驱动因素列表,这些参数的可处理性对于肌腱疾病和损伤建模至关重要。 请按此下载此表格。
表2:肌腱疾病和损伤模型系统的输出要求。 肌腱疾病特征的选择与输出参数的选择相匹配,其可量化性对于解释肌腱疾病和损伤模型行为至关重要。 请按此下载此表格。
补充文件 1:用于夹具支架、安装站和腔室模具的 .stl 文件。请点击此处下载此文件。
补充文件 2:右夹具支架平面图。请点击此处下载此文件。
补充文件 3:左夹具支架平面图。请点击此处下载此文件。
补充文件4:安装平台平面图 请点击此处下载此文件。
补充文件5:金属夹具平面图。请点击此处下载此文件。
补充文件6:显示无细胞水凝胶收缩的图像。请点击此处下载此文件。
补充文件7:显示失活的核心外植体的图像。请点击此处下载此文件。
讨论
总体而言,此处介绍的装配体模型系统有几个关键步骤需要强调。首先,模型系统的好坏取决于其组件的质量。在开始组装过程之前,在显微镜下检查核心外植体和待接种的细胞群至关重要。使用流式细胞术验证分离细胞群的表型至少一次同样重要。特别是当新一批胶原蛋白-1首次使用时,在将细胞包埋之前,在试运行中检查交联速度是有利的。组件组件需要大量的手动操作,这增加了感染的风险。为了最大限度地降低感染风险,请在具有层流气流的无菌生物安全罩中工作,经常更换手套,并用 80% 乙醇对手套和工作空间进行消毒。出于类似的原因,不要多次使用 3D 打印的夹具支架。在包埋过程本身之前,重要的是将所有水凝胶组分(交联溶液、胶原蛋白-1溶液)保持在冰上,以防止过早交联。因此,一旦将细胞添加到交联溶液中,就必须快速工作,以限制由于交联溶液的高pH值和低温而导致的细胞死亡。为了防止核心外植体中与干燥相关的细胞死亡,在将交联溶液与胶原-1溶液混合之前,立即吸出覆盖夹紧的核心外植体的培养基。为了保证核心外植体在水凝胶中的中心位置,理想的做法是将水凝胶浇铸在略微张紧的夹紧核心外植体周围。为此,请使用定位销和 M3 x 16 mm 螺栓螺钉将夹具固定到(3D 打印)板上,该板组具有适当长度的孔。在50分钟的聚合时间后,可以根据所需的培养条件再次对包埋的核心外植体进行拉伸。组装体在培养过程中经历的张力量对实验结果有深远的影响,并且在样品和条件下应保持一致21。
然而,与大多数组织工程替代方案相比,机械(非)加载对实验结果的巨大影响是组装体模型的主要优势,特别是因为核心外植体的基质组成保持不变,也应该在细胞水平上重建复杂的体内加载模式90。虽然在实践中,到目前为止只证明了组装体的线弹性模量、最大拉伸应变和最大拉伸应力的测量,但疲劳强度和应力松弛测量的协议已经在其他地方描述了腱芯外植体,并且应该适用于组装体91,92。除了类似体内的加载模式外,组件的多级模块化可能是其最大的优势。由于有单独的培养室,可以为每个样品单独设置一组可控的生态位条件(即温度、氧张力、葡萄糖浓度、补充剂、刺激剂、抑制剂和板静态拉伸)。接下来,外在区室的基质刚度和基质组成可以通过水凝胶组合物进行定制,例如,通过掺入更多的胶原蛋白-3和细胞纤连蛋白93,94,95来研究日益患病的组织微环境的影响。外源区室中评估的细胞群很容易通过选择要接种的细胞来适应,但也可以通过利用已建立的转基因细胞系和小鼠系(即ScxLin细胞耗竭)在肌腱核心外植体中进行修饰96。两个隔室的不同基质和细胞组成进一步提供了独特的区室化 3D 结构,这是另一个中央肌腱标志 1,30,46。
使用此系统时,重要的是要考虑系统模块化对结果参数粒度的影响。虽然可以单独评估每个隔室的细胞增殖和募集,但机械性能、分泌组成分和降解产物目前只能测量整个组装体。在吞吐量方面,一个经过适当培训的人员可以在一个正常工作日内准备多达 50 个组件,主要瓶颈是夹紧程序。虽然某些读出方法是相互排斥的,但可以重复评估同一样品的机械性能和分泌组成分,以及细胞群组成(流式细胞术)、细胞转录组(RT-qPCR、RNA 测序)或基质和细胞分布(免疫细胞化学/荧光显微镜)。在以前的出版物中,这些方法已被用于广泛表征暴露于病变样生态位的核心//成纤维细胞和核心//巨噬细胞集合体中的细胞间、跨室相互作用84,85。在这项工作中,探索了组合体模型系统在不同微环境刺激下探测核心和外在内皮细胞之间跨区室相互作用的能力。
模型系统的模块化允许将来对方法进行改进,这对于克服当前设计迭代的以下限制是必要的。这项工作中提出的流式细胞术分析和最近发表的单细胞RNA测序数据显示,肌腱核心驻留的腱细胞和跟腱衍生的群体比以前假设的24,34,59,84,97更具异质性24,34,59,84,97。此外,最初驻留在核心或水凝胶驻留的细胞群的迁移行为模糊了培养过程中的组装体区室化。这两个因素共同使得将转录组差异归因于特定细胞类型以及将增殖与基于迁移的过程区分开来具有挑战性。这一局限性可以通过以下方法克服:根据最近体内研究中表征的健康或患病肌腱的细胞组成,使用荧光激活细胞分选 (FACS) 细化输入群体,通过实施单细胞 RNA 测序来改善读数,并在显微镜检查期间整合增殖标志物,例如 EdU(5-乙炔基-2'-脱氧尿苷)染色。
这里介绍的组装体也与目前大多数可用的体外系统有一个共同的弱点,这些系统模拟与身体其他部分断开的患病器官98,99。然而,这里使用的基于培养室的平台将模型系统定位为可以很好地集成到多器官平台中,在该平台中,模拟不同器官的集合体被连接起来,并且可以研究器官间的相互作用。
该模型系统的核心是基于位置啮齿动物肌腱,这导致了其独特的缺点。首先,结果的可翻译性受到未发育或患有肌腱疾病的野生型小鼠的阻碍8,100,101。整合来自人类或新开发的表现出肌腱疾病方面的小鼠品系的组织和细胞可以缓解这个问题102。向基于人类的组合体的转变特别有趣,因为它可以研究来自不同患病肌腱(即肌腱炎、肌腱变性或肌腱膜炎)的患者来源组织,甚至是耐药供体,从而可以解锁更个性化的治疗方案。其次,小鼠尾腱外植体不能很好地处理超负荷诱导的微损伤,这限制了模型系统在急性肌腱损伤研究中的适用性。
由于所有这些原因,外植体//水凝胶组合体在研究肌腱核心生物学、基质结构-功能相互作用以及特定细胞群之间的跨区室相互作用以响应生态位诱导的微损伤方面处于主要地位。从这些相当高通量的研究中收集到的见解可以为 体内 研究和治疗开发提供方向。
披露声明
作者没有什么可透露的。
致谢
这项工作由 ETH Grant 1-005733 资助
材料
| Name | Company | Catalog Number | Comments |
| 0.4 mm x 25 mm injection needle (G27) | Sterican | 9186174 | |
| 3D printing filament: Clear polylactic acid prusament | Prusa | NA | |
| 4% formaldehyde | Roti-Histofix | P087.4 | |
| Accutase cell detachment solution | Sigma-Aldrich | A6964-100ML | |
| Amphotericin | VWR | L0009-100 | |
| Attachable digital C-mount camera: Moticam 2 | Motic | NA | |
| Bolt screw M3 x 16 mm, stainless steel | RS PRO | 1871235 | |
| Bolt screw M3 x 6 mm, stainless steel | RS PRO | 1871207 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CD146 antibody: PE anti-mouse | BioLegend | 134703 | |
| CD206 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 141709 | |
| CD31 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 102413 | |
| CD86 antibody: PE anti-mouse | BioLegend | 105007 | |
| Collagenase I | Thermo Fisher Scientific | 17100017 | |
| Collagenase IV | Gibco | 17104-019 | |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392-100ML | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 7000183 | |
| Dispase II | Sigma-Aldrich | D4693-1G | |
| DMEM/F12 | Sigma | 7002211 | |
| Dowel Pin, 3 mm x 16 mm, stainless steel | Accu | HDP-3-16-A1 | |
| Dragon Skin 10 Slow/1 silicone | KauPO | 09301-004-000001 | |
| Endopan 3 Kit | Pan-Biotech | P04-0010K | |
| Endothelial cell growth supplement | Lonza | CC-3162 | |
| Eppendorf safe-lock plastic tubes (1.5 mL) | Eppendorf | 30121023 | |
| Ethidium homodimer, EthD-1, 2 mM stock in DMSO | Sigma-Aldrich | 46043-1MG-F | |
| F4/80 antibody: Apc/fire 750 anti-mouse | BioLegend | 123151 | |
| Falcon plastic tube (15 mL) | Corning | 352096 | |
| Falcon plastic tube (50 mL) | Corning | 352070 | |
| Flow cytometer: LSR II Fortessa | BD Bioscience | 23-11617-02 | |
| Gelatin | Invitrogen | D12054 | |
| Hellmanex III alkaline cleaning concentrate | Sigma | Z805939-1EA | |
| Heparin | Sigma-Aldrich | H3149-10KU | |
| Hydroxyproline assay | Sigma-Aldrich | MAK008 | |
| Image analysis software: Motic Images Plus 3.0 ML | Motic | NA | |
| L-Ascorbic Acid Phosphate Magnesium Salt n-Hydrate | Wako Chemicals | 013-19641 | |
| LSE Low Speed Orbital Shaker | Corning | 6780-FP | |
| MEM non-essential amino acids | Sigma | 7002231 | |
| Mouse macrophage-stimulating factor (m-CSF) | PeproTech | 315-02-50ug | |
| MSD assay | Mesoscale Discovery | various | |
| NucBlue | Thermo Fisher Scientific | R37605 | |
| Nylon mesh strainer cap, 100 µm | Corning | 734-2761 | |
| Original Prusa i3 MK3S 3D printer | Prusa | i3 MK3S | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Phosphate-buffered saline (PBS), ph 7.4, sterile, 10 L | Gibco | 10010001 | |
| Puromycin | Gibco | A1113803 | |
| RBC lysis buffer | VWR | 786-650 | |
| recombinant m-CSF | PeproTech | 315-02 | |
| RNA extraction kit: Rneasy plus Micro | Qiagen | 74034 | |
| Slicing software: PrusaSlicer | Prusa | NA | Version 2.6.0 or higher |
| Sterile Cell Strainer 100 µm | Fisherbrand | 22363549 | |
| Surgical scalpel blade No. 21 | Swann-Morton | 307 | |
| Trizol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin-EDTA (0.5 %) | Gibco | 15400054 |
参考文献
- Snedeker, J. G., Foolen, J. Tendon injury and repair - A perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63, 18-36 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Kirkendall, D. T., Garrett, W. E. Function and biomechanics of tendons. Scandinavian Journal of Medicine and Science in Sports. 7 (2), 62-66 (1997).
- Götmark, F., Cafaro, P., O'Sullivan, J. Aging human populations: Good for us, good for the earth. Trends in Ecology and Evolution. 33 (11), 851-862 (2018).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clinics in Sports Medicine. 22 (4), 675-692 (2003).
- Renström, P. A. F. H., Woo, S. L. -. Y. Tendinopathy: A major medical problem in sport. Tendinopathy in Athletes. , (2007).
- Screen, H. R. C., Birk, D. E., Kadler, K. E., Ramirez, F., Young, M. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33 (6), 793-799 (2016).
- Wunderli, S. L., Blache, U., Snedeker, J. G., Wunderli, S. L., Blache, U., Tendon, J. G. S. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connective Tissue Research. 61 (3-4), 262-277 (2020).
- Magnusson, S. P., Langberg, H., Kjaer, M. The pathogenesis of tendinopathy: balancing the response to loading. Nature Reviews Rheumatology. 6 (5), 262-268 (2010).
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., Kjær, M. Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover. FASEB Journal. 32 (9), 4763-4775 (2018).
- Andersson, G., Backman, L. J., Scott, A., Lorentzon, R., Forsgren, S., Danielson, P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis in response to Achilles tendon overuse in a tendinopathy model. British Journal of Sports Medicine. 45 (13), 1017-1022 (2011).
- Rolf, C. G., Fu, B. S. C., Pau, A., Wang, W., Chan, B. Increased cell proliferation and associated expression of PDGFRβ causing hypercellularity in patellar tendinosis. Rheumatology. 40 (3), 256-261 (2001).
- Riley, G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 43 (2), 131-142 (2004).
- Jarvinen, M., Jozsa, L., Kannus, P., Järvinen, T. L., Kvist, M., Leadbetter, W. Histopathological findings in chronic tendon disorders. Scandinavian Journal of Medicine & Science in Sports. 7 (2), 86-95 (1997).
- Soslowsky, L. J., et al. Overuse activity injures the supraspinatus tendon in an animal model: A histologic and biomechanical study. Journal of Shoulder and Elbow Surgery. 9 (2), 79-84 (2000).
- Tran, P. H. T., et al. Early development of tendinopathy in humans: Sequence of pathological changes in structure and tissue turnover signaling. FASEB Journal. 34 (1), 776-788 (2020).
- Theodossiou, S. K., Schiele, N. R. Models of tendon development and injury. BMC Biomedical Engineering. 1 (1), 1-24 (2019).
- Stauber, T., Blache, U., Snedeker, J. G. Tendon tissue microdamage and the limits of intrinsic repair. Matrix Biology. 85-86, 68-79 (2020).
- Wang, T., et al. In vitro loading models for tendon mechanobiology. Journal of Orthopaedic Research. 36 (2), 566-575 (2018).
- Fang, F., Sawhney, A. S., Lake, S. P. Different regions of bovine deep digital flexor tendon exhibit distinct elastic, but not viscous, mechanical properties under both compression and shear loading. Journal of Biomechanics. 47 (12), 2869-2877 (2014).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biology. 89, 11-26 (2020).
- Wunderli, S. L., et al. Minimal mechanical load and tissue culture conditions preserve native cell phenotype and morphology in tendon - A novel ex vivo mouse explant model. Journal of Orthopaedic Research. 36 (5), 1383-1390 (2017).
- Arnoczky, S. P., Lavagnino, M., Egerbacher, M., Caballero, O., Gardner, K. Matrix metalloproteinase inhibitors prevent a decrease in the mechanical properties of stress-deprived tendons. The American Journal of Sports Medicine. 35 (5), 763-769 (2007).
- de Micheli, A. J., et al. Single-cell transcriptomic analysis identifies extensive heterogeneity in the cellular composition of mouse Achilles tendons. American Journal of Physiology - Cell Physiology. 319 (5), C885-C894 (2020).
- Arvind, V., Huang, A. H. Reparative and maladaptive inflammation in tendon healing. Frontiers in Bioengineering and Biotechnology. 9 (July), 1-16 (2021).
- Marsolais, D., Côté, C. H., Frenette, J. Neutrophils and macrophages accumulate sequentially following Achilles tendon injury. Journal of Orthopaedic Research. 19 (6), 1203-1209 (2001).
- Garcia-Melchor, E., et al. Novel self-amplificatory loop between T cells and tenocytes as a driver of chronicity in tendon disease. Annals of the Rheumatic Diseases. 80 (8), 1075-1085 (2021).
- Stolk, M., Klatte-Schulz, F., Schmock, A., Minkwitz, S., Wildemann, B., Seifert, M. New insights into tenocyte-immune cell interplay in an in vitro model of inflammation. Scientific Reports. 7 (1), 9801 (2017).
- Tempfer, H., Traweger, A. Tendon vasculature in health and disease. Frontiers in Physiology. 6, 330 (2015).
- Mienaltowski, M. J., Adams, S. M., Birk, D. E. Regional differences in stem cell/progenitor cell populations from the mouse achilles tendon. Tissue Engineering - Part A. 19 (1-2), 199-210 (2013).
- Sakabe, T., et al. Transcription factor scleraxis vitally contributes to progenitor lineage direction in wound healing of adult tendon in mice. Journal of Biological Chemistry. 293, (2018).
- Dyment, N. A., Hagiwara, Y., Matthews, B. G., Li, Y., Kalajzic, I., Rowe, D. W. Lineage tracing of resident tendon progenitor cells during growth and natural healing. PLoS One. 9 (4), e96113 (2014).
- Harvey, T., Flamenco, S., Fan, C. M. A Tppp3 + Pdgfra + tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Zhang, J., et al. Characterization of the structure, vascularity, and stem/progenitor cell populations in porcine Achilles tendon (PAT). Cell and Tissue Research. 384 (2), 367-387 (2021).
- Tarafder, S., et al. Tendon stem/progenitor cells regulate inflammation in tendon healing via JNK and STAT3 signaling. FASEB Journal. 31 (9), 3991-3998 (2017).
- Lee, C. H., et al. Harnessing endogenous stem/progenitor cells for tendon regeneration Find the latest version Harnessing endogenous stem/progenitor cells for tendon regeneration. J Clin Invest. 125 (7), 2690-2701 (2015).
- Lui, P. P. Y., Chan, L. S., Cheuk, Y. C., Lee, Y. W., Chan, K. M. Expression of bone morphogenetic protein-2 in the chondrogenic and ossifying sites of calcific tendinopathy and traumatic tendon injury rat models. Journal of Orthopaedic Surgery and Research. 4, 27 (2009).
- Takeuchi, E., et al. Localization and expression of osteopontin in the rotator cuff tendons in patients with calcifying tendinitis. Virchows Archiv. 438 (6), 612-617 (2001).
- Kadler, K. E., Hill, A., Canty-Laird, E. G. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Current Opinion in Cell Biology. 20 (5), 495-501 (2008).
- Millar, N. L., et al. MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease. Nature Communications. 6, 6774 (2015).
- Riley, G. P., Harrall, R. L., Constant, C. R., Chard, M. D., Cawston, T. E., Hazleman, B. L. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Annals of the Rheumatic Diseases. 53 (6), 359-366 (1994).
- Thorpe, C. T., Peffers, M. J., Simpson, D., Halliwell, E., Screen, H. R. C., Clegg, P. D. Anatomical heterogeneity of tendon: Fascicular and interfascicular tendon compartments have distinct proteomic composition. Scientific Reports. 6, 20455 (2016).
- Thorpe, C. T., et al. Distribution of proteins within different compartments of tendon varies according to tendon type. Journal of Anatomy. 229 (3), 450-458 (2016).
- Choi, H., et al. Heterogeneity of proteome dynamics between connective tissue phases of adult Tendon. eLife. 9, e55262 (2020).
- Spiesz, E. M., et al. Tendon extracellular matrix damage, degradation and inflammation in response to in vitro overload exercise. Journal of Orthopaedic Research. 33 (6), 889-897 (2015).
- Dyment, N. A., et al. The paratenon contributes to scleraxis-expressing cells during patellar tendon healing. PLoS One. 8 (3), e59944 (2013).
- Cadby, J. A., Buehler, E., Godbout, C., Van Weeren, P. R., Snedeker, J. G. Differences between the cell populations from the peritenon and the tendon core with regard to their potential implication in tendon repair. PLoS One. 9 (3), e92474 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From three-dimensional cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Derwin, K. A., Soslowsky, L. J. A quantitative investigation of structure-function relationships in a tendon fascicle model. Journal of Biomechanical Engineering. 121 (6), 598-604 (1999).
- Herod, T. W., Veres, S. P. Development of overuse tendinopathy: A new descriptive model for the initiation of tendon damage during cyclic loading. Journal of Orthopaedic Research. 36 (1), 467-476 (2017).
- Andersen, M. B., Pingel, J., Kjær, M., Langberg, H. Interleukin-6: A growth factor stimulating collagen synthesis in human tendon. Journal of Applied Physiology. 110 (6), 1549-1554 (2011).
- Langberg, H., Rosendal, L., Kjær, M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. Journal of Physiology. 534 (1), 297-302 (2001).
- Zitnay, J. L., et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nature Communications. 8, 14913 (2017).
- Hwang, J., et al. Molecular assessment of collagen denaturation in decellularized tissues using a collagen hybridizing peptide. Acta Biomaterialia. 53, 268-278 (2016).
- Lin, A. H., Zitnay, J. L., Li, Y., Yu, S. M., Weiss, J. A. Microplate assay for denatured collagen using collagen hybridizing peptides. Journal of Orthopaedic Research. 37 (2), 431-438 (2019).
- Blomgran, P., Blomgran, R., Ernerudh, J., Aspenberg, P. A possible link between loading, inflammation and healing: Immune cell populations during tendon healing in the rat. Scientific Reports. 6, 29824 (2016).
- Harvey, T., Flamenco, S., Fan, C. -. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Pryce, B. A., Brent, A. E., Murchison, N. D., Tabin, C. J., Schweitzer, R. Generation of transgenic tendon reporters, ScxGFP and ScxAP, using regulatory elements of the scleraxis gene. Developmental Dynamics. 236 (6), 1677-1682 (2007).
- Godinho, M. S. C., Thorpe, C. T., Greenwald, S. E., Screen, H. R. C. Elastin is localised to the interfascicular matrix of energy storing tendons and becomes increasingly disorganised with ageing. Scientific Reports. 7 (1), 9713 (2017).
- Smith, M. M., et al. Modulation of aggrecan and ADAMTS expression in ovine tendinopathy induced by altered strain. Arthritis and Rheumatism. 58 (4), 1055-1066 (2008).
- Asundi, K. R., Rempel, D. M. MMP-1, IL-1β, and COX-2 mRNA expression is modulated by static load in rabbit flexor tendons. Annals of Biomedical Engineering. 36 (2), 237-243 (2008).
- Millar, N. L., et al. Inflammation is present in early human tendinopathy. American Journal of Sports Medicine. 38 (10), 2085-2091 (2010).
- Dakin, S. G., et al. Inflammation activation and resolution in human tendon disease. Science Translational Medicine. 7 (311), 311ra173 (2015).
- Jelinsky, S. A., Rodeo, S. A., Li, J., Gulotta, L. V., Archambault, J. M., Seeherman, H. J. Regulation of gene expression in human tendinopathy. BMC Musculoskeletal Disorders. 12, 86 (2011).
- Kannus, P., Józsa, L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. The Journal of Bone and Joint Surgery. American. 73 (10), 1507-1525 (1991).
- Comin, J., et al. The prevalence and clinical significance of sonographic tendon abnormalities in asymptomatic ballet dancers: A 24-month longitudinal study. British Journal of Sports Medicine. 47 (2), 89-92 (2013).
- Schubert, T. E. O., Weidler, C., Lerch, K., Hofstädter, F., Straub, R. H. Achilles tendinosis is associated with sprouting of substance P positive nerve fibres. Annals of the Rheumatic Diseases. 64 (7), 1083-1086 (2005).
- Quigley, A. S., Bancelin, S., Deska-Gauthier, D., Légaré, F., Kreplak, L., Veres, S. P. In tendons, differing physiological requirements lead to functionally distinct nanostructures. Scientific Reports. 8 (1), 4409 (2018).
- Herod, T. W., Chambers, N. C., Veres, S. P. Collagen fibrils in functionally distinct tendons have differing structural responses to tendon rupture and fatigue loading. Acta Biomaterialia. 42, 296-307 (2016).
- Shepherd, J. H., Riley, G. P., Screen, H. R. C. Early stage fatigue damage occurs in bovine tendon fascicles in the absence of changes in mechanics at either the gross or micro-structural level. Journal of the Mechanical Behavior of Biomedical Materials. 38, 163-172 (2014).
- Birch, H. L. Tendon matrix composition and turnover in relation to functional requirements. International Journal of Experimental Pathology. 88 (4), 241-248 (2007).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Hussien, A. A., Niederoest, B., Bollhalder, M., Goedecke, N., Snedeker, J. G. The stiffness-sensitive transcriptome of human tendon stromal cells. Advanced Healthcare Materials. 12 (7), 2101216 (2023).
- Heo, S. J., et al. Aberrant chromatin reorganization in cells from diseased fibrous connective tissue in response to altered chemomechanical cues. Nature Biomedical Engineering. 7 (2), 177-191 (2023).
- Liu, C. -. F., Aschbacher-Smith, L., Barthelery, N. J., Dyment, N., Butler, D., Wylie, C. What we should know before using tissue engineering techniques to repair injured tendons: A developmental biology perspective. Tissue Engineering Part B: Reviews. 17 (3), 165-176 (2011).
- Ruiz-Alonso, S., Lafuente-Merchan, M., Ciriza, J., Saenz-del-Burgo, L., Pedraz, J. L. Tendon tissue engineering: Cells, growth factors, scaffolds and production techniques. Journal of Controlled Release. 333, 448-486 (2021).
- Rinoldi, C., et al. Tendon tissue engineering: Effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Advanced Healthcare Materials. 8 (7), e1801218 (2019).
- Walia, B., Huang, A. H. Tendon stem progenitor cells: Understanding the biology to inform therapeutic strategies for tendon repair. Journal of Orthopaedic Research. 37 (6), 1270-1280 (2018).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles from energy-storing tendons show an age-specific response to cyclic fatigue loading. Journal of The Royal Society Interface. 11 (92), 20131058-20131058 (2014).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles and the interfascicular matrix show decreased fatigue life with ageing in energy storing tendons. Acta Biomaterialia. 56, 58-64 (2017).
- Youngstrom, D. W., Rajpar, I., Kaplan, D. L., Barrett, J. G. A bioreactor system for in vitro tendon differentiation and tendon tissue engineering. Journal of Orthopaedic Research. 33 (6), 911-918 (2015).
- Stauber, T., et al. Extrinsic macrophages protect while tendon progenitors degrade: Insights from a tissue engineered model of tendon compartmental crosstalk. Advanced Healthcare Materials. 10 (20), e2100741 (2021).
- Stauber, T., Moschini, G., Hussien, A. A., Jaeger, P. K., De Bock, K., Snedeker, J. G. IL-6 signaling exacerbates hallmarks of chronic tendon disease by stimulating progenitor proliferation & migration to damage. eLife. 12, RP87092 (2023).
- Doillon, C. J., Mantovani, D., Rajan, N., Habermehl, J., Cote, M. Preparation of ready-to-use storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1 (6), 2753-2758 (2007).
- Blache, U., et al. Inhibition of ERK 1/2 kinases prevents tendon matrix breakdown. Scientific Reports. 11 (1), 6838 (2021).
- Liu, X., et al. The role of vascular endothelial growth factor in tendon healing. Frontiers in Physiology. 12, 766080 (2021).
- Claxton, S., Kostourou, V., Jadeja, S., Chambon, P., Hodivala-dilke, K., Fruttiger, M. Efficient, inducible Cre-recombinase activation in vascular endothelium. Genesis. 46 (2), 74-80 (2008).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nature Biomedical Engineering. 5 (12), 1457-1471 (2021).
- Lee, A. H., Szczesny, S. E., Santare, M. H., Elliott, D. M. Investigating mechanisms of tendon damage by measuring multi-scale recovery following tensile loading. Acta Biomaterialia. 57, 363-372 (2017).
- Lee, A. H., Elliott, D. M. Multi-scale loading and damage mechanisms of plantaris and rat tail tendons. Journal of Orthopaedic Research. 37 (8), 1827-1837 (2019).
- Williams, I. F., Heaton, A., McCullagh, K. G. Cell morphology and collagen types in equine tendon scar. Research in Veterinary Science. 28 (3), 302-310 (1980).
- Maffulli, N., Ewen, S. W. B., Waterston, S. W., Reaper, J., Barrass, V. Tenocytes from ruptured and tendinopathic achilles tendons produce greater quantities of type III collagen than tenocytes from normal achilles tendons: An in vitro model of human tendon healing. American Journal of Sports Medicine. 28 (4), 499-505 (2000).
- Pajala, A., Melkko, J., Leppilahti, J., Ohtonen, P., Soini, Y., Risteli, J. Tenascin-C and type I and III collagen expression in total Achilles tendon rupture. An immunohistochemical study. Histology and Histopathology. 24 (10), 1207-1211 (2009).
- Best, K. T., et al. Scleraxis-lineage cell depletion improves tendon healing and disrupts adult tendon homeostasis. eLife. 10, e62203 (2021).
- Lehner, C., et al. Tenophages: A novel macrophage-like tendon cell population expressing CX3CL1 and CX3CR1. DMM Disease Models and Mechanisms. 12 (12), dmm041384 (2019).
- Ajalik, R. E., et al. Human organ-on-a-chip microphysiological systems to model musculoskeletal pathologies and accelerate therapeutic discovery. Frontiers in Bioengineering and Biotechnology. 10, 846230 (2022).
- Ingber, D. E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics. 23 (8), 467-491 (2022).
- Brehm, M. A., Shultz, L. D., Luban, J., Greiner, D. L. Overcoming current limitations in humanized mouse research. The Journal of Infectious Diseases. 208 Suppl (Suppl 2), 125-130 (2013).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Disease Models & Mechanisms. 7 (11), 1205-1213 (2014).
- Costa-Almeida, R., Calejo, I., Reis, R. L., Gomes, M. E. Crosstalk between adipose stem cells and tendon cells reveals a temporal regulation of tenogenesis by matrix deposition and remodeling. Journal of Cellular Physiology. 233 (7), 5383-5395 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。