基于离子半导体测序平台的胃癌多基因单核苷酸多态性检测
摘要
该协议提出了基于离子半导体测序平台检测胃癌样本中单核苷酸多态性所需的整体实验室程序。此外,还详细介绍了靶序列、连接接头、文库扩增和纯化以及质量控制标准。
摘要
胃癌是一种常见的异质性肿瘤。大多数患者在诊断时患有晚期胃癌,通常需要化疗。虽然5-氟尿嘧啶(5-FU)在治疗中被广泛使用,但其治疗敏感性和药物耐受性仍有待确定,这凸显了个体化给药的重要性。药物遗传学可以指导个体化治疗的临床实施。单核苷酸多态性 (SNP) 作为一种遗传标记,有助于选择合适的化疗方案和剂量。一些SNPs与叶酸代谢有关,叶酸代谢是5-FU的治疗靶点。 亚甲基四氢叶酸还原酶 (MTHFR)rs1801131和rs1801133、 二氢叶酸还原酶 (DHFR)rs1650697和rs442767、 蛋氨酸合酶 (MTR)rs1805087、 γ-谷氨酰水解酶 (GGH)rs11545078和 溶质载体家族19成员 1(SLC19A1)rs1051298在不同种类的癌症和抗叶酸抗肿瘤药物中进行了研究,对5-FU的应用。ION TORRENT下一代半导体测序技术可以快速检测胃癌相关的SNP。每次碱基在DNA链中延伸时,都会释放一个H+ ,引起局部pH值的变化。离子传感器检测pH值变化,并将化学信号转换为数字信号,通过合成实现排序。该技术样本量低、操作简单、成本低、测序速度快,有利于指导SNPs个体化化疗。
引言
胃癌是全球公共卫生领域的沉重负担。根据国际癌症研究机构 (IARC) 发布的《2020 年全球癌症统计》,胃癌是第五大确诊癌症,也是癌症相关死亡的第四大原因。在世界范围内,东亚地区年龄标准化率的发病率在男性和女性中均最高1。胃癌的发生是隐匿的,这意味着患者在早期往往没有任何明显和特异性的症状。在所有胃癌患者中,在没有常规筛查的国家,80%-90%的患者要么在肿瘤无法手术的晚期被诊断为晚期,要么在手术后5年内复发2。
对于晚期或转移性胃癌,化疗是主要治疗方法,可以提高患者的生存率和生活质量。对于转移性胃癌患者的初始治疗,铂-氟嘧啶方案是一线化疗方案的主要选择3。氟嘧啶主要包括5-氟尿嘧啶(5-FU)和口服氟嘧啶衍生物,如卡培他滨和替加氟。5-FU的主要靶点是叶酸代谢相关酶,抑制DNA合成,减缓肿瘤组织的生长。药物不良反应限制了其实用性,腹泻、黏膜炎、骨髓抑制和手足综合征是最常见的副作用。据报道,治疗反应和药物不良反应与叶酸代谢途径中的因素密切相关。值得注意的是,rs1801131 的纯合突变已被确定为手足综合征的指标 (p = 4.1 x 10-6,OR =9.99,95% CI:3.84-27.8)4。尽管氟嘧啶在抗癌化疗中被广泛使用,但它们的化学耐药性是一种常见的紧急情况,会导致胃癌治疗失败。例如,在接受 5-FU 治疗的晚期结直肠癌患者中,总体缓解率仅为 10%-15%。此外,氟嘧啶类药物的毒性也不容忽视。5-FU诱导的毒性反应主要包括腹泻、手足综合征、口炎、中性粒细胞减少、血小板减少、神经毒性,甚至死亡6。在接受氟嘧啶类药物治疗的患者中,10%-30%发生严重治疗相关毒性,其中0.5%-1%的患者发生致命毒性7。
一项针对晚期胃癌患者的生活质量研究发现,接受基于 5-FU 的化疗的患者的反应率低于 50%8。因此,了解与基于5-FU的化疗敏感性相关的因素对于精确治疗以最大限度地提高反应率和有效性,同时最小化毒性尤为重要。考虑到5-FU与叶酸代谢密切相关,叶酸代谢途径中酶的遗传变异可能是影响因素之一。大约 90% 的人类序列变异归因于 DNA 中的单碱基突变,称为单核苷酸多态性 (SNP)9。当SNPs改变叶酸代谢的酶性质时,可能导致胃癌患者对氟尿嘧啶的疗效、毒性和化学耐药性存在个体差异。
亚甲基四氢叶酸还原酶(MTHFR)主要用于将5,10-亚甲基四氢叶酸(5,10-MTHF)转化为5-甲基四氢叶酸。5-FdUMP 是 5-FU 的代谢产物,与 5,10-MTHF 和胸苷酸合酶 (TS) 形成无活性的三元,抑制 TS 的活性并导致 dTMP10 的缺乏。5,10-MTHF的积累可以增强5-FU对TS的抑制作用,这与MTHFR的活性相关。 MTHFR rs1801131 和 rs1801133 是最常见的多态性,与酶活性降低(rs1801133 下降 75%,rs181131 下降 30%)和 5,10-MTHF11 积累有关。
二氢叶酸还原酶(DHFR)是叶酸代谢和DNA合成的关键酶。DHFR使用NADPH将二氢叶酸还原为四氢叶酸(THF),用于携带一碳单元。DHFR的SNPs可能影响其表达,改变THF的活性和丰度,进而影响叶酸代谢和5-FU的敏感性。DHFR rs1650697点突变发生在DHFR基因的主要启动子上,使DHFR表达增加12。一项研究发现,rs442767 与培美曲塞和甲氨蝶呤等抗叶酸类抗肿瘤药物的疗效和毒性有关。关于 SNP rs442767,GT 基因型表示每个父母在同源染色体上的同一位点遗传了 G 等位基因和 T 等位基因。同样,基因型 GG 和 TT 相应地表示两个 G 等位基因或两个 T 等位基因的遗传。与基因型 GT+TT 相比,GG 与无事件生存期降低和风险增加有关13.这表明rs442767可能导致对5-FU有一定的潜在影响。
蛋氨酸合酶 (MTR) 催化同型半胱氨酸再甲基化为蛋氨酸,蛋氨酸在叶酸代谢中起重要作用。 MTR rs1805087是 MTR 基因最常见的多态性。 MTR rs1805087 在蛋白质的潜在功能位点用甘氨酸替代天冬氨酸,这可能会降低 MTR 的活性。具有 G 等位基因的受试者血浆叶酸水平升高,血浆同型半胱氨酸水平降低14。相反,一项研究表明,rs1805087 与 5-FU 的功效没有统计学上的显着关联。但这项研究的重点是结直肠癌,样本量很小。rs1805087 与 5-FU 在胃癌患者中的疗效之间的关系仍有待探索15.
γ-谷氨酰水解酶 (GGH) 是一种调节细胞内叶酸浓度的溶酶体酶。紫檀酰谷氨酸是叶酸的同义词,由蝶呤、对氨甲基苯甲酸和谷氨酸组成。生物体中有两种形式的叶酸,单谷氨酸叶酸和多谷氨酸叶酸。THF-聚谷氨酸被 GGH 酶促转化为单谷氨酸叶酸,连续释放单谷氨酸 (mono-Glu) 或二谷氨酸 (di-Glu)16。一项关于局部晚期胃癌患者 GGH 表达的研究表明,高 GGH 表达可以降低 5,10-MTHF 和 TS,这意味着只需要少量的 5-FU 即可在这些患者中达到 TS 抑制作用17.GG 是局部晚期胃癌患者接受 S-1(5-FU 的前药)术后辅助化疗的预后生物标志物,在维持叶酸18 的细胞内稳态中起重要作用。 GGH rs11545078 是错义变体,将 Thr-127 改为 Ile-127。一项针对 GGH 底物特异性的研究表明,与野生型相比,rs11545078 对甲氨蝶呤的 Km 更高,催化效率更低,结构与叶酸19 相似。总之,探索 rs11545078 与 5-FU 临床结果之间的关系是了解耐药性的一种有前途的策略。
溶质载体家族 19 成员 1 (SLC19A1),也称为还原叶酸转运蛋白,是一种典型的促进性跨膜蛋白,它输入哺乳动物细胞缺乏从头合成能力的还原叶酸,这被认为可以估计肿瘤对 5-FU20 的反应。然而,关于 5-FU 与 SLC19A1 多态性之间的关联,只有少数研究21。在接受培美曲塞(叶酸类似物)的非小细胞肺癌患者中,SLC19A1基因上的rs1051298有助于增加所有药物不良反应的风险并降低总生存期22,23。SLC19A1 rs1051298 是一种关于叶酸代谢的 3' 未翻译区域变体,可能有助于解释 5-FU 疗法的一些个体差异。本文的目的是评估胃癌患者 rs1051298 与 5-FU 耐药性之间的关联。
采用基于半导体测序的试剂盒进行 体外 定性基因检测(图1),可检测5个基因的7个选定SNP、 MTHFR 基因的rs1801131和rs1801133突变、 DHFR 基因的rs1650697和rs442767突变、 MTR 基因的rs1805087突变、 GGH 基因的rs11545078突变和 SLC19A1 的rs1051298胃癌患者肿瘤组织样本中的基因。首先提取样本核酸,通过PCR对目标片段进行特异性扩增。在DNA片段的两端添加一个通用测序接头,以构建可用于测序的文库。然后通过PCR对测序文库进行扩增,形成测序模板。对阳性模板进行富集,满足测序要求。利用半导体测序系统,通过将DNA链固定在半导体芯片的微小孔中。DNA聚合酶以单链DNA为模板,根据互补碱基配对原理合成互补DNA链。每次碱基在DNA链中延伸时,都会释放一个质子,引起局部pH值的变化。离子传感器检测pH值变化,并将化学信号转换为数字信号,从而可以实时解读碱基,最后可以得到每个DNA片段的碱基序列。生物信息学分析用于将这些序列与人类基因组的参考图谱进行匹配。当胃癌相关基因发生突变时,其对应的DNA碱基序列会发生变化,从而获得相关基因的突变信息。
研究结果可显示胃癌患者的基因突变状态,为临床医生选择适宜的化疗药物类型和剂量,预测胃癌患者的耐药性提供参考。但检测结果仅供临床参考,不建议作为患者个体化治疗的唯一依据。临床医生应根据患者的病情、用药适应证、治疗反应等实验室检查指标作出综合判断。
研究方案
本研究中使用的所有方案和从上消化道内窥镜检查或手术中获得的胃癌组织样本均于 2023 年 7 月 24 日经医学伦理委员会审查和批准 (NFEC-2023-298)。此外,该协议专门用于说明胃癌中的多基因检测,而不进行队列比较,因此它没有规定纳入或排除患者的具体标准。患者/参与者提供了参与本研究的书面知情同意书。
1.胃癌嵌入块的制备
- 按照规定的操作指南配置组织包埋系统,包括石蜡储液器和分配器,以及温板和冷板。
- 从脱水机中提取准备好的包埋组织,并将其沉积到包埋中心的储存槽中。
- 根据组织大小选择适合包埋模具,倒入足够量的熔融石蜡以覆盖组织,然后将模具放置在温暖的板上。
- 从包埋盒中取出组织,并将胃粘膜垂直于包埋模具的基部放置,以确保横截面平面切开所有组织层。将组织对准模具中的组织。
- 将盒放在模具的顶部,然后二次浇注石蜡,填充模具。
- 将嵌入的模具放在冷板上,在石蜡凝固后,从模具中折断嵌入的块。
2. 从样本中提取核酸
- 使用核酸提取和纯化试剂盒从石蜡包埋的组织样品中提取核酸。
- 使用核酸定量器对提取的核酸进行定量。建议核酸浓度大于 2 ng/μL。
注意:此处使用的材料可在 材料表中找到。
3. 测序文库的准备
- 实验前的准备工作
- 打开紫外线灯,在超净工作台上,消毒30分钟。然后,关闭紫外线灯并打开风扇通风 10 分钟。
- 将核酸从-20±5°C冰箱中取出,检查并记录样品ID,核酸条形码和分配给样品的特定标签标签号。验证后将其置于离心管架上在室温(RT)下溶解,离心10秒,固定为2,500× g 待机。
- 靶片段的PCR扩增
- 从定制的胃癌多基因联合检测试剂盒中取出片段捕获反应溶液、胃癌扩增引物和融合扩增引物,置于冰上熔融。熔融后摇匀混合,离心10秒,制备无核酸酶水。详细的引物信息如 表1所示。
注意:该套件尚未上市,请联系 authotrs 了解更多详情。 - 准备0.2mL PCR反应管,按 补充表1依次向试剂管中加入试剂,涡旋混匀5秒,瞬间离心10秒,固定为2,500× g,使管壁和盖上无明显滴落。RNA样品应被逆转录成cDNA,然后用于后续文库构建。cDNA产物应依次加入试管中,照 附表2。
- 将每个反应管放在热循环仪上。对于 DNA 样品,运行扩增程序,如 表 2 中所述。对于 cDNA 产物,请按照 表 3 中详述的方式运行扩增程序。
- 从定制的胃癌多基因联合检测试剂盒中取出片段捕获反应溶液、胃癌扩增引物和融合扩增引物,置于冰上熔融。熔融后摇匀混合,离心10秒,制备无核酸酶水。详细的引物信息如 表1所示。
- 引物序列的酶解
- 取出引物消化酶,放在冰上融化。扩增后,取出上述反应管,向每个试管中加入2 μL引物酶解酶,保证总体积为22 μL。
- 在PCR管中涡旋并混合反应溶液,并立即离心10秒,固定的2,500× g。
- 将每个反应管放在热循环仪上,并按照 表4中所述运行程序。
- 接头结扎
- 将连接试剂的适配器放在冰上溶解。准备1.5mL微量离心管,然后根据 表5混合各组分,并将其标记为适配器混合物X。
注:连接试剂的接头包括 P1 接头和特定接头 X,编号为 1 至 48。它们旨在唯一地标记各种样品。添加特定适配器时,一次只能打开一个管子,以防止特定适配器的交叉污染。稀释的特定适配器混合物可以储存在-20±5°C以备备用。在测序工作流程中,样本不是单独处理的,而是将多个样本(每个样本都用特定适配器标记)组合到一个统一的库中,用于测序。该方法可以根据样品的特定接头序列对样品进行后续区分。 - 从热循环仪中取出消化的引物产物 (22 μL)。按 表6依次加入试剂入管中,涡旋混匀5秒。低速离心10秒,以固定的2,500× g离心,使管壁和管盖上无明显滴落。
- 将反应管放在热循环仪上。对于 DNA 样品,运行扩增程序,如 表 7 中所述。对于 cDNA 产物,请按照 表 8 中所述运行扩增程序。
- 将连接试剂的适配器放在冰上溶解。准备1.5mL微量离心管,然后根据 表5混合各组分,并将其标记为适配器混合物X。
- 连接产物的纯化和扩增
- 事先将DNA纯化磁珠从2-8°C冰箱中取出,均匀涡旋,并立即离心10秒,固定为2,500× g。在室温下平衡磁珠 30 分钟。
- 准备 1.5 mL 低吸附微量离心管,并将连接反应产物转移到相应的管中。
- 将 45 μL DNA 纯化的磁珠加入每个试管中,涡旋并充分混合,瞬间离心 10 秒,并在室温下孵育 5 分钟。
- 将试管放在磁性架上 3 分钟。丢弃上清液,避免将珠子移出。
- 将 300 μL 新制备的 75% 乙醇转移到微量离心管中,并将管轻轻旋转 4 次,旋转 180°。溶液澄清后,迅速弃去上清液。避免将珠子移出。重复洗涤过程 1 次以上。
- 从磁铁架中取出 1.5 mL 微量离心管,并短暂离心(10 秒,固定 2,500 x g)。将试管放回磁铁架中,然后用移液器吸出剩余的液体。确保管壁上没有残留液体。
- 打开每个 1.5 mL 微量离心管的盖子,并在室温下干燥珠子 5 分钟。注意珠子的干湿状况。磁珠干燥后,检查表面是否有水渍。如果磁珠太湿,请适当延长干燥时间。如果珠子上出现任何裂纹,请立即盖上盖子,并继续下一步以扩增和纯化文库。
- 文库的扩增和纯化
- 事先将PCR相关试剂置于冰上溶解,涡旋,离心10秒。从磁铁架中取出1.5mL微量离心管,根据 表9 将PCR试剂移液到管中,并盖上盖子并涡旋5s。短暂离心(10 秒),使管壁和盖子上没有明显的液滴。
- 将上述产物转移到新的PCR管中。将样品放在热循环仪上孵育。对于 DNA 样品,运行扩增程序,如 表 10 中所述。对于 cDNA 产物,请按照 表 11 中所述运行扩增程序。
- 准备一个新的 1.5 mL 低吸附微量离心管。孵育后将PCR管离心10秒。将产物从PCR管转移到EP管中。
- 将 25 μL DNA 纯化的磁珠加入每个试管中。涡旋混合均匀,低速离心,在室温下孵育 5 分钟。
- 将试管放在磁性架上 3 分钟,等待溶液变得透明。将上清液转移到新的微量离心管中。避免将珠子移出。
- 将 60 μL DNA 纯化的磁珠加入每个试管中。涡旋混合均匀,低速离心,在室温下孵育 5 分钟。
- 将试管放在磁性架上 3 分钟,等待溶液变得透明。丢弃上清液。避免将珠子移出。
- 将 300 μL 新制备的 75% 乙醇转移到试管中,并以 180° 轻轻旋转试管 4 次。溶液澄清后,迅速移液并弃去上清液。避免将珠子移出。重复洗涤过程 1 次。
- 从磁性架上取出 1.5 mL 微量离心管,短暂离心 (10 秒)。将试管插回磁性管架中,然后用吸液吸出剩余的液体。确保管壁上没有残留液体。
- 打开 1.5 mL 试管的盖子,在室温下干燥珠子 5 分钟。注意珠子的干湿状况。磁珠干燥后,表面没有水渍。如果磁珠太湿,请适当延长干燥时间。如果珠子上出现任何裂纹,请立即盖上盖子。
- 将 50 μL 洗脱液移液到试管中,涡旋并充分混合。短暂离心(5秒,固定2,500× g)并将管置于室温下5分钟。
- 将试管放在磁性架上 3 分钟,等待溶液变得透明。小心地将液体取出到新管中,并标记文库名称。
- 将库暂时存放在2-8°C的冰箱中,等待定量测定,或将库存放在-20±5°C的冰箱中长期储存。
4. 所建库的量化
- 使用核酸定量器对文库进行定量。如果文库浓度≥ 0.2 ng/μL,则为合格品。否则,请重建库。
- 混合等体积的DNA(或RNA)并定量溶液。根据定量结果,用以下公式将混合溶液稀释至100 pmol/L。
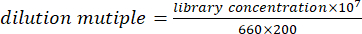
注:另一种方法是根据公式将文库稀释至100 pmol/L,然后通过荧光定量PCR进行定量。根据PCR仪器的定量结果均匀混合DNA(或RNA)文库。 - 以 4:1 的比例混合 100 pmol/L DNA 文库和 RNA 文库。使用DNA和RNA文库的混合溶液进行计算机测序。
5. 测序
- 参考测序反应通用试剂盒手册进行测序反应24,25(半导体测序法)进行测序。
6.样品的质量控制
- 胃癌DNA阳性质控:取胃癌DNA阳性对照,按试剂盒说明书进行检测。控制器随套件一起提供。结果表明,均检测到MTHFR、DHFR、MTR、GGH和SLC19A1基因突变体。
- 胃癌DNA阴性质控:取胃癌DNA阴性对照,按试剂盒说明书进行检测。控制器随套件一起提供。结果表明,该基因的野生型MTHFR、DHFR、MTR、GGH和SLC19A1基因均被检测到。
注意:确保在两种情况下都满足条件,否则需要重新检测。
7. 数据分析
- 在 Torrent Suite 软件中运行相应的插件(Variant Caller、Coverage Analysis 和 Ion Reporter 软件)以获得样品的分析结果。根据插件的分析结果判断样品检测结果。
结果
测试结果的确定依赖于正判断值,该值也被认为是参考区间。使用半导体测序方法检测收集的临床样本。当MTHFR、DHFR、MTR、GGH和SLC19A1基因的突变频率值为≥5%时,检测结果为对应基因的突变体。当突变频率值为<5 %时,检测结果为对应基因的野生型26。
以下标准可用于确定检测结果是否可信。首先,如果DNA测序结果的平均覆盖率为≥500,RNA测序结果的映射读长为20000≥,则检测结果是可信的27。否则,建议重新测试。其次,胃癌DNA阳性质控平均覆盖率为≥500,检测结果应符合 MTHFR 基因rs1801131和rs1801133突变、 DHFR 基因rs1650697和rs442767突变、 MTR 基因rs1805087突变、 GGH 基因rs11545078突变和 SLC19A1 rs1051298突变基因为阳性。否则,建议重新测试。(3)胃癌DNA阴性质控的平均覆盖率为≥500,检测结果应显示该试剂盒检测范围内的所有位点均为野生型。否则,建议重新测试。最后,文库浓度低于0.2 ng/μL,这可能是由于样品中DNA或RNA的降解,或者是实验过程中没有严格遵循实验过程或使用过期试剂。上述情况可能导致测序质量下降或失败。建议重建库。
使用该试剂盒,只需执行一系列步骤即可从临床样本中构建测序库。然后在离子半导体测序平台上对文库进行测序,并使用ANNOVAR对结果进行注释。测序后,使用一份文件来总结每个样本的突变体类型。没有突变类型表明样本没有发生该特定突变。 补充表3 提供了一个典型的例子。 表 12 包括此处检测到的 SNP 的基本信息。在各种数据库中使用基于过滤器的注释分析每个SNP,例如1000基因组计划(1000g2015aug; https://www.internationalgenome.org/;表13)以及外显子组聚合联盟(ExAC; https://gnomad.broadinstitute.org/;表14)可以揭示不同的SNPs在不同的群体中显著存在。
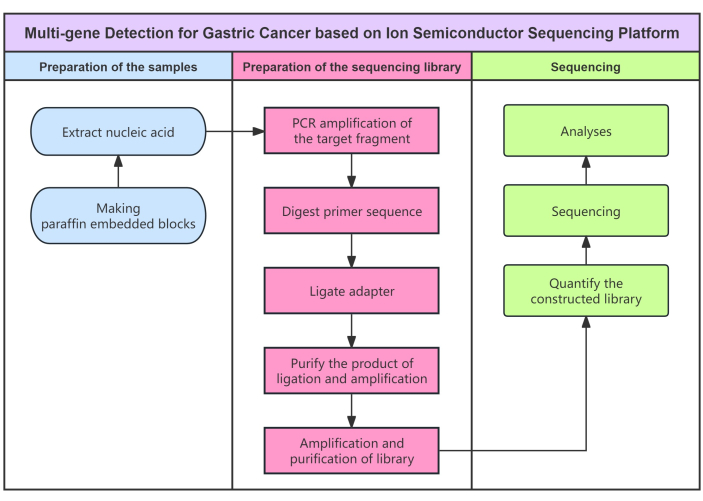
图 1:协议的流程图。 使用半导体测序方法进行胃癌多基因检测的流程图。 请点击这里查看此图的较大版本.
| 染色体 | 位置 | 引物设计间隔 | 左底漆 | 正确的底漆 | |
| CHR1的 | 11854475 | CHR1:11854175-11854775 | 阿卡加特格 GAAGTCACAG | AAACCGGAAT公司 GGTCACAAAG | |
| 11856377 | CHR1:11856077-11856677 | CTTCAGGTCA公司 GCCTCAAAGC公司 | TCCCTGTGGT CTCTTCATCC | ||
| CHR5型 | 79950780 | 中文5:79950480-79951080 | 中国总商会 AGTAGGTTCT | CTTCCTCCTC 中国总会化学工业联合会 | |
| 79951495 | CHR5:79951195-79951795 | CTTGGGTCAC公司 CTGCACAGTA | ATTTTGAAGC ACCCAAGCTG公司 | ||
| CHR1的 | 237048499 | CHR1:237048199-237048799 | GTCAAAGGCC AGTCCCTTCT | CTCCCTTCAC 中科院 | |
| CHR8型 | 63938763 | 中文:63938463-63939063 | 卡格加格特 CAGCGGCAT公司 | TATTTTCCTGT GTGGGGCAC公司 | |
| CHR21型 | 46934825 | CHR21:46934525-46935125 | CCAACCTGAG ATGGCTTTTC | TCCTTGGTGC(英语:TCCTTGGTGC) TCTTGCTTTT | |
表 1:5 个基因中 7 个选定 SNP 使用的引物。 该表显示了有关胃癌中与 5-FU 耐药性相关的 SNP 引物位置的信息。
| 温度 | 时间 | 不。周期数 |
| 99 摄氏度 | 2 分钟 | 1 个周期 |
| 99 摄氏度 | 15 秒 | 22 个周期 |
| 60 摄氏度 | 4 分钟 | |
| 10 摄氏度 | 拿 | 1 个周期 |
表 2:DNA 扩增的热循环程序。 图中显示了温度、时间和循环等热反应条件。
| 步 | 温度 | 时间 | 不。周期数 |
| 激活酶 | 99 摄氏度 | 2 分钟 | 1 个周期 |
| 变性 | 99 摄氏度 | 15 秒 | 30 个周期 |
| 退火和延伸 | 60 摄氏度 | 4 分钟 | |
| 保存 | 10 摄氏度 | 拿 | 1 个周期 |
表 3:cDNA 扩增的热循环程序。 图中显示了温度、时间和循环等热反应条件。
| 温度 | 时间 | 不。周期数 |
| 50 摄氏度 | 10 分钟 | 1 个周期 |
| 55 摄氏度 | 10 分钟 | 1 个周期 |
| 60 摄氏度 | 20 分钟 | 1 个周期 |
| 10 摄氏度 | 拿 | 1 个周期 |
表 4:用于酶解引物序列的热循环程序。 图中显示了温度、时间和周期等热反应条件。
| 元件 | 卷 |
| P1 适配器 | 1.5微升 |
| 特定适配器 X | 1.5微升 |
| 无核酸酶水 | 3微升 |
| 反应系统总体积 | 6微升 |
| X:表示特定的适配器编号 |
表5:用于制备接头混合物的添加试剂的顺序。 按照此处提供的顺序将试剂加入试管中。
| 元件 | 卷 |
| 连接缓冲器 | 4微升 |
| 适配器混合物 X | 2微升 |
| DNA连接酶 | 2微升 |
| 反应系统总体积 | 30微升 |
表6:将试剂添加到消化引物生产中的顺序。 按照此处提供的顺序将试剂加入试管中。
| 温度 | 时间 | 不。周期数 |
| 22 摄氏度 | 30 分钟 | 1 个周期 |
| 72 摄氏度 | 10 分钟 | 1 个周期 |
| 10 摄氏度 | 拿 | 1 个周期 |
表 7:用于将适配器连接到 DNA 的热循环程序。 图中显示了温度、时间和周期等热反应条件。
| 温度 | 时间 | 不。周期数 |
| 22 摄氏度 | 30 分钟 | 1 个周期 |
| 68 摄氏度 | 5 分钟 | 1 个周期 |
| 72 摄氏度 | 5 分钟 | 1 个周期 |
| 10 摄氏度 | 拿 | 1 个周期 |
表8:将适配器连接到cDNA的热循环程序。 图中显示了温度、时间和周期等热反应条件。
| 元件 | 卷 |
| 文库扩增反应溶液 | 50微升 |
| 文库引物混合物 | 2微升 |
| 反应系统总体积 | 52微升 |
表9:添加扩增试剂的顺序。 按照此处提供的顺序将试剂加入试管中。
| 温度 | 时间 | 不。周期数 |
| 98 摄氏度 | 2 分钟 | 1 个周期 |
| 98 摄氏度 | 15 秒 | 5 个周期 |
| 60 摄氏度 | 1 分钟 | |
| 10 摄氏度 | 拿 | 1 个周期 |
表 10:用于扩增 DNA 文库的热循环程序。 图中显示了温度、时间和周期等热反应条件。
| 温度 | 时间 | 不。周期数 |
| 98 摄氏度 | 2 分钟 | 1 个周期 |
| 98 摄氏度 | 15 秒 | 5 个周期 |
| 64 摄氏度 | 1 分钟 | |
| 10 摄氏度 | 拿 | 1 个周期 |
表 11:用于扩增 cDNA 文库的热循环程序。 图中显示了温度、时间和周期等热反应条件。
| 编号:rs1801131 | 货号:rs1801133 | RS1650697 | RS442767 | 编号:rs1805087 | 电子仓库 rs11545078 | RS1051298 | |
| 裁判 | T | G | 一个 | G | 一个 | G | G |
| 替代 | G | 一个 | G | T | G | 一个 | 一个 |
| Func.ref GeneWithVer 基因 | 外显子 | 外显子 | UTR5型 | 上游 | 外显子 | 外显子 | UTR3的 |
| 基因.ref GeneWithVer 基因 | MTHFR型 | MTHFR型 | DHFR | DHFR | 地铁 | GGH系列 | SLC19A1 |
| 基因详细信息 .refGeneWithVer | . | . | NG_023304.1: g.5020吨>G | . | . | . | NM_001205206.1: c.*64C>T; NM_001205207.1: c.*746C>T; NM_194255.2:c. *746C>T |
| ExonicFunc .refGeneWithVer | 非同义词; 单核神经系统(SNV) | 非同义词; 单核神经系统(SNV) | . | . | 非同义词; 单核神经系统(SNV) | 非同义词; 单核神经系统(SNV) | . |
| AAChange.ref GeneWithVer 基因 | MTHFR:NM_00 1330358.1:外 n8:c.A1409C:p. E470A;MTHFR: NM_005957.4: 外显子8:c.A1286 货号:p.E429A | MTHFR:NM_00 1330358.1:外 n5:c.C788T:p. A263V;MTHFR:N M_005957.4:e xon5:c.C665T: 型号:A222V | . | . | 港铁:NM_0012 91939.1:外显子2 5:c.A2603G:p. D868G;港铁:N M_001291940. 1:外显子25:c.A1 535G:P.D512G; 港铁:NM_0002 54.2:外显子26:c。 A2756G:P.D91 9G网络 | GGH:NM_003878 .2:外显子5:c.C452T: 第T151I号 | 晉語 |
| 细胞带 | 1页36.22 | 1页36.22 | 5季度14.1 | 5季度14.1 | 1季度43 | 8Q12.3 | 21问题22.3 |
表12:SNPs的相关信息。 使用 ANNOVAR 注释样本。
| MTHFR型 | DHFR | 地铁 | GGH系列 | SLC19A1 | ||||
| 编号:rs1801131 | 货号:rs1801133 | RS1650697 | RS442767 | 编号:rs1805087 | 电子仓库 rs11545078 | RS1051298 | ||
| 1000g2015aug_all | 0.249401 | 0.245407 | 0.76857 | 0.290136 | 0.218251 | 0.085463 | 0.524361 | |
| 1000g2015aug_afr | 0.1513 | 0.09 | 0.9349 | 0.0318 | 0.2844 | 0.056 | 0.5772 | |
| 1000g2015aug_amr | 0.1513 | 0.4741 | 0.755 | 0.3991 | 0.1772 | 0.0403 | 0.4323 | |
| 1000g2015aug_eas | 0.2192 | 0.2956 | 0.6607 | 0.5853 | 0.1052 | 0.0873 | 0.5635 | |
| 1000g2015aug_eur | 0.3131 | 0.3648 | 0.7555 | 0.3191 | 0.173 | 0.0924 | 0.4493 | |
| 1000g2015aug_sas | 0.4172 | 0.1186 | 0.6779 | 0.228 | 0.3211 | 0.1483 | 0.5552 | |
表 13:1000 基因组计划中基于过滤器的 SNP 注释。
| MTHFR型 | DHFR | 地铁 | GGH系列 | SLC19A1 | |||
| 编号:rs1801131 | 货号:rs1801133 | RS1650697 | RS442767 | 编号:rs1805087 | 电子仓库 rs11545078 | RS1051298 | |
| ExAC_ALL | 0.295 | 0.3037 | . | . | 0.2091 | 0.0936 | . |
| ExAC_AFR | 0.1588 | 0.1124 | . | . | 0.2666 | 0.0545 | . |
| ExAC_AMR | 0.1555 | 0.5141 | . | . | 0.1864 | 0.0361 | . |
| ExAC_EAS | 0.2148 | 0.3052 | . | . | 0.1132 | 0.0824 | . |
| ExAC_FIN | 0.3128 | 0.2227 | . | . | 0.1892 | 0.0581 | . |
| ExAC_NFE | 0.3191 | 0.345 | . | . | 0.1919 | 0.0969 | . |
| ExAC_OTH | 0.304 | 0.3062 | . | . | 0.2108 | 0.0973 | . |
| ExAC_SAS | 0.4153 | 0.1409 | . | . | 0.316 | 0.165 | . |
表 14:外显子组聚合联盟中基于过滤器的 SNP 注释。
补充表1:DNA扩增用加试剂的顺序。 按照此处提供的顺序将试剂加入试管中。 请点击这里下载此文件。
补充表2:用于cDNA扩增的添加试剂的顺序。按照此处提供的顺序将试剂加入试管中。 请点击这里下载此文件。
补充表3:临床标本测序结果示例。 只有标本中存在的突变才会被记录在文件中。 请点击这里下载此文件。
讨论
临床专家一致认为,即使胃癌类型和阶段相同,患者对相同的治疗方法也可能有明显不同的反应。多年的研究向科学家揭示,个体差异主要归因于胃癌作为一种异质性、多态性和多样化分化的细胞群的性质,导致治疗反应存在显着的个体差异28.因此,通过上消化道内窥镜检查或手术采集胃癌样本和血液样本,再加上用于基因分析的高通量测序,可实现个性化的胃癌治疗。该策略旨在提高临床治疗效果并降低严重毒副作用的风险。离子半导体测序技术的进步已将个性化治疗转变为实际现实29.
以下是此测试方法的一些限制。本文使用的试剂盒主要用于 体外 诊断,因此仅限于检测 MTHFR 基因rs1801131和rs1801133、 DHFR 基因rs1650697和rs442767、 MTR 基因rs1805087、 GGH 基因rs11545078和 SLC19A1 rs1051298的突变。无法检测到其他部分的突变。由于肿瘤组织存在显著的异质性,不同的采样位置可能会影响检测结果。对于储存时间较长的石蜡包埋组织样本,DNA和RNA可能会有一定程度的降解,从而影响检测结果。不合理的样品采集、运输和处理,以及不当的实验操作和实验环境都可能导致假阴性或假阳性结果。如果核酸浓度低于 2 ng/μL,则无法保证检测结果。该试剂盒的测试结果仅供临床参考。应结合患者的症状/体征、病史、其他实验室检查和治疗反应来考虑为患者选择个体化治疗。阴性结果并不能完全排除靶基因突变的存在。阴性结果也可能是由于样本中的肿瘤细胞过少、核酸过度降解或扩增反应系统中靶基因的浓度低于检测限引起的。
所用套件的一些性能指标如上所述。分析灵敏度:对于DNA样品,该试剂盒中总核酸的最小可检测量为10 ng,可检测5%的突变率。对于 RNA 样品,该试剂盒中总核酸的最小可检测量为 10 ng。正负符合率:正负符合率达到100%。检测限 (LOD):总共可以使用 14 个 LOD 参考,编号为 L1-L14。L1-L11为MTHFR、DHFR、MTR、GGH和SLC19A1基因的LOD参考文献,其检测结果应为对应基因位点突变类型为阳性,符合率为100%。重复性:共可使用五种重复参考物质,编号为R1-R5。R1 是一种强阳性重复参比物质(DPYD 基因的 rs67376798 突变)。包含该突变的R2为弱阳性重复参比物质(DPYD基因rs67376798突变),R3为阴性重复参照物质(DPYD、MTHFR和ABCB1基因的6个位点为野生型)。每个参考样本必须测试 10 次,确保这些重复评估的结果与其预定义的分类相对应。数据量:DNA和RNA样品的有效数据量应控制在0.05 M以上。DNA样品的测序深度应控制在500个以上,RNA样品的Mappped reads应控制在20000个以上。干扰测试:该试剂盒不受内源性干扰物质(甘油三酯和白蛋白)和外源性干扰物质(福尔马林和脱水酒精)的影响。
在实验过程中必须遵守一些预防措施。此处使用的试剂盒只能用于 体外 测试。实验前请仔细阅读本手册,并在有效期内使用。不同批次的试剂盒组件不能互换使用。建议使用此套件的一次性消耗品,以防止污染。在使用本套件期间,建议使用带有滤芯的吸头。为避免样品中出现任何潜在的生物危害,应将测试样品视为传染性物质,以避免与皮肤和粘膜接触。建议在生物安全柜中处理样品,以防止气溶胶流出。操作中使用的试管和吸盘应消毒后再丢弃。样品的操作和处置应符合有关法律法规的要求:《微生物生物医学实验室生物安全通用导则》和卫生部《医疗废物管理条例》30、31。实验人员必须接受专业培训,严格按照说明书操作,并严格按照实验过程将区域分开。实验操作的每个阶段都应使用专用仪器设备,每个区域每个阶段的物品不得互换使用。实验人员必须按照实验过程严格划分区域。在实验操作的每个阶段都应使用专用的仪器和设备。根据需要采取防护措施,如手套、工作服等。废弃物处理应当符合国家有关规定。
虽然本文的重点是与胃癌相关的五个基因中的七个SNP,但实际应用中的测序并不仅仅局限于这五个基因。本文明确地确定了七个 SNP 与胃癌对 5-FU 化疗的敏感性之间存在显着相关性。
披露声明
作者没有什么可透露的。
致谢
本研究得到国家自然科学基金面上项目《探索ERK2/Snai1/AGPS/PUFA-PL通路在胃癌细胞抗阿帕替尼诱导的铁死亡中的作用》(项目编号:82172814)的支持;广东省基础与应用研究经费委员会资助的锌指转录因子1在调节阿帕替尼诱导的肝铁死亡抵抗中的作用和机制研究(项目编号:2022A1515010267);“胃癌5-FU化学敏感性诊断试剂的研究与应用”(项目编号:201903010072),广州市科技项目。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL DNA LoBind Tubes | Eppendorf | 30108051 | |
| 50 mL tubes | Greiner Bio-One | 227261 | |
| Amplification primer of gastric cancer | Thermo Fisher | The primers are sythesized by Thermo Fshier according to the sequence in Table 1. | |
| Deparaffinization | Qiagen | 19093 | |
| DNA purification magnetic beads | Bechkman | A63881 | |
| Ethyl alcohol | Guangzhou Chemical Reagent Factory Thermo Fisher Scientific | http://www.chemicalreagent.com/ | |
| Ion AmpliSeq Library Kit 2.0 | Thermo Fisher | 4480441 | |
| Nuclease-Free Water | Life Technologies | AM9932 | |
| PCR tubes | Axygen | PCR-02D-C | |
| PCR tubes | Axygen | PCR-02D-C | |
| Pipette tips | Quality Scientific Products | https://www.qsptips.com/products/standard_pipette_tips.aspx | |
| PureLink RNA Mini Columns | Thermo Fisher | A29839 | |
| RecoverAll Total Nucleic Acid Isolation Kit | Thermo Fisher | AM1975 | |
| Tabletop mini centrifuge | SCILOGES | S1010E | |
| Thermal Cycler | Life Technologies | 4375786 | |
| Ultramicro nucleic acid analyzer | BEIJING ORIENTAL SCIENCE & TECHNOLOGY DEVELOPMENT LTD. | BD-1000 |
参考文献
- Sung, H., et al. Global cancer statistics 2020: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71 (3), 209-249 (2021).
- Wagner, A. D., et al. Chemotherapy for advanced gastric cancer. Cochrane Database Syst Rev. 8, (2017).
- Shah, M. A., et al. Immunotherapy and targeted therapy for advanced gastroesophageal cancer: Asco guideline. J Clin Oncol. 41 (7), 1470-1491 (2023).
- Loganayagam, A., et al. Pharmacogenetic variants in the dpyd, tyms, cda and mthfr genes are clinically significant predictors of fluoropyrimidine toxicity. Br J Cancer. 108 (12), 2505-2515 (2013).
- Giacchetti, S., et al. Phase iii multicenter randomized trial of oxaliplatin added to chronomodulated fluorouracil-leucovorin as first-line treatment of metastatic colorectal cancer. J Clin Oncol. 18 (1), 136-147 (2000).
- Hoff, P. M., et al. Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: Results of a randomized phase iii study. J Clin Oncol. 19 (8), 2282-2292 (2001).
- Meulendijks, D., et al. Clinical relevance of dpyd variants c.1679t>g, c.1236g>a/hapb3, and c.1601g>a as predictors of severe fluoropyrimidine-associated toxicity: A systematic review and meta-analysis of individual patient data. Lancet Oncol. 16 (16), 1639-1650 (2015).
- Sadighi, S., Mohagheghi, M. A., Montazeri, A., Sadighi, Z. Quality of life in patients with advanced gastric cancer: A randomized trial comparing docetaxel, cisplatin, 5-fu (tcf) with epirubicin, cisplatin, 5-fu (ecf). BMC Cancer. 6, 274 (2006).
- Collins, F. S., Brooks, L. D., Chakravarti, A. A DNA polymorphism discovery resource for research on human genetic variation. Genome Res. 8 (12), 1229-1231 (1998).
- Ladner, R. D. The role of dutpase and uracil-DNA repair in cancer chemotherapy. Curr Protein Pept Sci. 2 (4), 361-370 (2001).
- Capitain, O., et al. The influence of fluorouracil outcome parameters on tolerance and efficacy in patients with advanced colorectal cancer. Pharmacogenomics J. 8 (4), 256-267 (2008).
- Askari, B. S., Krajinovic, M. Dihydrofolate reductase gene variations in susceptibility to disease and treatment outcomes. Curr Genomics. 11 (8), 578-583 (2010).
- Ceppi, F., et al. DNA variants in dhfr gene and response to treatment in children with childhood b all: Revisited in aieop-bfm protocol. Pharmacogenomics. 19 (2), 105-112 (2018).
- Sharp, L., Little, J. Polymorphisms in genes involved in folate metabolism and colorectal neoplasia: A huge review. Am J Epidemiol. 159 (5), 423-443 (2004).
- Yousef, A. M., et al. The association of polymorphisms in folate-metabolizing genes with response to adjuvant chemotherapy of colorectal cancer. Cancer Chemother Pharmacol. 82 (2), 237-243 (2018).
- Schneider, E., Ryan, T. J. Gamma-glutamyl hydrolase and drug resistance. Clin Chim Acta. 374 (1-2), 25-32 (2006).
- Moran, R. G. Roles of folylpoly-gamma-glutamate synthetase in therapeutics with tetrahydrofolate antimetabolites: An overview. Semin Oncol. 26 (2), 24-32 (1999).
- Maezawa, Y., et al. High gamma-glutamyl hydrolase and low folylpolyglutamate synthetase expression as prognostic biomarkers in patients with locally advanced gastric cancer who were administrated postoperative adjuvant chemotherapy with s-1. J Cancer Res Clin Oncol. 146 (1), 75-86 (2020).
- Cheng, Q., et al. A substrate specific functional polymorphism of human gamma-glutamyl hydrolase alters catalytic activity and methotrexate polyglutamate accumulation in acute lymphoblastic leukaemia cells. Pharmacogenetics. 14 (8), 557-567 (2004).
- Zhang, Q., et al. Recognition of cyclic dinucleotides and folates by human slc19a1. Nature. 612 (7938), 170-176 (2022).
- Ulrich, C. M., et al. Polymorphisms in folate-metabolizing enzymes and response to 5-fluorouracil among patients with stage ii or iii rectal cancer (int-0144; swog 9304). Cancer. 120 (21), 3329-3337 (2014).
- Zhang, X., et al. Discovery of novel biomarkers of therapeutic responses in han chinese pemetrexed-based treated advanced nsclc patients. Front Pharmacol. 10, 944 (2019).
- Corrigan, A., et al. Pharmacogenetics of pemetrexed combination therapy in lung cancer: Pathway analysis reveals novel toxicity associations. Pharmacogenomics J. 14 (5), 411-417 (2014).
- Ion 520 & ion 530 ext kit - chef user guide. Thermofisherscientific Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2FMAN0015805_Ion520_530ExTKit_UG.pdf (2023)
- Ion genestudio s5 instrument user guide. Thermofisherscientific Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2FMAN0017528_Ion_GeneStudio_S5_Instrument_UG.pdf (2023)
- Parkin, N. T., et al. Multi-laboratory comparison of next-generation to sanger-based sequencing for hiv-1 drug resistance genotyping. Viruses. 12 (7), 694 (2020).
- Ziller, M. J., Hansen, K. D., Meissner, A., Aryee, M. J. Coverage recommendations for methylation analysis by whole-genome bisulfite sequencing. Nat Methods. 12 (3), 230-232 (2015).
- Lordick, F., et al. Unmet needs and challenges in gastric cancer: The way forward. Cancer Treat Rev. 40 (6), 692-700 (2014).
- Kumar, K. R., Cowley, M. J., Davis, R. L. Next-generation sequencing and emerging technologies. Semin Thromb Hemost. 45 (7), 661-673 (2019).
- Chinese Centres for Disease Control and Prevention. Ministry of Health of the People's Republic of China. WS 233-2002. Chinese Centres for Disease Control and Prevention. , 1-64 (2002).
- China Environmental Protection Industry. Medical waste management regulations. China Environmental Protection Industry. (1), 6-10 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。