Method Article
一种改良的大鼠鞘内导管插入术方法
摘要
在此,我们介绍了一种改进的大鼠鞘内导管插入术方法,该方法代表了一种简单、方便、可靠的重复鞘内给药方法。
摘要
鞘内导管插入术已广泛应用于动物实验,尤其是神经性疼痛的实验。但是,传统方法仍然存在一些限制。尽管一些研究人员试图改进传统方法,但现有方法仍需要修改。在此,我们介绍了一种改进的大鼠鞘内导管插入术方法。
该方法使用 20 cm 长的不锈钢丝(直径 0.2 mm)、15 cm 长的塑料 PE10 管、自制密封帽和 0.3 cm × 0.5 cm 的抗过敏带。我们改进的鞘内导管插入术方法有几个优点。首先,在 PE10 管中引入不锈钢丝,增加了管子的弹性,提高了鞘内导管插入术的成功率,减少了手术所需的空间量,并最大限度地减少了对腰椎周围组织的损伤。其次,PE10 管的长度在手术前确定,导管留置时间可超过一周。第三,PE10 管由 8 字形缝合线固定,缝合 4 次,可防止动物移动时管子移动和缩回。第四,采用自制密封帽密封 PE10 管,既防止脑脊液渗漏,又减少了 PE10 管重复切割的需要。最后,PE10 管的体外端用带子系住,防止动物移动时管子回缩。
这种方法可以提高大鼠的导管插入成功率,因为即使在手术后 80 天,大约 28% 的 PE10 管仍留在原位。因此,这种修改后的方法可能代表了一种简单、方便和可靠的重复鞘内给药方法。
引言
大鼠鞘内导管插入术(也称为蛛网膜下腔导管插入术)是一种涉及通过椎间隙将导管插入蛛网膜下腔的方法1。药物通过导管直接注射到蛛网膜下腔,这有助于研究人员研究药物对脊髓的影响,而无需考虑穿透血脑屏障的药物的影响 2,3。此外,可以在鞘内导管插入后收集脑脊液以研究中枢神经系统的微环境 4,5。目前使用的鞘内导管插入术由 Yaksh 和 Rudy6 于 1976 年首次建立,从那时起,它已广泛应用于神经科学、麻醉和镇痛、脊髓介导的心血管调节,尤其是神经性疼痛等领域的动物实验 2,7。然而,这种方法仍然存在一些局限性,例如脊髓损伤发生率高、蛛网膜下腔出血、术后感觉和运动功能障碍、术后死亡率高以及神经损伤风险高 4,5,8,9,10 .为了克服这些限制,Størkson 等人于 1996 年提出了通过腰椎间隙对蛛网膜下腔进行导管插入术11,并报告了更高的术后成功率。值得注意的是,在这种方法中留置导管的固定仍然是一个挑战,并且由于动物运动,导管回缩很常见,这使得鞘内给药不方便。
由于上述限制,一些研究人员 12,13,14,15 试图改进穿刺工具、导管插入方法和导管固定方法,但由于难以量化所用珠子的直径、需要反复穿刺和导管长度短,现有方法仍需要修改, 等11
根据鞘内导管插入术的腰椎入路1 和中央静脉导管插入术的 Seldinger 技术 16 ,我们开发了一种大鼠鞘内导管插入术的方法,该方法使用不锈钢丝、自制密封帽和抗过敏带来简化现有方法。通过这种方法,可以很容易地将导管插入蛛网膜下腔并稳定地固定在大鼠的背部,避免了重复鞘内给药的需要。
在此,我们介绍了一种改良的方法,该方法可以提高大鼠鞘内导管插入术的成功率,并代表了一种简单、方便、可靠的重复鞘内给药方法。
研究方案
鞘内导管插入术严格按照美国国立卫生研究院实验动物护理和使用指南中的建议进行,该方案得到了中国实验动物伦理委员会的批准(No.TJBH15523201)。实验使用雄性 Sprague-Dawley (SD) 大鼠。注意尽量减少动物的疼痛和不适。
1. 材料和仪器准备
注意:材料和器械的准备对于成功的鞘内导管插入术非常重要。
- 准备一根 15 厘米长的 PE10 管(长度根据大鼠头部与尾端的距离确定),将一根 20 厘米长的不锈钢丝(直径 0.2 毫米)插入 PE10 管中,两端抛光作为支撑,并在管子上标记距一端 2 厘米以指示插入深度(如图 1A 中的黑色十字标记,B).
- 剪断 22 G 针的锋利尖端并密封远端(图 1C)。
- 将硬膜外导管(外径 1.0 毫米)切成 1 厘米的碎片。然后,将碎片插入无尖尖的 22 G 针头(图 1D),并用一对加热的直镊子密封碎片的远端。这种装置称为管密封帽(图 1E)。
- 用剪刀剪下丝带(1.25 厘米× 9.1 m),准备一条 0.3 厘米× 0.5 厘米的抗过敏带(图 1F)。
2. 手术准备
- 通过在手术前对器械进行消毒来准备用于鞘内导管插入术的器械。用于手术的器械是齿形镊子、剪刀、管饲器、手术刀手柄和 #10 刀片。(图 2)。
- 将 PE10 管和导丝浸入 75% 乙醇中消毒约 2 小时。
3. 手术
- 用 3% 异氟醚以 3 L/min 的流速麻醉大鼠。
- 将大鼠放在手术台上,观察用镊子捏住后爪时的撤退反射。后爪对刺激没有反应的运动证实了麻醉成功。鞘内导管插入前通过肌内注射 1 mg/kg 美洛昔康进行充分的镇痛。
- 用剃须刀去除背部腰椎区域和两只耳朵之间区域的毛发。
- 在大鼠腹部的腰髋交界处放置一根离心管(直径 3 厘米),以增加腰椎的屈曲,为针头和导管提供更多空间通过。
- 用聚维酮碘溶液消毒手术部位(腰椎区域上方的区域和两只耳朵之间的区域),然后用乙醇溶液消毒 3 次。用无菌敷料覆盖大鼠,并暴露手术部位。然后在手术前用生理盐水清洗 PE10 管和导丝。
注意:尾部没有被覆盖,因此在鞘内导管插入术中可以观察到尾部运动。 - 通过将 L6 的棘突定位在左右双侧髂嵴之间的中点,确定 L5 和 L6 之间的椎间隙位置。用作者的左手拇指和左手食指固定皮肤,然后在 L4 和 S1 之间的棘突上方做一个 3-4 厘米长的中线切口。
- 用剪刀钝地分离皮下组织。再次找到 L5 和 L6 之间的椎间隙,并在 L5 和 L6 背突的两侧做一个小切口(0.3 - 0.5 厘米)。
- 用一对齿形镊子夹住并抬起 L5 背突,以扩大椎间空间。然后,用一把剪刀钝地分离椎体周围的肌肉,直到 L6 背突的顶部完全暴露出来。
注意:应避免切除椎体和肌肉的任何部分,以尽量减少对周围组织的损害。 - 当用一对带齿的镊子抬起 L5 背突并用另一对镊子扩大椎间隙时,用棉球清洁 L5-6 椎间隙,直到倒"V"区域完全暴露。
- 用 23 G 针在 L6 背突顶部正下方的倒"V"区域刺穿脊柱。
注意:观察到尾部甩动,和/或无色透明液体从蛛网膜下腔流出,表明成功穿刺到蛛网膜下腔。 - 小心地将含有不锈钢丝的 PE10 管插入穿刺部位的椎管中,向尾部倾斜 30°。调整插入角度,直到 PE10 管可以无阻力地成功插入(在此过程中观察到尾部甩动)。
- 当 PE10 管的标记区域到达后肌时,停止导管插入术。
- 慢慢从 PE10 管中取出不锈钢丝。可能会观察到尾巴甩动。
注意:可能会观察到尾部甩动,并且在移除导线后,透明液体(或浅红色液体)可能会从管中流出。 - 然后,将 PE10 管连接到 1 mL 注射器,通过注射器注射 20 μL 生理盐水。取出注射器后,生理盐水会不断从 PE10 管中流出,表明已成功插入蛛网膜下腔。
- 一旦确认 PE10 管通畅,用 4-0 缝合线缝合椎体一侧的肌肉并打结。然后,将缝合线系在 PE10 管上并打另一个结。不要剪断缝合线;缝合另一侧的肌肉;再次将缝合线系在 PE10 管上,打第三个结,然后剪断缝合线。
注意:此过程用 10 字形缝合线固定 PE8 管,以减少管子移位和缩回的可能性。 - 在耳朵之间中点下方 0.5 厘米处做一个 1 厘米长的切口。用剪刀钝地分离皮下组织,并将金属管饲管插入尾部,直到在腰椎切口处可以看到尖端。
- 将 PE10 管的远端插入管饲管,直到 PE10 管从管饲管的另一端退出;然后轻轻地取出管饲法。
- 当确认 PE10 管再次通阻时,用 4-0 缝合线缝合腰部切口周围剩余的肌肉,将缝合线系在 PE10 管上,再打一个结,再次固定 PE10 管。
- 缝合皮肤,避免损坏 PE10 管。然后,用 4-0 缝合线缝合颈部皮肤,将缝合线系在 PE10 管上,打结固定 PE10 管。
- 当确认 PE10 管再次通畅时,用密封帽密封 PE10 管的体外端。
- 用一张纸巾擦干 PE10 管,然后将抗过敏带系在 PE10 管上数次,以防止大鼠运动时 PE10 管缩回。
4. 利多卡因验证实验
- 手术后,将大鼠放回笼子(每个笼子一个),并在麻醉恢复期间密切监测它,直到大鼠恢复意识。
- 大鼠完全清醒后,取下密封帽,通过 Hamilton 注射器以 0.02 mL/s 的速率将 20 μL 2% 利多卡因注入 PE10 管中,然后注射 10 μL 生理盐水。
- 用密封盖密封 PE10 管。
- 将大鼠放在桌子上并仔细观察。鞘内注射利多卡因(来自 PE10 管)后后肢麻痹的存在表明导管插入成功(图3)。后肢麻痹通常持续约 30 分钟10。
注意:在以下实验之前,让大鼠恢复 5-7 天。 - 在恢复期密切监测大鼠,直到肢体功能完全恢复。
结果
鞘内注射时,切掉 PE10 管的体外尖端,在两次药物注射之间用密封帽密封 PE10 管。在我们的初步研究中,鞘内导管插入术的成功率约为 95% (20 只大鼠中有 19 只);手术过程中甩尾巴和/或释放无色透明液体表明成功。大约 85% 的管子在手术后 7 天留在原位,大约 80% 的管子在手术后 28 天留在原位。大鼠术后很快恢复,术后 7 天内未观察到并发症。日常运动正常,未观察到行为异常。这些结果表明,我们的方法在成功率和长留置率方面优于以前报道的方法。
通过导管注射利多卡因后下肢完全麻痹表明鞘内导管插入成功15。鞘内导管插入术的成功率是通过将大鼠总数除以导管插入成功的大鼠数来计算的。使用我们修改后的方法,成功率为 95%,高于 Hou 等人报告的方法所达到的成功率 (88%)15。如图 4 所示。
在鞘内导管插入术后 2 、 5 和 7 天监测鞘内管,留置导管成功率计算为成功留置导管的大鼠数/× 100% 的大鼠总数。在 StØrkson 等人的研究中,在鞘内导管插入术后 2 、 5 和 7 天,留置导管的成功率分别为 94% 、 81% 和 65% 11。使用我们的技术,鞘内导管插入术后 2 、 5 和 7 天留置导管的成功率分别为 95% 、 90% 和 85% (图 5)。

图 1.用于鞘内导管插入术的材料和器械。 (A) 制备一根 15 cm 长的 PE10 管,并在管子上标记距一端 2 cm 以指示插入深度。(B) 将一根 20 cm 长的不锈钢丝插入 PE10 管中,该不锈钢丝具有两个抛光端作为支撑。(C) 用一把剪刀剪断 22G 针的尖尖,远端用一把镊子密封。(D) 将硬膜外导管(外径 1.0 毫米)切成 1 厘米的碎片,然后将其插入无尖尖的 22G 针头中。(E) 硬膜外导管远端用一对加热的直镊子密封;这种装置被称为管密封帽。(F) 用一把剪刀制备 0.3 cm × 0.5 cm 的抗过敏带(丝带,1.25 cm × 9.1 m)。 请单击此处查看此图的较大版本。
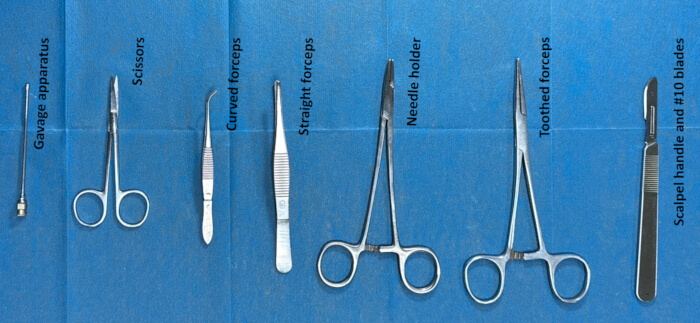
图 2.准备鞘内导管插入术的器械。 将器械(如齿形镊子、剪刀、管饲器、手术刀手柄和 #10 刀片)用乙醇消毒约 2 小时,然后在手术前约 30 分钟用生理盐水洗涤。 请单击此处查看此图的较大版本。
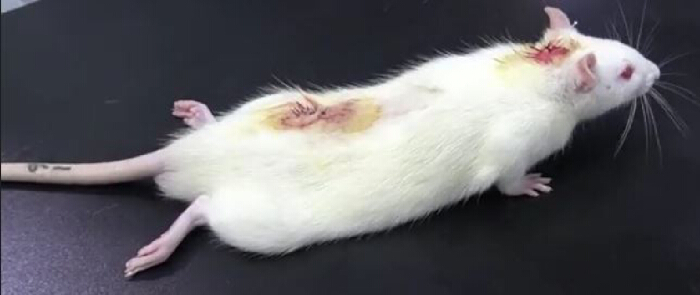
图 3.鞘内导管插入术后利多卡因验证实验的结果。 鞘内注射 20 μL 2% 利多卡因后,再注射 10 μL 生理盐水后,大鼠暂时瘫痪:下肢麻痹发生在 30 s 内,30 min 后消失,表明鞘内导管插入成功。 请单击此处查看此图的较大版本。
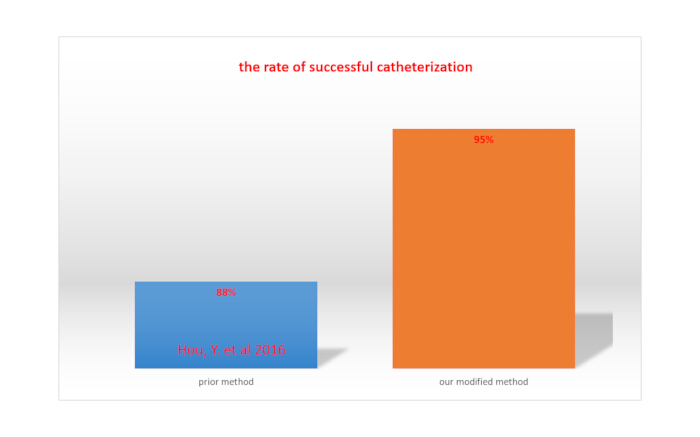
图 4.我们修改后的方法与先前报道的方法之间的导管插入成功率比较。请单击此处查看此图的较大版本。
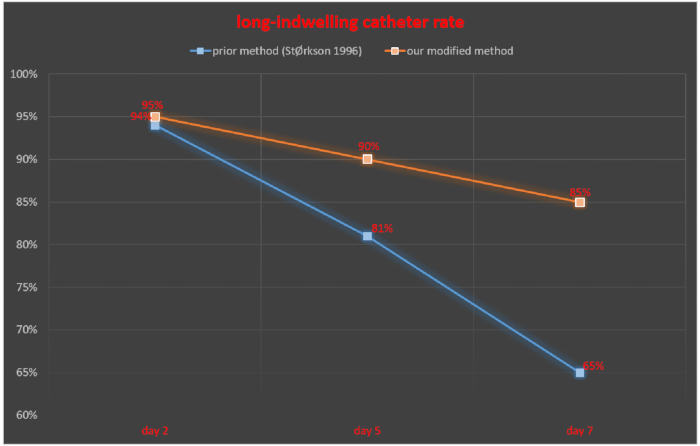
图 5.我们修改后的方法与先前报道的方法之间的长留置导管率的比较。请单击此处查看此图的较大版本。
| 修改方法 | 先验方法 | 修改方法的优点 | 先前方法的缺点 | |
| 插入的导向方法 | 不锈钢丝 | 导向套管 (20G 0.9× 38 mm) | 增加管子的弹性, | 阻力难以感觉到,增加了作难度 |
| 提高鞘内导管插入术的成功率 | 由于反复穿刺而对组织造成损伤 | |||
| 减少对作空间的要求 | 管子的一端被拉伸到原始长度的 1.5 倍,使两端的直径不同 | |||
| 最大限度地减少对腰椎周围组织的损伤 | 易患脑脊液泄漏,因为 20G 导管的直径是拉伸 PE10 管的 2 倍或更多 | |||
| PE10 管的长度 | 15 厘米 | 14 或 28 厘米 | 易于确定 PE10 管的长度,无论导管留置的持续时间如何 | 对于较短的 PE10 管,导管留置时间更短;较长的 PE10 管容易从体内脱落 |
| 固定方法 | "8" 缝合和 4 次 | 1 或 2 颗珠子 | 避免了动物活动期间的管子移动和缩回 | 管两端直径的差异,以及在微珠制作过程中对 PE10 管位移的敏感性 |
| 管道密封方法 | 自制帽 | 不 | 防止脑脊液渗漏 | PE10 管重复切割的要求 |
| 避免了 PE10 管的重复切割 | ||||
| 防止回缩的方法 | 抗过敏手环 | 1 或 2 颗珠子 | 防止管子在动物活动期间缩回 | 易回缩 |
表 1. 修改后的方法和以前报道的方法的优缺点。
讨论
这种改进的方法可以最大限度地提高鞘内导管插入术的成功率,有几个关键技巧。首先,应准备一根 20 厘米长的不锈钢丝,带有两个抛光端,并将其插入 PE10 管中作为支撑。其次,作者用棉球清洁 L5-6 椎间隙后,应完全暴露倒"V"区,同时用齿形镊子抬起 L5 背突,同时用另一把镊子扩大椎间隙。第三,PE10 管应用八字形缝合线固定四次。最后,PE10 管的体外端应用带子绑扎,并用自制帽密封。
鞘内导管插入术的成功率和椎体周围组织的损伤可能会显着影响实验结果的可靠性15。因此,尽可能提高成功率并减少对周围组织的损伤对于建立动物模型和相关实验至关重要1。在这种改进的方法中,将不锈钢丝插入 PE10 管中进行引导,增加了管的弹性,提高了鞘内导管插入术的成功率。此外,这种改进的方法减少了手术所需的空间量,并且由于周围组织被钝化,但未切割,因此对腰椎周围组织的损伤降至最低。相比之下,在先前报道的方法11 中,使用 20 G 的导向套管来降低穿刺时的阻力,并且通常需要反复穿刺,这可能会损伤组织。此外,在先前报道的方法中,为了减小 PE10 管的直径,将其浸入温水 (60 °C) 中,然后在一端拉伸至原始长度的约 150%,这可能无法保证管径的一致性,因此可能导致脑脊液泄漏,因为 20G 引导套管的直径大约大于或等于拉伸的 PE10 管的直径的两倍。而且,在我们的方法中,最大程度地保留了腰椎功能,避免了手术对后续实验结果的影响。这些结果与 Xu 等人2 报告的结果一致。
在先前报道的方法11 中,如果管子固定在穿刺部位周围的部位,则 PE10 管的长度约为 14 cm,但在这些情况下导管留置时间通常短于 7 天(或管子被大鼠从体内取出)。如果管子固定在颈部后部,PE10 管的长度约为 28 厘米,这比我们方法中使用的 PE10 管 (15 厘米) 长得多。尽管按照 Størkson 等人 11 报告的方案形成了珠子,但一些管子从体内取出,只有大约 65% 的管子在手术后 7 天仍固定到位,这显着影响了后续实验的结果。在我们的方法中,PE10 管用 8 字形缝合线固定 4 次,PE10 管的体外端用带子系住,以减少移位和回缩的可能性。按照我们的方法,大约 85% 的管子在手术后 7 天留在原位,大约 80% 的管子在手术后 28 天留在原位。
在先前报道的方法11 中,每次给药时应切断鞘内导管的体外尖端。然而,反复鞘内给药可能会缩短导管留置时间,这使得鞘内给药不方便。因此,在我们的方法中,使用自制的盖子密封 PE10 管,每天用乙醇消毒一次。这不仅可以防止脑脊液渗漏,还可以减少重复切割 PE10 管进行鞘内给药的需要,确保药物的有效输送。
表 1 总结了修改后的方法和以前报道的方法的优缺点。首先,对于改良的方法,在 PE10 管中使用不锈钢丝增加了管子的弹性,提高了鞘内导管插入术的成功率,减少了手术所需的空间量,并最大限度地减少了对腰椎周围组织的损伤。在以前报道的方法中,插入 20G 导套管直到感觉到阻力,并且通常需要反复穿刺,这可能会导致组织损伤。此外,一端的 PE10 管被拉伸至其长度达到原始长度的约 150%,这可能会导致脑脊液渗漏,因为 20G 引导管的直径大于或等于拉伸的 PE10 管的直径的 2 倍。其次,在改良方法中,手术前确定 PE10 管的长度,导管留置时间可超过一周。在先前报道的方法中,如果 PE10 管固定在穿刺部位,则其长度约为 14 cm,但导管留置时间通常短于 7 天,因为管子容易被大鼠拉出体外;如果 PE10 管固定在颈部后部,则其长度约为 28 厘米,这明显长于我们方法中使用的管子长度。三、在改良方法中,用 8 字形缝合 4 次固定 PE10 管,防止管子移动和缩回;采用自制帽密封 PE10 管,既防止脑脊液渗漏,又无需重复切割 PE10 管。在先前报道的方法中,很难获得直径一致的珠子,形成珠子时 PE10 管的位移很常见,并且经常需要重复切割 PE10 管。最后,在改进的方法中,PE10 管的体外端用带子系住,以防止管在运动过程中缩回。然而,在以前的方法中,珠子不能可靠地防止 PE10 管回缩,因为很难获得直径一致的珠子。
总体而言,这种改进的鞘内导管插入术具有以下优点。首先,在 PE10 管中使用不锈钢丝增加了管子的弹性,提高了鞘内导管插入的成功率,减少了手术所需的空间量,最大限度地减少了对腰椎周围组织的损伤,从而最大程度地保留了腰椎功能,避免了手术对后续实验结果的影响。其次,PE10 管用 8 字形缝合线固定 4 次,防止管子在移动过程中移动和缩回。第三,采用自制密封帽密封 PE10 管,既防止脑脊液渗漏,又避免了 PE10 管的重复切割。反复切割导管可能会缩短导管,从而使药物的输送变得不便。最后,PE10 管的体外端用抗过敏带系住,防止管子在运动过程中缩回。
然而,这种改良的鞘内导管插入术存在一些局限性。首先,手术后,需要将大鼠单独饲养(每个笼一个),以避免损坏 PE10 管的体外端。其次,在后续实验之前,需要在鞘内注射利多卡因后恢复 5-7 天。
总之,这种改进的鞘内导管插入术方法可作为重复鞘内给药的有用工具,并代表了一种简单、方便和可靠的缩短实验持续时间的方法。
披露声明
本手稿的作者声明不存在利益冲突。
致谢
这项工作得到了国家自然科学基金(No. 81971042)和上海市虹口区卫生健康委员会重点支撑专项项目(No.HKZK2020A06)。
材料
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
参考文献
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。