模型膜上的动态光诱导蛋白质模式
摘要
在这里,描述了一种协议,用于在人工脂质膜上以高时空精度生成光调节和可逆的蛋白质模式。该方法包括固定在模型膜上的蛋白质 iLID(改进的光诱导二聚体)的局部光激活,该模型膜在蓝光下与其伙伴蛋白 Nano(野生型 SspB)结合。
摘要
蛋白质在特定时间内在细胞膜上的精确定位和激活引发了许多细胞过程,包括细胞极化、迁移和分裂。因此,在合成细胞中复制和控制此类过程时,募集蛋白质以具有亚细胞分辨率和高时间控制的膜建模的方法至关重要。本文描述了一种在脂质膜上以高时空精度制备光调节可逆蛋白质模式的方法。为此,我们将光开关蛋白 iLID(改进的光诱导二聚体)固定在支持的脂质双层 (SLB) 和巨型单层囊泡 (GUV) 的外膜上。在局部蓝光照射下,iLID 与其伙伴 Nano(野生型 SspB)结合,并允许将与 Nano 融合的任何目标蛋白 (POI) 从溶液募集到膜上的照明区域。这种结合在黑暗中是可逆的,它提供了 POI 的动态结合和释放。总的来说,这是一种灵活且通用的方法,用于使用蓝光在空间和时间上高精度地调节蛋白质的定位。
引言
在亚细胞区域内的细胞膜上形成蛋白质模式会引起许多生物过程,包括迁移、分裂和局部细胞间通讯 1,2。这些蛋白质模式在空间和时间上受到调节,并且是高度动态的。在合成细胞中复制这种蛋白质模式对于模拟由它们产生的细胞过程以及更好地了解这种调节如何在分子水平上起作用至关重要。与在活细胞中观察到的膜类似,在人工膜上生成蛋白质模式的方法必须捕获其动力学并提供精确的时空控制。
在各种刺激中,光因其提供最高的时空控制和一些额外的优势而脱颖而出3.通过光的调节,可以在任何需要的时间以无与伦比的精度直接照亮所需的区域。此外,光提供了高可调性,因为光强度和脉冲持续时间都可以调节。此外,可见光对包括蛋白质在内的生物分子是无害的,甚至可以处理不同波长的多种功能。因此,基于可见光的光响应方法成为在空间和时间中控制和双正交调节蛋白质模式的有前途的途径 4,5,6。利用来自光遗传学的光开关蛋白对,作为光诱导二聚体,提供了一种将特定蛋白质募集到膜的简单方法。特别是,利用 iLID(改进的光诱导二聚体,基于燕麦的光开关 LOV2 结构域)和 Nano(野生型 SspB)7,8、蓝光诱导的 SpyTag 系统 (BLISS)9、绿光响应蛋白四聚体 CarH 10 以及 PhyB 和 PIF6 之间的红光诱导相互作用 11,成功地在人工膜上形成了蛋白质模式11。
已经证明,iLID 和 Nano5 之间的光开关相互作用可用于使用蓝光7 在模型膜上形成光模式蛋白。iLID/Nano 相互作用在黑暗中是可逆的,具有高度特异性,并在生理条件下运行。将 iLID 锚定在脂质膜模型上,例如巨大的单层囊泡 (GUV) 或支持的脂质双层 (SLB),可以光调节 Nano 募集到这些膜上,这在黑暗中是可逆的。值得注意的是,我们观察到,在 iLID 的 N 末端引入一个无序结构域(产生一种名为 disiLID 的蛋白质)作为与模型脂质膜的拴系可提高 Nano 募集效率和回归动力学8。
通过采用 disiLID/Nano 相互作用,我们开发了一种在 SLB 和 GUV 外膜上生成纳米融合目标蛋白 (POI) 高对比度图案的方法。这种方法允许在几分钟内创建具有显着的空间和时间分辨率以及高可逆性的蛋白质模式。详细的方案概述了将蛋白质局部募集到人工膜上的过程。具体来说,这是通过生物素-链霉亲和素 (SAv) 相互作用将生物素化版本的 disiLID 固定在 SLB 和 GUV 上来实现的。随后,在蓝光照射下,荧光标记的纳米(mOrange-Nano)被募集到这些disiLID功能化膜上。我们的实验方案提供了一种简单且适应性强的方法,用于实现局部蛋白质募集到膜。重要的是,这种方法并不局限于报道的 SLB 和 GUV 接口或 mOrange-Nano;它可以扩展到其他与纳米融合的disiLID功能化材料和蛋白质。
研究方案
1. 实验准备
- 按照先前报道的程序表达和纯化生物素化-二氧化锂 (b-disiLID) 和 mOrange-纳米(参见材料表) 7,8。
- 在玻璃瓶中制备具有所选脂质组成和浓度的脂质混合物。首先,将脂质溶解在氯仿中,以获得浓度为 1 mg/mL 的最终脂质溶液。
- 混合脂质以获得94.9 mol%2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC)、5 mol%1,2-二油酰基-sn-甘油-3-磷酸乙醇胺N-(帽生物素)钠盐(DOPE-生物素)和0.1 mol%1,1'-二十八烷基-3,3,3',3'-四甲基吲哚二羰花青(DiD)(见 材料表)。
注意:脂质混合物可以通过不同的比例和DOPE-生物素浓度和/或不同的膜染料进行调整。推荐的 DOPE-生物素浓度 (5 mol%) 允许在以下步骤中形成高密度链霉亲和素 (SAv) 层。
- 混合脂质以获得94.9 mol%2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC)、5 mol%1,2-二油酰基-sn-甘油-3-磷酸乙醇胺N-(帽生物素)钠盐(DOPE-生物素)和0.1 mol%1,1'-二十八烷基-3,3,3',3'-四甲基吲哚二羰花青(DiD)(见 材料表)。
- 按照先前报道的方法7,8,12制备小的单层囊泡(SUV)。对于此步骤,建议准备直径为 ≤100 nm 的 SUV。
- 本研究采用超声处理方法。首先,在旋转小瓶的同时,用氮气流蒸发玻璃瓶中的氯仿溶液,以形成一层薄薄的脂质膜。接下来,在真空下除去残留的氯仿至少1小时。
- 通过涡旋将干燥膜在终浓度为 1 mg/mL 脂质的超纯水中再水化。最后,将获得的溶液超声处理10分钟,直到不透明溶液变清。
注意:将脂质混合物储存在冰箱的微量离心管中最多 2 周。只要最终SUV的尺寸为100nm,也可以使用不同的SUV制备方法(例如,挤出法≤。
- 通过涡旋将干燥膜在终浓度为 1 mg/mL 脂质的超纯水中再水化。最后,将获得的溶液超声处理10分钟,直到不透明溶液变清。
2. mOrange-Nano 募集到 disiLID 功能化 SLB
- 在 μ 载玻片 18 孔玻璃底室的每个孔中加入 150 μL 2 M NaOH(参见 材料表),并在室温下孵育 1 小时。随后,除去NaOH,先用150μL超纯水洗涤孔3-5次,然后用含有10mM CaCl2的150μL缓冲液(10mM Tris pH 7.4,100mM NaCl)洗涤3次。
- 将 15 μL 新鲜制备的 SUV(储备浓度为 1 mg/mL 的水溶液)加入含有 150 μL 缓冲液和 10 mM CaCl2 的孔中,以使缓冲液中 SUV 的稀释度约为 10 倍。让SUV在室温下孵育30分钟。孵育时间过后,将形成生物素化的SLBs。
- 用不含CaCl2 的缓冲液(10mM Tris pH 7.4,100mM NaCl)洗涤SLB至少7次,首先除去溶液,然后在每个步骤中加入新鲜缓冲液。建议每个洗涤步骤使用 80 μL 缓冲液。
注意:通过在不接触表面的情况下上下移液新鲜溶液数次,可以获得 SLB 的最佳洗涤。在含有新形成的 SLB 的孔中移液溶液应该是温和的,以减少小气泡的形成,这些气泡会损坏形成的 SLB。从这一刻起,孔应包含足够体积的缓冲液,以防止 SLB 变干。 - 为了用SAv进一步官能化生物素化的SLB,加入SAv溶液至终浓度为250nM,并在室温下孵育30分钟。随后,用缓冲液(10mM Tris pH 7.4,100mM NaCl)洗涤至少5次,去除过量的SAv。
- 从这一刻起,将样品置于保护性红光下,以避免光开关蛋白发生不必要的光活化。在孔中加入b-disiILD(参见 材料表)至终浓度为1μM。在室温下孵育 30 分钟后,用缓冲液洗涤至少 5 次以去除多余的蛋白质。
- 加入 mOrange-Nano(参见 材料表)至终浓度为 200 nM,并用铝箔覆盖样品,使其保持在黑暗中。
- 将载玻片μ载玻片置于荧光显微镜下并调整成像设置。设置 552 nm 激光器以激发 mOrange-Nano。调整发射范围以优化 mOrange 信号。disiLID 的光活化是通过 488 nm 激光实现的,使用间隔为 2.58 秒的光脉冲。
3. GUV的制备
- 制备5%(w / v)聚乙烯醇(PVA,见 材料表)(MW:145 000g / mol)与100mM蔗糖在超纯水中的溶液,在80°C下以400rpm混合过夜。
- 在具有所需成分(终浓度 10 mg/mL)的氯仿中制备脂质溶液。对于该方法,推荐使用由 10 mg/mL POPC、10 mol% 1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸-(1'-rac-甘油) (POPG)、2 mol% DOPE-生物素和 1 mol% DiD 组成的组合物(参见 材料表)。
- 用水合技术制备GUV 7,8。首先,将 40 μL 制备的 PVA 溶液作为均匀的薄层铺在 60 mm x 24 mm 载玻片的顶部,最好使用移液器吸头。接下来,将薄层在50°C下干燥30分钟。
- 用针头将5μL脂质溶液铺在PVA层上,并在30°C下干燥1小时。
- 使用垫片(~40 mm × 24 mm × 2 mm,参见 材料表)和第二个载玻片在功能化载玻片上组装一个腔室。
- 在室温下将 1 mL 再水缓冲液(10 mM Tris pH 7.4,100 mM NaCl)加入腔室 1 小时以形成 GUV。1小时后,倒置腔室并用移液器吸头轻轻敲击玻璃表面。
- 小心地取下一侧的载玻片,打开构建的腔室,并用移液管收获GUV。
- 将溶液放入塑料管中,让GUV沉淀2小时。
4. mOrange-Nano 募集到 disiLID 功能化 GUV
- 将SAv溶液添加到新鲜收获的GUV中,并在室温下静置30分钟。
注意: 以下步骤应在保护性红光下执行,以避免 disiLID 光活化。 - 向GUVs溶液中加入1μM b-disiLID并将样品在黑暗中放置30分钟,用铝箔覆盖。
- 用 150 μL BSA 溶液(3% w/v 水溶液)预处理 μ 载玻片 18 孔玻璃底室 10 分钟。接下来,取出 BSA 溶液并用 150 μL 超纯水洗涤孔 3 次。
- 向孔中加入 145 μL 200 nM mOrange-Nano 缓冲液(10 mM Tris pH 7.4,100 mM NaCl)。
- 接下来,向溶液中加入 5 μL 用 b-disiLID 修饰的 GUV,并等待 ~15 分钟让 GUV 沉降。
- 将μ载玻片置于共聚焦显微镜下。在 552 nm 处激发样品以观察 mOrange (λex = 557 nm;λem = 576 nm) 荧光,在 638 nm 处观察 GUV 膜中的 DiD (λex = 644 nm; λem = 665 nm)。mOrange-Nano 募集每 5.3 秒由蓝光脉冲(488 nm,强度 1%)触发,以最大限度地减少不希望的光漂白效应。
注意:激发波长可以根据所使用的显微镜类型进行调整。显微镜可用的其他常见激发波长还包括 532 nm 或 561 nm 和 633 nm、647 nm、639 nm 或 640 nm 激光器。
代表性结果
所描述的程序允许形成 SLB 以在合成膜上募集 mOrange-Nano。 图 1A 显示了在用 b-disiLID 功能化的 SLB 上形成定义的 mOrange-Nano 图案化。当SLB上的平方(24μm×24μm)感兴趣区域(ROI)用488nm蓝光照射时,在200 s内观察到ROI的mOrange通道(红色显示)中的荧光信号快速增加。该图案显示出非常清晰和锐利的边缘(图1B),表明对光活化区域的空间控制很高。这种相互作用是快速的,并且是完全可逆的,因为蓝光的照明被中断。该方法还允许在几个照明周期内形成图案(图2)。~200 秒的蓝光和 200 秒的暗光交替循环导致 mOrange-Nano 在选定区域多次可逆募集,图案中荧光的 Δ 强度值相当。
图3 显示了GUVs制备的示意图。在 GUV 上也观察到 mOrange-Nano 的募集。结果表明,放置在黑暗中的GUV不会表现出mOrange荧光(图4A)。当 GUV 用蓝光全局照射时,观察到 mOrange 荧光,与 GUV 膜染料 (DiD) 共定位。由于照明被终止,因此相互作用是高度可逆的。GUV膜上mOrange强度随时间推移的量化显示了蛋白质的快速有效募集以及完全可逆性(图4B)。
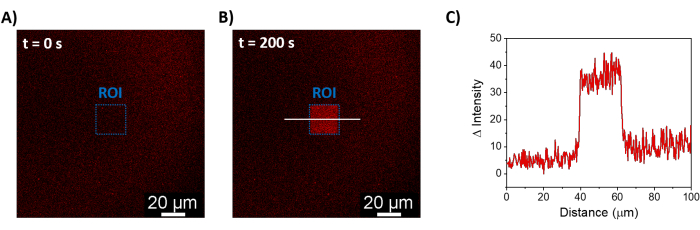
图 1:使用 b-disiLID 功能化的 SLB 的荧光显微镜图像。 在 ROI 中 (A) 和 (B) 局部蓝光 (488 nm) 照明期间存在 mOrange-Nano 的荧光图像。比例尺 = 20 μm。 (C) 用 b-disiLID 功能化的 SLB 在 ROI 中测量的 mOrange 的荧光强度(在 = 200 秒时)。图改编自 Di Iorio et al.8。 请点击这里查看此图的较大版本.
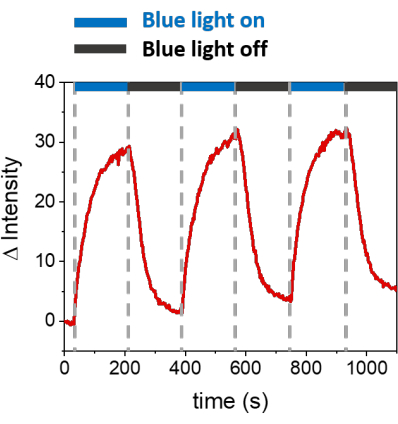
图 2:在三个募集周期中,在用 b-disiLID 修饰的 SLB 上,在 ROI 中招募的 mOrange 的荧光强度。 在每个光活化步骤后,mOrange-Nano 荧光在 ROI 内增加。图案在 120 秒内达到饱和,荧光在 120 秒内减弱,几乎达到背景水平。在不同的蓝光/黑暗周期中,没有观察到图案质量的损失。图改编自 Di Iorio et al.8。 请点击这里查看此图的较大版本.
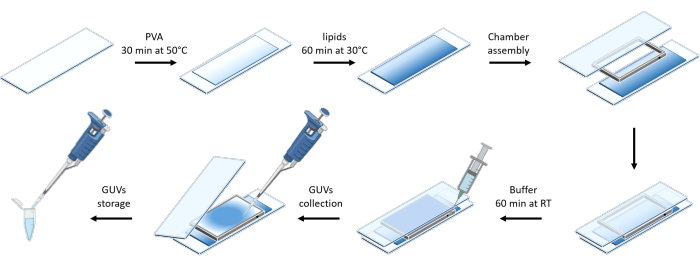
图 3:使用温和水合法制备 GUV 的示意图。 该方案直观地表示了几个步骤以及使用两个载玻片和一个垫片构建的腔室。 请点击这里查看此图的较大版本.
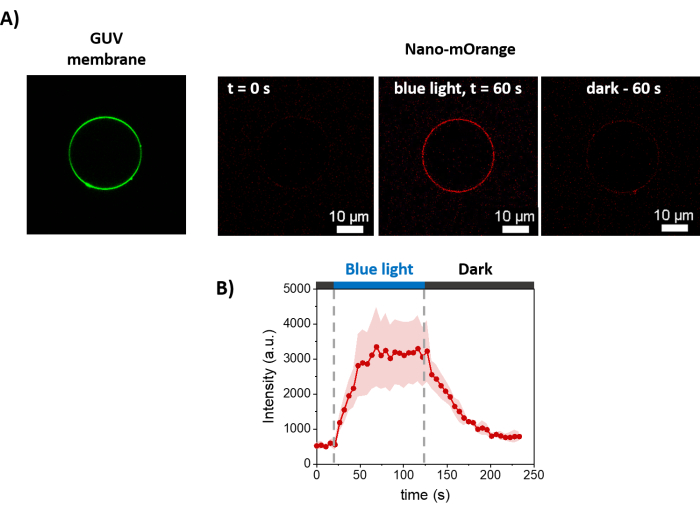
图 4:mOrange-Nano 在 GUVs 膜上光依赖性募集的荧光显微镜测量。 (A) 在 mOrange-Nano 存在下 disiLID 功能化 GUV 的荧光图像。绿色是 GUV 的膜染料,红色是蓝光照射前、期间和后的 mOrange 荧光。比例尺 = 10 μm。 (B) mOrange 随时间定位在 GUV 上的荧光强度。照射后,脂质膜上的mOrange荧光(以红色显示)在60 s内达到最大强度,荧光强度增加5.9倍。当照明停止时,mOrange荧光在60秒内降低到几乎达到照明前的值(恢复率为90%)。图改编自 Di Iorio et al.8。 请点击这里查看此图的较大版本.
讨论
我们已经描述了一种通过使用光开关蛋白 disiLID8 在模型膜上局部募集 mOrange-Nano 蛋白的方法,例如支持的脂质双层和巨大的单层囊泡。影响模式质量的方面包括蛋白质的质量以及 SLB 和 GUV 的良好质量。
为确保表达和纯化后的良好蛋白质质量,首先评估disiLID的光开关特性非常重要。为此,必须在黑暗中和蓝光照射后测量FMN辅因子的吸收。预计 disiLID 的紫外-可见光谱将在黑暗中显示辅因子 FMN 的特征性三峰,该峰在蓝光照射下显着降低,并在黑暗中恢复13。在以下步骤中,这种光开关行为对于获得可重复和可逆的募集至关重要。在样品制备过程中,使用保护性红光并将disiLID暴露在最小的外部照明下,可以提高实验性能。
另一个关键步骤,也许是最关键的一步,是形成适当的 SLB。 膜中的缺陷和/或不均匀 SLB 的形成(即,存在多层或修补的 SLB)将影响蛋白质图案的质量。因此,对于没有经验的用户,建议通过用一些膜染料(例如DiD和DiO)标记SUV来重现该协议,以形成荧光标记的SLB。通过这种方式,SLBs的性质和质量可以通过荧光显微镜很好地表征。FRAP测量代表了一种通过评估膜的流动性来评估SLB质量的典型方法。或者,在生物素化SLB的情况下,例如本协议中描述的那些,荧光标记的SAv(例如, Atto 488-SAv)可用于可视化和评估SLB的质量。
该协议的第一部分描述了 SLB 上模式的形成。为确保最佳结果,将 mOrange-Nano 添加到 SLB 中并让样品在黑暗中孵育 15 分钟非常重要。在光活化过程中,ROI 的选择不限于特定大小。然而,需要调节激光强度和曝光时间,以减少荧光蛋白的意外光漂白。
该方法不限于生物素化蛋白,其他方法可用于将 disiLID 锚定到 SLB 上。例如,His标记的disiLID可以表达并锚定在含有Ni-NTA的SLBs上。然而,用不同的标签表达 Nano 和 disiLID 至关重要,以避免替换 SLB 上的蛋白质。该方法还允许反转蛋白质的顺序,从而用 Nano 功能化 SLB 并在蓝光照射下募集 disiLID(或 disiLID 融合的蛋白质)。
为了动态控制蛋白质定位,蛋白质到选定区域的可逆定位应该是可能的。为了实现这一点,溶液中纳米(200 nM)的浓度是获得高可逆性的关键参数。
另一个问题是 Nano 募集到 disiLID 功能化的 GUV 表面。与SLB上的蛋白质图案化一样,该方法可以扩展到不同的膜功能化策略。在该协议中,整个GUV用蓝光照射,以在整个GUV表面上募集mOrange-Nano。然而,选择定位在GUV膜上的小ROIs应该会导致蛋白质在更受限的区域进行精确定位。
该方法仅存在与用于在 SUV 或 GUV 膜上对纳米募集成像的荧光团选择相关的限制。特别是,必须避免使用激发光谱在蓝光范围内的荧光基团,因为它们的使用会干扰(dis)iLID的光活化。因此,对于这种类型的实验,建议选择绿光或红光范围内的荧光基团(例如,mOrange或Cy5)。
disiLID 设计提供了一种简单且适应性强的方法,可以改善局部蛋白质向膜的募集,并拓宽了光遗传学4 中 iLID 和 Nano 的动态范围。这些方法的重点是将 Nano 募集到模拟膜上,例如脂质双层和 GUV。然而,这种方法可以扩展到细胞中的众多光遗传学工具,其中(dis)iLID或Nano与膜相连。
披露声明
作者没有什么可透露的。
致谢
这项工作由欧洲研究委员会 ERC Starting Grant ARTIST (# 757593 S.V.W.) 资助。DDI感谢亚历山大·冯·洪堡基金会(Alexander von Humboldt Foundation)提供的博士后奖学金。
材料
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 Well | Ibidi | 81817 | For SLB preparation |
| 25 µL Microliter Syringe | Hamilton | Model 702 N | For the preparation of lipid mixture and spreading the lipid solution on the PVA layer |
| Biotinyl Cap PE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl)) (sodium salt) | Avanti Polar Lipids | 870273C | For SUVs preparation |
| CaCl2 (Calcium chloride) | Sigma-Aldrich | C5670 | For SLB formation |
| Cover Slips 24 mm x 60 mm | Engelbrecht | K12460 | For GUVs formation |
| DiD (1,1'-Dioctadecyl-3,3,3',3'- Tetramethylindodicarbocyanine) | Thermo Fisher Scientific | D7757 | Membrane dye |
| disiLID | Sequence: MGGSGLNDIFEAQKIEWHEGGSH HHHHHGSMAATELRGVVGPGPAA IAALGGGGAGPPVGGGGGRGDA GPGSGAASGTVVAAAAGGPGPG AGGVAAAGPPAPPTGGSGGSGA GGSGSAGEFLATTLERIEKNFVIT DPRLPDNPIIFASDSFLQLTEYSR EEILGRNCRFLQGPETDRATVRK IRDAIDNQTEVTVQLINYTKSGKK FWNVFHLQPMRDYKGDVQYFIG VQLDGTERLHGAAEREAVMLIKK TAFQIAEAANDENYF | ||
| DOPC (1,2-di-(9Z-octadecenoyl)-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850375P | For SUVs lipid composition |
| Eppendorf Protein LoBind microcentrifuge tubes | Merk | EP0030108116-100EA | For collecting freshly made GUVs |
| mOrange-Nano | Sequence: MRGSHHHHHHGSKIEEGKLVI WINGDKGYNGLAEVGKKFEKDT GIKVTVEHPDKLEEKFPQVAATG DGPDIIFWAHDRFGGYAQSGLLA EITPDKAFQDKLYPFTWDAVRYN GKLIAYPIAVEALSLIYNKDLLPNP PKTWEEIPALDKELKAKGKSALM FNLQEPYFTWPLIAADGGYAFKY ENGKYDIKDVGVDNAGAKAGLTF LVDLIKNKHMNADTDYSIAEAAFN KGETAMTINGPWAWSNIDTSKVN YGVTVLPTFKGQPSKPFVGVLSA GINAASPNKELAKEFLENYLLTDE GLEAVNKDKPLGAVALKSYEEELA KDPRIAATMENAQKGEIMPNIPQM SAFWYAVRTAVINAASGRQTVDEA LKDAQTNSSSNNNNNNNNNNLGI EGTTENLYFQGSVSKGEENNMAI IKEFMRFKVRMEGSVNGHEFEIE GEGEGRPYEGFQTAKLKVTKGG PLPFAWDILSPQFTYGSKAYVKH PADIPDYFKLSFPEGFKWERVMN FEDGGVVTVTQDSSLQDGEFIYK VKLRGTNFPSDGPVMQKKTMG WEASSERMYPEDGALKGEIKMR LKLKDGGHYTSEVKTTYKAKKPV QLPGAYIVGIKLDITSHNEDYTIVE QYERAEGRHSTGGMDELYKGG SGTSSPKRPKLLREYYDWLVDN SFTPYLVVDATYLGVNVPVEYVK DGQIVLNLSASATGNLQLTNDFIQ FNARFKGVSRELYIPMGAALAIYA RENGDGVMFEPEEIYDELNIG | ||
| NaCl (Sodium chloride) | Sigma-Aldrich | S9888 | For buffer |
| NaOH (Sodium hydroxide) | Sigma-Aldrich | 1064980500 | For surface activation in SLB formation |
| POPC (1-Palmitoyl-2- oleoylphosphatidylcholine) | Avanti Polar Lipids | 850457C | For GUVs lipid composition |
| POPG (1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-(1'-racglycerol)) | Avanti Polar Lipids | 840457C | For GUVs lipid composition |
| PVA (Polyvinyl alcohol) fully hydrolyzed | Sigma-Aldrich | 8148940101 | For GUVs formation |
| SP8 confocal laser scanning microscope | Leica | ||
| Streptavidin | TermoFisher | 434301 | |
| Sucrose | Sigma-Aldrich | 84097 | For GUVs formation |
| Tris hydrochloride | Sigma-Aldrich | 10812846001 | For buffer |
参考文献
- Kretschmer, S., Schwille, P. Pattern formation on membranes and its role in bacterial cell division. Curr Opin Cell Biol. 38, 52-59 (2016).
- Yang, H. W., Collins, S. R., Meyer, T. Locally excitable Cdc42 signals steer cells during chemotaxis. Nat Cell Biol. 18 (2), 191-201 (2016).
- Caldwell, R. M., et al. Optochemical control of protein localization and activity within cell-like compartments. Biochem. 57 (18), 2590-2596 (2018).
- Kennedy, M. J., et al. Rapid blue-light-mediated induction of protein interactions in living cells. Nat Methods. 7 (12), 973-975 (2010).
- Guntas, G., et al. Engineering an improved light-induced dimer (iLID) for controlling the localization and activity of signaling proteins. Proc Natl Acad Sci. 112 (1), 112-117 (2015).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461 (7266), 997-1001 (2009).
- Bartelt, S. M., et al. Dynamic blue light-switchable protein patterns on giant unilamellar vesicles. Chem Commun. 54 (8), 948-951 (2018).
- Di Iorio, D., Bergmann, J., Higashi, S. L., Hoffmann, A., Wegner, S. V. A disordered tether to iLID improves photoswitchable protein patterning on model membranes. Chem. Commun. 59 (29), 4380-4383 (2023).
- Hartzell, E. J., Terr, J., Chen, W. Engineering a blue light inducible Spytag system (BLISS). J Am Chem Soc. 143 (23), 8572-8577 (2021).
- Xu, D., Bartelt, S. M., Rasoulinejad, S., Chen, F., Wegner, S. V. Green light lithography: a general strategy to create active protein and cell micropatterns. Mater Horiz. 6 (6), 1222-1229 (2019).
- Jia, H., et al. Light-induced printing of protein structures on membranes in vitro. Nano Lett. 18 (11), 7133-7140 (2018).
- Di Iorio, D., Verheijden, M. L., vander Vries, E., Jonkheijm, P., Huskens, J. Weak Multivalent Binding of influenza hemagglutinin nanoparticles at a sialoglycan-functionalized supported lipid bilayer. ACS Nano. 13 (3), 3413-3423 (2019).
- Kasahara, M., Torii, M., Fujita, A., Tainaka, K. FMN binding and photochemical properties of plant putative photoreceptors containing two LOV domains, LOV/LOV proteins. J Biol Chem. 285 (45), 34765-34772 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。