Method Article
使用主动食管冷却确定心房颤动消融术的连续性指数值
摘要
该方案描述了用于确定使用射频消融术接受肺静脉隔离手术的患者连续性指数的方法,并展示了使用主动食管冷却的消融手术与使用传统管腔食管温度监测的手术之间连续性指数的差异。
摘要
射频 (RF) 消融术进行肺静脉隔离 (PVI) 治疗心房颤动,对侧支结构(包括食管)存在一些风险。美国食品药品监督管理局 (FDA) 已授予使用专用设备的主动食管降温的上市许可,以降低 RF 心脏消融手术导致消融相关食管损伤的风险,最近的数据还表明,食管降温可能有助于改善治疗的长期疗效。解释这些发现的机制基础是通过量化定义为连续性指数 (CI) 的病变放置连续性而存在的。Kautzner 等人通过病灶放置的顺序量化了 CI,因此,每当病灶放置在与先前病灶不相邻的位置时,CI 就会增加导管尖端移动的节段数。
为了促进 CI 的实时计算并鼓励进一步采用该工具,我们提出了一种修改,其中非相邻病灶的位置仅使 CI 增加一个单位,避免了对心房分割的潜在模糊标志物进行计数的需要。该协议的目的是描述在实时 PVI 病例中前瞻性计算 CI 和使用记录的病例数据回顾性计算 CI 的方法。然后比较了使用主动食管冷却的病例和使用管腔食管温度 (LET) 监测的病例之间的结果。
引言
在全球心房颤动 (AF) 病例数量不断增加的情况下,使用射频 (RF) 导管消融术的肺静脉隔离 (PVI) 已成为恢复窦性心律的最常用方法之一1。研究表明,间接病变质量标志物,如阻抗下降、导管-组织接触力、导管稳定性和双极电图振幅降低,是跨壁性的证据,这有助于 PVI2 的有效性。尽管有这些可用的标志物,但改进成功隔离并最终实现长期无心律失常仍然是电生理学家的首要任务。临床数据表明,沿圆周隔离线放置相邻、重叠和连续病灶与较低的复发率和实现跨壁相关单极电图 (TUE) 的可能性较高相关2,3。
Kautzner 等人在 EFFICAS II 研究中开发了连续性指数 (CI) 来量化不连续的病变放置,以进一步了解消融过程中病变放置的顺序如何影响短期和长期疗效(图 1)3。CI 是指由于局部过热而提前停止射频电源后,导管尖端移动以将后续病灶放置在非相邻位置的位置数。较高的 CI 意味着连续病灶放置的不连续性更多。这项研究表明,与 CI ≥ 6 相比,低 CI (CI < 6) 的 PVI 由于连续导管移动导致成功隔离率显着增加,从而实现更有效的电隔离 63。观察到的与较高 CI 相关的长期疗效降低的一种可能机制是病变周围发生的快速水肿形成,这被认为会导致可逆的 PVI 4,5。当后续病变延迟时,快速水肿形成可能会阻止相邻位置的透壁或连续病变形成,并可能显着改变或隐藏受阻组织区域的局部电图 2,3。在 PVI 期间需要预防食管热损伤和可能致命的食管瘘 (AEF);然而,由于在食管中检测到局部过热,使用传统的管腔食管温度 (LET) 监测通常会迫使射频能量应用停止 6,7,8。这反过来又会导致 CI 显著增加。
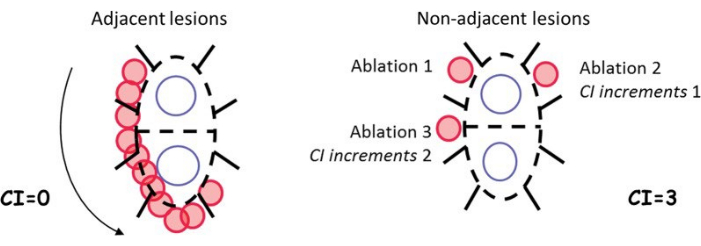
图 1:最初为两个消融模式示例定义的连续性指数计算示例3。该数字取自 Kautzner 等人 3。缩写:CI = 连续性指数。 请单击此处查看此图的较大版本。
美国食品药品监督管理局 (FDA) 已授予主动食管冷却装置(参见材料表)的上市许可,以降低射频心脏消融手术导致消融相关食管损伤的可能性,来自 25,000 多名患者的数据表明,冷却后 AEF 率显着降低9.长期随访数据还表明,与 LET 监测相比,使用降温时心律失常的发生率更高10,11。冷却装置是放置在食管中的非无菌多腔硅胶管,很像口胃管,用于冷却或加热患者。该管充当无意中传递到食管的射频能量的散热器,从而最大限度地减少食管组织损伤,而心包组织则阻止心房组织显着冷却12。通过将食管冷却装置连接到外部热交换器来控制设备温度,该热交换器在设备内循环蒸馏水(图 2)。该设备可由任何获准放置标准口胃管的提供者(护士、医生、护理人员)放置。对于消融手术,该装置通常由麻醉师或 CRNA 在麻醉诱导和插管后立即放置。通过在透视上观察胃腔中不透射线的远端尖端来确认放置。该装置也可以在消融术中常用的心内超声心动图 (ICE) 上看到。在手术过程中,可以通过常规方法(Foley、直肠、前额、腋窝或鼓膜温度探头)连续测量患者的体温,但不能通过食管探头测量。回想一下,腋窝温度通常比核心温度低 1.5°C,因此有必要将其添加到腋窝测量值中以反映患者核心温度13。
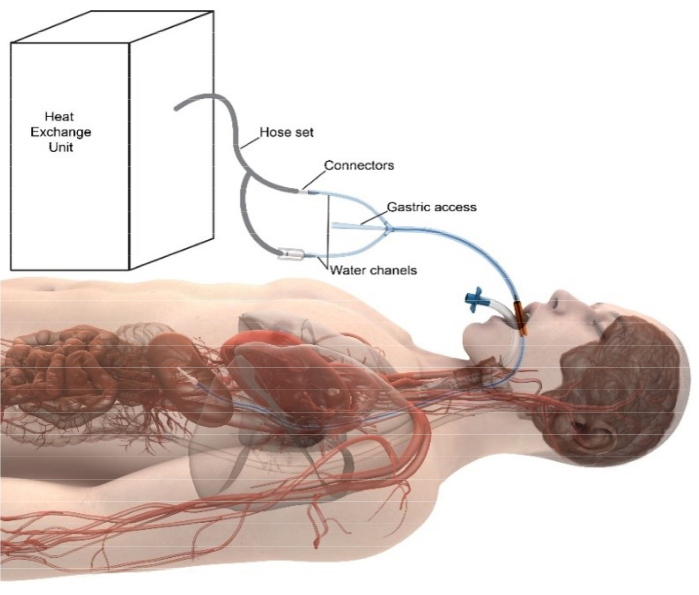
图 2:主动食管温度管理系统示意图。 市售的热交换装置产生温控水,然后通过标准管组输送到放置在食道中的设备中。在设备内以 ~1.5 L/min 的速率循环后,水返回热交换装置。独立的中央管腔允许胃减压和抽吸。装置远端的射线不透性允许在胃腔进行透视观察,以确认正确放置。 请单击此处查看此图的较大版本。
最近的烧伤文献发现,热损伤后降温与烧伤严重程度降低之间存在很强的关联,这种影响的机制延伸到热量消散之外,包括通过以下方式改变细胞行为:(i) 减少乳酸和组胺的释放,(ii) 稳定血栓素和前列腺素水平,(iii) 减缓局部新陈代谢, (iv) 改变膜通透性,以及 (iv) 抑制激肽释放酶活性14。对体温过低对烧伤的局部影响的日益了解为本研究中使用的食管冷却装置所看到的显着安全益处提供了机制基础15。主动食管冷却允许连续放置连续病灶而不会中断,并且无需因局部过热情况或温度警报而暂停,这可能是由于上述机制。这反过来又减少了操作员的认知负荷,减少了手术时间,并允许减少 CI,从而提高长期 PVI 成功率16,17。
我们在本协议中的目的是描述在实时病例中前瞻性计算修改后的 CI 的方法,并描述在记录的病例中用于回顾性计算修改后的 CI 的方法。然后,我们为利用主动食管冷却的实时观察以及采用冷却之前的回顾性数据的病例提供代表性结果。这种方法的一个优点是可以很容易地实时和回顾性地测量 CI。通过观察有和没有降温的 PVI 病例的 CI,可以进一步量化降温对长期疗效和病变连续性的影响,并且有可能进一步促进使用 CI 作为 PVI 质量指标。继续研究在 RF 消融和临床疗效方面探索 CI 和病变质量仍然很重要,尤其是当脉冲场消融似乎与新不良事件的风险相关而没有令人信服地改善长期结果时 18。
研究方案
这项研究由北岸大学卫生系统机构审查委员会审查并批准为豁免。
1. 计算 Prospective cases 的 CI
- 对于活体潜在病例,让工作人员通过观察操作员在 3-D 标测软件屏幕上放置的病灶顺序来监测控制室中的病灶放置。
注意:Surpoint VISItag 大小可以设置为操作员首选项的范围,例如 2-3 mm。 - 让工作人员使用以下设置的参数实时量化 CI。放大屏幕上看到的病变位置,以使用毫米 (mm) 标记设置确认位置。
- 记录 CI 增加零 (0)。
- 观察到放置在每根右静脉或左静脉上的第一个病灶不会增加 CI。
- 与先前放置的病灶重叠的病灶(由标测软件和视觉测定确定)不会增加 CI。
- 将连续病灶的路径连接到其他病灶(例如闭合肺静脉周围的圆圈)的病灶不会增加 CI。
- 不要增加放置在已完成的连续病灶线顶部的病灶的 CI,以进行额外的燃烧/进一步隔离(修补病灶)。
- 当将病灶放置在新位置时,对于放置前一个病灶的静脉(这包括 VISItag 之间显示的小间隙),记录 CI 增加 1 (+1)。
- 当一组新的连续病灶放置在新位置时,记录 CI 增加 2 (+2),不接触任何先前的病灶,然后放置另一个病灶以继续之前的病灶线。在这里,第一次离开的区域将 CI 增加 1,从第二个区域(可能是相同的矿脉)移动的 CI 增加 1(+1 表示初始不连续性,+1 表示返回)。
- 记录 CI 增加零 (0)。
- 要对 CI 进行汇总,请让工作人员实时记录整个病例中左右肺静脉的不连续性,并在病例结束时对 CI(每条静脉和总数)求和。
2. 计算回顾性病例的 CI
- 要访问回顾性案例文件,请安装并打开 3-D 映射软件。
- 从 3-D 绘图系统下载过去的案例。单击 System (系统 | )研究存档器 |恢复。通过使用屏幕左上角的 From: 和 To: 部分中的下拉菜单选择日期范围来筛选案例。
示例: 从: 2018 年 10 月 11 日到 : 2018 年 11 月 12 日 - 在屏幕顶部的 First Name(名字)、Last Name(姓氏)或 Patient ID(患者 ID)部分中键入星号 *。单击屏幕右上角 Patient ID 旁边的 Query。
- 选择标记为 AF 或 Afib 的案例,然后单击屏幕上案例列表旁边的 > 按钮,将每个选定的案例带到屏幕右侧。
- 单击 Restore 以恢复数据并访问所选案例。单击 Exit |确定 ,当所选案例已完全恢复时(将在屏幕上显示为 100% 恢复)。
- 一旦所选病例完全恢复,请工作人员按照以下步骤开始审查病灶之间的不连续性病例。
- 单击主屏幕中的 Review Study 。屏幕上将出现一个案例列表。更改 患者姓名 或 研究日期 之间的排序顺序,以按特定患者或按执行程序的日期组织病例审查。
- 从案例列表中选择感兴趣的案例,然后单击 Ok (确定)。所有病变的图像将在屏幕上显示为红色气泡。如果病变 (VISItags) 最初没有出现,请单击 VISItag 工具栏 以获取下拉菜单,单击菜单中 的 VISItags 图像 ,然后在下拉菜单的底部,选择 所有 未 在视图中 ,使它们在屏幕上显示为红色气泡。
- 要观察带有病变的左心房的结构,请从左侧屏幕顶部的地图下拉菜单中选择显示 VISItag 最多的 LA 地图。
- 确保所选 映射处于活动状态。要激活包含所有 VISItag 的特定地图,请在下拉菜单中选择之前所选地图的小圆圈(小方块旁边)。这将在屏幕左侧的图形查看器部分中显示顺序 VISItag 的列表。
- 根据需要调整透明度(通过单击键盘上的 < 或 > 按钮);地图上的透明度越高,则可以看到整个静脉周围的病变圈。
- 单击屏幕左上角的 Window |选择 Graph Viewer 并将其拖动到屏幕左侧。Graph Viewer 屏幕将按放置顺序显示病变列表。
- 单击屏幕左侧图形查看器部分中病变列表顶部 的第一个点 (VISItag)。 右键单击 VISItag 编号,然后单击 Select VISItag location。
- 观察屏幕右侧,橙色突出显示的左心房病变。如果视野受阻,请围绕屏幕旋转,以更清晰地看到突出显示的病变图像。通过按住鼠标上的中心按钮并在表面上拖动鼠标来执行此操作。
- 重复步骤 2.9.-2.9.1。对于病变图形视图列表中的 Sequences Sequences。
- 当工作人员突出显示每个 VISItag 病变时,请他们使用下面定义的参数开始记录左右肺静脉的 CI。
- 记录 CI 增加零 (0):
- 放置在右静脉或左静脉上的第一个病灶不会增加 CI。
- 与先前放置的病灶重叠的病灶(由 3-D 标测软件和视觉测定确定)不会增加 CI。
- 将连续病灶的路径连接到其他病灶(例如闭合肺静脉周围的圆圈)的病灶不会增加 CI。
- 不要增加放置在已完成的连续病灶线顶部的病灶的 CI,以进行额外的燃烧/进一步隔离(修饰)。
- CI 记录 1 (+1) 增加:
- 为明显未接触最后一个放置的病灶放置添加一个 (+1) 不连续性。
- 为每根肺静脉的每个显着跳跃增加一个 (+1) 不连续性(情况 2.10.1.1 除外 - 在隔离第一条静脉后,不要为新静脉上的第一个病变添加不连续增量)。
- 选择并观察每个 VISItag 后,对 CI 求和。总和将是总 CI 分数。对左肺静脉和右肺静脉的 CI 分别进行评分,以获得更精细的数据。两个分数之和等于总连续性指数分数。
- 记录 CI 增加零 (0):
- 要完成其他相关病例信息(即消融医师、手术日期、患者性别、出生日期)的数据收集,请按照以下步骤操作。
- 选择每个 标签后,从最左上角选择 study(研究 ),然后单击 continue study(继续研究)。
- 单击 Setup |study 并记录感兴趣的其他数据。
- 要退出软件,请单击屏幕左上角的 Study ,然后选择 Exit。
结果
记录了总共 75 例使用主动食管降温接受 PVI 治疗的患者的数据。患者平均年龄为 69.8 ± 9.0 岁,其中 42.7% 为女性,37.3% 为阵发性,62.7% 为持续性 AF。PVI 的平均 ± SD CI 为 2.6 ± 3.7,左肺静脉分离 (1.2 ± 1.7) 和右侧肺静脉分离 (1.4 ± 2.3) 相似。在 75 名患者中,只有 5.3% (4) 两侧的 CI 高于 6,只有 22% (16) 的总 CI 高于 6。 图 3 显示了队列中左静脉和右静脉的平均 CI。作为比较,回顾了来自同一实验室使用 LET 监测的代表性病例,发现总 CI 为 29;左侧 15 个,右侧 14 个。
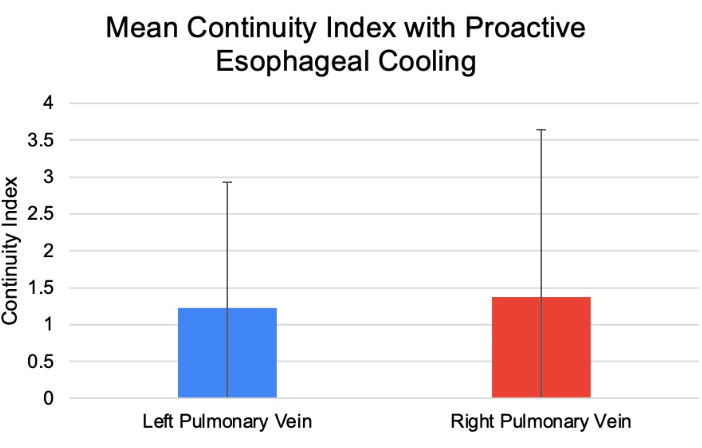
图 3:使用主动食管冷却分析的 75 名患者队列的左肺静脉和右肺静脉的平均 CI。 缩写:CI = 连续性指数。 请单击此处查看此图的较大版本。
讨论
CI 是反映在 PVI 案例中获得的隔离质量的附加指标。Kautzner 等人在 EFFICAS II 研究中开发了测量这一关键变量的初始方法,并证明了 CI 对隔离完整性和由此产生的心律失常自由度的显着影响3。在此处描述的方案中,CI 计算是从 EFFICAS II 研究修改而来的,以进一步简化计算,并提供一种更简单的方法来在实时实时病例中前瞻性计算 CI,以及从常规获得的病例记录中回顾性计算 CI (图 4)。在活体病例中,查看肺静脉并评估任何给定病灶被放置在哪个象限可能具有挑战性(由于缺乏肺静脉节段的正式划分,并且导致适当数量的指数单位增加的歧义)。此处描述的拟议修改方法捕获了 EFFICAS II 中报告的基本假设和方法,同时提供了一种更可行的方法来获取每种情况的 CI,这反过来可能有助于现有标测系统的自动化。
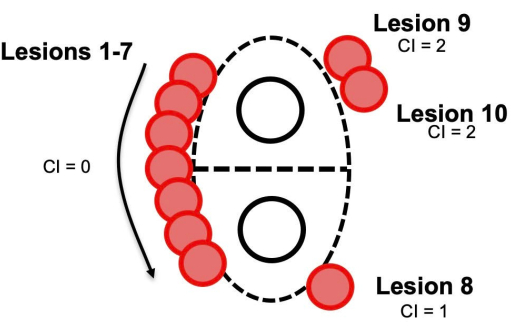
图 4:用于实时和回顾性计算的修改后的连续性指数计算示例。 这些计算仅涉及将每个非相邻病灶增加一个单位。缩写:CI= 连续性指数。 请单击此处查看此图的较大版本。
在潜在病例中确定 CI 的关键是让一名工作人员能够在实时手术期间跟踪病变位置并记录数据。回顾性病例审查的关键部分是让一名能够访问 CARTO 3 绘图软件的工作人员能够轻松高效地访问病例并记录数据。对于回顾性病例,详细说明 CI 计数和汇总的方案的关键步骤(步骤 2.9.7-2.10)通常需要 ~10-15 分钟。但是,完成前面的步骤大约需要 30 分钟的额外时间,因为每个案例的下载可能需要 10 分钟以上。
该方法的局限性包括:在现场病例期间计算 CI 需要在医生消融时房间内有额外的人,以及这项工作所需的时间。在每种情况下,这个人通常会花费一个小时或更长时间,以确保他们从第一个到最后一个病灶放置都在场。许多实验室和控制室的空间有限,可能难以容纳额外的人员。测量回顾性案例的 CI 还需要一名专职人员在场。在这项研究中,提供了一个具有代表性的回顾性病例作为 LET 监测 PVI 中 CI 的比较。目前正在收集其他数据,以提供更正式和有充分把握度的比较分析。
其他限制包括收集的数据来自单个中心的 4 名操作员,用于前瞻性和回顾性病例。虽然回顾性评价可能最大限度地减少了偏倚,但电生理学家可能在前瞻性病例期间获取数据时改变了他们的病灶放置策略以最小化 CI。此外,每个病例的 CI 由一名评价员确定,而不是由另一名评价员独立验证。
该方法的未来应用或方向将是自动化 CI 采集过程。与导管-组织接触力类似,CI 理想情况下是在病例期间实时计算的自动生成值,通过导管放置病灶位置和现有的电解剖标测功能来测量。在病例中接近 5-6 个 CI 单位的医生可以调整他们下一个计划的病灶放置或采用其他方法来最大限度地减少病灶不连续性/高 CI。
在射频消融过程中使用 ensoETM(Attune Medical,芝加哥)进行主动食管冷却,可实现低 CI。以前的出版物表明,这可能是主动降温 PVI 病例长期无心律失常率较高的一种可能机制10,11。一项前瞻性随机对照试验 (NCT04577859) 正在进行中,该试验比较了主动食管降温与 LET 监测对长期手术效果的影响。这项多中心研究的入组目标是 250 名患者,研究中心将包括 CI 数据。在随机对照试验中进一步探索该变量有望提供更强的 CI 对长期无心律失常影响的估计。有力的证据表明存在重大影响,反过来可能支持消融导管制造商开发软件以包括这项措施的努力。
披露声明
Catherine Lazarus、Jacob Sherman、Natalie Putzel 和 William Zagrodzky 曾在 Attune Medical 实习;Tiffany Sharkoski 在 Attune Medical 工作;Erik Kulstad 拥有 Attune Medical 的股权和就业;Mark Metzl 曾为 Abbott、Biosense Webster、Attune Medical、Medtronic、Sanofi Aventis 和 Philips 提供咨询服务。所有剩余的作者都没有什么可披露的。
致谢
本出版物中报告的研究得到了美国国立卫生研究院国家心肺血液研究所的部分支持,奖项编号为 R44HL158375(内容完全由作者负责,不一定代表美国国立卫生研究院的官方观点)
材料
| Name | Company | Catalog Number | Comments |
| Blanketrol III hyper-hypothermia system | Gentherm Medical, Cincinnati, OH | Model 233 | Programmable heat exchanger for temperature regulation |
| Carto 3 System | Biosense Webster, Inc. (J&J MedTech), Irvine, CA | FG-5400-00 | 3-D mapping system with the integration, scalability and insights to help electrophysiologists make optimal treatment decisions. |
| ensoETM | Attune Medical, Chicago, IL | ECD02A | Active esophageal cooling device |
| Esophageal Stethoscope with Temperature Sensor Level 1 | Smiths Medical ASD Inc., Minneapolis, MN | ES400-18 | Luminal Esophageal Temperature (LET) monitoring system |
参考文献
- Scott, M., et al. Contemporary trends in cardiac electrophysiology procedures in the United States, and impact of a global pandemic. Heart Rhythm O2. 4 (3), 193-199 (2023).
- Jankelson, L., et al. Lesion sequence and catheter spatial stability affect lesion quality markers in atrial fibrillation ablation. JACC Clin Electrophysiol. 7 (3), 367-377 (2021).
- Kautzner, J., et al. EFFICAS II: optimization of catheter contact force improves outcome of pulmonary vein isolation for paroxysmal atrial fibrillation. Europace. 17 (8), 1229-1235 (2015).
- Thomas, S., et al. Higher contact force during radiofrequency ablation leads to a much larger increase in edema as compared to chronic lesion size. J Cardiovasc Electrophysiol. 29 (8), 1143-1149 (2018).
- Ren, J. F., Callans, D. J., Schwartzman, D., Michele, J. J., Marchlinski, F. E. Changes in local wall thickness correlate with pathologic lesion size following radiofrequency catheter ablation: an intracardiac echocardiographic imaging study. Echocardiography. 18 (6), 503-507 (2001).
- Della Rocca, D. G., et al. Clinical presentation, diagnosis, and treatment of atrioesophageal fistula resulting from atrial fibrillation ablation. J Cardiovasc Electrophysiol. 32 (9), 2441-2450 (2021).
- Shen, K. R. Commentary: The rising storm of atrioesophageal fistulae after catheter ablation for atrial fibrillation. JTCVS Tech. 6, 169(2021).
- Tan, M. C., et al. Causes of early mortality after catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol. 16 (5), e011365(2023).
- Sanchez, J., et al. Atrioesophageal fistula rates before and after adoption of active esophageal cooling during atrial fibrillation ablation. JACC Clin Electrophysiol. 9 (12), 2558-2570 (2023).
- Wm Leung, L., et al. Effect of esophageal cooling on ablation lesion formation in the left atrium: insights from ablation index data in the IMPACT trial and clinical outcomes. J Cardiovasc Electrophysiol. 33 (12), 2546-2557 (2022).
- Joseph, C., et al. Improved 1-year outcomes after active cooling during left atrial radiofrequency ablation. J Interv Card Electrophysiol. 66 (7), 1621-1629 (2023).
- Mercado Montoya, M., et al. Proactive esophageal cooling protects against thermal insults during high-power short-duration radiofrequency cardiac ablation. International Journal of Hyperthermia. 39 (1), 1202-1212 (2022).
- Sessler, D. I. Temperature monitoring and perioperative thermoregulation. Anesthesiology. 109 (2), 318-338 (2008).
- Griffin, B. R., Frear, C. C., Babl, F., Oakley, E., Kimble, R. M. Cool running water first aid decreases skin grafting requirements in pediatric burns: a cohort study of two thousand four hundred ninety-five children. Ann Emerg Med. 75 (1), 75-85 (2020).
- Bender, D., et al. The acute impact of local cooling versus local heating on human skin microcirculation using laser Doppler flowmetry and tissue spectrophotometry. Burns. 46 (1), 104-109 (2019).
- Cooper, J., et al. Active esophageal cooling during radiofrequency ablation of the left atrium: data review and update. Expert Rev Med Devices. 19 (12), 949-957 (2022).
- Joseph, C., et al. Reduced procedure time and variability with active esophageal cooling during radiofrequency ablation for atrial fibrillation. JoVE. (186), (2022).
- Bunch, T. J. Hope, hype, and reality of pulsed field ablation for atrial fibrillation. N Engl J Med. 389 (18), 1720-1721 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。