大鼠非侵入性ACL损伤后膝关节退化的可视化
Overview
资料来源:林赛·莱普利1,2, 史蒂文 M. 达维1,蒂莫西 A. 巴特菲尔德3,4和西娜沙赫巴兹莫哈马迪5,
1康涅狄格大学运动学系,斯托尔斯,CT;2康涅狄格大学健康中心骨科外科系,法明顿,CT;3肯塔基大学康复科学系,列克星敦,肯塔基州;4肯塔基大学生理学系肌肉生物学中心,列克星敦,肯塔基州;5康涅狄格大学生物医学工程系,斯托尔斯,CT
膝关节前十字韧带 (ACL) 损伤大大增加了创伤后骨关节炎 (PTOA) 的风险,因为大约三分之一的人将在 ACL 受伤后的第一个十年内展示放射学 PTOA。虽然 ACL 重建 (ACLR) 成功地恢复了膝关节稳定性,但 ACLR 和当前的恢复技术并不妨碍 PTOA 的发病。因此,ACL损伤是研究创伤性关节损伤后PTOA发展的理想模型。
鼠模型被广泛用于研究ACL损伤对PTOA的发病和影响。ACL损伤应用最广泛的模型是ACL分型,这是一种在手术上破坏关节稳定的急性模型。虽然实用,该模型并不忠实地模仿人类ACL伤害,由于侵入性和非生理伤害程序,掩盖了原生生物对伤害的反应。为了改进结果的临床翻译,我们最近开发了一种新的非侵入性ACL损伤模型,其中ACL通过单负荷的tibial压缩破裂。这种损伤与人类相关的损伤情况密切相关,并且具有很高的可重复性。
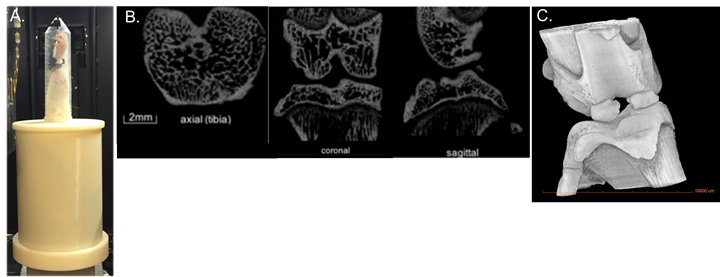
通过微计算机断层扫描 (μCT) 实现关节退化的可视化,与传统 OA 染色技术相比,提供了几大进步,包括整个关节退化的快速、高分辨率、非破坏性的 3D 成像。本演示的目的是在啮齿动物模型中引入最先进的非侵入性 ACL 损伤,并使用 _CT 量化膝关节退化。
Procedure
非侵入性 ACL 伤害
- 穿戴适当的个人防护设备。您可以使用呼吸面罩,但此协议不是强制性的。
- 使用具有 5% 无氧和 1 L/min 氧气的感应室对大鼠进行麻醉。使用鼻锥维持麻醉的流量,鼻锥体为 1 - 3% 的异常胶和 500 mL/min 的氧气。如果未在背拔或下拔表上设置设备,请确保使用桌面系统和木炭过滤器清除废气。
- 进行脚趾捏,以确保已经达到足够的麻醉深度。请注意,无需使用眼润滑剂,协议执行迅速(< 3 分钟),角膜干燥的风险最小。
- 将右后肢置于30°的多西弯曲和100°的膝关节弯曲处,同时为骨质骨相对于股骨的前次压度提供空间。
- 将顶部膝部级牢固地安装到线性执行器上。
- 将弯曲的膝盖放在底部,该膝盖直接安装在称重传感器的正上方。
- 以 8 mm/s 的速度使用单负载的 tibial 压缩来诱导 ACL 损伤。
- ACL 损伤通过释放压缩力来表示。这通过自定义程序进行监视。
- 受伤后,当动物仍在麻醉平面下时,执行拉赫曼的测试,以临床上确认ACL破裂已经发生。Lac
Results
Application and Summary
References
- Maerz T, Kurdziel MD, Davidson AA, Baker KC, Anderson K, Matthew HW. Biomechanical Characterization of a Model of Noninvasive, Traumatic Anterior Cruciate Ligament Injury in the Rat. Ann Biomed Eng. 2015;43(10):2467-2476.
- Christiansen BA, Anderson MJ, Lee CA, Williams JC, Yik JH, Haudenschild DR. Musculoskeletal changes following non-invasive knee injury using a novel mouse model of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 2012;20(7):773-782.
- Lockwood KA, Chu BT, Anderson MJ, Haudenschild DR, Christiansen BA. Comparison of loading rate-dependent injury modes in a murine model of post-traumatic osteoarthritis. J Orthop Res. 2014;32(1):79-88.
- Blair-Levy JM, Watts CE, Fiorentino NM, Dimitriadis EK, Marini JC, Lipsky PE. A type I collagen defect leads to rapidly progressive osteoarthritis in a mouse model. Arthritis Rheum. 2008;58(4):1096-1106.
- Mohan G, Perilli E, Kuliwaba JS, Humphries JM, Parkinson IH, Fazzalari NL. Application of in vivo micro-computed tomography in the temporal characterisation of subchondral bone architecture in a rat model of low-dose monosodium iodoacetate-induced osteoarthritis. Arthritis Res Ther. 2011;13(6):R210.
- Jones MD, Tran CW, Li G, Maksymowych WP, Zernicke RF, Doschak MR. In vivo microfocal computed tomography and micro-magnetic resonance imaging evaluation of antiresorptive and antiinflammatory drugs as preventive treatments of osteoarthritis in the rat. Arthritis Rheum. 2010;62(9):2726-2735.
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。