Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Visualisierung der Live- Drosophila Glial-neuromuskulären Synapse mit Fluoreszenzfarbstoffen
In diesem Artikel
Zusammenfassung
Wir beschriebenen strukturellen Merkmale der Glia-neuromuskuläre Synapsen in einem Roman Inside-out Gewebe Vorbereitung der Live-Larven unter Verwendung von fluoreszierenden Farbstoffen mit der konfokalen Mikroskopie. Wir gekennzeichnet leben Neuronenendigungen mit fluoreszierenden primären Antikörper gegen HRP und auch visualisiert die perisynaptic Raum mit fluoreszierenden Dextrane.
Zusammenfassung
Unser Projekt identifiziert GFP-markierten Gliazellen Strukturen an der Entwicklung von Larven zu fliegen neuromuskulären Synapse. Um sich die Entwicklung von Live-Glia-Nerv-Muskel-Synapsen, entwickelten wir eine Larvengewebe Vorbereitung, die Features von Live intakten Larven hatte, sondern hatte auch gute optische Eigenschaften. Das neue Präparat auch für den Zugang von Perfusaten zur Synapse erlaubt. Wir verwendeten Fliegenlarven, eingetaucht in diese künstliche Hämolymphe, und entspannt ihre normale rhythmische Kontraktionen Körper durch Kälte ihnen. Als nächstes werden wir aus der hinteren Segmente der einzelnen Tiere seziert und mit einem stumpfen Insekten pin schob die Mundwerkzeuge rückwärts durch die Leibeshöhle. Diese umgestülpt die Larven Körper Wand, wie aus einer Socke von innen nach außen. Wir haben die Dissektion mit ultra-feinen Sezierung Schere und somit ausgesetzt der viszeralen Seite des Körpers Wand Muskeln. Die Glia-Strukturen an der NMJ ausgedrückt Membran gezielt GFP unter der Kontrolle von Glia-spezifische Promotoren. Die postsynaptischen Membran, die SSR (subsynaptischen Reticula) im Muskel ausgedrückt synaptisch gezielte dsRed. Wir mussten akut Etikett der Motor Neuron-Terminals, der dritte Teil der Synapse. Dazu wandten wir primäre Antikörper gegen HRP, konjugiert mit einem weit rot emittierenden Fluorophor. Zur Prüfung auf Farbstoffdiffusion Eigenschaften in die perisynaptic Raum zwischen den Motoneuronen-Terminals und der SSR, verwendeten wir eine Lösung der großen Dextran-Moleküle konjugiert weit rot emittierenden Fluorophor und sammelte Bilder.
Protokoll
Teil 1: Tissue Vorbereitung
- Unser Ziel ist ein Gewebe Vorbereitung von Fliegenlarven, wo das Nervensystem intakt ist, aber die innere Oberfläche des Körpers Wand Muskel ist, um eine künstliche Hämolymphe ausgesetzt sind, und schließen kann, ein Mikroskop Deckglas für eine gute Optik positioniert werden. In anderen Worten, eine von innen nach außen Larven Vorbereitung.
Da herkömmliche Gewebe Vorbereitungen Schneiden, Pinning und Dehnen des Körpers Wand Muskeln, und manchmal Entfernen eines Teils des Nervensystems beteiligt, mussten wir einen anderen Ansatz.
Wir wollten die Tiere von innen nach außen, weil wir einen guten Blick auf strukturelle Merkmale und strukturelle Veränderungen im Laufe der Zeit in der Synapse zu bekommen wollte, und wir wollten immer das Nervensystem intakt. Wir wollten auch verhindern Dehnung der Gewebe und aktiviert Stretch-Rezeptoren, die die Muskeln zucken und ruinieren unsere Bilder würden. - Für den Anfang Bühne der Tiere. Feeding dritten Larven und Wandering dritten Larven sind groß und leicht zu zerlegen, damit wir auf W3-Larven werden zu demonstrieren. Dieses Tier ist, hat die Tubby Phänotyp und breit ist, so ist es leicht, Evert.
Wir haben nur Larven, die wir sahen, aktiv kriechen, einschließlich W3 Larven. - Reinigen Sie die Oberfläche eine Made mit einem sehr weichen Pinsel in einer Petrischale zweifach destilliertem H2O. Saubere Larven haben eine bessere Optik und Reinigung reduziert Bakterien.
- Übertragen Sie die Tiere zu einer kleinen Petrischale von ca. 3 ml eiskaltem HL-6 und künstliche Hämolymphe. Setzen Sie die Schüssel auf Eis, bis das Tier nicht mehr bewegt und entspannt (ca. 5 Minuten).
- Halten Sie sehr feine Spitze Pinzette in der einen Hand und Feder Schere in der anderen. Ich benutze die Schere mit meiner dominanten Hand. Machen Sie ein kleines Loch in die Wand des Körpers mit der Schere, um den Druck über den Körper Wand equlibrate.
- Halten Sie das Tier vorsichtig mit der Pinzette auf den Boden der Schale und schneiden Sie die hinteren beiden Segmenten. Dissect entfernt die Eingeweide und fetten Körper wird wahrscheinlich ausziehen der Körperhöhle. Schneiden Sie dieses Gewebe auch.
- Halten Sie die Larven gegen die Schale unten mit feinen Pinzetten. Halten Sie ein # 0 Insekt pin in (mit einem stumpfen Spitze) und drücken Sie es gegen die Mundwerkzeuge der Larven. Drücken Sie die Mundwerkzeuge durch die Körperhöhle wie Sie drehen eine Socke von innen nach außen sind.
- Die von innen nach außen Gewebe wird wie in Abbildung aussehen: unten. Mit ultra-feinen Sezieren Werkzeug zerlegen das Fett Körper und trachioles aus dem Körper Wand. Schon sehr anstrengen, nicht auf die trachioles ziehen, oder trennen Sie das Nervensystem. Ripping die trachioles wird rip Löcher in die Wand des Körpers Muskeln.
Entfernen Sie so viel Fett Körper, wie Sie können. Beide Strukturen stören die optische Qualität Ihres Gewebes. Vielleicht möchten Sie den Kaffee, bevor Sie diese Vorbereitung zu überspringen. - Wenn Sie fertig sind die Muskeln werden transparent, nicht deckend oder weiß. Wenn Sie das Gewebe prep setzen in HL-6 ohne Glutamat, bei Raumtemperatur, wird es wahrscheinlich rhythmisch zusammenzuziehen, weil der Motor Pattern-Generatoren in das ZNS arbeiten.
Vermeiden Sie die Verwendung preps mit offensichtlich vertraglich oder unregelmäßig kontrahiert Körperwand Muskel.
Die intakte innen heraus Körperwand leicht dazu neigt, in der Hälfte entlang der dorsalen und ventralen Mittellinien falten, so dass die Vorbereitung gibt einen nach links oder rechts "Hemi-Tier" zu visualisieren. - 1,9 Montieren Sie die Gewebe entweder in einem kleinen Volumen Kammer für Handelssachen, wie die Warner Kammer oder einem Mikroskop-Objektträger mit einem Deckglas überbrückt Anordnung. Siehe Teil 3 für Vorschläge zur Montage Gewebe.
Teil 2: Neuronale Bouton Markierung mit fluoreszenzmarkierten primären Antikörper gegen HRP.
- Setzen Sie 50 Mikro Liter fluoreszenzmarkierten primäre Anti-Körper gegen HRP in HL-6 in einem Tropfen auf eine Petrischale. Tauchen Sie die inside-out Körperwand prep in das Farbbad. Sie können Neuron Klemmenbezeichnung nach ca. 5 Minuten zu sehen, aber inkubieren für 10-20 Minuten, für eine vollständige und helle Beschriftung.
- Spülen Sie den Farbstoff ab für 10-30 Sekunden in HL-6 bei Raumtemperatur. Nicht-gebundene Farbstoff spült schnell, so dass der Spülgang nicht brauchen werden aggressiv.
- Variieren Sie die Farbstoffkonzentration und Inkubationszeit nach Bedarf.
Teil 3: Perisynaptic Raum Markierung mit Dextran Fluorophor-Konjugat
- Verdünnen fluoreszierend konjugierte Dextran Farbstoff in HL-6 verdünnt. Eine Konzentration, die gut für unsere Zwecke gearbeitet wurde:
- Wenn Sie nicht über den Zeitpunkt des Farbstoffs Zugang zu Ihren extrazellulären Raum betroffen sind, stellen eine 20 Mikroliter Tropfen Farbe auf einem "überbrückt" Deckglas (siehe Teil 4) und die Hinterlegung der Vorbereitung in das Farbbad.
Teil 4: Montage des Gewebes für die Visualisierung (mit der konfokalen Mikroskopie).
Wenn Sie nicht brauchen, um Ihre prep (kurze Beobachtungen) perfuse oder Sie wollen das Volumen des Badens HL-6 klein zu halten, verwenden Sie die doppelte überbrückt Dia-Methode
Wenn Sie Ihre prep perfuse wollen, versuchen Sie, eine Perfusionskammer. Wir verwendeten eine modified Kammer von Warner Instruments.
Details für beide folgen.
Montage prep auf einer Doppel-verbrückten gleiten.
- Verwenden Sie einen sehr sauberen Objektträger. Sekundenkleber zwei quadratische, 18mm (# 1.5) Deckgläschen auf den Objektträger. Leave a 2 mm Abstand zwischen den Rändern der Deckgläser.
- Lassen Sie den Kleber vollständig trocken, oder es wird eine seltsame Film über die wässrigen Medien rund um Ihre prep bilden.
- Position innen heraus Larven zwischen den Rändern der Deckgläser. Möglicherweise müssen Sie die Vorbereitung auf eine diagonale Position, wenn die Larven ist groß und Ihre Bildaufnahme-System verfügt über eine begrenzte Pixel-Array.
- Decken Sie die Gewebe mit einem # 1.5 Deckglas, 18mm (sehr sauber). Halten die "top" Deckglas der Folie angebracht Gewebe flankierenden rutscht, mit minimalem Vaseline.
- Einen Tropfen Cargill eigene Ziel Öl mit einem Brechungsindex von 1,3379 (wenn Sie HL-6 verwenden) auf der Oberseite Deckglas und Flip dieser Versammlung über.
- Position des Gewebes Montage an Ihrem Mikroskop, Öl Seite in Richtung des Ziels, und konzentrieren Sie Ihre Ziele.
Montage des Gewebes in einer modifizierten Perfusionskammer. - Kleben Sie ein 1,5 Deckglas auf dem Boden in der RC 20 Kammer zu bilden. Position des Gewebes in der Kammer als je RC-20 Anleitung. Verwenden Sie ein Stück Nytex Mesh anstelle eines Deckglases, um ein Dach für die Kammer zu bilden.
Teil 5: Repräsentative Ergebnisse:
- Inside-out Gewebeaufbereitung Dissektion Reihenfolge:
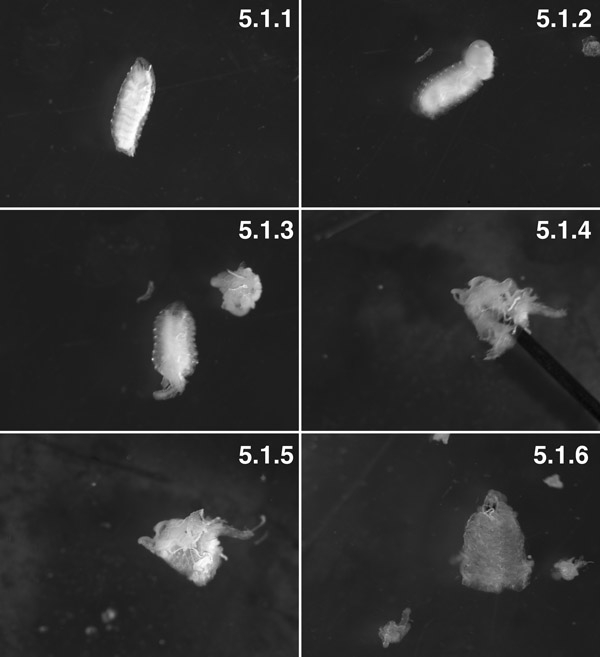
W3-Larven, gewaschen ("Tubby" Phänotyp) (5.1.1). W3-Larven, posterior 2 Segmente zerlegt. Sie können sehen, fetten Körper aus der Leibeshöhle von trans-Körperwand Druck (Pfeil) gedrückt. Versuchen Sie, viszerale "Ausbruch", indem sie ein kleines Loch in die Wand des Körpers 1 Minute vor ihrer Zerlegung (5.1.2) zu minimieren. Die Vorbereitung mit den Eingeweiden, bevor Sie die Vorbereitung von innen nach außen (5.1.3) seziert. Die Vorbereitung, meist umgestülpt, mit dem Stift (Pfeil) in das Lumen des prep (5.1.4). Der Muskel ist jetzt auf der Außenseite und die Kutikula ist auf der Innenseite mit etwas Fett Körper und trachioles befestigt (5.1.5). Ein voll seziert Gewebeaufbereitung mit nahezu allen fetten Körper und trachioles seziert (5.1.6).
- Live-Kennzeichnung mit anti-HRP auf das Larvenstadium NMJ. Ein Vertreter W3 larvalen Nerv-Muskel-Synapse mit einer Glia-Erweiterung (von innen nach außen-prep). Der Motor Neuron bouton Terminals sind mit einem primären anti-Körper gegen HRP (magenta), die konjugiert Cy5 markiert. Die Glia-Prozesse werden mit GFP (grün) gekennzeichnet.
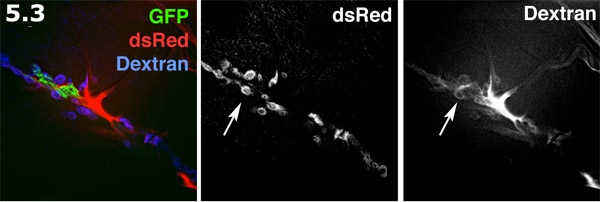
- Perisynaptic Raum Fluoreszenz sichtbar gemacht mit Alexa 680 Dextran in einer von innen nach außen prep. Die Glia-Prozess (grün) ist mit der Membran gezielt GFP-markierten. Die postsynaptischen SSR auf den Muskel Oberfläche (blau) ist markiert mit DsRed. Das Alexa Dextran (rot) bildet konzentriert sich in extrazellulären Bereichen. Die Dextran Farbstoff bildet Donut geformte Pools in der perisynaptic Räume. Die Dextran Kennzeichnung und dsRed gekennzeichnet SSR sind in Graustufen dargestellt. Beachten Sie die vielen Krapfen geformt Farbstoff Pools Hervorhebung der perisynaptic Bereiche (Pfeil).
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Verfahren ermöglicht langfristige Darstellung von Live-markierten Proteine und zelluläre Prozesse. Die in situ Tissue prep beschrieben wir eine intakte und funktionierende ZNS, PNS und Reflex-Schaltungen. Dieses Gewebe prep hat Vorteile gegenüber Standard-Larven fliegen Muskel-Protokolle, in denen die Larven Körperwand Muskel gedehnt (wenn es merken wird). Stretching kann verzerren synaptischen Morphologie und Trigger-Reflex basiert Kontraktionen. Unsere in-und auswendig prep war mechanisch sta...
Access restricted. Please log in or start a trial to view this content.
Danksagungen
Dieses Projekt wurde von der CIHR und NSERC finanziert. Wir möchten Barb Jusiak für einen Beitrag zur Schaffung der Fliege-Stämme, dsRed gekennzeichnet SSR (BJ Linie), und der UBC Bio-Imaging-Anlage bestätigen.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
Referenzen
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten