Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zebrafisch Whole Mount High-Resolution Doppel Fluorescent In-situ Hybridisierung
In diesem Artikel
Zusammenfassung
Whole mount in situ Hybridisierung ist eine der am häufigsten verwendeten Techniken in der Entwicklungsbiologie. Hier präsentieren wir ein hochauflösendes Doppel-Fluoreszenz-in situ-Hybridisierung Protokoll zur Analyse der genauen Expressionsmuster eines einzelnen Gens und zur Bestimmung der Überlappung der Ausdruck Domains von zwei Genen. Wir gehören eine Propidiumiodid nukleare Gegenfärbung des Gewebes Organisation hervorzuheben.
Zusammenfassung
Whole mount
Protokoll
1. FIXATION
- Fix Embryonen über Nacht bei 4 ° C mit 4% Paraformaldehyd (PFA) in PBS.
- Entfernen Sie fix und waschen 2 x PBS, jeweils 5 Minuten bei Raumtemperatur (RT).
- Manuelles dechorionate Embryonen in PBS in einem Glas Depression Platte mit Uhrmacher Pinzette. Nach dechorionation sind Embryonen mit einem Feuer-poliertem Glas Pasteur Pipette, wie sie Polypropylen Pipette kann bleiben.
- -Embryonen durch eine Reihe von 25%, 50% und 75% Methanol in PBS für jeweils 5 Minuten.
- Ersetzen Flüssigkeit mit 100% Methanol, inkubieren 5 Minuten und ersetzen Sie dann mit frischem Methanol.
- Legen Embryonen bei -20 ° C für mindestens eine Stunde. (Wir normalerweise inkubieren die Embryonen über Nacht. Standard in-situ-Hybridisierung wird an Embryonen für mehr als ein Jahr gespeichert, aber wir haben nicht untersucht, ob die hohe Auflösung der Fluoreszenz-in situ-Hybridisierung bei längerer Lagerung verloren geht.)
- Wash Embryonen für jeweils 5 Minuten in 75%, 50%, 25% Methanol in PBST bei RT. Zweimal waschen für jeweils 5 Minuten in PBST bei RT.
- Fix wieder für 20 Minuten in 4% PFA in PBS bei RT.
- Zweimal waschen für jeweils 5 Minuten in PBST bei RT.
HINWEIS ZU PFA:
Wir speichern 4% PFA in Aliquots bei -20 º C (siehe Tabelle der Reagenzien). Für die erstmalige Fixierung verwenden wir nur PFA, dass noch nie zuvor aufgetaut. Für die anschließende Fixierungen, benutzen wir oft PFA, dass zuvor aufgetaut. Die anfängliche Fixierung zu sein scheint entscheidend für eine erfolgreiche Färbung mit diesem Protokoll.
2. Proteinase und Nachfixierung
- Digest mit Proteinase K (5μg/ml in PBST) bei RT für 3 bis 12 Minuten, um die Embryonen permeabilisieren. (Die Inkubationszeit ist abhängig vom Alter der Embryonen als jüngere Stadien empfindlicher sind. Es hängt auch von der Charge des Enzyms.) Für Somitogenese Embryonen, wir in der Regel für 3-4 Minuten permeabilisieren. Während dieser Inkubation legen wir den Mikrozentrifugenröhrchen auf seiner Seite.
- Spülen Sie kurz in PBST waschen einmal für 5 Minuten in PBST.
- Fix wieder für 20 Minuten in 4% PFA in PBS bei RT.
- Zweimal waschen, für jeweils 5 Minuten, in PBST bei RT.
3. Prähybridisierung
- Inkubieren Sie die Embryonen für 5 Minuten bei 65 º C in HYB-.
- Prehybridize bei 65 º C für mindestens 1 Stunde in HYB +.
4. HYBRIDIZATION
- Entfernen Sie alle 50 ul der preHYB, aber stellen Sie sicher, dass die Embryonen völlig untergetaucht zu halten.
- Fügen Sie 1-2 ul jeder Ribosonde (Digoxigenin-und Fluorescein-markierten Ribosonden), die Embryonen und mischen durch vorsichtiges Schnippen der Röhre. Die Höhe der Sonde ist in der Regel 1-2μl von einem 20 &mgr; l-Sonde Synthesereaktion.
- Da Fluorescein lichtempfindlich ist, sollten die Rohre in Aluminiumfolie eingewickelt werden oder anderweitig zu wenig Licht von diesem Punkt an ausgesetzt.
- Inkubieren Sie die Embryonen über Nacht bei 65 º C.
5. Sondenentnahme
Beachten Sie, dass die Lösungen von diesem Punkt an Mangel Reinigungsmittel. Elimination des Waschmittels scheint die Färbung Reaktionen helfen, aber nicht Ursache der Embryonen zu werden und nicht klebrig.
- Entfernen Sie die Ribosonde.
- Wash 2 x 30 Minuten bei 65 º C in 50% formamide/2xSSC.
- Wash für 15 Minuten bei 65 º C in 2 x SSC.
- Wash für 30 Minuten 65 º C in 0,2 x SSC.
6. Anti-Fluorescein Antikörperinkubation
- Block für mindestens 1 Stunde bei RT in 500μl einer Lösung von 1x Maleinsäure-Puffer plus 2% Blocking Reagenz (siehe Tabelle der Reagenzien).
- Fügen Sie die Anti-Fluorescein-POD-Antikörper, wie Roche geliefert, bei einer Verdünnung 1:500 in Blocking-Lösung.
- Inkubieren über Nacht bei 4 º C. Während dieser Inkubation legen wir den Mikrozentrifugenröhrchen auf seiner Seite.
- Wash 4 x 20 Minuten in 1x Maleinsäure-Puffer. Zweimal waschen für jeweils 5 Minuten in PBS.
7. DETECTION von Fluorescein-markierten PROBE
- Inkubieren 30-60 Minuten in TSA Plus-Fluorescein-Lösung. (Down TSA Substrat Spin bevor Färbelösung. Für die Reaktion verdünnter Tyramid Reagenz 1:50 in Perkin Elmer Verstärkung Verdünnungspuffer.) Während dieser Inkubation legen wir den Mikrozentrifugenröhrchen auf seiner Seite. Reaktionszeit muss empirisch für jede Sonde ermittelt werden. Leider kann die Farbreaktion nicht visuell überwacht werden, da das Substrat fluoreszierenden, und man wird überall grüne Fluoreszenz in der Färbung zu sehen.
- Wash für jeweils 10 Minuten in 30%, 50%, 75% und 100% Methanol in PBS.
- Inkubieren in einer Lösung von 1% H 2 0 2 in Methanol für 30 Minuten auf den ersten Peroxidase zu inaktivieren.
- Wash jeweils 10 Minuten in 75%, 50% und 30% Methanol in PBS. Dann zweimal waschen für jeweils 10 Minuten in PBS. Es ist wichtig, dass alle erfüllthanol entfernt werden.
NOTES ON THE Tyramid Signalverstärkung:
Wir haben mit dem Perkin Elmer TSA-Kits. Wir finden, dass der Alexa-Tyramid Substrate gut Fleck mit dem Perkin Elmer Verstärkung Verdünnungspuffer, aber wir haben nicht den Erfolg mit dem Färbepuffer mit dem Invitrogen / Molecular Probes Kits zur Verfügung gestellt. Schließlich haben wir festgestellt, dass Cy5-Fluoreszenz durch nachfolgende Methanol / H 2 O 2-Behandlung eliminiert wird, während Fluorescein und Alexa-647 nicht betroffen sind. Cy3 kann auch negativ durch die Methanol / H 2 O 2-Behandlung, wie es strukturell zu Cy5 Zusammenhang betroffen sein. Aus diesem Grund sollte Cy3 und Cy5 TSA Reaktionen nur für die zweite Farbreaktion in einem doppelten Fluoreszenz-in situ-Protokoll verwendet werden.
8. ANTI-Digoxygenin Antikörperinkubation
- Blockieren Sie die Embryonen erneut für mindestens 1 Stunde bei RT in einer Lösung aus 1x Maleinsäure-Puffer plus 2% Blocking Reagenz.
- Fügen Sie die Anti-DIG-POD-Antikörper, wie Roche in einer 1:1000 Verdünnung geliefert in obigen Blockierungslösung
- Inkubieren über Nacht bei 4 º C. Während dieser Inkubation legen wir den Mikrozentrifugenröhrchen auf seiner Seite.
- Wash 4 x 20 Minuten in 1x Maleinsäure-Puffer. Zweimal waschen für jeweils 5 Minuten in PBS.
9. NACHWEIS VON Digoxygenin-ETIKETTIERT PROBE
- Inkubieren 30-60 Minuten in TSA Plus-Cy5-Lösung (Spin down TSA Substrat, bevor Färbelösung. Für die Reaktion verdünnter Tyramid Reagenz 1:50 in Verdünnungspuffer Verstärkung) Während dieser Inkubation legen wir den Mikrozentrifugenröhrchen auf seiner Seite. Reaktionszeit muss empirisch für jede Sonde ermittelt werden.
- Dreimal für jeweils 10 Minuten in PBST.
10. Propidiumiodid-Färbung
- Zweimal waschen für jeweils 5 Minuten in 2 x SSC.
- Inkubieren Embryonen für 30 Minuten bei 37 ° C in 50 ul 2 x SSCT mit 10 ul RNAse (für eine Endkonzentration von 100μg/ml).
- Wash sechsmal für jeweils 3 Minuten in 2 x SSC bei RT.
- Stain Embryonen für 8 Minuten in eine Lösung von 330μg/ml Propidiumiodid in 2 x SSC.
- Wash sechsmal für jeweils 3 Minuten in 2 x SSC bei RT.
- Fix für 20 Minuten in 4% PFA in PBS bei RT.
- Zweimal waschen, für jeweils 5 Minuten, in PBST bei RT.
11. MONTAGE
- Inkubieren Sie die Embryonen für jeweils 10 Minuten in 25% und 50% Glycerin in PBST. Klare Nacht in 75% Glycerin bei 4 º C.
- Wir analysieren und deyolk die Embryonen und flach montieren sie auf einen Objektträger. Das Eigelb können erhebliche Hintergrundfluoreszenz. Dissection ist viel leichter, nachdem die Embryonen ovenight in gylcerol gelöscht.
SOLUTIONS:
| PBST | PBS plus 0,1% Tween | |
| SSCT | SSC plus 0,1% Tween | |
| HYB- | 50% Formamid 5xSSC 0,1% Tween-20 | |
| HYB + | HYB- 5mg/ml Torula (Hefe) RNA 50μg/ml Heparin | Die Torula RNA wird durch Proteinase K-Verdau der RNA mit vorbereiteten anschließender Phenol-, Phenol-Chloroform-und Chloroform-extraction.The RNA ausgefällt und gelöst in DEPC-behandeltem Wasser. |
| 1 x Maleinsäure-Puffer | 150 mM Maleinsäure, 100 mM NaCl (pH 7,5) |
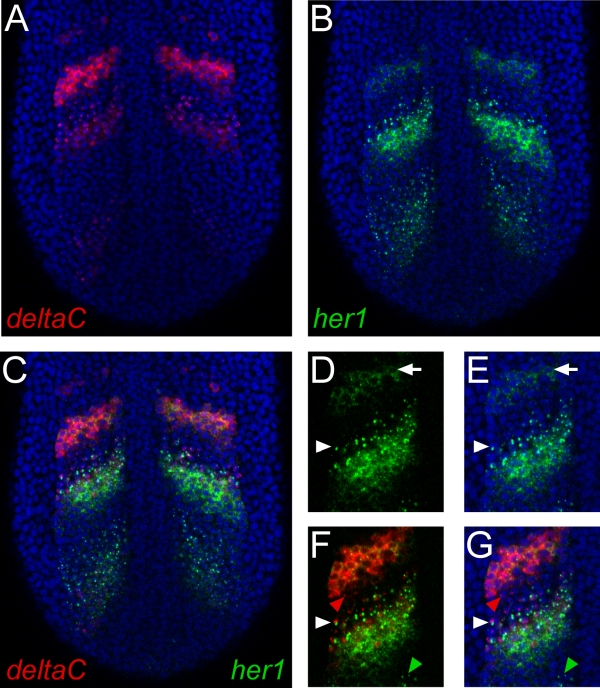
Abbildung 1. Repräsentative Ergebnisse der ganze Berg doppelt Fluoreszenz-in situ-Hybridisierung. (AC). Bilder zeigen einen einzigen konfokalen Schnitt durch den hinteren Bereich eines Zebrafisch-Embryos bei den zehn-Somiten-Stadium. Die Aussicht ist dorsal mit vorderen an die Spitze. Zellkerne mit Propidiumiodid sind blau gefärbt. (A) deltaC mRNA wurde unter Verwendung eines Digoxigenin-markierten Ribosonde und TSA-Cy5-Reagenz. (B) mRNA transkribiert aus dem HER 1-Gen wurde mit einem Fluorescein-markierten Ribosonde und TSA-Fluorescein-Reagens nachgewiesen werden. (C) Die Zusammenlegung der grünen und roten Kanälen eindeutig identifiziert Regionen unterschiedliche oder sich überschneidende Genexpression der beiden Gene. (D, E) Detail HER1 Ausdruck zeigt die hohe Auflösung dieses Verfahrens. Subzelluläre Lokalisation der mRNA ist deutlich zu erkennen. Pfeilspitzen weisen auf eine Zelle ausstellenden aktive Transkription, die durch Punkte der Färbung im Zellkern offenbart. Die Pfeile zeigen eine Zelle zeigt zytoplasmatische Lokalisierung von mRNA. (F, G) Doppelfärbung für HER1 und deltaC zeigt Zellen, die Transkription beider Gene (weiße Pfeilspitze), oder auch Gen getrennt (rote und grüne Pfeile) sind.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das Protokoll hier vorgestellten Arbeiten gut mit Sonden, die eine saubere starkes Signal nach Färbung für 30-45 Minuten in einem typischen alkalischen Phosphatase-vermittelte Reaktion zu geben. Vor Durchführung der Fluoreszenz-in situ-Hybridisierung Protokoll haben wir immer prüfen unsere Sonden mit dem Standard nicht-fluoreszierenden Protokoll (sofern in ergänzendes Material zusammen mit der Sonde Synthese-Protokoll). Wir haben weniger Erfolg mit der Fluoreszenz-in situ-Hybridisierung Protokoll hatte bei der Verw...
Access restricted. Please log in or start a trial to view this content.
Danksagungen
Wir möchten die Beiträge von Dörthe Jülich, Jennifer Runde und Andrew Mara in der Entwicklung dieses Protokoll bestätigen. Forschungsförderung durch die NICHD, die American Cancer Society und der March of Dimes zur Verfügung gestellt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde 16% solution, EM Grade | Electron Microscopy Sciences | 15710 | Dilute to 4% in 1.33x PBS (final 1x). Store in 2ml aliquots at –20°C |
| Proteinase K, recombinant PCR grade | Roche Group | 03115879001 | Make a 20mg/ml stock solution in water. Store in 1ml aliquots at –20°C |
| Blocking Reagent | Roche Group | 11096176001 | Make a 10% stock solution in 1x maleic acid buffer. Store in 50ml aliquots at –20°C. Stable over multiple freeze/thaws. |
| Anti-Fluorescein-POD, Fab fragments | Roche Group | 11426346910 | Aliquot and store at -20°C. Keep one working aliquot at 4°C. |
| Anti-Digoxigenin-POD, Fab fragments | Roche Group | 11207739910 | As above. |
| TSA Plus Fluorescein system | PerkinElmer, Inc. | NEL741001KT | Prepare each vial of TSA reagent only when needed. Dissolve in 60μl DMSO. Store at 4°C. |
| TSA Plus Cyanine5 system | PerkinElmer, Inc. | NEL745001KT | As above |
| TSA Plus Cyanine3 system | PerkinElmer, Inc. | NEL744001KT | As above |
| TSA Kit #16 AlexaFluor647 tyramide (plus HRP-goat-anti-rabbit IgG) | Molecular Probes, Life Technologies | T20926 | Dissolve tyramide reagent in 150μl DMSO, aliquot and store at –20°C. |
| RNase, DNase free | Roche Group | 11119915001 | Supplied as 500μg/ml solution |
| Propidium Iodide | Molecular Probes, Life Technologies | P-3566 | Supplied as 1mg/ml solution in water. |
Referenzen
- Schulte-Merker, S., Ho, R. K., Herrmann, B. G., Nüsslein-Volhard, C. The protein product of the zebrafish homologue of the mouse T-gene is expressed in nuclie of the germ ring and the notochord of the early embryo. Development. 116, 1021-1027 (1992).
- Jowett, T. Double in situ hybridization techniques in zebrafish. Methods. 23, 345-358 (2001).
- Jülich, D. beamter/deltaC and the role of Notch ligands in the zebrafish somite segmentation, hindbrain neurogenesis and hypochord differentiation. Dev Biol. 286, 391-404 (2005).
- Mara, A., Schroeder, J., Chalouni, C., Holley, S. A. Priming, Initiation and Synchronization of the Segmentation Clock by deltaD and deltaC. Nat Cell Biol. 9, 523-530 (2007).
- Lecuyer, E. Global analysis of mRNA localization reveals a prominent role in organizing cellular architecture and function. Cell. 131, 174-187 (2007).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten