Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Grundlagen zur nicht-menschlichen Primaten Brain in stereotaktischen Raum
In diesem Artikel
Zusammenfassung
Die nicht-menschlichen Primaten ist ein wichtiger translationale Arten für unser Verständnis der normalen Verarbeitung des Gehirns. Die anatomische Organisation des Primas Gehirn kann wichtige Einblicke in normalen und pathologischen Bedingungen beim Menschen liefern.
Zusammenfassung
Die Verwendung von nicht-menschlichen Primaten bietet eine hervorragende translationale Modell für unser Verständnis der Entwicklungs-und Alterungsprozessen beim Menschen
Protokoll
Teil 1: Pre-Processing von Gewebe
- Tissue sollte gut mit Paraformaldehyd, Glutaraldehyd oder Formalin perfundiert werden. Dies kann durch Standard-transcardial Perfusion in der Regel verwendet, um andere Organe Ernte erreicht werden. In der vorliegenden Studie das Thema war tief mit Ketaminhydrochlorid (10 mg / kg, im), mit einer Überdosis Natrium-Pentobarbital (25 mg / kg, iv) eingeschläfert sediert und perfundierten transkardial mit 0,1 M PBS, bis sie vollständig exsanguinated.This folgt von einem 4% Paraformaldehyd-Lösung in PBS für 5 min (~ 1 Liter).
Teil 2: Stereotaktische blockiert
- Vor Inbetriebnahme des Kopfes in den stereotaktischen Rahmen der Koordinaten des Horsley-Clarke/interaural Flugzeug Null muss genommen werden. Dies ist die theoretische Mitte zwischen den Ohren. Zur Messung dieser Ebene, das Ohr Bars gleichermaßen in das Gerät eingebaut werden müssen, legen Sie dann ein Skalpell in der stereotaktischen Manipulatorarm und messen in der Mitte zwischen dem Ohr Bars. Dies ist für die Bestimmung, wo das Gewebe auf die Forschung Bedürfnisse Block wichtig. Sobald dies abgeschlossen ist der Schädel muss für die Fixierung in den stereotaktischen Apparat vorbereitet werden.
- Um den Kopf in den stereotaktischen Rahmen statt des Unterkiefers wird sich mit Knochen Rongeure und einem Skalpell entfernt werden. Zusätzlich wird die Haut-, Muskel-und Bindegewebe sollte entfernt werden, um den Schädel freizulegen. Sobald das Bindegewebe aus dem Schädel entfernt wird, setzen das Gehirn durch kratzen die Schädeldecke (der tabellarischen Teil des Os occipitale sowie die parietal, ad Stirnbeins). In dem vorliegenden Experiment Teil der Schädeldecke ist alles fertig wurde entfernt. Achten Sie darauf, nicht vollständig zu entfernen zeitlichen Knochen, da die Gehörgänge müssen intakt sein, den Kopf in den stereotaktischen Rahmen statt. Die restlichen dura Angelegenheit sollte von den freiliegenden Gehirns entfernt werden. Der Schädel ist nun bereit, in den stereotaktischen Rahmen platziert werden.
- In der gleichen Weise, in der man einen stereotaktischen Operation durchführen würde, passen Sie die Augen, Gaumen und Ohr Bars, so dass der Kopf sicher in der stereotaktischen Apparat fixiert. Setzen Sie den stereotaktischen Manipulators in der vorgegebenen anterior / posterior (A / P) koordiniert und bewegen Sie den Manipulator der lateralen Seite des Gehirns. Langsam senken die Klinge in das Gehirn, völlig erhöhen die Klinge aus dem Gehirn, dann medial bewegen und senken Sie die Klinge wieder. Wiederholen Sie diese beiden Schritte, bis die Klinge der lateralen Seite der gegenüberliegenden Hemisphäre erreicht hat. Damit ist die erste koronalen blockieren. Für die anschließende koronale Blöcke verschieben Sie den Manipulator 1cm in die A / P-Achse, und wiederholen Sie, bis das gesamte Gehirn blockiert wurde.
Teil 3: Entfernen der Gehirn aus dem Schädel
- Entfernen Sie den Kopf aus dem stereotaktischen Rahmen und halten Sie die freiliegende Gehirn in der Handfläche. Versuchen Sie, das Gehirn durch leichtes Platzierung Verweichlichung des Gehirns in der Handfläche und platzieren Sie Ihre kleinen Finger über den Frontallappen, dies minimiert Bewegung des Gehirns in den Schädel zu sichern. Um die Trocknung der pialen Oberfläche des Gehirns zu verhindern, legen Sie ein Stück PBS angefeuchteten Mull über das Gehirn. Halten Sie den Kopf fest mit dem Schädel und Chip entfernt die restlichen occipital und zeitlichen Knochen zusammen mit der Wirbelsäule. Dies macht die Basis und seitliche Aspekte des Gehirns. Schließlich entfernen Sie alle verbleibenden Stirnbein und das Nasenbein, die Zugang zu den Riechkolben ermöglichen. Es ist wichtig, das Stirnbein letzten entfernen, weil, wie Sie die Basis des Schädels entfernt das Gehirn bewegt sich leicht und die Frontallappen auf die gezackten Ränder der Fontal Knochen beschädigt werden. Cut entfernt und noch verbleibende Dauer Angelegenheit. Heben Sie die Vorderseite des Gehirns, schieben Sie das Skalpell unter dem Gehirn und kostenlos das Gehirn aus dem Schädel.
Teil 4: Messungen
- Es gibt eine Reihe von nützlichen Messungen, die vor dem Einfrieren gemacht werden können. Zum Beispiel die A / P-Achse des Gehirns mit einer Schieblehre. Darüber hinaus die spezifische Dichte kann durch Wiegen des Gehirns gemessen werden, Messvolumen durch die Verdrängung von Wasser in einem Messzylinder dividiert Raumgewicht Verschiebung (Tabelle 1).
Teil 5: Fertig blockiert das Gehirn.
- Normalerweise, wenn das Skalpell in das Gehirn eingeführt wird es nicht lange genug, um vollständig durchdringen die volle dorsal-ventralen Umfang des Gehirns. Sobald das Gehirn entfernt und grobe Messungen erhalten, nehmen Sie eine Gewebe-Schneidscheibe und Ziel blockiert das Gehirn durch die Bauchseite des Gehirns (Abbildung 2).
- Vor dem Einfrieren der Blöcke, ist es notwendig, das Gewebe in abgestuften PBS-gepufferte Saccharose-Lösungen cryoprotect (10, 20 und 30%) gehalten bei 4 ˚ C, bis das Gehirn sinkt. Es dauert in der Regel einer Inkubation über Nacht in 10%, 2-3 Tage in 20% und weitere 3-5 Tage in 30% für die Blöcke an den Boden des Behälters sinken. Ein täglicher Wechsel der the 30% Saccharose-Lösung wird empfohlen.
Teil 6: Repräsentative Ergebnisse
Es gibt eine Reihe von groben morphologischen Messungen, die vorgenommen werden, wenn das Gehirn aus dem Schädel entfernt worden sein kann. Dazu gehören A / P Länge, Gewicht und spezifische Dichte (Tabelle 1). Wir in der Regel blockieren das Gehirn in 6-7 Blöcke messen 1cm (Abbildung 1). Jedes Stück wird dann fotografiert (Abbildung 2) und kann weiter je nach Forschungsbedarf zerlegt werden oder hergerichtet für das Einfrieren in abgestuften Saccharose-Lösungen.
Thema | A / P Länge (Mm) | Gewicht (G) | Wasserverdrängung (Ml) | Spezifische Dichte (G / ml) |
| O2303-2-1-1 | 64,3 | 28,1 | 24 | 1,171 |
| O5180-1 | 71,3 | 38,7 | 34 | 1,138 |
| O2708-3-1 | 62,8 | 28,7 | 26 | 1,104 |
| O9184-4-2 | 65,3 | 29,5 | 24 | 1,229 |
| N459-1-14-2 | 68,2 | 31,6 | 26 | 1,215 |
| AVERAGE | 66,38 | 31,32 | 26,8 | 1,171 |
| STD DEV | 3,38 | 4,33 | 4,17 | 0,052 |
Tabelle 1. Gross Morphologische Messungen der Right Hemisphere von 5 Monate alten Meerkatzen
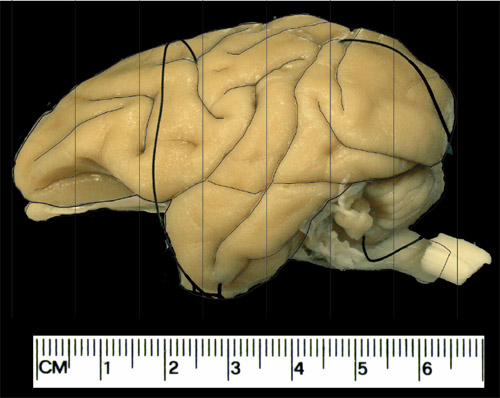
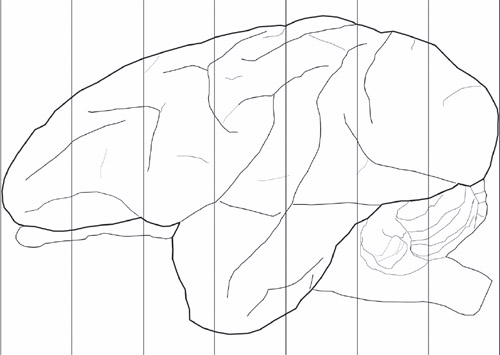
Abbildung 1. Schaltpläne für die Frontalebene zur Blockierung des Gehirns eingesetzt. Dies ist ein Beispiel für eine externalisiert Erwachsenen vervet Gehirn. Beispiel für die Sperrung Verfahren. Die vertikalen Linien sind hier bei 1cm Abstand, typischerweise Herstellung von 7 koronalen Blocks von jeder Hemisphäre.
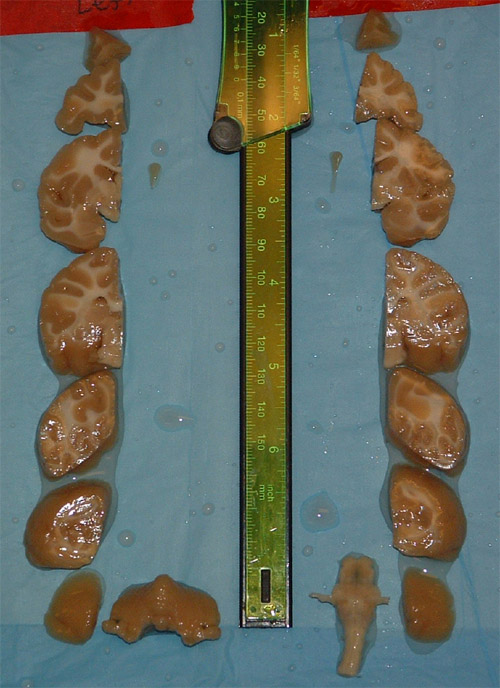
Abbildung 2. Blockiert von Hirngewebe in stereotaktischen Raum. Jeder Block wird Ausbeute etwa 200 Sektionen 50 um übernommen. Mit diesem Stichprobenverfahren über 1200 Schnitte durch die Rinde wird genommen, und eine zusätzliche 400-500 aus dem Kleinhirn, wenn in der koronalen Ebene geschnitten.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die St. Kitts vervet (Chlorocebus aethiops sabeus) ist ein Old World Primaten mit ähnlichen Mustern und Preisen von kortikalen und subkortikalen die Entwicklung des Gehirns wie das des Menschen. Diese Spezies wurde verwendet, um komplexe menschliche Verhaltensstörungen wie ängstliches Verhalten, Bluthochdruck 8, Hemisphärektomie 9, Parkinson-Krankheit 10, Alzhemier-Krankheit 11, und Alkoholmissbrauch 12 Modell. In jüngerer Zeit hat diese Art verwendet ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Die Autoren bedanken sich bei Ikiel Ptito für seine weitere fachliche Unterstützung danken. NSERC Zuschuss zu MP.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scalpel blades | Fine Science Tools | 10011-00 | |
| Scissors | Fine Science Tools | 14090-11 | Any surgical scissors are sufficient |
| Rongeurs | Fine Science Tools | 16121-14 | |
| Forceps | Fine Science Tools | 11027-12 | |
| Filter paper | Fisher Scientific | 09-924-150 | |
| Stereotaxic Frame | Kopf Instruments | ||
| Tissue slicing blade | Thomas Scientific |
Referenzen
- Gallagher, M., Rapp, P. R. The use of animal models to study the effects of aging on cognition. Annu Rev Psychol 48. , 339-370 (1997).
- Clancy, B., Darlington, R., Finlay, B. Translating developmental time across mammalian species. Neuroscience. 105, 7-17 (2001).
- Nowakowski, R. S., Rakic, P. The site of origin and route and rate of migration of neurons to the hippocampal region of the rhesus monkey. J Comp Neurol. 196, 129-154 (1981).
- Rakic, P., Bourgeois, J. P., Eckenhoff, M. F., Zecevic, N., Goldman-Rakic, P. S. Concurrent overproduction of synapses in diverse regions of the primate cerebral cortex. Science. 232, 232-235 (1986).
- Granger, B., Tekaia, F., Le Sourd, A. M., Rakic, P., Bourgeois, J. P. Tempo of neurogenesis and synaptogenesis in the primate cingulate mesocortex: comparison with the neocortex. J Comp Neurol. 360, 363-376 (1995).
- Zecevic, N., Rakic, P. Development of layer I neurons in the primate cerebral cortex. J Neurosci. 21, 5607-5619 (2001).
- Ervin, F. R., Palmour, R. M., Young, S. N., Guzman-Flores, C., Juarez, J. Voluntary consumption of beverage alcohol by vervet monkeys: population screening, descriptive behavior and biochemical measures. Pharmacol Biochem Behav. 36, 367-373 (1990).
- Palmour, R. M., Mulligan, J., Howbert, J. J., Ervin, F. Of monkeys and men: vervets and the genetics of human-like behaviors. Am J Hum Genet. 61, 481-488 (1997).
- Boire, D., Théoret, H., Ptito, M. Stereological evaluation of neurons and glia in the monkey dorsal lateral geniculate nucleus following an early cerebral hemispherectomy. Exp Brain Res. 142, 208-220 (2002).
- Bjugstad, K. B., Teng, Y. D., Redmond, D. E. J. r, Elsworth, J. D., Roth, R. H., Cornelius, S. K., Snyder, E. Y., Sladek, J. R. Jr Human neural stem cells migrate along the nigrostriatal pathway in a primate model of Parkinson's disease. Exp Neurol. 211, 362-369 (2008).
- Lemere, C. A., Beierschmitt, A., Iglesias, M., Spooner, E. T., Bloom, J. K., Leverone, J. F., Zheng, J. B., Seabrook, T. J., Louard, D., Li, D., Selkoe, D. J., Palmour, R. M., Ervin, F. R. Alzheimer's disease abeta vaccine reduces central nervous system abeta levels in a non-human primate, the Caribbean vervet. Am J Pathol. 165, 283-297 (2004).
- Mash, D. C., Staley, J. K., Doepel, F. M., Young, S. N., Ervin, F. R., Palmour, R. M. Altered dopamine transporter densities in alcohol-preferring vervet monkeys. Neuroreport. 7, 457-462 (1996).
- Burke, M. W., Palmour, R. M., Ervin, F. R., Ptito, M. Neuronal reduction in frontal cortex of primates after prenatal alcohol exposure. Neuroreport. 20, 13-17 (2009).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten