Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Heterotope und orthotopen Tracheal Transplantation in Mäuse als Modelle benutzt, um die Entwicklung von obliterans Airway Disease Study
In diesem Artikel
Zusammenfassung
Dieses Video zeigt und vergleicht zwei experimentellen Modellen zur Entwicklung von obliterative Atemwegserkrankung (OAD) bei Mäusen, die heterotopen und orthotopen Transplantation Tracheal-Modell zu studieren.
Zusammenfassung
Obliterans Atemwegserkrankung (OAD) ist die wichtigste Komplikation nach Lungentransplantationen, dass das langfristige Überleben (1-7) Grenzen.
Zur Untersuchung der Pathophysiologie, Behandlung und Prävention von OAD, verschiedenen Tiermodellen der Tracheal-Transplantation bei Nagetieren entwickelt (1-7). Hier verwenden wir zwei etablierte Modelle der Luftröhre Transplantation, die heterotopen und orthotopen Modell und zeigen ihre Vor-und Nachteile.
Für die heterotopen Modell wird der Spender Luftröhre in das große Netz des Empfängers gewickelt, während die Spender Luftröhre wird durch End-to-End-Anastomose in der orthotopen Modell anastomosiert.
In beiden Modellen ist die Entwicklung von obliterative Läsionen histologischen ähnlich klinischen OAD nachgewiesen (1-7).
Dieses Video zeigt, wie beide ausführen, vergleicht die heterotopen sowie orthotopen Transplantation Tracheal-Technik bei Mäusen, und der zeitliche Verlauf der OAD Entwicklung in beiden Modellen mit der Histologie.
Protokoll
- Männliche Balb / C Mäuse (8-12 Wochen) werden von Charles River Laboratories (Sulzfeld, Deutschland) erworben. Die Mäuse werden unter üblichen Bedingungen, gefüttert Standard Mäuse Futter und Wasser ad libitum untergebracht.
- 2% Isofluran ist für Anästhesie eingesetzt.
SPENDER VORBEREITUNG
- Shave der Bauch Haare und desinfizieren Sie die Fläche mit Betaisodona.
- Unter mikroskopischer Sicht, führen Sie eine Mittellinie zervikale Inzision von der Höhe des Kehlkopfes bis zum Brustbein.
- Entfernen Sie das subkutane Fett und die Halsmuskulatur zu einem klaren Blick auf die Luftröhre zu bekommen.
- Präparieren Sie die Luftröhre von allen umliegenden Geweben, wie der Speiseröhre, Nerven, Arterien und des Bindegewebes.
- Entfernen Sie die gesamte Trachea (vom Kehlkopf bis zur Bifurkation).
- Spülen Sie die Transplantation mit kalter Kochsalzlösung und speichern das Transplantat bei 4 ° C.
- Der Spender ist durch Genickbruch nach der Ernte der Luftröhre eingeschläfert.
EMPFÄNGER: heterotope Transplantation
- Shave der Bauch Haare in einem breiten Rand um den Inzisionsstelle und desinfizieren Sie die Fläche, die dreimal mit Betaisodona (betadine) durch Alkohol. Die Augen sollten mit einer Augensalbe Produkt geschmiert werden, um die Hornhaut vor dem Austrocknen zu verhindern.
- Führen Sie eine mediane Laparotomie und platzieren Sie den Darm in eine sterile, befeuchtet Handschuh.
- Verbreiten Sie das große Netz sorgfältig. Legen Sie das Transplantat in den Mittelpunkt und fixieren es mit einem einzigen Naht mit 8-0 (Prolene, Ethicon, Deutschland).
- Decken Sie die Transplantation mit dem Omentum majus und fixieren das Transplantat mit einer einzigen Naht 8-0 (Prolene, Ethicon, Deutschland).
- Stellen Sie den Darm wieder in den Bauch und bündig mit warmer, steriler Kochsalzlösung vor der Schließung.
- Close up in 2 Schichten - Bauchwand und Hautschicht mit kontinuierlicher Muster mit 7-0 Prolene für den Muskelaufbau und 7-0 Vicryl für die Haut.
EMPFÄNGER: orthotopen Transplantation
- Shave der Bauch Haare in einem breiten Rand um den Inzisionsstelle und desinfizieren Sie die Fläche, die dreimal mit Betaisodona (betadine) durch Alkohol. Die Augen sollten mit einer Augensalbe Produkt geschmiert werden, um die Hornhaut vor dem Austrocknen zu verhindern.
- Teilen Sie die Halsmuskulatur, die gesamte laryngotracheale komplexer visualisieren.
- Sorgfältig sezieren die Luftröhre aus dem umgebenden Gewebe, kümmern sich um die laryngeus recurrens zu bewahren.
- Teilen Sie die Luftröhre drei Ringe caudal aus dem Ringknorpel. Das Tier hält physiologische Atmung über die Tracheotomie.
- Stellen Sie sicher, sauber tracheale Kanten in den Empfängerländern als auch in das Transplantat.
- Das Transplantat wird zwischen dem Empfänger Luftröhrendefekten und orientiert sich an anatomischen Polarität zu halten zwischengeschaltet.
- Mit 8-0 (Prolene, Ethicon, Deutschland) anastomosieren die Spendertransplantat mit dem distalen (mediastinal) Luftröhre. Die hintere Seite der Anastomose ist in Dauerbetrieb Weise durchgeführt. Die Vorderseite ist dann abgeschlossen mit unterbrochenen Nähten.
- Entfernen Sie alle Sekreten aus den Atemwegen.
- Die proximale Anastomose wird dann in der gleichen Weise wie die distalen abgeschlossen.
- Stellen Sie sicher, Integrität der Atemwege und eine adäquate Spontanatmung.
- Stellen Sie den Gurt Muskeln und in der Nähe des subkutanen Gewebes und der Haut Schicht mit 6-0 Nähten (Vicryl, Ethicon, Deutschland) mit kontinuierlicher Muster.
- Verwenden Sie Injektionsanästhesie für den Empfänger, damit das Tier physiologische Atmung durch die Luftröhre zu behalten. Eine Kombination aus 75/1/0.2 mg / kg Propofol, Medetomidin und Fentanyl ist jeweils für die IP-Narkose bei Mäusen verwendet.
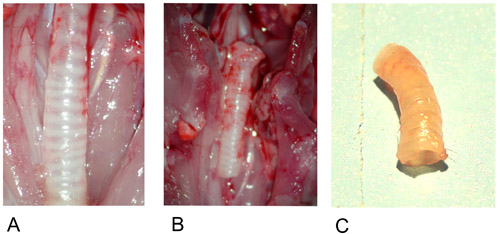
Abbildung 1: Donor Luftröhre.
1A: Donor Luftröhre in situ nach der Zubereitung.
1B: Abgeschnittene Spender Luftröhre.
1C: Donor Luftröhre nach Explantation.
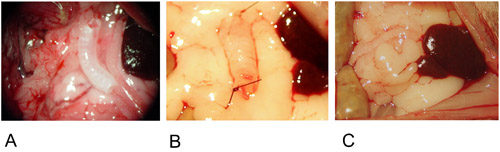
Abbildung 2: Heterotope Modell.
2A: Das Transplantat wird in der Mitte des großen Netzes positioniert.
2B: Das Transplantat wird an beiden Enden mit einer einzigen Naht fixiert.
2C: Das Transplantat wird in das große Netz gewickelt und mit einer einzigen Naht.
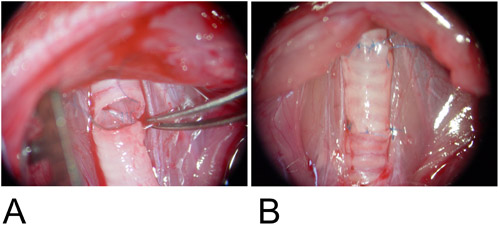
Abbildung 3: orthotopen Modell.
3A: Das Transplantat wird zwischen dem Empfänger Luftröhrendefekten und die hintere Wand dazwischen ist in Dauerbetrieb Mode anastomosiert.
3B: Die vordere Wand ist fertig mit einer einzigen Naht.
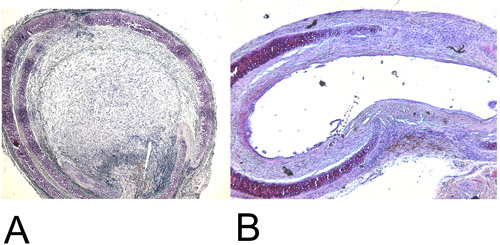
Abbildung 4: Histologie.
4A: Zurückgewonnen heterotope Transplantation Luftröhre nach 28 Tagen in der H + E staining (15x). Beachten Sie die 100% luminalen Auslöschung.
4B: Zurückgewonnen orthotopen Transplantation Luftröhre nach 60 Tagen in der H + E-Färbung (15x). Maximal erreicht luminalen Auslöschung beträgt ca. 45%.
| Heterotope Tracheal Transplantation Modell | Orthotopen Transplantation Tracheal-Modell | |
| Vorteile | + Leicht zu führen + Luminal Auslöschung alles Atemwege Okklusion nach 28 Tagen + Keine körperliche Zuwendung von Tieren durch OAD | + Physikalische Belüftung des Transplantats + Inhalative Drug Administration möglich + Starke immunologischen Reaktionen, wie alloreaktive IgM Antikörper-Produktion + Physiologische Thorax Milieu + Tracheal-tracheale Anastomose imitiert die klinischen |
| Nachteile | - Keine Belüftung von transplantierten Luftröhre - Keine Bewertung von inhalativen Erreger möglich - Hemmung der mukoziliäre Clearance und behielt Sekrete - Peritoneal Mikroumgebung statt Thorax Milieu | - Chirurgische Ausbildung notwendig - Luminal Auslöschung mit luminalen Okklusion App. 45% nach 60 Tagen - Tiere entwickeln können Symptome von OAD |
Tabelle 1: Vor-und Nachteile der heterotopen und orthotopen Tracheal Transplantation.
Diskussion
Mäuse sind in verschiedenen transgeneic und Knock-out-Modell zur Verfügung, und daher geeignet, mechanistische Fragen im Zusammenhang mit OAD (4) zu studieren.
Beide Modelle der Luftröhre Transplantation in diesem Video gezeigt kann als zuverlässige Modelle für das Studium OAD Entwicklung genutzt werden.
Zeigt jedoch, jedes Modell Vor-und Nachteile.
Die heterotopen Trachea-Transplantation ist einfach durchzuführen und erfordert keine spezielle chirurgisch...
Offenlegungen
Sonja Schrepfer hat ein Forschungsstipendium der Deutschen Forschungsgemeinschaft (DFG) (SCHR992/3-1) erhalten haben.]
Alle Tiere erhielten menschlicher Obhut in Übereinstimmung mit den Prinzipien des Laboratory Animal Care, wurden Experimente an Tieren in Übereinstimmung mit den Richtlinien und Vorschriften her von der Nationalen Gesellschaft für Medizinische Forschung und der Leitfaden für die Pflege und Verwendung von Labortieren durch die veröffentlichten durchgeführt National Institutes of Health (National Institutes of Health Veröffentlichung 85-23, revised 1985).
Alle Tiere wurden von Charles River Laboratories (Sulzfeld, Deutschland) erhalten und wurden in der Tierpflege Einrichtungen des Universitätsklinikums Hamburg Eppendorf gepflegt. Die Tiere erhielten Standard-Futter und Wasser ad libitum.
Danksagungen
Die Autoren danken Christiane Pahrmann (Lab Manager).
Referenzen
- Adams, B., Berry, G., Huang, X., Shorthouse, R., Brazelton, T., Morris, R. Immunosuppressive therapies for the prevention and treatment of obliterative airway disease in heterotopic rat trachea allografts. Transplantation. 69, 2260-2266 .
- Adams, B., Brazelton, T., Berry, G., Morris, R. The role of respiratory epithelium in a rat model of obliterative airway disease. Transplantation. 69, 661-665 .
- Deuse, T., Schrepfer, S., Reichenspurner, H., Hoyt, G., Fischbein, M., Robbins, R., Pelletier, M. Techniques for experimental heterotopic and orthotopic tracheal transplantations – when to use which model; Transplant Immunology 17. , 255-261 (2007).
- Hele, D., Yacoub, M., Belvisi, M. The heterotopic tracheal allograft as an animal model of obliterative bronchiolitis. Respiratory Research. 2, 169-183 .
- Hertz, M., Jessurun, J., King, M., Savic, S., Murray, J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American Journal of Pathology. 142, (1993).
- McDyer, J. Human and murine obliterative bronchiolitis in transplant. Proceedings of the American Thoracic Society. 4, 37-43 .
- Schrepfer, S., Deuse, T., Hoyt, G., Sheikh, A., Hoffmann, J., Reichenspurner, H., Robbins, R., Pelletier, M. Experimental orthotopic tracheal transplantation: the stanford technique. Microsurgery. 27, 187-189 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten