Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vivo-Imaging von Deep kortikalen Schichten mit einem MICROPRISMEN
In diesem Artikel
Zusammenfassung
Rechtwinklige Mikroprismen in die Maus gesteckt Neokortex ermöglicht tiefe Bildgebung von mehreren kortikalen Schichten mit einer Sicht in der Regel in Scheiben gefunden. Ein-Millimeter-Mikroprismen bieten ein weites Feld-of-view (~ 900 um) und räumliche Auflösungen ausreichen, um dendritischen Dornen zu lösen. Wir zeigen, Schicht V neuronalen Bildgebung und Neokortex Gefäßdarstellung mit Mikroprismen.
Zusammenfassung
Wir präsentieren ein Protokoll für die in-vivo-Bildgebung der kortikalen Gewebe mit einem tiefen bildgebenden Sonde in der Form eines Mikroprismenring. Mikroprismen sind 1-mm groß und haben eine reflektierende Beschichtung auf der Hypotenuse die interne Reflexion der Anregungs-und Emissions Licht zu ermöglichen. Die Mikroprismen Sonde gleichzeitig Bilder multiple kortikale Schichten mit einer Perspektive in der Regel nur in Scheiben Vorbereitungen gesehen. Die Bilder werden mit einem großen gesammelt field-of-view (~ 900 um). Darüber hinaus bieten wir Informationen über die Nicht-Überleben chirurgischen Eingriff und Mikroskop-Setup. Repräsentative Ergebnisse sind Bilder von Schicht V Pyramidenneuronen von Thy-1 YFP-H-Mäuse zeigen ihre apikalen Dendriten, die sich durch die oberflächliche Rindenschicht und sich in Büscheln. Resolution war ausreichend, um Bild dendritischen Dornen in der Nähe des Soma der Schicht V Neuronen. Ein tail-Injektion von Fluoreszenzfarbstoff zeigt die komplizierte Netzwerk von Blutgefäßen in der Hirnrinde. Line-Scan von roten Blutkörperchen (Erythrozyten) fließt durch die Kapillaren zeigt RBC Geschwindigkeit und Flussraten erreicht werden kann. Dieser Roman Mikroprismenring Sonde ist ein elegantes und dennoch leistungsfähige neue Methode zur Visualisierung tiefe Zellstrukturen und kortikale Funktion in vivo.
Protokoll
Teil 1: MICROPRISMEN Optik und Mikroskop-Setup
- Die Mikroprismen wir benutzen, sind 1-mm, Winkel-Prismen aus BK7 Glas aus dem Optosigma Corporation (Abbildung 1) erworben haben. Mikroprismen behandelt werden mit einer Pinzette, wenn möglich.
- Die Hypotenuse des Mikroprismas ist mit erhöhter Silber beschichtet, um eine Reflektivität von mehr als 97% von 400 liefern - 2000 nm. Dies bietet interne Reflexion sowohl der Laser-Anregung Licht und die emittierte Fluoreszenz.
- Mikroprismen sind immer behandelt mit einer Pinzette, wenn möglich. Handschuhe sind zu allen Zeiten getragen zu halten das Prisma sauber.
- Wir verwenden eine custom-built Zwei-Photonen-Mikroskop in der Lage Kleintier-Bildgebung. Das Tier, an der stereotaktischen Gerät basiert auf einem 3-Achsen motorisierten Bühne platziert.
- Das Mikroskop ist auf einem Windows-PC läuft scanimage-Software verbunden. Scanimage ist Bildaufnahmesoftware in Matlab durch Pologruto et al 1 geschrieben.
- Für Mikroprismenring Bildgebung, sammeln wir Bilder mit einer Auflösung von 1024 x 1024 oder 512 x 512 Pixel. Darüber hinaus haben wir in der Regel bei 2 ms / Zeile oder 4 ms / Zeile zu scannen.
- Zwei Arten von Zielen werden in den Experimenten verwendet:
- Ein niedrigerer numerischer Apertur (NA) Luft Ziel für weite Feld-of-view-Tomographie (siehe Tabelle der Reagenzien und Geräte).
- Eine höhere NA Luft-Objektiv mit einem Glas Korrektur Kragen Lage Minimierung sphärischer Aberrationen durch 0 induzierte - 2 mm aus Glas (siehe Tabelle der Reagenzien und Geräte).
- Wenn das Tier bereit für die Bildgebung unter einer niedrigen Vergrößerung Ziel ist, richten Sie den quadratischen Rastern Muster des Lasers mit der Spitze des Mikroprismas. Dies wird dazu beitragen orientieren das Bild und machen die effiziente Nutzung der Laserleistung.
- Mit einem höheren NA-Objektiv mit einem Glas Korrektur Kragen, setzen Sie die Korrektur Kragen für etwa 1 mm von Glas zu korrigieren. Sobald ein fluoreszierendes Bild erscheint während des Experiments kann man sorgfältig im Innern des Mikroskops zu erreichen, um die Korrektur Kragen zu optimieren, um die Bildauflösung zu optimieren.
Teil 2: Nicht-Überleben Tiere Chirurgie und MICROPRISMEN Insertion
- Die gesamte Prozedur Länge, vom ersten Schnitt bis zum Abschluss der Bildgebung, hängt von den Zielen des Experiments. Allerdings kann die Nicht-Überleben chirurgischen Eingriff und Mikroprismenring Platzierung erwartet, dass etwa 30 nehmen - 40 Minuten dauern.
- Mäuse (P30-P60) werden gewogen und anästhesiert entsprechend mit einer IP-Injektion von Ketamin (100 mg / kg) und Xylazin (10 mg / kg) auf eine Ebene, geeignet für chirurgische Eingriffe.
- Während des gesamten Experiments, sollte das Tier alle 15-20 Minuten auf das Niveau der Anästhesie zu beurteilen überprüft werden. Wenn das Tier reagiert auf einen festen Fuß-und Zuziehen, eine zusätzliche Dosis von Ketamin / Xylazin ist nicht erforderlich. Typischerweise wird eine zusätzliche Dosis von einem Drittel der ursprünglichen Dosis und kann vor der Zeit in eine Spritze für den sofortigen IP Injektion vorbereitet werden, wenn nötig.
- Sobald die Maus richtig betäubt, ist die Mehrheit der Haare auf dem Kopf des Tieres aus mit einem Trimmer mit einem # 40 Klinge rasiert.
- Nair ® ist es, die verbleibenden Haare auf dem Kopf, zum Aufbau einer Oberfläche frei von Haaren, die im Wege des Mikroprismas während der Bildgebung bekommen kann angewendet werden. Nach 5 Minuten wird die Nair ® off mit einem Wattestäbchen Wattestäbchen gereinigt.
- Die narkotisierten Tier richtig in eine Maus stereotaktische Gerät platziert. Während des chirurgischen Eingriffen und Imaging-Sitzungen das Tier befindet sich auf einem mit Wasser gefüllten Heizkissen bei 36 Grad Celsius eingestellt gehalten.
- Mit dem Kopf des Tieres richtig fixiert, ist eine saubere Schnitt erfolgt mit einem Skalpell auf der Mittellinie des Schädels, um die Haut zu trennen.
- Eine kleine Menge von 3% Wasserstoffperoxid basiert auf einem Wattestäbchen Wattestäbchen platziert und auf den Schädel zu beseitigen Membranen zwischen dem Schädel und der Haut.
- Das Wasserstoffperoxid hilft auch Bregma, ein Meilenstein in weiß, wo man die Kraniotomie durchführen und legen Sie die Mikroprismenring offenbaren.
- Vor der Kraniotomie gestartet wird, werden die Ohren Bars und beißen bar richtig eingestellt, um die exponierte Schädel, so dass es im Grunde Ebene mit der Tabelle ist zu kippen. Dies bietet eine bessere Plattform für die Kraniotomie. Darüber hinaus macht das die Oberfläche des Prismas senkrecht mit dem eingehenden Anregungslicht. Dies wird dazu beitragen minimieren optische Aberrationen, während Bildgebung.
- Eine kleine Zahn-Grat (~ 0,8 mm Kopfgröße) wird an einen Dremel ®-Tool mit Hilfe eines flexiblen Ausleger verbunden. Für Kraniotomien, setzen wir die Geschwindigkeit auf etwa 7.000 bis 10.000 rpms.
- Die zahnärztliche Grat entlang des Schädels Magermilch, bis eine viereckige Nut in den Knochen hergestellt wird. Die Seiten des Quadrats sind ca. 2-3 mm in der Länge und zentriert 1,5 mm caudal und 1 mm lateral Bregma.
- Continuing Ausdünnung der Knochen, bis eine kleine Öffnung durch den Schädel gemacht wird. Eine Pinzette ca.n Heben Sie den Knochendeckel vom Schädel.
- Die Dura muss entfernt werden, bevor die Mikroprismen in die Rinde eingesetzt werden kann. Blutungen sind am besten, indem man das Blut an der Oberfläche für einige Minuten gerinnen gesteuert. Danach wird das geronnene Blut entfernt mit einem chirurgischen Schwamm vor dem Einsetzen der Mikroprismenring.
- Um sie für die Unterstützung der Ausrichtung des Prismas mit der Hirnrinde, ist die vertikale Fläche des Mikroprismas up parallel an den Griffen an der Zange gefüttert.
- Mit dem Prisma richtig gehalten wird, ist die gesamte Mikroprismenring eingeführt, bis die Spitze des Prismas ist bündig mit der Oberfläche Neokortex.
- Wenn richtig eingesetzt, sollte die Mikroprismen in die richtige Position zu bleiben. Jede Blutung, die Ergebnisse ist minimal und kann mit einem kleinen chirurgischen Schwamm aufgenommen werden. Sobald das Prisma anstelle des Tieres ist bereit für die Bildgebung.
- Nach einer Mikroprismenring hat in einem Tier verwendet wurde, kann es sein, mehrere Male wieder verwendet werden. Allerdings braucht es für richtig gereinigt werden, um alle verbleibenden biologischen Material zu entfernen. Dies kann durch Eintauchen des Prismas in einem kleinen Volumen HCl Säure, durch einen Sprung in Methanol erreicht werden. Das gereinigte Mikroprismenring können dann in der Linse Papier bis die zukünftige Verwendung gewickelt werden.
Teil 3: Repräsentative Ergebnisse

Abbildung 1: Die Bilder des rechten Winkels Mikroprismenring. Prismen in diesem Experiment verwendet werden einen Millimeter, BK7 Glasprismen mit einer verbesserten Silberschicht auf der Hypotenuse die interne Reflexion der Anregungs-und Emissions Licht zu ermöglichen.

Abbildung 2: Bild der Schicht V YFP Pyramidenneuronen. Weitfeld-of-view-Bildgebung mit der Mikroprismenring zeigt eine große Population von pyramidenförmigen Zellkörper ~ 800 bis 900 um tief aus der kortikalen Oberfläche. Darüber hinaus apikalen Dendriten sich bis zur Schicht kann ich auch gelöst werden. Maßstab = 200 um.
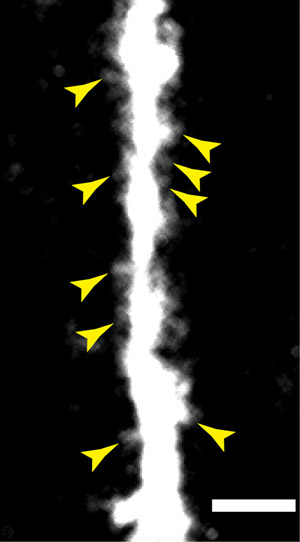
Abbildung 3: Eine höhere numerische Apertur Ziel in Verbindung mit dem Mikroprismenring bietet räumliche Auflösung ausreicht, um dendritischen Dornen auf der apikalen Dendriten auf der Schicht V Pyramidenneuronen lösen verwendet. Balken = 10 um.
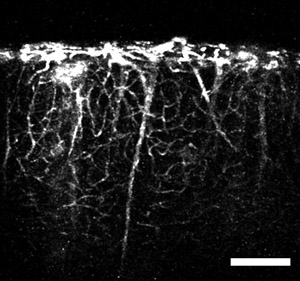
Abbildung 4: Ein Bild unter Verwendung des Mikroprismenring und einen Schwanz-Injektion von Fluoreszenzfarbstoff. Das Bild zeigt vertikale, großkalibrige Gefäße, die sich von tiefen Hirnregionen und kleineren Kapillaren abzweigen durch die kortikale Volumen. Maßstab = 200 um.

Abbildung 5: Mit einer höheren numerischen Apertur Ziel, kann das Netzwerk von Kapillaren in den Neocortex mit detaillierter abgebildet werden. Balken = 50 um.
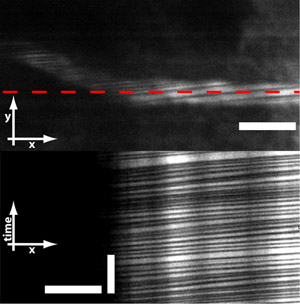
Abbildung 6: Mikroprismen ermöglicht auch für die Bildgebung roten Blutkörperchen (Erythrozyten) fließen durch die Gefäße. Erythrozyten nicht absorbieren den Fluoreszenzfarbstoff und werden daher als dunkle Streifen auf dem Schiff gesehen. Durch Online-Scannen über das Schiff, bekommt man Messungen von RBC Fluss und die Geschwindigkeit. Balken = 10 um (horizontaler Balken oben und unten, Bild) und 250 ms (vertikaler Strich in Bild unten).
Diskussion
Mit einem Mikroprismenring in einem bildgebenden Experiment ist relativ einfach und bietet viele Vorteile für in-vivo-Studien auf dem Neocortex. Repräsentative Beispiele mit dieser Technik gehören Bilder von transgenen Mäusen, die gelb fluoreszierenden Proteins in Schicht V kortikalen Neuronen übernommen. Mit Mikroprismen kann man sehen, eine Sammlung von großen Pyramidenzellen Zellkörper in Schicht V, fast 1 mm unterhalb der kortikalen Oberfläche. Ebenfalls zu sehen sind die apikalen Dendriten, dass durch all d...
Offenlegungen
Tierversuche wurden in Übereinstimmung mit den Richtlinien und Vorschriften her von der Yale University IACUC gesetzt durchgeführt.
Danksagungen
Wir danken Anthony J. Koleske, PhD für die Bereitstellung der YFP Mäusen.
Materialien
| Name | Company | Catalog Number | Comments |
| With enhanced silver reflective coating-(R77) | OptoSigma Corp. (Santa Ana, CA) | 055-0010 | With enhanced silver reflective coating-(R77) |
| Fluorescein-dextran | Sigma-Aldrich | FD70 | 70 kDa |
| 0.28 NA, 4x air objective | Olympus Corporation | XLFLUOR 4x/340 | |
| 0.60 NA, 40x air objective | Olympus Corporation | LUCPLFLN | With 0-2 mm coverglass correction |
Referenzen
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed Eng Online. 2, 13-13 (2003).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Kleinfeld, D., Mitra, P. P., Helmchen, F., Denk, W. Fluctuations and stimulus-induced changes in blood flow observed in individual capillaries in layers 2 through 4 of rat neocortex. Proc Natl Acad Sci U S A. 95 (26), 15741-15741 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten