Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In vivo-ähnlichen Organotypische Murine Retinal Wholemount Kultur
In diesem Artikel
Zusammenfassung
Dieses Video Artikel veranschaulicht die Einrichtung von organotypischen Retina wholemount Kulturen und einer Cytospin Verfahren zur Analyse von exogen induzierten Effekte. Organotypischen Retina wholemount Kulturen imitieren die In vivo Situation und deutlich erleichtern die Zugänglichkeit von murinen Retina für experimentelle Manipulationen unter Umgehung der Nachteile der klassischen Maus-Tiermodell.
Zusammenfassung
Gezielte Ablationen von Genen und Analyse von Tiermodellen ist die klassische Strategie für die Einschreibung spezifische retinale Genfunktion. Allerdings transgenen, Retina-spezifische oder Knockout-Mausmodelle zeigen oft schon Letalität oder an einer schweren Fehlbildungen, verhindern eine Analyse über die embryonalen oder frühen postnatalen Stadien.
Primäre Zellkultur ist eine Alternative zu den Auswirkungen der exogen applizierten rekombinanten Faktoren, die Überexpression von Genen oder siRNA-vermittelten Gen-Knockdown in einer kontrollierten Umgebung zu untersuchen. Dissoziierten Zellkultur hat den Vorteil, dass das körpereigene Signale erreichen die Zielzellen reduziert werden, wodurch auch die Identifikation von exogen ausgelöst Wirkungen nach pharmakologischen Manipulation. Allerdings sind wichtige Zell-Zell-Interaktionen zunächst durch enzymatische Verdauung oder mechanische Dissoziation zerstört, auch wenn re-aggregiert retinospheroid Kulturen 1 verwendet werden.
Im Gegensatz dazu bieten organotypischen Retina wholemount Kulturen ein System in der Nähe der physiologischen in vivo Situation mit neuronalen Interaktionen und Verbindungen noch erhaltenen 2-5.
In diesem Video-Artikel bieten wir Ihnen eine Schritt für Schritt Demonstration (1) die Einrichtung von in vivo-ähnlichen organotypischen Retina wholemount Kulturen einschließlich Dissektion Besonderheiten der embryonalen, postnatalen und adulten murinen Augen und (2) eine Dissoziation und Zytospin Verfahren zur Analyse von neuronalen Apoptose und retinalen Zell-Proliferation in organotypischen wholemounts nach Kultur in Gegenwart von exogen applizierten rekombinanten Faktoren wie zB.
Protokoll
Alle Geräte und Reagenzien sind gekauft sterile oder muss Wärme oder Dampf sterilisiert oder sterilisiert mit 70% EtOH werden.
Die Autoren stellen fest, dass Tierversuche in Übereinstimmung mit der Europäischen Gemeinschaften Richtlinie (86/609/EWG) durchgeführt wurden, nach den Richtlinien der NIH zur Pflege und Verwendung von Tieren für experimentelle Verfahren und den Regularien der Institutional Tiere gesetzt Pflege und Nutzung Committee (IACUC) an der Universität Duisburg-Essen (Deutschland).
Teil 1: Enukleation murine Augen der verschiedenen Entwicklungsstadien
Enukleation der embryonalen Augen
- Zeit schwanger Paarungen aufgestellt und am Morgen des Tages, an dem ein Vaginalpfropf bei Frauen Paarung erkannt wird, ist Schwangerschaftswoche Tag 0 bezeichnet.
- Die schwangere Frau ist durch Genickbruch getötet, wenn die Entwicklung des Embryos die gewünschte Stufe (hier: embryonale Tag (E) 15) erreicht hat und auf einer Wachs-Brett 6.
- Die Bauchdecke wird mit 70% EtOH angefeuchtet, geschnitten entlang der Mittellinie und die Hautlappen werden seitlich durch Stifte 6 fixiert.
- Die uterusses aus dem Bauch, gelöst und in ein Becherglas mit kaltem PBS 6 entfernt.
- Die Embryonen werden getrennt, in eine Petrischale und Gebärmutterwand und embryonalen Membranen sind sorgfältig durch die Verwendung von Zangen 6 entfernt.
- Die Embryonen werden durch Enthauptung getötet.
- Die Augen sind entkernte werden die Verwendung von feinen, gebogenen Pinzette, "Peeling" die Augen aus der Augenhöhle.
Enukleation der postnatalen und adulten Augen
- Junge Welpen sind durch Enthauptung, älteren Jungtieren und Erwachsenen durch Genickbruch getötet.
- Bis zu postnatalen Phase P15, haben den Zeitpunkt, wenn Mäuse ihre Augen öffnen, Sehschlitzen mechanisch durch den Einsatz von Zange geöffnet und erweitert durch zwei Querschnitte der Augenlider mit Feder Schere.
- Die Augen sind durch die Hilfe einer gebogenen Pinzette entkernte, Druck auf die Umlaufbahn.
Hinweis: Wie bei postnatalen Tag 2, der orbitalen Knochen noch Knorpel, ist es wichtig, nicht zu viel Druck ausüben, bei dem Versuch, die Augen zu entfernen.
Im Gegensatz dazu in der erwachsenen Mäusen sind die orbitalen Knochen fest. So um die Augen entkernen ist es ausreichend, um Druck auf die Bahn ohne Vergrößerung der Sehschlitzen im Voraus bewerben.
Teil 2: Präparation des embryonalen, postnatalen und adulten murinen Netzhaut
Dissection der Netzhaut
- Die Augen sind in eine kleine Petrischale mit sterilem PBS und die umliegenden Auge Schichten unter einem Dissektionsmikroskop entfernt platziert.
- Um das äußere Auge Schichten zu entfernen, in postnatalen Stadien und erwachsene Augen des Sehnervs hat durch die Hilfe des Frühlings Schere oder eingeklemmt abgeschnitten werden mit einer Pinzette an der Basis wie möglich zu schließen.
- Drehen Sie die Augen, so dass die Rückseite mit dem Loch, wo der Sehnerv ursprünglich befanden Ihnen zeigt. Geben Sie den subretinalen Raum zwischen Netzhaut und Pigmentepithel mit den Spitzen von zwei sehr feinen Pinzette aus dem Ort, wo der Sehnerv das Auge eingedrungen Schichten.
Hinweis: In der Regel das Pigmentepithel kann leicht durch seine dunkle Farbe identifiziert werden. In einigen Maus Mutanten - vor allem in Albino-Tiere - dieses Pigment-Schicht kann jedoch nicht eingefärbt werden und dürfen somit nicht ohne weiteres zu erkennen. - Entfernen Sie das Pigmentepithel mit dem beigefügten Aderhaut und Sklera durch vorsichtiges Reißen auf beiden Seiten mit beiden Zangen.
- Ziehen Sie die Schichten bis auf die Ebene der Hornhaut, dann drehen Sie die Augenmuschel an der Linse Seite und entfernen Sie die Hornhaut mit Pigmentepithel, Chorioidea und Sklera, während Sie die restlichen Netzhaut-Cup und den anderen Pinzette.
- Fassen Sie die Glaskörper zusammen mit der kleinen Linse und während Reißen mit einer Pinzette, halten Sie die Netzhaut wholemount statt mit der zweiten Zange.
Hinweis: Wenn Sezieren embryonalen Augen, stellen Sie sicher, vollständig zu entfernen dreieckig, zeltartige Kapillarplexus unter dem Glaskörper zusammen mit dem Glaskörper.
In der erwachsenen Auge, muss der Glaskörper an den Seiten fassen und Sorgfalt, um nicht zu durchbohren den Glaskörper mit den Spitzen der Pinzette, als sein Inhalt ist dickflüssig und klebt an der Zange, behindern ihre Entfernung getroffen. - Für organotypischen wholemount Kultur der Netzhaut Becher sind in einer 96-Well-Platte mit 200 ul Dulbecco modifiziertem Eagle-Medium (siehe unten) gesammelt.
Hinweis: Zwischen Dissektion der einzelnen Netzhaut, halten Sie die 96-well-Sammlung Platte mit dem Kulturmedium in den Inkubator, wie der pH-Wert des Kulturmediums von CO 2 wird über das Carbonat-System ausgelöst.
Teil 3: Murine organotypischen Retina wholemountKultur
- Bereiten Sie 500 ml Kultur durch die Gewichtung 7,8 g Dulbecco modifiziertem Eagle-Medium / Nährstoffmischung F-12 HAM (DMEM) und 0,6 g NaHCO 3 und Auflösen sowohl in MiIliQ Wasser. Den pH-Wert auf 7,15. Add 50mg apo-Transferrin, 50 ul Putrescin (Bestand: 60mg/ml), 50 ul Natriumselenit (Bestand: 52μg/ml), Progesteron (Bestand: 60μg/ml) und 2,5 ml Gentamicin (200 mM) unter der Haube. Mix und durch ein Bottle Top-Filters. Unmittelbar vor der Verwendung hinzufügen 10 &mgr; l Glutamin (200 mM) pro ml Kulturmedium.
Hinweis: Dieses Serum-und Insulin-freiem Medium kann bei 4 ° C gelagert werden bis zu 2 Wochen und für die Apoptose-Induktion Experimente wie kein Insulin wirkt der Effekte. Wenn Inkubation wholemounts länger als 24 Stunden gewünscht wird und Zelltod Preise werden nicht ausgewertet, Insulin-Serum (zB fötales Kälberserum; FCS) sollen oder Ergänzungen hinzugefügt, um die Überlebensraten zu verbessern. - Vor Beginn der Kultur, sind die retinalen wholemounts für 15 min bei 37 vorinkubiert ° C mit 200 ul warm, pH-neutral DMEM mit 0,5-Promillegrenze Hyaluronidase vor, verdauen die Hyaluronidase mit inneren und äußeren Grenzmembran M ller Glia Zellen, die Erleichterung Eindringen von exogen applizierten Substanzen.
- Netzhaut sind eine 24-Well-Platte mit so wenig wie möglich Hyaluronidase und kultiviert wie organotypischen wholemounts in 2ml chemisch definierten Dulbecco modifiziertem Eagle-Medium überführt.
Hinweis: Für die Übertragung der Netzhaut, verwenden Sie eine 1ml Pipette und schneiden Sie die Pipettenspitze einige Millimeter, um die Öffnung zu erweitern. Für embryonalen Augen, ist ein 200 ul Pipettenspitze ausreichend. Die Schnittkanten sollten durch Einsetzen und Verdrehen eines zweiten Pipettenspitze geglättet werden.
Für 24-48 Stunden kurzfristige Kulturen lassen sich alle Schritte bei der Bank durchgeführt werden, aber wenn eine Kontamination der Kulturen stellt sich heraus, ein Problem zu sein, sollte man unter der Motorhaube arbeiten. - 48 Stunden bei 37 ° C in einer 5% CO 2-Atmosphäre und pharmakologische Behandlung mit rekombinanten Faktoren unterworfen zB - Kulturen werden für 24 aufrechterhalten.
Teil 4: Die Dissoziation von kultivierten retinalen wholemounts
- Nachdem die gewünschte Kultur der Zeit, sind Netzhaut in 2ml Eppendorf-Röhrchen mit rundem Boden enthält 850 ul PBS und 50 ul Rinderserumalbumin (; 30 mg / ml BSA) gesammelt.
- Ort Eppendorf-Röhrchen mit einer Netzhaut in einem Heizblock, bis bei 37 ° C erhitzt
- Add 25 ul Kollagenase (200 U / ml) und 25 ul Hyaluronidase (20mg/ml) in jede Eppendorf-Röhrchen und starten Sie distanziert die Netzhaut in einzelne Zell-Suspension von 3 durchläuft eine silikonisierte Pasteurpipette.
- Fügen Sie 10 ul Trypsin (1mg/ml), für 3-5 min warten und dann langsam Pipette 3-5 mal rauf und runter mit silikonisierten Pasteurpipette mechanisch distanzieren Gewebe.
- Fügen Sie 10 ul DNase I (5mg/ml), wieder warten, für 3-5 min, dann langsam Pipette 3-5 mal rauf und runter mit silikonisierten Pasteurpipette.
Hinweis: Die Inkubationszeit für die enzymatische Dissoziation variiert und hängt von der Größe der Augen und der Entwicklungsphase bzw.. Überprüfen Sie die Stufe der enzymatischen Aufschluss des Gewebes durch vorsichtiges Auf-und Abpipettieren. - Wenn die Zellsuspension wird nicht von jetzt homogen, sondern enthält noch große Zellaggregate, zusätzliche 10 pl Trypsin und 10 ul DNase I.
- Wenn die Zellsuspension homogen ist, die Verdauung des Gewebes durch Zugabe von 10 ul EDTA (0,5 M) gestoppt wird, Eppendorf-Röhrchen sind aus dem Kaminofen und die Zellsuspensionen entfernt werden für 1h durch Zugabe von 1 ml frisches, eiskaltes 8% Paraformaldehyd fixiert (PFA) bei Raumtemperatur auf einem Schüttler Rotation.
Teil 5: Das Waschen der dissoziierten Zellsuspensionen
- Die Zellsuspension wird 5 min bei 4 ° C und bei 0,2 rcf in einer Kühlzentrifuge zentrifugiert.
- Der Überstand wird verworfen und das Pellet in 1ml PBS mit 3mg/ml BSA resuspendiert.
- Nach Wiederholung dieser Waschschritte zweimal wird das Pellet schließlich in 500 ul PBS 3mg/ml BSA, 5 mM EDTA und 0,1% Natriumazid resuspendiert.
Hinweis: Der Zusatz von Natrium-Säure ermöglicht eine Lagerung der Zellsuspension für mehrere Tage bei 4 ° C. Wenn jedoch eine immunzytochemische Färbung werden folgen, fügen Sie nicht Natrium-Säure zum Resuspensionspuffer, da dies zum Verlust der Färbung Qualität.
Teil 6: Cytospin von Zellsuspensionen für quantitative Apoptose und Proliferation Analyse
- Ein matt-End-Mikroskop-Objektträger, einer Cytospin Filter mit einem oder zwei Löcher und ein Zytospin Trichter in eine Zytospin Dia-Clip eingefügt. Die Dia-Clip wird geschlossen und in das Zytospin Rotor.
- Die dissoziierten Zellsuspension wird durch vorsichtiges Auf-und Abpipettieren homogenisiert.
Hinweis: Je nach Entwicklungsstadium der Netzhaut, kann die Zellsuspension aus der Dissoziation Verfahren müssenmit PBS verdünnt werden, um eine zählbare Anzahl von Zellen zu erhalten. - Ein Aliquot (100 ul) der Zellsuspension auf einen Zytospin Trichter eingesetzt.
Hinweis: Beim Pipettieren der Zellsuspension auf den Trichter, die Spitze der Pipette sollte den ganzen Weg bis hinunter auf den Boden des Trichters. Es ist wichtig, nicht durch die zweite Druckpunkt der Pipette drücken, da dies schafft Luftblasen, die sichtbar in der Zelle vor Ort wird nach der Zytospin und behindert Zellzahlen. - Die Zellsuspension wird auf einer Folie bei 700 rpm für 7 min gesichtet.
- Zur Bestimmung der Wirkung von exogen applizierten Faktoren auf die Apoptose Ebenen Zellen mit 4 angefärbt werden ',6-Diamidino-2-phenylindole (DAPI; 2μg/ml), mit fluoreszierenden Eindeckmedium montiert. Änderungen in Apoptose kann durch Zählen mindestens 1000 Zellen (mindestens 10 pycnotic Kerne) in die Zelle Zytospin Flecken und der Zelltod-Rate wird als Prozentsatz der gesamten Zellen berechnet zählt 3,4 ermittelt werden.
Hinweis: Alternativ kann die Verteilung der apoptotischen Kernen können in flatmounts 3 oder Kryostat sections4 von kultivierten retinalen wholemounts durch TdT-vermittelte dUTP nick end labeling (TUNEL) ausgewertet werden. - Für den Nachweis der Zellproliferation, können BrDU (5 pM) zugesetzt 6h vor dem Ende der Kultur und der BrdU-Einbau visualisiert in Cytospins von Zellhomogenaten durch immunzytochemische Färbung mit einem Anti-BrdU-Antikörper (zB Developmental Studies Hybridoma Bank, Iowa, USA) werden.
- Die Auswirkung der Behandlung auf verschiedenen retinalen Zelltypen können in Cytospins visualisiert Neuron-spezifischen Antikörpern wie Brn3a (Ganglienzelle Marker) oder Opsin (Photorezeptor Marker) und Gegenfärbung mit DAPI.
Teil 7: Repräsentative Ergebnisse
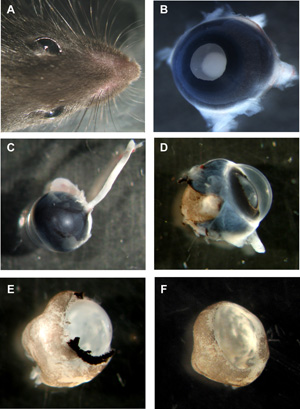
Abbildung 1: Schritte zur Vorbereitung der murinen organotypischen Retina wholemounts
Ein Leiter der Maus mit beiden Augen. B Murine Auge mit Linse nach oben, alle Schichten noch an seinem Platz. C Murine Auge von der Rückseite mit dem Sehnerv noch beigefügt. D Murine Auge mit Sklera und Pigmentepithel teilweise entfernt. E Murine Netzhaut mit Cornea, Sklera und Pigmentepithel vollständig entfernt, sondern Linse und Glaskörper noch an seinem Platz. F Murine Netzhaut wholemount Tasse mit Linse und Glaskörper entfernt. Bitte klicken Sie hier, um eine größere Version der Abbildung 1 zu sehen.
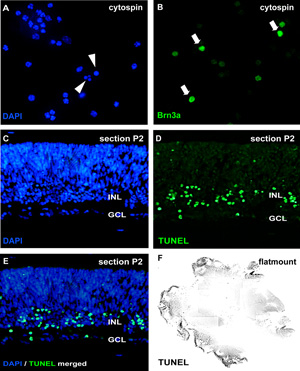
Abbildung 2: Analyse der organotypischen Retina wholemount Kulturen Zytospin und Abschnitte
Für die Analyse der Apoptose, sind Cytospins dissoziierter Zellsuspensionen durch DAPI gefärbt und pycnotic Kerne durch nukleare Fragmentierung oder Chromatinkondensation unterschieden werden (Pfeilspitzen in A). Alternativ wholemount Abschnitte (CE; murine Netzhaut postnatalen Tag (P) 2) oder retinalen Flatmount (F) kann mit einem TUNEL-Assay unterzogen werden und Gegenfärbung mit DAPI (E). Die Auswirkung der Behandlung auf verschiedenen retinalen Zelltypen können in Cytospins visualisiert Neuron-spezifischen Antikörpern wie die Ganglienzellen Marker Brn3a (Pfeile in B) GCL, Ganglienzellschicht;. INL, prospektiven inneren Körnerschicht. Bitte klicken Sie hier, um eine größere Version der Abbildung 2 zu sehen.
Diskussion
Der Vorteil der murine organotypischen Retina wholemount Kulturen 2-5 über Dissoziation, Monolayer, retinospheroid oder re-aggregiert 3D Sphäroid Kulturen 1 liegt in der Erhaltung der neuronalen Interaktionen und Verbindungen, imitiert die in vivo Situation. Im Vergleich zu früheren Berichten 2, bietet unser Video Artikel eine ausführliche Demonstration der Besonderheiten in Enukleation murine Augen und Dissektion der Netzhaut von verschiedenen Entwicklungsstadien einschlie?...
Danksagungen
Die Autoren bedanken sich bei E. de la Rosa und AI Valenciano für erste Hilfe zu danken mit der Gründung der organotypischen Kulturen und U. Laub und U. Gerster für die technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments | |
| Mice | Animal | Charles River Laboratories | ||
| Dissection microscope | Tool | Carl Zeiss, Inc. | ||
| PBS | Reagent | Sigma-Aldrich | PBS should be cold (> 4°C) and sterile | |
| Dulbecco`s modified eagle`s medium / nutrient mixture F-12 Ham | Reagent | Sigma-Aldrich | D 8900 | DMEM / F-12 |
| Apo-transferin | Reagent | Sigma-Aldrich | T 1147 | |
| Putrescin | Reagent | Sigma-Aldrich | P 5780 | |
| Sodium selenite | Reagent | Sigma-Aldrich | S 9133 | |
| Progesterone | Reagent | Sigma-Aldrich | P 6149 | |
| Gentamicine | Reagent | Invitrogen | ||
| L-Glutamine | Reagent | Invitrogen | 25030-024 | 200 mM (100X), liquid |
| Bovine serum albumine (BSA) | Reagent | Carl Roth Gmbh | 8076.3 | 30 mg/ml |
| Collagenase | Reagent | Sigma-Aldrich | C 0773 | 200 U/ml |
| Trypsin | Reagent | Sigma-Aldrich | T4799 | From porcine pancreas; 1 mg/ml |
| Hyaluronidase | Reagent | Sigma-Aldrich | H 3884 | 200 mg/ml |
| DNase I | Reagent | Roche Group | 1 284 932 | 10 mg/ml |
| EDTA | Reagent | Sigma-Aldrich | E 6511 | |
| Silicone solution | Reagent | SERVA Electrophoresis | 35130 | |
| Paraformaldehyde (PFA) | Reagent | Sigma-Aldrich | P6148 | 8% PFA in 0.1M phosphate buffer (pH 7.4). |
| 4’,6-diamidino-2-phenylindole dihydrochloride | Reagent | Sigma-Aldrich | D 0542 | DAPI |
| Fluorescent Mounting Medium | Reagent | Dako | S3023 | |
| BrDU | Reagent | Sigma-Aldrich | B 9285 | |
| 96-well plates | Tool | Falcon BD | 3072 | |
| 24-well plates | Tool | Falcon BD | 3047 | |
| Pasteur pipettes | Tool | Brand GmbH | 747720 | |
| Forceps DUMONT #5 | Tool | Fine Science Tools | 11252-30 | bevelled very fine shanks (0.05 mm x 0.02 mm tip) |
| Forceps DUMONT #7 | Tool | Fine Science Tools | 11271-30 | curved shanks (0.07 mm x 0.10 mm tip) |
| Spring scissors,straight, 8cm | Tool | Fine Science Tools | 15000-00 | fine, small straight blades |
| Standard scissors, straight, sharp/blunt | Tool | Fine Science Tools | 14007-14 | Use for decapitation or cervical dislocation |
| Eppendorf tubes | Tool | Eppendorf | 2ml; round bottom for better precipitation of pellet during centrifugation /cytospin | |
| Cooling centrifuge | Tool | Eppendorf | ||
| Rotation shaker | Tool | CAT | ||
| Cytospin | Tool | Thermo Fisher Scientific, Inc. |
Referenzen
- Rieke, M., Gottwald, E., Weibezahn, K. -. F., Layer, P. G. Tissue reconstruction in 3D-spheroids from rodent retina in a motion-free, bioreactor-based microstructure. Lab. Chip. 8, 2006-2213 (2008).
- Donovan, S. L., Dyer, M. A. Preparation and square wave electroporation of retinal explant cultures. Nature Protocols. 1, 2710-2718 (2006).
- Duenker, N., Valenciano, A. I., Franke, A., Hernandez-Sanchez, C., Dressel, R., Behrendt, M., de Pablo, F., Krieglstein, K., de la Rosa, E. J. Balance of pro-apoptotic transforming growth factor-beta and anti-apoptotic insulin effects in the control of cell death in the postnatal mouse retina. Eur. J. Neurosci. 22, 28-38 (2005).
- Franke, A. G., Gubbe, C., Beier, M., Duenker, N. Transforming growth factors beta and Bone morphogenetic proteins: Cooperative players in chick and murine programmed retinal cell death. J. Comp. Neurol. 495, 263-278 (2005).
- de la Rosa, E. J., Díaz, B., De Pablo, F. Organoculture of the chick embryonic neuroretina. Curr. Top. Dev. Biol. 36, 133-144 (1998).
- Dohle, D. S., Pasa, S. D., Gustmann, S., Laub, M., Wissler, J. H., Jennissen, H. P., Duenker, N. Chick ex ovo culture and ex ovo CAM assay: How it really works. J Vis Exp. 32, (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten