Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Photokonversion von gereinigtem fluoreszierende Proteine und Dual-Sonde Optische Hervorhebung in lebenden Zellen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt einen allgemeinen Ansatz zur Photokonversion von fluoreszierenden Proteinen auf einem konfokalen Laser-Scanning-Mikroskop durchgeführt. Wir beschreiben Verfahren für die Photokonversion puried Protein-Proben, sowie für Dual-Sonde optische Hervorhebung in lebende Zellen mit mOrange2 und Dronpa.
Zusammenfassung
Photokonvertierbare fluoreszierende Proteine (pc-FPs) sind eine Klasse von fluoreszierenden Proteinen mit "optischen Hervorheben"-Funktion, was bedeutet, dass die Farbe der Fluoreszenz durch Bestrahlung mit Licht einer bestimmten Wellenlänge verändert werden kann. Optische Hervorhebung ermöglicht nicht-invasive Kennzeichnung einer Subpopulation von fluoreszierenden Molekülen, und ist daher ideal für die Verfolgung von einzelnen Zellen oder Organellen.
Kritische Parameter für eine effiziente Photokonversion sind die Intensität und die Belichtungszeit der Photokonversion Licht. Wenn die Intensität zu niedrig ist, wird Photokonversion werden langsam oder gar nicht vorzukommen. Auf der anderen Seite kann zu viel Intensität oder zu lange Exposition photobleach des Proteins und somit die Verringerung der Effizienz des Photokonversion.
Dieses Protokoll beschreibt einen allgemeinen Ansatz zur Einrichtung eines konfokalen Laser-Scanning-Mikroskop für PC-FP Photokonversion Anwendungen. Zunächst beschreiben wir ein Verfahren zur Herstellung gereinigtes Protein Tropfen Proben. Diese Sample-Format ist sehr praktisch für das Studium der photophysikalische Verhalten von fluoreszierenden Proteinen unter dem Mikroskop. Zweitens verwenden wir das Protein Tröpfchen Probe, um zu zeigen, wie man das Mikroskop für Photokonversion konfigurieren. Und schließlich werden wir zeigen, wie optische Hervorhebung in lebenden Zellen, einschließlich Dual-Sonde optische Hervorhebung mit mOrange2 und Dronpa durchzuführen.
Protokoll
1. Vorbereitung des fluoreszierenden Proteins Tropfen Proben
Ein fluoreszierendes Protein Tröpfchen Probe besteht aus einem 1-octanol/water Emulsion mit dem fluoreszierenden Protein mit Wohnsitz in der wässrigen Phase. Diese Emulsion wird zwischen einen Objektträger und ein 22 mm ² Deckglas für Mikroskopie-Anwendungen eingebettet.
- Bevor fluoreszierendes Protein Tropfen Proben der Objektträger und Deckgläser müssen gereinigt und mit einem hydrophoben Mittel beschichtet werden.
- Saubere Gläser durch Waschen 5 Minuten mit Aceton und zu verlassen, um von der Luft trocknen. (Optional kann nach der Reinigung der Gläser kann für 30 Sekunden in ein Plasma-Reiniger behandelt werden, um optimale Ergebnisse zu erzielen Beschichtung).
- Bereiten Sie eine 2% Methyltrimethoxysilan Lösung in Aceton und Beschichtung der Gläser während einer 2-Minuten Inkubation in dieser Lösung. Nach der Beschichtung entfernen Sie die Glaswaren aus der Lösung und lassen Sie von der Luft trocknen. Dann mit 70% Ethanol spülen aus einer Sprühflasche und verlassen, um wieder trocken. (Optional an dieser Stelle die Gläser können für 1 Stunde bei 80 ° C gebacken werden, um kovalent verbinden die Beschichtung auf dem Glas). Beschichtete Gläser können für mindestens einen Monat gelagert werden.
- Fluoreszierende Proteine sind als His 6-markierte Protein aus E. gereinigt Coli 1. Messen Sie das Absorptionsspektrum des gereinigten Proteins und bereiten ein Lager Verdünnung mit einer optischen Dichte von ~ 0,1 in STE-Puffer (150 mM NaCl, 10 mM Tris-HCl pH 8, 1 mM EDTA), mit 0,1% Rinderserumalbumin (BSA) . Darüber hinaus bereiten 10 ml eines 1:1-Gemisches von 1-Octanol und STE-Puffer in einem 15 ml konischen Rohr und kräftig schütteln. Nach dem Mischen zu verlassen, bis die Phasentrennung abgeschlossen ist. Die obere Phase ist die 1-Octanol. (Achtung: Da 1-Octanol hat einen starken Geruch ist es wichtig, einen geschlossenen Abfallbehälter für alles, was in Kontakt mit 1-Octanol ist, benutzt.)
- Um die Emulsion Pipette 45 ul 1-Octanol und 5 ul fluoreszierendes Protein in einem Mikrozentrifugenröhrchen. Tippen Sie auf die Tube ein paar Mal mit dem Finger, um die Bildung der Emulsion zu starten und dann beschallen das Röhrchen für 30 Sekunden in einem Ultraschallbad. In der Zwischenzeit erhalten eine beschichtete Objektträger und Deckglas bereit. Nach der Beschallung der Emulsion sollte vollständig bedeckt. Unmittelbar nach Beschallung Pipette 4 ul-Emulsion aus der Mitte der Röhre auf einen beschichteten Objektträger und decken mit einer beschichteten Deckglas.
- Wenn das Verfahren richtig gemacht die Emulsion gleichmäßig verteilt zwischen dem Objektträger und dem Objekt Glas. Innerhalb weniger Minuten die Probe sollte stabil sein, bestehend aus ca. 10 mu m dicke Leuchtstoff Tröpfchen mit unterschiedlichem Durchmesser. Die größten Tropfen werden in der Nähe der Mitte der Probe und die kleineren sind weitere zu den Rändern hin gelegen.
2. Einrichten einer Photokonversion Experiment
Das folgende Verfahren ist eine allgemeine Strategie für den Aufbau eines fluoreszierenden Proteins Photokonversion Experiment. Dieses Verfahren kann für gereinigte Proteine als auch für lebende Zellen angewendet werden.
- Die folgenden Parameter stellen einen allgemeinen Ausgangspunkt, um Ihre Photokonversion Experiment:
40x 1.3NA Ölimmersionsobjektiv
Bildgröße = 512 x 512 Pixel
Scan-Zoom = 4
Pixelverweilzeit = 6 us.
Z-Auflösung (Pinholegröße) = 3 um - Konfigurieren Sie zwei Detektionskanäle für die Anfangs-und photokonvertiertem Fluoreszenz, sowie eine "Photokonversion Kanal". In diesem Beispiel verwenden wir gereinigt mOrange2 Protein, das einen orange-to-rot Photokonvertierbare fluoreszierenden Proteins ist. Die orange Spezies erkannt wird mit 561 nm Anregungs-und die Fluoreszenz zwischen 570 nm und 630 nm gesammelt. Die photokonvertiertem roten Spezies erkannt wird mit 633 nm Anregungs-und die Fluoreszenz zwischen 640 nm und 700 nm gesammelt. Für die "Photokonversion channel" wählen 488 nm Anregungs-und Fluoreszenz sammeln zwischen 490 nm und 540 nm. (Hinweis:. Bildgebung der Photokonversion Kanal ist nicht unbedingt notwendig)
- Verwenden Sie den Kanal für die Bildgebung der ersten Fluoreszenz mit kontinuierliche Abtastung der Laserleistung und Detektor Gewinn für optimale Bildqualität anzupassen.
- Aktivieren Sie die Photokonversion Kanal und wählen Sie eine niedrige Laserleistung. Starten Bildgebung einer Zeitserie und schrittweise Erhöhung der Photokonversion Laser, bis signifikante Ausbleichen der anfängliche Fluoreszenz beobachtet wird. Setzen Sie den Scanvorgang, bis die anfängliche Fluoreszenz beträgt ca. 75% gebleicht.
- Deaktivieren Sie die Photokonversion Kanal und aktivieren Sie die Erkennung Kanal für die photokonvertiertem Fluoreszenz. Starten Bildgebung mit hoher Detektor zu gewinnen und niedrige Laserleistung und schrittweise Erhöhung der Laserleistung, bis die photokonvertiertem Fluoreszenz detektiert. Sobald Sie erkennen die photokonvertiertem Fluoreszenz Sie Laserleistung und Detektor zu gewinnen für eine optimale Bildqualität einstellen können.
- Schließlich verwendet die Laserleistungfür Photokonversion sowie die Dauer der Photokonversion müssen optimiert werden. Die Erhöhung der Photokonversion Laserleistung beschleunigt die Rate der Photokonversion jedoch zu viel Laserleistung wird das Protein photobleach.
- Sobald die optimale Photokonversion Laserleistung und die Dauer bestimmt worden sind, können diese Parameter verwendet, um ein Standard-Bleichen oder FRAP-Modul und dem "Photokonversion Kanal" ist nicht mehr erforderlich zu konfigurieren.
3. Dual-Sonde optische Hervorhebung mit mOrange2 und Dronpa
Aufgrund der Rotverschiebung spektralen Eigenschaften können mOrange2 in Kombination mit dem grünen photoschaltbare fluoreszierendes Protein Dronpa für Dual-Sonde optische Hervorhebung verwendet werden, um eine selektive Hervorhebung von 4 einzelnen Zelle (Organellen) Populationen zu ermöglichen.
- Die Zellen werden in Glasboden MatTek Gerichte gewachsen und transfizierten 24 Stunden vor der Bildgebung unter Verwendung von Standard Lipofectamine2000 Transfektion 1.
- Richten Sie das Mikroskop für mOrange2 Photokonversion wie in Abschnitt 2 beschrieben.
- Konfigurieren Sie das Mikroskop für Dronpa Photoschaltung. Dronpa Fluoreszenz abgebildet mit den mOrange2 "Photokonversion channel" (siehe Schritt 2.2). (Hinweis: Minimieren Sie die Laserleistung für die Bildgebung verwendet Dronpa, weil zu viel Laserleistung Inaktivierung von Dronpa verursachen.) Hinzufügen eines Kanals für Dronpa Photoaktivierung. Wir verwenden 800 nm Zwei-Photonen-Anregung für Photoaktivierung, sondern alternativ kann dies erreicht mit 405 nm Anregung sein. Bestimmen Sie die Laserleistung für die Bildgebung erforderlich, Photoaktivierung und Photoinaktivierung Dronpa Fluoreszenz.
- Achtung: Photokonversion mOrange2 und Inaktivierung von Dronpa sowohl bei 488 nm Anregung auftreten. Aufgrund der hohen Laserleistung für mOrange2 Photokonversion benötigt wird dies auch inaktivieren Dronpa Fluoreszenz. Auf der anderen Seite tritt Dronpa Inaktivierung bereits bei viel geringerer Laserleistung und kann ohne nennenswerte mOrange2 Photokonversion durchgeführt werden.
- Nachdem die Parameter für mOrange2 Photokonvertierung und Dronpa Photoschaltung gesetzt sind, ist dual-Sonde optische Hervorhebung durch die folgenden Schritte erreicht. Zunächst inaktivieren Dronpa Fluoreszenz in der gesamten Sichtfeld mit Low-Power 488 nm Anregung. Zweitens, wählen Sie eine Region von Interesse und photoconvert mOrange2 mit hoher Leistung 488 nm Anregung. Schließlich wählen Sie eine Region von Interesse Dronpa Fluoreszenz zu aktivieren.
4. Repräsentative Ergebnisse
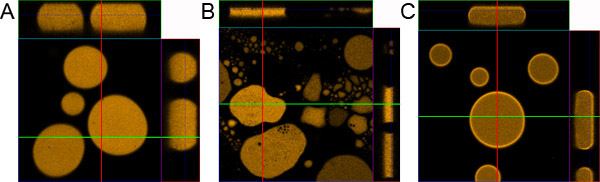
Abbildung 1. Droplet Probenvorbereitung. A) richtig vorbereitet Tropfen Probe. B) Muster ohne Beschichtung der Objektträger und Deckglas vorbereitet. C) Probe ohne Zugabe von 0,1% BSA vorbereitet.
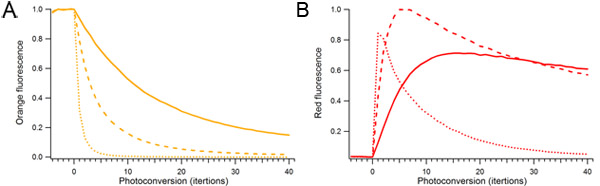
Abbildung 2. Wirkung von Photokonversion Laserleistung und die Dauer auf mOrange2 Photokonversion. Einzel Tröpfchen mit mOrange2 Protein wurden kontinuierlich photokonvertiertem mit unterschiedlichen Mengen von 488 nm Laserleistung. Relative Laserleistung für Photokonversion betrug 10% (massiv), 25% (gestrichelt) und 100% (gepunktet). A) Orange fluoreszierende Spezies. B) photokonvertiertem rot fluoreszierende Spezies.
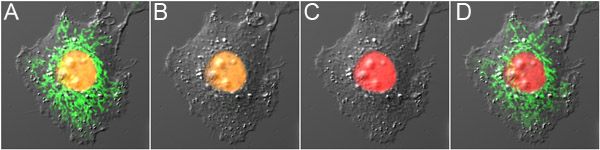
Abbildung 3. Dual-Sonde optische Hervorhebung mit mOrange2 und Dronpa. A) exprimiert mOrange2-Histone H2B und Dronpa-Mito vor Photokonversion, zeigt orangefarbene Fluoreszenz in den Zellkern und grüne Fluoreszenz in den Mitochondrien. B) Dronpa Fluoreszenz wurde mit Low-Power 488 nm Anregung eingeschaltet, wodurch minimale Photokonversion mOrange2. C) mOrange2 war rot mit hoher Leistung 488 nm Anregung photokonvertiertem. D) Dronpa Fluoreszenz wurde wieder mit 800 nm 2-Photonen-Anregung eingeschaltet. Die Paneele sind Überlagerungen der Fluoreszenzbilder zusammen mit dem Differential-Interferenz-Kontrast Bild.
Diskussion
Das gereinigte fluoreszierendes Protein Tröpfchen Probe ist eine sehr bequeme Sample-Format für die photophysikalische Charakterisierung von fluoreszierenden Proteinen, zum Beispiel zu studieren photobleaching Kinetik und Photokonversion Kinetik. Die extrem kleinen Tröpfchen Volumen (~ 20 Picoliter) erleichtert Bleichen und Photokonversion Experimente, die schwierig sein, in Küvette basierten Systemen ausgeführt werden können. Darüber hinaus, da hier die Tröpfchen Probe ist ideal für den Aufbau eines konfokalen...
Offenlegungen
Danksagungen
Wir danken Mike W. Davidson (Florida State University) für die Bereitstellung von Plasmid-DNA, die fluoreszierende Proteine. Diese Arbeit wurde vom National Institutes of Health gewähren GM72048 (zum DWP) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Microsope slides | VWR international | 48312-003 | |
| 22 mm cover glass | Corning | 2940-245 | |
| 1-octanol | Sigma-Aldrich | O4500 | |
| methyltrimethoxysilane | Sigma-Aldrich | M6420 | |
| MatTek dishes | MatTek Corp. | P35G-1.5-14-C | |
| Lipofectamine2000 | Invitrogen | 11668-019 |
Referenzen
- Kremers, G. J., Hazelwood, K. L., Murphy, C. S., Davidson, M. W., Piston, D. W. Photoconversion in orange and red fluorescent proteins. Nature Methods. 6, 355-358 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten