Method Article
Adulten und embryonalen Skelettmuskel Microexplant Kultur und Isolation der Skelettmuskulatur Stem Cells
In diesem Artikel
Zusammenfassung
Die Mikro-seziert Explantate Technik ist eine robuste und zuverlässige Methode zur Isolierung proliferative Skelettmuskelzellen von Jugendkriminalität, adulte oder embryonale Muskeln als eine Quelle der Skelettmuskulatur Stammzellen. Einzigartig sind diese Zellen klonal abgeleitet, um Skelettmuskulatur Stammzelllinien für in vivo-Transplantation verwendet produzieren.
Zusammenfassung
Kultivierte embryonale und adulte Skelettmuskelzellen haben eine Reihe von verschiedenen Anwendungen. Die Mikro-seziert Explantate Technik in diesem Kapitel beschrieben ist eine robuste und zuverlässige Methode zur Isolierung von relativ großen Zahl von proliferative Skelettmuskelzellen von Jugendkriminalität, adulte oder embryonale Muskeln als eine Quelle der Skelettmuskulatur Stammzellen. Die Autoren haben Mikro-seziert Explantation Kulturen verwendet, um das Wachstum Eigenschaften von Skelettmuskelzellen in Wildtyp-und dystrophischen Muskeln zu analysieren. Jede der Komponenten von Gewebewachstum kann nämlich das Überleben der Zelle, Proliferation, Seneszenz und Differenzierung getrennt analysiert mit Hilfe der hier beschriebenen Methoden werden. Der Nettoeffekt aller Komponenten des Wachstums kann durch Messung der Explantation Auswuchs Preise festgelegt werden. Die Mikro-Explantat-Methode kann verwendet werden, um primäre Kulturen aus einer breiten Palette verschiedener Muskelgruppen Schularten und Altersstufen zu etablieren und, wie hier beschrieben, wurde von den Autoren angepasst worden, um die Isolierung von embryonalen Skelettmuskelzellen Vorstufen zu ermöglichen.
Einzigartig sind Mikro-Explantat-Kulturen verwendet worden, um daraus klonalen (einzelne Zelle Herkunft) Skelettmuskulatur Stammzellen (SMSC) Linien, die ausgebaut werden und für in vivo-Transplantation kann. In vivo transplantiert SMSC verhalten, als funktionelle, Gewebe-spezifische, Satelliten-Zellen die dazu beitragen, Skelettmuskel-Faser Regeneration, aber die auch beibehalten werden (in der Satelliten-Zell-Nische) als eine kleine Gruppe von undifferenzierten Stammzellen, die in Kultur re-isoliert werden können mit Hilfe der Mikro-Explantat-Methode.
Protokoll
Zwei Ansätze werden können, um proliferative Skelettmuskelzellen zu isolieren. In den ersten Muskelgewebe werden enzymatisch verdaut, um einzelne Zellen vor zu isolieren, um out 1-Beschichtung. Die zweite Methode ist, um Stücke von Muskelgewebe in Kultur Explantation, damit Zellen zu wachsen während der Inkubation 2, 3. Die zweite Methode ist in diesem Protokoll beschrieben. Gewebekultur selbst hat seine Wurzeln in Explantation Kultur. Das Jahr 2007 war der 100. Jahrestag der klassischen Experimenten von Harrison in dem er Neuron Auswüchse durch Inkubation Nerven Explantate in hängenden Tropfen von Lymphe 4. Explantation Kultur Techniken wurden verwendet, und in einer Vielzahl von unterschiedlichen Kontexten verfeinert in den folgenden 100 Jahren als Mittel zur Schaffung von proliferative primären Kulturen von adulten und embryonalen Zellen 4, 5. Das Prinzip hinter dem Explantat-Technik bleibt jedoch die gleiche, zu minimieren das Trauma der primären Zelle Isolierung durch die Aufrechterhaltung der dreidimensionalen Struktur der Muttergesellschaft Gewebe während der kritischen Frühphase der Zelle Auswuchs und gleichzeitig die auswachsenden Zellen mit einem reichhaltigen Nährmedien in denen sich zu vermehren. In der Skelettmuskulatur gibt es einen zusätzlichen Vorteil bei der Verwendung Explantation Kultur, weil der Akt des Schneidens das Muskelgewebe nachahmt Muskelfaser Trauma, die üblichen Auslöser für Satelliten-Zell-Aktivierung, Migration und Proliferation 3, 6. Adult Skelettmuskulatur Satelliten-Zellen (auch als Myoblasten) sind die proliferative Stammzellen Bevölkerung verantwortlich für die Muskelfaser Reparatur und Wachstum 7.
Skelettmuskulatur Explantate so ahmen die in vivo-Umgebung des sich regenerierenden Muskeln und stimuliert Stammzellen Migration und Division. In den Embryo stammt die Mehrzahl der Wirbeltiere Skelettmuskel (Rumpf-und Beinmuskeln) aus der Somiten, obwohl somitomeres und Kiemenbogen Anlass zu der Muskulatur des Kopfes 8, 9. Das Myotom können als zwei getrennte Gruppen von identifiziert werden Myf-5 zum Ausdruck Stammzellen in der dorsalen, medialen und lateralen Ränder der differenzierenden Somiten gelegen, jeweils. Jeweils erzeugen diese Zellen die epaxialer Muskeln des Rückens, die in situ zu unterscheiden, und das ventrale und laterale hypaxial Muskulatur (Gliedmaßen, Bauch-und Atemmuskulatur), die die Migration von Muskel-Stammzellen aus dem Somiten 10 erfordern. Embryonale Stammzellen Muskel Migration ist unter der Kontrolle von Pax 3 11. Myf-5 Ausdruck ist wesentlich für die Gründung der embryonalen Muskulatur und diese Bedeutung besteht eine postnatale Muskeln, wo über 98% der aktivierten Satelliten-Zellen exprimieren Myf-5 12. Myf-5 ist daher eine zuverlässige und spezifische Marker der wuchernden Skelettmuskulatur Stammzellen Bevölkerung in beiden adulten und embryonalen Geweben. Embryonale Muskel-Stammzellen (auch als Muskel-Vorläuferzellen, Skelettmuskel Vorstufen, Myoblasten oder sogar embryonaler Satelliten-Zellen) können aus den Somiten im frühen Entwicklungsstadium, Maus, Küken und Froschembryonen 13 isoliert werden. Um myogene Kulturen aus der embryonalen Skelettmuskulatur von älteren Embryonen die Autoren zu isolieren, die mikrodissezierten Explantat-Technik für die embryonale Gewebe angepasst. Ein ähnlicher Ansatz wird von Cossu et al. 14 bis klonale Zellpopulationen aus der embryonalen Somiten 14 zu erzeugen.
1. In-vitro-Zellkultur der Skelettmuskulatur Stem Cells (SMSC)
SMSC sind Zelllinien einzelne Zelle Ursprungs, die klonal haben von der Grundschule Skelettmuskulatur Explantation Kulturen abgeleitet. Sie können kultiviert mit Standard-Zellkultur-Methode, wenn genügend darauf geachtet werden. Beachten Sie, dass, sofern nicht anders angegeben, alle Manipulationen beschrieben out sind unter aseptischen Bedingungen mit einer sterilen Werkbank (Klasse 1 oder 2 sterile Schrank) und aller Kultur Reagenzien sind bis 37 ° C in einem Wasserbad vor Gebrauch erwärmt.
- Zu bringen, SMSC von flüssigem Stickstoff Speicher (siehe Abschnitt 1.2 für das Einfrieren down-Methode) Kryoröhrchen sollte schnell aufgetaut werden und der Inhalt in 5 ml vorgewärmtem übertragen (37 ° C) DF10 Kulturmedium für die sofortige Zentrifugation (1.000 g für 3 min) zu entfernen, DMSO . Die beste Methode, um Zellen auftauen wird durch Wiederholung Pipettieren kleiner Mengen von vorgewärmten Kulturmedium in das Fläschchen vor der Übertragung auf die Zentrifugenröhrchen. Der Prozess der Auftauen von Zellen sollte sehr schnell sein, da kryokonservierten Zellen 10% DMSO, die toxisch für Zellen bei Raumtemperatur (LD50 ca. 2 min) ist enthalten durchgeführt.
- Nach Zentrifugation wurde der Überstand entfernt und die Zellen werden gewaschen durch Resuspendieren des Zellpellets in weiteren 5 ml DF10, dann wie zuvor zentrifugiert.
- Das Zellpellet dann zum zweiten Mal mit 5 ml DF10 und die daraus resultierende Zellsuspension gemischt wird, um eine kleine 25 cm 2 Kunststoff-Kultur ve übertragenssel.
- Die Kulturen werden bei 37 ° C in einem befeuchteten Inkubator mit 5% CO 2 in Luft. Sofern Schiffe mit einer gefilterten Kappe verwendet werden, muss die Kappe der Flasche leicht für mehrere Stunden gelöst werden, damit die Luft in das Kulturgefäß mit dem Inkubator ins Gleichgewicht und säuern das Kulturmedium. pH des Mediums wird durch Einbau eines Phenol roten Farbstoff pH-Indikator in das Kulturmedium überwacht.
- Aufgetauten Zellen müssen immer 24 h nach dem Ausplattieren und wieder zugeführt mit frischen DF10 Medium überwacht werden, um die Entfernung von Zelltrümmern und Rest-Toxine zu gewährleisten (siehe Anmerkungen 1 und 2).
1.1. Subkultur
Für etablierte SMSC Linien, wenn die Zellen ca. 95% Konfluenz erreichen, sollten sie aus ihrer Kultur Gefäß entfernt werden, verdünnt und in ein neues Gefäß zu weiterem Wachstum zu ermöglichen. Diese Subkultur Verfahren kann durch eine Reihe von verschiedenen enzymatischen Verfahren erreicht werden, Trypsin / EDTA zu den am häufigsten verwendet werden (siehe Anmerkung 3). Es ist üblich (und gut) Praxis-Zellen bei Dichten, welche ihnen am dritten Tag des Wachstums subkultiviert werden müssen wachsen. Für die meisten SMS-Zelllinien kann dies durch die Spaltung von Zellen 1 / 10 bei jedem Subkultur erreicht werden. Dies ermöglicht eine sorgfältige Überwachung der Zellen und ermöglicht es den Durchführung der Gewebekultur zur sofortigen Identifizierung von ungewöhnlichen Wachstum Verhalten (z. B. schnelleres Wachstum), die phänotypische Veränderungen der Zell-Linie, wie Wandlung oder Minderung in Apoptose durch Anpassung an die Kulturen Bedingungen verursacht hinweisen könnte. Darüber hinaus setzt eine sorgfältige und Subkultivierung Routine enorm verringert die Häufigkeit solcher Ereignisse.
- Für Subkultur mit Trypsin (Trypsinierung) Schiffe werden aus dem Brutschrank und ihr Medium durch Absaugen entfernt verworfen.
- Die Zellen werden dann zweimal mit sterilem gewaschen Calcium-und Magnesium-freier Phosphat-gepufferter Salzlösung (PBS), 10 ml pro Waschgang entfernt jedes Mal durch Aspiration.
- Um den Zellrasen (25 mm 2 Kolben) 1 mL 1 Trypsin / EDTA zugegeben und nach links auf die Zellen bei Raumtemperatur für 2 3 min, bis die Zellen zu lösen beginnen (siehe Anmerkung 4). Distanzieren Dies kann durch den erfahrenen Anwender als kleine Löcher bilden in der etwas undurchsichtigen Monoschicht, wenn der Kolben, um das Licht gehalten wird (siehe Anmerkung 5) zu sehen. Während Zellen für eine ausreichende Zeit, um eine einzelne Zelle Suspension zu gewährleisten trypsiniert werden sollte, sollte darauf geachtet werden, nicht überbelichtet SMSC Trypsinierung werden, da dies in hohem Zelltod und schlechte Anlage, wenn die Zellen werden neu vergoldet führen wird.
- Zum Stoppen der Reaktion Trypsin, Serum-haltigem Medium (DF10) ist auf ein Minimum von 2 Volumen (dh das doppelte Volumen des Trypsin-Lösung) zugegeben. Wenn Subkultivierung einer 25 mm 2 Kolben ist es zweckmäßig, 9 mL DF10 zu diesem Zeitpunkt hinzufügen. A 1 / 10 Teilung der Zellen können dann leicht durch Verdünnen von 1 ml der resultierenden Zellsuspension in eine neue 25 mm 2 Kulturflasche zusammen mit einem weiteren 9 ml frisch DF10 Medium vorgenommen werden. Die übrigen Zellen können für die Zell-Expansion (Übertragung auf einen größeren Behälter), kryokonserviert werden (siehe Abschnitt 1.2) oder gezählt und vernickelt in der experimentellen Küche, Brunnen oder Platten für die Proliferation und das Überleben Assays, Differenzierung, Wachstumsfaktor-Behandlung oder für andere Zwecke (siehe unten).
1.2. Kryokonservierung von Zelllinien und Primärzellen Kulturen
- Für die Kryokonservierung Zellen sind losgelöst von ihren Monoschicht für Subkultur (Abschnitt 3.1.1) und durch Zentrifugation pelletiert (3 min bei 1.000 g).
- Der Überstand wird abgesaugt und die Zellen werden sorgfältig und schnell in 10 ml einfrieren Downmix (10% DMSO in DF10) resuspendiert, bevor sie erneut durch Zentrifugation pelletiert werden.
- Dieses Mal wird das Pellet in ausreichender Frost Downmix resuspendiert bis 0,5 ml Zellsuspension pro Kryoröhrchen zu ermöglichen (siehe Tabelle 1) und sofort in 80 º C über Nacht.
- Kryoröhrchen sind flüssigen Stickstoff überführt am nächsten Tag für eine langfristige Lagerung (siehe Anmerkung 6). Wie bei dem Auftauen der Zellen, muss dieser Prozess der Kryokonservierung sehr zügig erfolgen. Während DMSO ist Schutzkleidung für Zellmembranen während des Einfrierens ist es sehr toxisch für Zellen bei nicht-Minustemperaturen.
1.3. Bestimmen Zelle Numbers
- Zur Bestimmung der Zellkonzentration von einem einzigen Zellsuspension (nach Subkultur) eine Neubauer Zählkammer verwendet werden kann. Um die Genauigkeit der Zählung der Deckglas muss sicher auf den Hämocytometer Sockel montiert werden (siehe Anmerkung 7).
- Ein kleiner Tropfen der Zellsuspension wird dann nahe an den Rand des Deckglases und platziert wird durch Kapillarwirkung genommen werden.
- Die Zellen werden dann gezählt mit einem inversen Mikroskop mit Phasenkontrast-Beleuchtung. Um die Genauigkeit der Endzellkonzentration, die c erhöhenEllen in der Zählkammer sollten sich nicht überschneiden, wenn sie die ursprüngliche Zellsuspension tun verdünnt werden sollte, und die Zellen erneut gezählt. Klumpende sollte durch gründliche Dissoziation der Zellen während der Trypsinierung vermieden werden und 100-200 Zellen über eine bekannte Oberfläche sollte gezählt, um eine genaue Schätzung der Zellzahl zu erhalten. Eine bequeme Methode unter Verwendung der Neubauer Zählkammer wird, um Zellen in 2 oder mehr 16 Quadratmeter setzt zählen. Die Zelldichte pro Milliliter wird dann durch Division der Summe durch die Anzahl der Sätze gezählt (zB 2) und Multiplikation mit 10 4 erhalten. Zum Beispiel 100 Zellen über 2 x 16 Quadratmeter setzt = 100 / 2 = 5 x 10 5 Zellen / ml gezählt.
2. Gründung Primary Skelettmuskel Microexplant Kulturen
Primäre Mikro-Explantat-Kultur lässt sich SMSC von jeder zugänglichen Skelettmuskulatur einschließlich der einzelnen Muskeln der vorderen und hinteren Gliedmaßen, Zwerchfell, Rücken-und Bauchmuskulatur zu isolieren. Die Methode zur Ableitung microexplant Kulturen von jugendlichen und erwachsenen Muskeln wird ausführlich von Smith und Schofield 3 beschrieben und wurde in der Folge ausführlich abzuleiten SMS Zellen aus jugendlichen, erwachsenen und alten Maus Muskeln eingesetzt. Das Verfahren kann auch zur Ableitung von kultivierten Skelettmuskelzellen aus Fisch 24 und der menschlichen Skelettmuskulatur (Rao und Smith, unveröffentlicht) werden. Auswachsen von SMSC von einer Maus Muskel microexplant ist in Abbildung 1a, b dargestellt. Das Verfahren wurde für die Isolierung von embryonalen Muskel-Vorläuferzellen (siehe Abschnitt 3) geändert worden. Die grundlegende Methode ist wie folgt:
- Aseptische Dissektion der Zielmuskel (s) aus einer frisch gepflückt Maus erfolgt über sterile Instrumente, ein sauberes Arbeitsumfeld und der großzügige Einsatz von 70% Ethanol besprühen.
- Isolierte Muskeln werden durch zwei Änderungen der DF20-Medium gewaschen und in frischem DF20 Medium in einer 60 mm 2 Schale gelegt. Mit einem Stereo-Dissektionsmikroskop Muskeln sind sorgfältig unter sterilen Bedingungen mikrodissezierten Fett, Bindegewebe und Knochen auszuschließen.
- Gereinigt Muskel Stücke werden dann in 400 &mgr; 3 Würfel, die mit Juwelier s Pinzette einzeln in das Zentrum sich 60 Vertiefungen einer 96-Well-Platte mit 50 ul DF20 (siehe Anmerkung 8) geschnitten. Wells werden unter dem Mikroskop geprüft und in den Inkubator. Die äußeren Vertiefungen werden mit Kochsalzlösung, um zu verhindern das Austrocknen von Brunnen, die Explantate (3) gefüllt.
- Microexplant Befestigung und Auswuchs ist nach 24-48 h Inkubation und danach in 48-72 h Abständen (je nach Wachstum der Muskeln kultiviert) erzielt.
- Zur Erweiterung und Isolierung von SMS-Zellen, sollte Auswuchs Kulturen individuell für Zellen mit einer überwiegend SMSC Morphologie, dh sphärische einkernigen Zellen mit hoher Brechkraft, die in der Aggregation Clustern wachsen (siehe Abbildung 3.1b) überwacht werden.
- Nach Explantation Auswuchs ist etabliert einzelnen Vertiefungen eingespeist werden (siehe Anmerkung 9) durch die Zugabe von 50 ul Schritten von Medium, wenn das Medium säuert durch erhöhte Zelldichte. Wenn das auch voll und Zellkultur fast konfluent ist, werden Vertiefungen durch Ersatz von 50% des Mediums jeweils zugeführt, um die Wartung der "Konditionierung" Faktoren, die von den Zellen sezerniert werden (siehe Kommentar zu konditioniertem Medium unter Klonen; Abschnitt 2.1) zu gewährleisten. Zur Unterdrückung der Differenzierung sind bei 60-70% Konfluenz primäre Explantat Auswüchse in Calcium-abgereichertem Medium durch Substitution DF20 Medium für Calcium-abgereicherten DMEM/F12 (alle Ergänzungen bleiben gleich) zum Zuführen Zellen 3 eingeschaltet.
- Explantation konditionierten Medium von Kulturen können in dieser Phase vorbereitet und gelagert werden für den Einsatz bei der Expansion und das Klonen von Primär-SMSC (zum Klonen Methode, siehe Abschnitt 2.1, Abbildung 1c f). Kulturen sind subkultiviert mit der Dispase-Methode (siehe Abschnitt 3.5).
- Klonal abgeleitet SMSC kann in vivo durch intramuskuläre Injektion (Abbildung 3.1 gk) 19 analysiert werden.
- Karyotypisierung kann auf klonal abgeleitet SMSC-Linien durchgeführt werden, um diploide Status zu bestätigen (siehe Abschnitt 2.2, Abbildung 3.1 l) 25.
- Diese Methode kann für die Kultivierung embryonaler Muskel (Abschnitt 3) angepasst werden.
2.1. Klonale Ableitung
Primäre Explantation Myoblasten Kulturen (Abb. 1a, b) sind ein nützliches und genaues Werkzeug für den Aufbau einer Vielzahl von verschiedenen Wachstums-Parameter in Wildtyp und Mutante Skelettmuskeln. Klonale Ableitung, die Isolierung einer Zelllinie, die aus einer einzigen Zelle, ist ein wesentlicher Schritt in die Isolation der Skelettmuskulatur Stammzellen und kann auch auf Subklon SMSC Linien mit RNAi-Konstrukten oder Transgene transfizierten verwendet werden. Gegründet SMSC und primäre Explantat Kulturen sind sehr Dichte abhängig und wird "crash "(detach aus der Schüssel und sterben), wenn bei einer zu niedrigen Zelldichte überzogen. Dies liegt daran, SMSC Freisetzung löslicher Faktoren, die benötigt, um Wachstum und das Überleben der Zelle zu erhalten sind. ein High-Density Kultur zu simulieren und liefern diese Faktoren bei der Klonen Prozess werden SMSC in Selbst-konditionierten Mediums geklont. Die Zugabe von konditioniertem Medium erwies sich als wesentlich, dass einzelne Zellen in einer isolierten Umgebung vermehren.
- Konditionierte Medium wird von proliferierenden SMSC für 48 h zwischen 33 und 75% Konfluenz gezüchtet vorbereitet.
- Die Medien, in denen diese Zellen gezüchtet werden, ist nach 48 h entnommen und mit Hilfe eines 0,2 &mgr; Spritzenfilter; dies gewährleistet die Sterilität des konditionierten Mediums und entfernt alle restlichen Zellen und Trümmer.
- Das konditionierte Medium wird in einem Verhältnis von 1:1 mit frischem Kulturmedium (Klonen Medium, siehe Anmerkung 10) gemischt und als Nährboden für einzelne Zelle Klonen verwendet.
- Um dies zu erreichen einzelne Zelle Verdünnungen Zellen dissoziiert zu einem einzigen Zellsuspension durch sorgfältige Trypsinierung (gegründet SMSC) oder Dispase Behandlung (Primär-Explantat-Kulturen) und verdünnt auf eine Konzentration von einer Zelle pro 100 ul Klonen Medium.
- 50 ul dieser Zellsuspension kann dann in jedem der Zentrum 60 Vertiefungen einer 96-well-Platte ausgestrichen werden.
- Cells dürfen durch Inkubation bei 37 ° C legen in 5% CO 2 für 6 h und jede Vertiefung wird dann sorgfältig auf das Vorhandensein von Zellen erzielt. Wells mit 0 oder mehr als eine Zelle in diesem Stadium abgezinst.
- Wells mit einem einzigen angeschlossenen Zelle werden sorgfältig notiert und der Kolonie von diesem einzigen Zelle abgeleitet wird sorgfältig überwacht (täglich während der ersten paar Tage), dass nur eine Kolonie, aus einer einzigen Zelle abstammen, vorhanden ist sicherzustellen. Zelllinien wurden nur aus Brunnen mit 1 Zelle abgeleitet. Abbildung 1c-e zeigt die Ausdehnung einer solchen einzigen Zelle abstammen Kolonie.
- Nachdem die Kolonie erreicht Zusammenfluss in der 96-Well-Platte kann es zu einer Vertiefung einer 48-Well-Platte subkultiviert werden.
- Die geklonten Zelllinien können dann vorsichtig in 24 erweitert werden - und 6-Well-Platten, bis genügend Zellen zur Verfügung Platte in eine 25 cm 2-Kolben sind.
- Die Skelettmuskulatur Ursprung dieser Kulturen können durch die Expression von Myf-5 (Abbildung 1f) oder andere Skelettmuskel-spezifischen Markern wie MyoD und Pax 7 demonstriert werden.
- In diesem Stadium Linien sind, bevor eine weitere Expansion eingefroren war (siehe Tabelle 1).
2.2. Karyotypisierung
Karyotypisierung ist eine wichtige Methode zur Überwachung Zellphänotyp. Zelllinien durch klonale Ableitung stammt, sollte karyotypisierten, um sicherzustellen, dass sie einen diploiden Chromosomensatz ohne grobe chromosomale Umlagerungen, die ihren Phänotyp beeinflussen könnten, zurückgehalten werden.
- Für Karyotypisierung Zellen zur späten exponentiellen Phase (80% konfluent) in 25 cm 2 Kulturgefäße (2 Tage nach Subkultivierung) gezüchtet, um den Anteil von mitotischen Zellen in der Kultur zu maximieren.
- Vierundzwanzig Stunden vor Karyotypisierung werden die Zellen mit 10 ml frischem Kulturmedium zugeführt. 0,2 ml 10 mg / mL Colchicin (siehe Anmerkung 11) wird dann auf die Zellen, die für eine weitere 1 h bei 37 inkubiert ° C.
- Nach 1 h werden die Zellen unter dem üblichen Trypsinierung Subkultur Verfahren, außer dass beide das Kulturmedium und PBS gewaschen werden beibehalten, um die Anzahl der mitotischen Zellen geerntet zu maximieren.
- Die dissoziierten Zellen, behielt mittel-und PBS Waschungen bei 1.000 g für 3 min zur Pelletierung der Zellen und der Überstand abgenommen und verworfen zu bleichen. Gesponnen
- Das Zellpellet wird dann in 5 ml von 0,0075 M Kaliumchlorid für genau 4 min resuspendiert, bevor Zellen wieder durch Zentrifugation pelletiert.
- Die meisten der Überstand wird abgesaugt, so dass eine geringe Menge (~ 50-100 ul) in das Rohr für die Resuspension. Die Zellen von flicking der Basis des Falcon-Röhrchen, bis eine Zellaufschlämmung erreicht ist. Die Zellen werden dann auf Eis gelegt und fixiert in frisch zubereiteten eiskaltes Fixativ (Methanol: Eisessig im Verhältnis 3:1) wie folgt: 10 ml Fixativ langsam zugetropft, um die Zellen mit einem kleinen Glas Pasteur Pipette ( Dies verhindert, dass Zellen verklumpen).
- Die Zellen werden auf Eis für 30 min gestellt und dann durch Zentrifugation pelletiert, nach der das Zellpellet in 0,5 ml frisches Fixativ resuspendiert.
- Slides sind, indem er die feste Zellsuspension auf die vorbereiteten Objektträger (siehe Abschnitt 3.2.2.1) in einem Winkel von 45 ° gehalten produziert. Um gut verteilte Metaphase sicher breitet sich die Pipette mindestens 30 cm über der Folie gehalten werden sollte.
- Zur Visualisierung Chromosomen sind Folien für 2 min in Leishmans Stain gefärbt, verdünnt mit drei Bände Gurr pH 6,8 kurz vor dem Gebrauch.
- Slides sind bei Raumtemperatur getrocknet und montiert in DePex Eindeckmedium.
2.2.1. Vorbereitung der Objektträger für die Karyotypisierung
- Glasobjektträger (Premium Objektträger, VWR International, UK) sind für den Einsatz in der Karyotypisierung Protokoll, indem man sie über Nacht in einem großen (Glas) Behälter mit Schwefelsäure hergestellt.
- Folien werden dann unter fließendem Wasser für 8 h gelegt und dann in 70% Ethanol gelagert, bis sie benötigt.
- Vor Gebrauch sollte Objektträger unter fließendem Leitungswasser für weitere 30 min und bei Raumtemperatur für 1-2 Stunden an der Luft getrocknet gespült werden
3. Gründung Primary Micro-Explantat-Kulturen aus Embryos
Drei Mausstämme wurden verwendet, um diese Methode, wild-type (C57BL/10) zusammen bestätigen Sie mit der mdx und CAV3KO (beide dystrophischen Mutanten). Das Dystrophin-defizienten mdx-Maus entstand spontan in C57BL/10 wurde diese Linie von der Bullfield Labor im Jahr 1991 gewonnen und ist seitdem kontinuierlich in unsere Inzucht Kolonie 26 gehalten. CAV3KO dystrophischen Mäusen, die eine Mutation im Caveolin-3-Gen enthalten, wurden auf die C57BL/10 Hintergrund für 10 Generationen, bevor sie in dieser Studie 27 verwendet gezüchtet. Jede Maus Linie erzeugt eine robust reproduzierbare Auswuchs, Proliferation und das Überleben Profil, das Embryonalstadium spezifische und für jedes Stammes wurde. Die folgenden Protokolle wurden für Embryonen aus Smith und Schofield PN (1994) 3, im wesentlichen wie in Merrick 21 angepasst.
3.1. Embryo-Entnahme
- Um inszeniert Embryonen sind paarweise als natürliche (1:1) Paarungen gesetzt und Frauen überprüft jeden Morgen auf Vaginalpfropf. Am Tag der Plug-Erkennung, sind Embryonen E0.5 Tage (12 h nach der Befruchtung) gezählt.
- Sobald Vaginalpfropf erkannt wurden die Männchen aus dem Käfig entfernt, um die Genauigkeit der embryonalen Inszenierung zu gewährleisten.
- Wenn die gewünschte embryonalen Stadium erreicht ist (E11.5 bis E17.5) der Mütter durch Genickbruch getötet werden, der Bauch ist rasiert, die Haut und Umgebung mit 70% Alkohol abgewischt und die Gebärmutter über einen Bauchschnitt entfernt horizontal unter Verwendung von sterilen Sezierbesteck.
- Die Gebärmutter ist dann noch einmal in primäre Explantat Kulturmedium (PECM), bevor sie in eine kleine Schale mit frischem PECM vor Dissektion platziert gewaschen.
- E11.5 bis E17.5 Embryonen aus der Gebärmutter mit einem Binokular präpariert und einzeln in Petrischalen mit PECM in Bereitschaft für detaillierte Mikrodissektion.
3.2. Embryo Mikrodissektion
- Individuelle Embryonen weiter seziert, um Gegenden, die reich in der Skelettmuskulatur (siehe Abbildung 2a) zu isolieren. Hind und Vorderbeine (hypaxial Skelettmuskulatur) werden, seziert sowie die oberen und unteren Körperpartien Wand (vorwiegend epaxialer Skelettmuskulatur). Dazu ein Schnitt entlang der Länge des Thorax, Abdomen und Becken ist geschaffen, um die inneren Organe des Embryos zu entfernen.
- Zur Bereicherung für die embryonale Skelettmuskelzellen Stammzellen (eSMSc), sind der Kopf, Wirbelsäule und alle inneren Organe dann entnommen.
- Bei älteren Embryonen (E15.5-E17.5 Embryonen) ist es auch möglich, Haut und Knorpel / Knochen wieder zu entfernen, um den Anteil der Muskelzellen in den Kulturen zu erhöhen.
3.3. Einrichten Embryo Microexplant Kulturen
- Sobald Vorderbeine, Hinterbeine und Ober-und Unterkörper Wände wurden herauspräpariert sie an die frische PECM platziert und weitere mikrodissezierten zu kleine Würfel von Gewebe von gleicher Größe (~ 0,5 mm 3; Abbildung 2a) zu produzieren.
- Diese microexplants werden dann in das Zentrum 60 Vertiefungen einer 96-Well-Platte (eine Explantation pro Well) mit 50 ul PECM pro Vertiefung gelegt. Ein Minimum von 60 Brunnen mit 1 Explantation pro etabliert sind, studierte pro Embryo.
- Für die Kultivierung der Embryonen Zentrum 60 Bohrlöcher kann in Regionen bezeichnet, wo das Explantat aus (Abb. 2b) abgeleitet wurde, unterteilt werden. Dieses Design ermöglicht 15 Quellen mit jeweils jeweils Vorderbein, Oberkörper Wand, Hinterlauf und Unterkörper Wand Explantate 21.
3.4. Überwachung Outgrowth
Outgrowth Rate ist ein zuverlässiges Maß für das Wachstum von embryonalen Skelettmuskelzellen Explantate und unter der sorgfältig kontrollierten Bedingungen hier beschriebene hohe Reproduzierbarkeit.
- Explantate werden bei 37 ° C und 5% CO 2 für 3 Wochen und erzielte am 3., 7., 14. und 21. Tag der Kultivierung mit einem inversen Mikroskop. Explantate werden nach der Höhe der Einmündung der Zellen in jedes Well (Abb. 3a, e) erzielt.
- Fotografische Bilder von Kulturen kann entnommen werden, z. B. mit einer SLR-Kamera an das Mikroskop angeschlossen und 100 ASA Fuji (Farbe) oder Kodak TMAX (schwarz und weiß) professionelle Film (Abbildung 3f).
- Ein SkelettMuskel-spezifische Antikörper, der spezifisch für Myf-5 lässt sich die Skelettmuskulatur Ursprung eSMSc zeigen, je nach Belastung 80 95% der Zellen isoliert mit dieser Methode sind Myf-5 positiv bewertet werden. Andere Marker wie MyoD und Pax 7 kann auch verwendet werden, um die Skelettmuskulatur Ursprung dieser Zellpopulationen zu demonstrieren. Während diese Zellen enthalten einen sehr hohen Anteil an embryonalen Stammzellen der Skelettmuskulatur nicht davon ausgegangen werden (vor allem für jüngere Embryonen) werden kann, dass sie alle der Skelettmuskulatur Ursprung oder dass sie alle Stammzellen sind. Zur Isolierung reinen Stammzell-Populationen ist es notwendig, klonal ableiten primäre Explantat Kulturen wie in Abschnitt 2.1 beschrieben.
3.5. Subkultivierung primären embryonalen Explantate
Sobald konfluent, Explantation Kulturen zeigt die morphologischen Merkmale der SMSC (Abbildung 3f) kann wie folgt 3, 21 subkultiviert werden:
- Kulturmedium wird aus den ausgewählten Brunnen, gefiltert durch eine 0,2 um Acrodisc R_ Spritze Filter entfernt und aufbewahrt für den Einsatz als konditionierte Medium. Das Medium kann bei 4 ° C für 1 Woche gelagert werden.
- 100 L Dispase 1:10 verdünnt in PECM wird in jede Vertiefung gegeben und die Platten dann wieder in die 37 ° C Inkubator für 20 min.
- Eine Pipettenspitze wird dann verwendet, um sanft kratzen die gelösten Zellen von der Oberfläche des Brunnens.
- Die Zellsuspension wird dann bei 1.000 g für 3 min zur Pelletierung der Zellen und der Überstand wird entfernt und weggeworfen zentrifugiert.
- Die Zellen werden in 200 ul der 1:1-Mischung aus konditioniertem Medium und PECM resuspendiert.
- Die Zelle Mix ist auf 48-Well-Platten für die weitere Expansion übertragen.
- Für In-vitro-Analyse-Zellen können in einer Dichte von 5 x 10 3 Zellen / cm beschichtet werden 2 entweder in 48-Well-Platten (jeweils mit einer 9 mm 2 sterile Deckglas) oder in 8-well-Glas-Kammer-Objektträgern. Zur Unterscheidung Analyse Zellen werden über Nacht auf 50-60% Konfluenz gezüchtet, bevor sie zu einer Differenzierung permissive Medium übertragen werden (siehe Abschnitt 4 für die in vitro-Methode Details) für 3 Tage, vor der Fixierung.
4. In-vitro-Analyse der Skelettmuskulatur Stem Cells and Primary Kulturen
4.1. Vorbereitung der Zellen
- Dispase subkultiviert (§ 3,3) primäre embryonale Explantation Kulturen sind in PECM / konditioniertem Medium auf Deckgläschen in 48-Well-Platten mit einer Dichte von 3 x 10 3 Zellen / cm 2 beschichtet und erlaubt zu befestigen.
- Für die Beurteilung der Apoptose und Proliferation Deckgläser sind zweimal in PBS gewaschen, in 4% Paraformaldehyd fixiert (siehe Abschnitt 4.2) in PBS für 20 min bei Raumtemperatur, gefolgt von weiteren 10 min PBS waschen.
- Deckgläser vorbereitet auf diese Weise bei 4 ° C gelagert werden kann für bis zu 1 Woche in PBS oder PBS / Glycin.
4.2. Vorbereitung der Paraformaldehyd-Fixativ
- In einer Abzugshaube, wiegen 4 g Paraformaldehyd (PFA; Sigma-Aldrich, UK) und fügen Sie eine Glasflasche von 100 ml steriler PBS mit einem Magnetrührer. Eine Gesichtsmaske und Handschuhe sollten zum Schutz getragen werden.
- In einer Abzugshaube, ist die Lösung erhitzt und ständig gerührt auf einem magnetischen Heizplatte erwärmen, bis das Pulver vollständig gelöst. Dies dauert ca. 5-10 min bei 65 ° C. Es muss darauf geachtet, die Temperatur steigt über 70 ° C zu verhindern, da die Gefahr besteht, der Lösung explodiert bei hohen Temperaturen.
4.3. Apoptose und Proliferation Assay
- Feste Deckgläser (hergestellt wie in Abschnitt 4.1) werden mit 10 ug / ml DAPI für 3 min gefärbt.
- Deckgläser werden einmal in PBS (5 bis 10 min) gewaschen und umgedreht auf einem Fleck Vectashield Eindeckmedium auf einem Glasträger 17, 18.
- Die Ränder des Deckglases mit Nagellack (siehe Anmerkung 12) abgedichtet.
- Für die Lagerung sind Folien in Folie gewickelt und bei 20 ° C.
- Zum Zählen sind Folien unter Fluoreszenz (UV-Filter) auf einem aufrechten Mikroskop betrachtet und erzielte für apoptotischen und mitotischen Zellen mit Hilfe eines Okular-Strichplatte. Zwanzig zufällig verteilte Netze sind gezählt (dies entspricht ca. 1.000 Zellen), und die Zellen sind morphologisch als nicht-apoptotische, apoptotischen oder mitotische (Abbildung 3 g) aus.
- Mitotischen und apoptotischen Indizes werden als Anteil der gesamten Zellen berechnet.
4.4. Immunhistochemie
Zellen auf Deckgläsern fixiert werden auch für die Immunhistochemie verwendet werden. Für Antigen-Retrieval mit einem Dampfkochtopf Deckgläser müssen fest auf Glasplättchen mit Standard-Büroklammern befestigt werden. Immunfärbung kann zur wuchernden Zellen zu identifizieren, mit einem Antikörper gegen Ki67 (1.1, 000 Verdünnung), um ihre Identität festzustellen, mit einem Antikörper gegen Myf-5 (1.1, 000 Verdünnung), oder um die Genexpression zu untersuchen (sieheAbschnitt 4.5). Immunfärbung kann mit Hilfe einer Reihe von Methoden, die folgenden (beschrieben in (28, 29)) wird routinemäßig von den Autoren verwendet werden:
- Natriumcitratpuffer ist in den Schnellkochtopf vorgewärmt. Für Antigen-Retrieval, sind Folien mit geschnittenen Gewebe in den beheizten Puffer gelegt und unter Druck erhitzt für 2 min. Der Druck wird durch striktes Festhalten der Schnellkochtopf Deckel und das Inverkehrbringen Gewicht erreicht. Sobald die 2 min Retrieval Zeit abgelaufen den Schnellkochtopf wird dann sorgfältig unter fließendem kaltem Wasser, um den Druck zu reduzieren platziert. Um zu verhindern, der Puffer Aufkochen, sollte darauf geachtet werden, um den Deckel zu entfernen, bis der Druck mit dem atmosphärischen Druck ausgeglichen hat. Der Druck ist ausreichend reduziert, wenn das Gewicht leicht entfernt werden kann (ohne Gewalt) und der Deckel entfernt werden. Folien werden dann aus dem Puffer entfernt und gewaschen in Raumtemperatur PBS für 10 min.
- Folien werden durch Eintauchen in 3% Wasserstoffperoxid / Leitungswasser für 5 min und dann dreimal in PBS pre-blocked + 0,05% Tween 20 (10 min pro Waschgang).
- Blocking wird durch eine 30 min Inkubation in TNB Blockierungspuffer (im Lieferumfang enthalten in TSA-Kit) bei Raumtemperatur erreicht.
- Primärer Antikörper ist in TNB Puffer, um die geeignete Verdünnung (der sich aus der Titration, siehe Anmerkung 12) verdünnt und über Nacht bei 4 ° C (oder alternativ 1 bis 2 h bei Raumtemperatur).
- Nach drei 10 min Waschen in PBS + 0,05% Tween 20, sind Folien für 1 h bei Raumtemperatur in die entsprechenden biotinylierten zweiten Antikörper in TNB-Puffer inkubiert.
- Nach drei weiteren 10 min Waschen in PBS + 0,05% Tween 20, sind Folien für 30 min in Streptavidin-HRP (sofern in der TSA-Kit) 1:100 verdünnt in TNB-Puffer inkubiert und anschließend dreimal gewaschen (10 min jeweils) in PBS + 0,05% Tween 20.
- Biotinyl Tyramid (Amplifikationsreagenz; TSA Kit) wird dann zu jedem Abschnitt, um zwischen 8 und 15 min (die genaue Zeit soll durch Optimierung Experimenten gewonnen werden) aufgenommen.
- Nach Amplifikation Dias dreimal gewaschen (10 min jeweils) in PBS + 0,05% Tween 20 und dann für 30 min in SA-HRP.
- Nach drei weiteren Waschungen (10 Min.) in PBS + 0,05% Tween 20, visualisieren mit 3,3 _-Diaminobenzidintetrahydrochlorid Chromogen (DAB) für 5 bis 10 min. Führen Sie dann zwei abschließenden Waschschritten in Wasser vor Gegenfärbung Dias in Hämatoxylin und Eindecken. DAB ist ein bekanntes Karzinogen und sollten mit Vorsicht behandelt werden (wie Colchicin, Abschnitt 3.2.2).
4.5. Differenzierung
- SMSC auf Deckgläser oder Kammer-Objektträgern ausplattiert (siehe Anmerkung 13) kann auch vor der Fixierung für Myotuben Analyse unterschieden werden.
- Für diese Experimente Zellen werden bei einer Dichte von 10 4 / cm 2 beschichtet und erlaubt, für 6 bis 8 h. legen
- Die Zellen werden dann in der Differenzierung permissiven Bedingungen für 3 Tage (siehe Anmerkung 14).
- Differenzierung Medium DMEM komponiert + 0,5% FCS mit 2% Pferdeserum und 1% Glutamin. Diese Differenzierung permissive Kulturmedium in 48 h Intervallen ausgetauscht.
- Deckgläser werden dann in 4% Paraformaldehyd wie oben (§ § 3.4.1 und 3.4.2) fixiert.
4.6. Die Transfektion von SMSC: Expression der Transgene und shRNAi Konstrukte
Stammzellen und primären Kulturen sind refraktär Transfektion und mit einer Mehrheit von Methoden der Transfektion Rate in SMSC und primären Skelettmuskelzellen ist sehr gering (<10%), Verhinderung der Nutzung des transienten Transfektion Methoden. Um dies zu überwinden hat es gängige Praxis in unserem Labor zur klonalen Derivate von Transgen transfizierten Kulturen (siehe Abschnitt 3.2.1) nach der Transfektion mit Calciumphosphat oder Lipofectamin isolieren. Alternativ Zellen effizient transfiziert werden mit Infektion viral verpackten Konstrukte. Abbildung 1 m zeigt eine stabile Expression von β-Galactosidase in PD50A, eine klonale SMSC derivative unter G418-Selektion nach Infektion mit pIRV, eine Replikation isoliert defekte Retrovirus tragen die Gene für neo/G418 Widerstand und β-Galactosidase (19). Diese Zelllinie wurde verwendet, um formal zeigen, dass SMSC als funktionelle Stammzellen in vivo verhalten (siehe Abbildung 3.1). Während die Erzeugung eines stabilen klonale Zelllinie ein Marker-Gen ist wünschenswert, dass in vivo Stammzelltransplantation Experimente, es ist ein zeit-und unbefriedigende Methode zur Analyse von Genfunktionen in vitro. Aus diesen Gründen haben die Autoren kürzlich eine optimierte Modifikation des Lipofectamine 2000 Transfektionsreagenz die in der Lage zu liefern Transfektionsraten von 60 bis 70% entwickelt. Dies ermöglicht die Analyse von Genfunktionen mittels transienter Transfektion von Transgenen oder RNAi-Konstrukten in SMSc oder primäre Explantat Kulturen (Abbildung 3h, i). Die Autoren verwenden eine kurze Haarnadel-RNA-Vektor (pSHAG RNAi) (30) zu shRNAi Konstrukte in der Lage Gen-spezifischen Ausrichtung der mRNA-Expression in SMSC zu generieren. Der Erfolg der shRNAi Technik beruht auf zwei Elementen: (a) eine effiziente Transfektion Methode und (b) den Entwurf einer kurze Haarnadel-Sequenz, die spezifisch erkennt das Zielgen. Ein shRNAi konstruieren gerichtet eGFP verwendet werden, um die RNAi-Knockdown-Methode (Abbildung 3j, m) zu validieren.
4.7. Optimierte LipofectamineTM 2000 Transfektionsprotokolls für SMSC
- Die Zellen werden mit 5 bis 10 April Zellen / cm 2 in die Kammer gleitet in 250 ul DF10 Kultur ausplattiert und kultiviert für 18 h bis 95% Konfluenz (optimal Zusammenfluss für jede Zelllinie wurde von der Beurteilung der Transfektion Preise in unterschiedlichen Dichten hergestellt) zu erreichen.
- Für jeden gut ist 0,5 ug DNA (shRNAi Vektoren, Transgene) auf 33 ul Serum-freiem DMEM mit 2 mM Glutamin und schonend in ein steriles Eppendorf-Röhrchen gemischt.
- Für jeden gut, ist 1,25 uL Lipofectamine 2000 separat in weiteren 33 ul Serum-freiem Medium DMEM + Glutamin verdünnt, vorsichtig gemischt und aufbewahrt bei Raumtemperatur für 5 min
- Die DNA-und Lipofectamin Mixe sind dann schnell zusammen, fügte sanft für 60 s durch Pipettieren gemischt und dann bei Raumtemperatur für 19 min inkubiert, damit DNA Lipofectamine 2000 Komplexe zu bilden.
- Für die Transfektion von 66 ul der komplexen Mischung zu jeder Kammer gut und fügte hinzu Folien sind leicht für 10 s rockten eine gleichmäßige Verteilung der Komplexe zu gewährleisten.
- Die Zellen werden für 24 bis 72 h bei 37 ° C und 5% CO 2 inkubiert. Je nach Konstruktion, funktionelle Genexpression oder shRNAi Zuschlag wird zunächst zwischen 8 und 24 h nach der Transfektion nachgewiesen werden.
5. Repräsentative Ergebnisse
Als Explantate sorgfältig aus adulten Skelettmuskel oder aus Embryonen explantierten die Explantate beginnen die Zellen innerhalb von wenigen Stunden bis zu 72 Stunden nach der Inkubation bei 37 ° C (5% CO 2 / Luft) (Abbildung 3A). Generieren Die Zeit für diese auftreten, hängt von der Quelle der Explantate: embryonale Explantate werden schneller als ältere Erwachsene Skelettmuskulatur Explantate hinauswachsen. In unserer Erfahrung das Timing der Auswuchs ist hoch reproduzierbare 3, 29. Expansion der Zellpopulation wird über einen Zeitraum von Tagen (Embryo-Explantaten) oder Wochen (ältere Skelettmuskulatur Explantate) auftreten, um hohe Dichte Aggregation SMS Zelle primären Kulturen zu erzeugen (siehe Abbildung 3B-F zur Illustration dieser Kulturen). Abbildungen 1 & 3 zeigen repräsentative Ergebnisse für die erfolgreiche Gewinnung und Kultur der Skelettmuskulatur und embryonalen Explantate, klonale Ableitung und in vivo Transplantation von Skelettmuskel abgeleitet adulten Stammzellen, β-Galactosidase Kennzeichnung, Karyotypisierung und myf-5 Immunhistochemie von embryonalen SMSC zur Skelettmuskulatur Ursprung der Veranschaulichung . der Zellpopulationen Abbildung 3 zeigt ein repräsentatives Ergebnis der Auswuchs Scoring (mit Myf-5 Immunhistochemie auf SMSC visualisieren), die Morphologie der embryonalen Muskel Primärzellen, DAPI-Färbung für die Apoptose und die shRNAi Transfektionsprotokolls. Weitere Details finden Sie in der Abbildung Legenden im Zusammenhang mit diesen beiden Figuren. Abbildung 2 zeigt das Verfahren aus Embryo-Mikrodissektion angereichert Populationen von embryonalen Stammzellen der Skelettmuskulatur zu generieren.
Tabelle 1: Berechnung Tabelle, um die Anzahl der Kryoröhrchen für maximalen Lebensfähigkeit der Zellen während der Zellteilung eingefroren erforderlich unten Protokolle Schätzung
| Plate / Flask / Chamber Slide | Volumen des Kulturmediums | PBS waschen | Volume von Trypsin | Anzahl der Frost sich Ampullen (3.1.2) |
| 96-Well- | 50 ul | 2 X 100 ul | 25 ul | N / A |
| 48-Well- | 150 ul | 2 X 200 ul | 50 ul | N / A |
| 24-Well- | 500 ul | 2 x 700 ul | 200 ul | N / A |
| 6-well | 3 ml | 2 X 3 ml | 500 ul | 1 |
| Kleine (25 cm 2) | 10 ml | 2 X 10 ml | 1 mL | 2 |
| Medium (80 cm 2) | 10 ml | 2 X 10 ml | 3 ml | 4 |
| Large (175 cm 2) | 10 ml | 2 X 10 ml | 5 ml | 8 |
| Kammer auch | 500 ul | 2 X 500 ul | 100 ul | N / A |
N / A = nicht anwendbar; Zellzahlen waren zu niedrig, um freeze nach unten, wenn mehrere Brunnen wurden zusammen eingefroren.
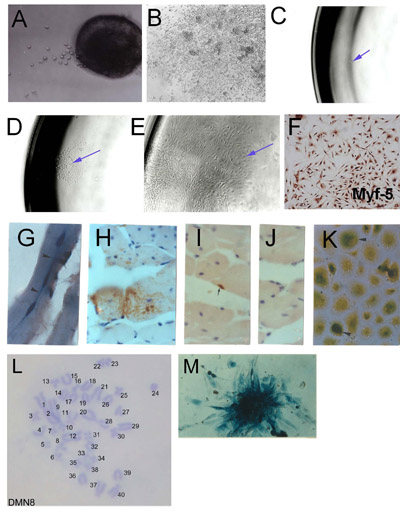
Abbildung 1. Isolation der Skelettmuskulatur Stammzellen (SMSC) von microexplants: (A) Frühe Auswuchs aus explantierten Erwachsenen Skelettmuskel (Tag 2) (B) gegründet Explantation Auswuchs zeigt aggregierte Kulturen und hoher Zelldichte.. Klonale Ableitung von SMSC. (C) Single-Zelle in eine 96-Well-Platte isoliert. (D) Colony einzelner Zellen zurückzuführen. (E) gegründet Klonpopulation. (F) Überprüfung der SMSC Identität mit Myf-5 Immunhistochemie. Zellen von SMSC Klon PD50A (Ausdruck β-Galactosidase) in Host-Mäusen nach 3 Monaten (G) und (HJ) abgeleitet 14 Monate nach der Injektion von 2.000 PD50A Zellen in Maus-tibialis anterior. (G) Drei kürzlich fusioniert (zentral gelegene Kerne ) β-Galaktosidase-positiven Zellen (Bläue) in Muskelfaser (Längsschnitt). (H) Umfangreiche Beitrag der β-Galaktosidase-positiven Zellen (braune Verfärbung, die von anti-β-Galactosidase-Antikörper) in Muskelfasern (Querschnitt ). (I) β-Galactosidase-positive Satelliten-Zelle (braune Verfärbung, die von anti-β-Galactosidase-Antikörper). (J) Sekundäre Antikörper-Kontrolle (keine Färbung). (K) β-Galactosidase-positiven Zellen (Bläue) vermehren sich in Kultur, wenn sie von injiziert Host Muskeln isoliert 12 Monate nach der Injektion. (L) Karyotyp einer Maus klonale SMSC-Linie (DMN8) zeigt normalen diploiden Chromosomensatz. (M) Histochemie zeigt β-Galaktosidase-Expression in einer Kolonie von PD50A Zellen ( Abbildung 3.1 g, k, mit freundlicher Genehmigung von AACR drücken, Smith und Schofield, 1997) wiedergegeben.
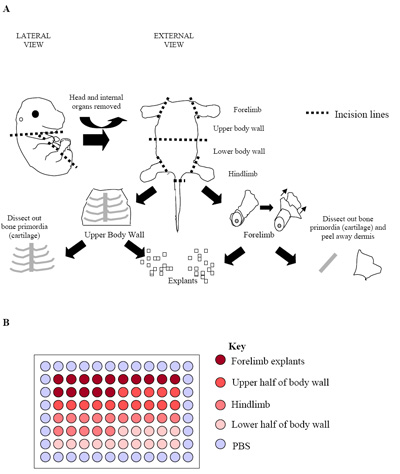
Abbildung 2. (A) Illustration des Embryos Dissektion Prozess. Die Figur stellt einen E15.5 Embryos, wo Knochen Ur (Knorpel) leicht identifiziert werden können und frei präpariert der umliegenden Skelettmuskulatur. In diesem Stadium, und in späteren Embryonen (E15.5 E17.5) wurde Dermis auch entfernt werden, um den Anteil der Skelettmuskelzellen erhalten zu maximieren. (B) Setup der primären Explantation Kulturen in einer 96-Well-Platte. Jeder Embryo wurde verwendet, um eine Platte wie oben gesehen zu produzieren. Übliche Praxis ist mit der Platte Replikate von drei separaten Embryonen (drei Platten = 180 Brunnen) zu Auswuchs Preise zu etablieren.
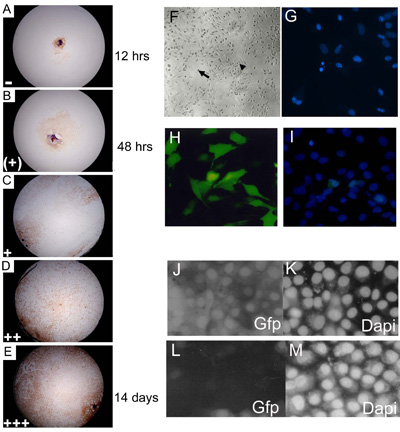
Abbildung 3. Embryonale primäre Explantat Kulturen wurden bei 3, 7, 14 und 21 Tagen der Kultur erzielt und zugeordnet ein Auswuchs Ebene Vertreter der Einmündung Ebene. (AE) C57BL10 E15.5 primären embryonalen Explantation Kulturen mit Myf-5 gefärbt, um 0 14% () veranschaulichen; 15 24% (+); 25 49% (+); 50 74% (++); 75 100% ( + + +) Ebenen der Mündung. Vor Erhebung von Daten, der Anteil der Brunnen zeigt jede Ebene der Auswuchs (an jedem Tag des Scoring) wurde von einer beliebigen Anzahl (; (+) = 2;; + = 3 + + = 4 und + + + = 5 = 1) multipliziert zu einer endgültigen Auswuchs Wert zu geben. Etwa 85% der Wildtyp (C57BL/10) primäre eSMSc für die Skelettmuskulatur Zellmarker Myf-5-Färbung. Die Vergrößerung ist 10. (F) gegründet embryonalen Kulturen haben die morphologischen Merkmale der Erwachsenenbildung SMSC, bipolare Zellen (kleiner Pfeil) und sphärische monomorphe Zellen (großer Pfeil). (G) Identifizierung von Fragmentierung apoptotischen Kernen mit DAPI-Färbung. (HALLO) Hohe (~ 75%) der Transfektion eines GFP-exprimierende Konstrukt in SMS-Zelllinien mit der optimierten Lipofectamine 2000 Transfektionsmethode. (I) Zählen von insgesamt Zellzahl wird durch DAPI Gegenfärbung unterstützt. RNAi mit pSHAGshRNAigfp (JM) hebt die GFP-Expression in SMSC (siehe (29) Ein Beispiel für diese als Kontrolle verwendet Konstrukt). (J) Control (Mock-Transfektion) zeigt die GFP-Expression in einer GFP SMSC Linie. (K) DAPI-Steuerung . (L) shRNAiGfp 24 h nach der Transfektion. (M) DAPI-Steuerung für shRNAiGfp transfizierten Zellen in (L).
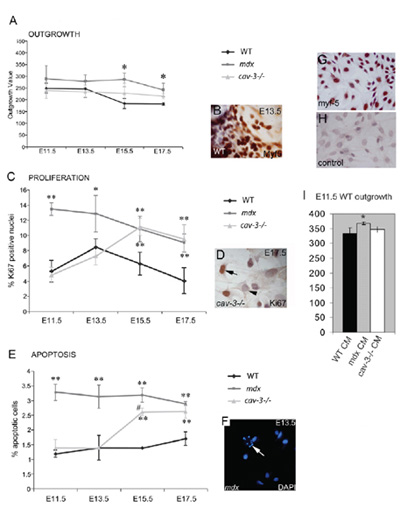
Abbildung 4. Dystrophischen, embryonale Myf5-positive Myoblasten sind hyperproliferative und anfällig für Apoptose. (A) Der Auswuchs von embryonalen Myoblasten aus dem Muskel Explantation Kultur is erhöht sowohl in mdx-Mutanten aus E11.5 und in cav-3 (-/-) Mutanten bei E15.5 und E17.5, wenn sie mit WT Explantaten in parallel kultivierten verglichen. (B) A Myf5-immungefärbt Explantation. (C) Hyperproliferation von embryonalen Myoblasten in mdx-Mutanten aus E11.5 und in cav-3 (-/-) Mutanten aus E15.5, wie Ki67-positive Immunreaktivität (D) bestimmt. (E) Erhöhte Apoptose von E11.5 in mdx Embryonen und von E15.5 in cav-3 (-/-) Embryonen, wie durch DAPI-Färbung (F) gezeigt, der Pfeil in F weist auf eine apoptotische Zelle. * P <0,05 im Vergleich mit WT; ** p <0,01 im Vergleich mit WT; * p <0,05 beim Vergleich mdx mit cav-3 (-/-) (G, H) E15.5 Primär kultivierte WT embryonalen Myoblasten mit Myf5 Färbung. (G) und ein zweiter Antikörper-Steuerung (H). (I) Der Auswuchs von E11.5 WT Explantaten erhöht (* p <0,05) in E11.5 mdx Explantat-konditioniertem Medium (CM), aber nicht in cav-3 (-/-) oder WT CM. Fehlerbalken zeigen sd Diese Zahl unter Autoren urheberrechtlich reproduziert wird und wurde erstmals von der Gesellschaft von Biologen in Merrick et al., 2009 veröffentlicht.
6. Notes: kritische Schritte und mögliche Änderungen
- Wenn aufgetauten Zellen haben bei sehr niedrigen Zelldichte befestigt ist es ratsam, nur ersetzen die Hälfte der mittel-bis Kultur Absturz zu verhindern.
- SMSC von dystrophischen Muskel isoliert sind anfällig für Apoptose und darf nur mit besonderer Sorgfalt behandelt werden. Dystrophischen SMSC (wie die dfd-13-Zelllinie, die aus der Skelettmuskulatur erhalten von 5-Wochen alten dystrophen (MDX)-Mäusen festgestellt wurde) sollte bei höheren Zelldichten als üblich für Myoblasten angebaut werden. Solche Apoptose-sensitive Zelllinien sind auch bei höheren Dichten (siehe Abschnitte 1.1 und 1.2) (19) kryokonserviert.
- Eine alternative Methode zur Entfernung von Zellen aus einer Monoschicht nutzt Dispase, die eine schonendere Methode der Zelle Dissoziation bietet, mit dem Vorteil, dass es in Gegenwart von FCS und Kalzium (beide in DF10) durchgeführt werden. Dispase kann daher Subkultur verwendet werden und erweitern primäre Skelettmuskulatur Explantation Kulturen und EarlyStage SMSC-Klone (siehe Abschnitte 2 und 3).
- Für größere Flaschen die Menge der Trypsin / EDTA verwendet werden soll aufgestockt werden wie folgt: 75 mm 2 Kolben (3 ml Trypsin) und 175 mm 2 Kolben (5 ml Trypsin). Auch für kleinere Flächen reduzieren die Menge an Trypsin verwendet werden (siehe Tabelle 1).
- Alternativ Dissoziation überwacht werden können mit einem inversen Mikroskop, ist dies für Anfänger zu empfehlen.
- Kryokonservierung von Zelllinien wird in der Regel mit einer konfluenten großen (175 mm 2) Kunststoff Behälter durchgeführt. Zwischen 7 und 9 Kryoröhrchen können von einem so großen Schiff erreicht werden, je nach dem Überleben Profil der Zelllinie wird kryokonserviert. Primäre Kulturen und neu etablierten Zelllinien sind oft sehr refraktär einfrieren Festlegung von Verfahren. Zur Verbesserung der Genesung und der Erfolg des Einfrierens sich solche Zellen zwei Ansätze verwendet werden (einzeln oder in Kombination) werden kann. (A) Die FCS-Gehalt der freeze unten Gemisch aus 10% (bis maximal 50%) erhöht werden. (B) Die Freeze-down-Prozess kann durch Platzieren Kryoröhrchen in der Gasphase von N2 für 12-24 h vor der Übertragung Fläschchen in die flüssige Phase verlangsamt werden.
- Ein bequemer Weg, um einen festen Sitz der haemacytometer Deckglas Prüfung wird für das Newton-Ringe (Regenbogen Spiegelungen im Glas) auf dem Deckglas oder alternativ auf die haemacytometer kopfüber halten über eine offene Hand zu suchen.
- Eine Variation der Explantation Methode kann für die kurzfristige Kulturen für den Einsatz in der Immunhistochemie, Proliferation oder Apoptose-Assays eingesetzt werden. Mikrodissezierten Explantate auf Glas mit 8-Well-Kammer-Objektträgern platziert. Eine alternative Methode ist die Verwendung von 9 mm 2 Deckgläschen in 24-Well-Platten gelegt. In beiden Fällen zwei Explantate werden in jede Vertiefung in 150 ul DF20 Medium übertragen. Alternativ können primäre Kulturen von der Dispase Methode subkultiviert werden und hinaus auf Deckgläschen in 24-well Platten oder direkt in 8-Well-Kammer-Objektträgern ausgestrichen.
- Für die quantitative Analyse der Auswuchs Preise mindestens 60 Bohrlöcher mit 1 Explantation pro etabliert sind, pro Muskelgruppe / Maus-Stamm. Um das Wachstum Parameter für einen Stamm an mindestens drei verschiedenen Tieren verwendet werden muss etablieren. Platten und einzelnen Vertiefungen sind nicht gefüttert, während Auswuchs wird erzielt wurde.
- Für das Klonen etabliert SMSC Linien ist es ausreichend, Kultur Einzelzellen in einer 1:1-Mischung aus konditioniertem Medium und DF10 Medium. Für die Haupt-Explantate ist es notwendig, das Serum Inhalt des Kulturmediums auf 20% zu erhöhen.
- Colchicin ist sehr giftig und krebserregend und sollte mit entsprechender Vorsicht behandelt werden. Doppelbehandschuhung und Arbeiten in den Grenzen eines bestimmten Fach ist von wesentlicher Bedeutung. Alle Verbrauchsmaterialien (dh GilsonSpitzen) werden in ein Becherglas von Bleiche gelegt (5% Natriumhypochlorit) über Nacht vor der Entsorgung mit reichlich Wasser die fol-genden Tag.
- Wir verwenden derzeit primäre spezifische Antikörper Ki67 und Myf-5 jeweils bei 1 / 1, 000 Verdünnung. Die optimale Verdünnung der primären Antikörper muss empirisch für jeden Antikörper verwendet und im Idealfall auch für verschiedene Chargen des gleichen Antikörper nachgewiesen werden, auch wenn sie aus derselben Quelle erhalten.
- Chamber Slides können auch für diesen Test verwendet werden. Vor der Befestigung Zellen in 4% PFA, wird das Kulturmedium entfernt und die Zellen zweimal mit 37 ◦ C sterile PBS. Die gut Kammern, sind Dichtung und Kleber entfernt und die Objektträger in einer 50 ml Glas Coplin Gefäß mit frisch zubereiteten 4% Paraformaldehyd bei Raumtemperatur, die dann sanft auf einem Gyro-Rocker R_ Schüttler für 25 min gerockt platziert. Folien werden dann zweimal in PBS gewaschen (Raumtemperatur) und entweder sofort verwendet oder gespeichert in PBS bei 4 ◦ C (kurzfristig, 1-2 Wochen) für immunhistochemische (IHC) Analyse.
- Wenn umfangreichere Myotuben Bildung ist erforderlich, primäre Skelettmuskelzellen kann für bis zu 8 Tage differenziert werden.
Diskussion
Mikrodissezierten Explantation Kulturen lassen sich zuverlässig und reproduzierbar zu isolieren Zellpopulationen mit einem sehr hohen Anteil (~ 85%) der proliferative Myf-5 positive Skelettmuskulatur Stammzellen (SMSC) werden. Unter dem streng kontrollierten Kulturbedingungen hier beschriebenen primären Explantation Kulturen verwendet werden, um das Wachstum Verhaltensweisen genetisch mutierte Maus SMSC charakterisieren und kann als ein Mittel zur Erzeugung von Myotuben für detaillierte In-vitro-Analyse der Differenzierung Prozesse verwendet werden. Sorgfältige Pflege und Handhabung von diesen Kulturen ermöglicht langfristige Kultur und Expansion. Mit den hier beschriebenen Methoden ist es auch möglich abzuleiten klonale Skelettmuskulatur Stammzelllinien aus Explantat Kulturen durch einzelne Zelle Verdünnung. Um die Verbreitung von isolierten Einzelzellen während der Klonierung, "konditionierte Medium" wird verwendet, um den normalen Bedarf an diesen Zellen für High-Density-Kultur nachahmen zu erreichen. Das Verfahren ist anwendbar (mit Änderungen) zu embryonalen, Erwachsenen und alten-adulten Geweben und zusätzlich zu Maus kann verwendet werden, um Zellen aus der Skelettmuskulatur von anderen Tierarten einschließlich des menschlichen (Rao und Smith, unveröffentlicht), Hühnerembryo und Fisch zu isolieren ( Lachs) 24. Klonal abgeleitet SMSC kann in vivo durch intramuskuläre Transplantation analysiert und unter diesen Bedingungen injiziert SMSC mit Host Myotuben zu kombinieren, um Hybrid-Muskelfasern zu bilden. Intramuskulär injiziert SMSC bilden keine Tumoren und haben in Host Muskeln in der Satelliten-Zell-Position mehr als ein Jahr nach der Injektion gefunden, was darauf hindeutet, dass sie einer endogenen Kontrolle durch den Satelliten-Stammzellen niche.These Zellen können aus injiziert wieder isoliert werden Gastgeber als proliferative SMSC mehr als 12 Monate nach Host-Injektion 19.
Offenlegungen
Danksagungen
Wir danken Patrick Paddison für seine Gabe des shRNAi Shuttle-Vektor. Angela Sloan erwirtschaftete das GFP RNAi Bild in Abbildung 3. Wir danken auch den folgenden Geldgebern für ihre Unterstützung:
Muscular Dystrophy Campaign Grantnummer RA2/592/2; SPARKS Grantnummer 02BHM04, The Royal Society Grantnummer 574006.G503/1948./JE und BBSRC Grantnummer 6/SAG10077.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
Referenzen
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten