Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Erzeugung von rekombinanten Influenza Virus von Plasmid-DNA
In diesem Artikel
Zusammenfassung
Rettung von Influenza A-Viren von Plasmid-DNA ist eine grundlegende und wichtige experimentelle Technik, die Influenza-Forscher an rekombinanten Viren zu erzeugen, um mehrere Aspekte in der Biologie des Influenza-Virus zu untersuchen und als potentielle Vektoren oder Impfstoffe verwendet werden können.
Zusammenfassung
Die Bemühungen durch eine Reihe von Influenza Forschergruppen haben maßgeblich an der Entwicklung und Verbesserung von Influenza A-Virus durch reverse Genetik. Ursprünglich im Jahr 1999 gegründet
Protokoll
1. Influenza-Virus zu retten Transfektion
Influenza A-Virus gehört zur Familie der Orthomyxoviridae negativen RNA-umhüllte Viren. Das Influenza-A-Virus-Genom besteht aus acht verschiedenen RNA-Gene von negativer Polarität, dass codieren mindestens 4 11 virale Proteine (Abbildung 1). Wir konzentrieren wird, in diesem Bericht über die Rettung eines der am häufigsten Laborstamm, Influenza A/PR/8/34, 5 mit AmbiSense Plasmide (PDZ) mit der 8 Influenza A/PR/8/34 viralen Segmente ( Abbildung 2).
Für die Rettung von rekombinanten Influenza-Viren von Plasmid-DNA, empfehlen wir 3 unabhängige Transfektionen pro rekombinanten Virus. Wenn mehr als ein rekombinantes Virus zu retten versucht wird, Skala die folgenden Schritte accordantly, um die Anzahl von Viren, gerettet zu werden. Die nach der Transfektion und Infektion Protokoll ist für 6-well-Platten hergestellt. Eine schematische Darstellung des Protokolls ist in Abbildung 3 dargestellt.
- OptiMEM-Lipofectamine 2000 (LPF2000) Mischung: Prepare 250 ul OptiMEM Medien und 6-8 pl LPF2000 pro Transfektion. Inkubieren für 5-10 Minuten bei Raumtemperatur (RT). Unterdessen bereiten sich die Plasmid-Transfektion Mischung.
- Plasmid-Transfektion Mischung: Bereiten Sie die Plasmid-Transfektion Cocktail in 50 ul OptiMEM Medien. Wir verwenden normalerweise 1 pg jedes Influenza-DNA-Plasmid pro retten. Add 1 ul der PDZ-Plasmiden (bei 1 ug / ul) PB2, PB1, PA, HA, NP, NA, M und NS in ein Röhrchen mit 50 ul OptiMEM Medien.
- OptiMEM-LPF2000-DNA-Plasmid-Gemisch: In 250 ul aus Schritt 1.1 in die Influenza-DNA-Plasmid-Transfektion Mischung (Schritt 1,2). Inkubieren Sie diese Mischung für 20-30 Minuten bei RT. In der Zwischenzeit bereiten Suspensionen von 293T und MDCK-Zellen für die Transfektion.
- Vorbereitung der 293T/MDCK Co-Kultur: Bevor Sie beginnen, bringen die PBS 1X, DMEM 10% FBS 1% PS Medien und EDTA-Trypsin-Gemisch auf 37 ° C. Die Dichte der Zellen sollte bei 80-90% Konfluenz Tag der Transfektion werden. Normalerweise kann man konfluenten 100 mm Schale von 293T und einem konfluenten 100 mm Schale von MDCK-Zellen für 10-12 verwendet werden rettet. Wir werden 250 ul Zellen pro Vertiefung verwendet werden. Beide Zelllinien werden in insgesamt 3 ml DMEM 10% FBS 1% PS resuspendiert werden.
- Vorsichtig resuspendieren jeder Zelllinie in 10 ml DMEM 10% FBS 1% PS in einem 15 ml Zentrifugenröhrchen. Sie haben eine Röhre für 293T-Zellen und eine Tube für MDCK-Zellen.
- Resuspendieren 293T-Zellen in 3 ml DMEM 10% FBS 1% PS und wenn resuspendiert, liefern die 3 ml der MDCK-Zellen, diese Zellen zu resuspendieren. Dadurch erhalten Sie die Mischung aus 293T und MDCK-Zellen für Ihre Co-Kultur verwendet werden.
- Add 250 ul der 293T/MDCK Zellen pro Well (10-12 6-well Brunnen).
- Nach 20-30 Minuten RT Inkubation (Schritt 1,3), 1 ml DMEM 10% FBS 1% PS auf die OptiMEM-LPF2000-Influenza-DNA-Plasmid-Gemisch.
- Fügen Sie die 1,3 ml (Schritt 1,5) in die Vertiefungen mit dem 250 ul 293T/MDCK Zellen (Schritt 1,4).
- Schütteln Sie die 6-well-Platte und lassen Sie die Transfektion inkubiert über Nacht (ON) in den Brutschrank bei 37 ° C und 5% CO 2.
- Am nächsten Tag, ca. 16-24 Stunden nach der Transfektion, ändern Sie die Transfektion Medien und inkubieren Sie die transfizierten Zellen in DMEM 0,3% BA 1% PS mit 1 pg / ml TPCK-Trypsin für 48 Stunden.
- Nach 48 Stunden der Veränderung der Medien, den Überstand der transfizierten Zellen in ein Mikrozentrifugenröhrchen.
- Centrifuge das Gewebe Kulturüberstand in einer Mikrozentrifuge für 1-2 Minuten, 13.000 Umdrehungen pro Minute.
- Infect frischen MDCK-Zellen in 6-well-Platten (vernickelt am Vortag) oder 10-Tage alten Hähnchen embryonierten Eier mit 200 ul zentrifugiert Gewebe Kulturüberständen von Schritt 1,10. Inkubieren Sie die Zellen und / oder Eier bei 37 ° C für 2-3 Tage.
- Die Infektion von 10-Tage alten Hähnchen embryonierten Eiern: Alle Verfahren, die Hühner embryonierten Eier infizieren werden unter sterilen Bedingungen durchgeführt.
- Candle die 10-Tage alte Eier mit einem Licht-Durchleuchten Feld, um die Schnittstelle zwischen den Luftsack und die Allantoishöhle sehen. Machen Sie einen Bleistift an der Schnittstelle Grenze.
- Mit einer 5 ml Spritze Nadel ein Loch in die Eierschale.
- Mit einer 1 ml Spritze zu infizieren jedes Ei mit 200 ul des Gewebes Kulturüberständen von Schritt 1,10.
- Decken Sie das Loch in der Eierschale mit geschmolzenem Wachs mit einem Wattestäbchen.
- Inkubieren Sie die infizierten Eiern 37οC für 2-3 Tage.
- Die Infektion von frischen MDCK-Zellen: Der Tag vor dem Durchgang der Gewebekultur Überstand aus der 293T/MDCK Co-Kulturen, vorpare 6-Well-Platte Gerichte mit MDCK-Zellen zu erreichen 80-90% Konfluenz am nächsten Tag. Normalerweise kann eine konfluente 100 mm Gewebekulturplatte in 6-8 Bohrungen aufgeteilt werden. Waschen Sie die Zellen zweimal mit PBS 1X, trypsinize und bereiten die 6-well Platten. Vorsichtig von Hand schütteln die Platten, um eine gleichmäßige Verteilung der Zellen haben. Kultur der Zellen, ON, in der 37 ° C Inkubator, 5% CO 2. Vor der Infektion, überprüfen Sie die Zellen unter dem Mikroskop, um eine Monoschicht bestätigen, dann, mit der Infektion vor:
- Wash-Zellen, zweimal mit 1 ml PBS 1X.
- Infect mit 200 ul zentrifugiert Gewebe Kulturüberständen für 1 Stunde bei RT. Lassen Sie sich nicht die Zellen trocknen. Rock the 6-well-Platte alle 10 Minuten.
- Nach 1 Stunde virale Absorption, entfernen Sie die Infektion Medien aus dem MDCK-Zellen und 2 ml DMEM 0,3% BA 1% PS mit 1 pg / ml TPCK-Trypsin.
- Bei 48-72 Stunden nach der Passage, in Abhängigkeit von der Transfektionseffizienz und der Viruslast, wird ein zytopathischen Effekts (CPE) in den MDCK infizierten Zellen beobachtet werden. CPE deutet auf eine erfolgreiche Rettung. Sollte jedoch ein HA-Test (Abschnitt 2) noch durchgeführt, um die Präsenz des Virus im Gewebe Kulturüberständen zu bestätigen.
- Die Infektion von 10-Tage alten Hähnchen embryonierten Eiern: Alle Verfahren, die Hühner embryonierten Eier infizieren werden unter sterilen Bedingungen durchgeführt.
- Ernte Allantoisflüssigkeit von infizierten Hühnern embryonierten Eiern: Alle Verfahren, die Allantoisflüssigkeit aus infizierten Eiern Ernte werden unter sterilen Bedingungen durchgeführt. Etwa 8-12 ml des Allantoisflüssigkeit kann von jedem 10-day-old-infizierte Eier geerntet werden. Vor der Ernte der Allantoisflüssigkeit, bebrüten die Hühnereier für 2 Stunden (oder ON) bei 4 ° C, um den Hühnerembryo töten und Koagulation des Blutes.
- Waschen Sie die Eierschalen mit 70% Ethanol, um sterile Bedingungen zu schaffen.
- Öffnen Sie das Ei vorsichtig über den Luftraum, indem Sie mit einem Löffel. Entfernen Sie die kaputte Eierschale mit Hilfe einer Pinzette.
- Mit einer 1 ml Nadel, entfernen Sie die Allantois, ohne das Ei ist Eigelb.
- Stabilisierung der Hühnerembryo mit einem Spatel, wie Sie einer 10 ml Pipette Führung in der Allantoisflüssigkeit. Sammeln Sie so viele Allantoisflüssigkeit wie möglich in ein 15 ml Zentrifugenröhrchen auf Eis in einem Eiskübel, ohne zu brechen oder das Sammeln einer der Eizelle Dotter. Verwenden Sie ein 15 ml Zentrifugenröhrchen für jedes Ei.
- Zentrifugieren Sie für 5 Minuten bei 4 ° C und übertragen die Allantoisflüssigkeit (ohne Berücksichtigung pelletiert roten Blutkörperchen), um ein frisches 15 ml Zentrifugenröhrchen.
- Bewahren Sie die Röhrchen mit dem zentrifugiert Allantoisflüssigkeit bei 4 ° C, bis sie auf das Vorhandensein von gerettet Virus mit einer Hämagglutination (HA)-Test überprüft.
2. HA-Test, um die Rettung von rekombinanten Influenzaviren bestätigen
Hämagglutinationstest (HA) wird routinemäßig verwendet werden, um die Anwesenheit der geretteten Virus in MDCK Zellkultur-Überstände und / oder der Allantoisflüssigkeit geerntet Eier zu erkennen. Alternativ können Immunfluoreszenz-Assays (IFA) auch durchgeführt werden. Sobald ein Test identifiziert die Anwesenheit von Viren befreit, sollte das Virus plaquegereinigt und die genetische Zusammensetzung des Virus wird durch RT-PCR und Sequenzierung bestätigt werden.
Die Anwesenheit des Virus in den MDCK Zellkultur-Überstände und / oder in der Allantoisflüssigkeit aus infizierten Eiern bestimmt makroskopisch mit HA vom Huhn (oder einer anderen Quelle) roten Blutkörperchen (RBC) werden. Das Vorhandensein von Viren induziert Hämagglutination von RBC, während das Fehlen des Virus ermöglicht die Bildung einer rot Pellet am Boden des Brunnens (Abbildung 4). Im Fall von Influenza-Virus, wird angenommen, dass etwa 10 3 -10 4 Plaque-bildenden Einheiten (PFU) erforderlich sind, um ein positives Signal in den HA-Test geben, weshalb eine IFA können parallel mit dem HA-Test durchgeführt werden, um zu bestätigen ein wahres negatives Ergebnis. IFA mit primären anti-Influenza-Antikörper ist empfindlicher als die HA-Test, weil weniger als 103-104 Viren mit dieser Technik nachgewiesen werden kann. Es ist möglich, als Überstände oder Allantois-Flüssigkeit, die HA-negativ sind positiv von der IFA. In diesem Fall sollte das Virus durch Passagieren verstärkt werden, wieder in MDCK-Zellen oder in Eiern. Allantoisflüssigkeit und / oder Gewebe Kulturüberständen aus dem zweiten Durchgang sollte nun deutlich positiv in den HA-Test.
HA-Assays sind in V-Boden 96-well-Platten durchgeführt. Negative (z. B. PBS 1X) und positive (tissue Kulturüberständen und / oder Allantoisflüssigkeit aus einer Influenzavirus-Infektion) Kontrollproben sollten immer in einer HA-Assay zu validieren einbezogen werden.
- Geben Sie 50 ul PBS 1X in jedes Well der V-Boden 96-Well-Platte.
- Add 50 uldie MDCK Zellkultur-Überstände und / oder Allantoisflüssigkeit aus den infizierten Eiern in die erste Vertiefung und machen 2-fach serielle Verdünnungen für die folgenden Vertiefungen. Entsorgen Sie die zusätzlichen 50 ul aus den letzten gut.
- Dann werden 50 ul von 0,5% -1,0% Huhn roten Blutkörperchen (hergestellt in PBS 1X) in jede Vertiefung.
- Inkubieren Sie die V-Boden 96-Well-Platte für 30-45 Minuten (bis zu einem red dot ist sichtbar in den Boden einer negativen Kontrolle PBS Probe) auf Eis. Lesen und interpretieren die Ergebnisse wie in Abbildung 4 dargestellt.
3. Passage der Zellkultur-Überstände
Ein negatives Ergebnis in der HA-Test kann eine Folge der niedrigen Transfektionseffizienz mit niedrigen Virus im Gewebe Kulturüberständen und / oder Allantoisflüssigkeit werden. Passage dieser Proben in frischem MDCK und / oder Bruteiern ermöglicht Verstärkung des Virus (wie in Abbildung 3 dargestellt) Infektionen sind wie zuvor in Abschnitt 1.11.2 beschrieben, durchgeführt.
4. Repräsentative Ergebnisse
Erfolgreiche Influenza-Virus zu retten wird durch das Vorhandensein einer positiven HA-Assay (Abbildung 4) bestätigt werden. Darüber hinaus wird die Existenz von CPE in Zellen mit dem Gewebe Kulturüberständen oder mit dem Allantoisflüssigkeit aus Eiern infiziert deuten auf eine positive viral zu retten.
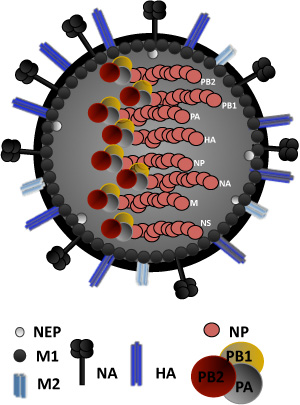
Abbildung 1. Influenza Virus-Struktur: Influenza-Virus wird durch eine Lipid-Doppelschicht, die beiden viralen Glykoproteine (HA, NA) und, umgeben auch die Ionenkanal-Protein, M2. HA ist die virale Attachment-Protein, verantwortlich für die Bindung an Sialinsäure-haltige Rezeptoren. NA ist verantwortlich für virale Freisetzung von Wirtszellen. Unter der Lipid-Doppelschicht, ist ein Protein Schicht der inneren Oberfläche Umschlag Matrix Protein 1, M1, die eine Rolle spielt in Virionen und Knospen und die nukleare Export-Protein (NEP), für die nukleare Export viraler ribonucleocapsids erforderlich zusammen. Der Kern des Virus besteht aus einem ribonucleoprotein (RNP)-Komplex hergestellt, bestehend aus 8 einsträngige RNA negativ viralen Gene durch die virale Nukleoprotein, NP eingekapselt. Im Zusammenhang mit dem RNP-Komplex der viralen RNA-abhängigen RNA-Polymerase-Untereinheiten PA, PB1, PB2 und. Die Nicht-Strukturproteine NS1 und PB1-F2, durch die RNA-Segmente NS und PB1 bzw. kodiert, sind nicht Bestandteil des Virion-Struktur.
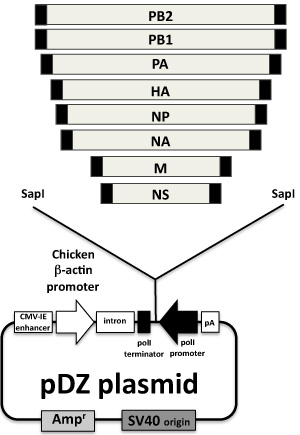
Abbildung 2. Influenza-Virus zu retten Plasmide: Die acht Influenza-Virus Gene in die AmbiSense Plasmid PDZ geklont werden angezeigt. PDZ Plasmid 6, aus dem Protein Expressionsplasmid pCAGGs 7 abgeleitet, ist eine bidirektionale Plasmidvektor mit einem menschlichen RNA-Polymerase I-Promotor und eine Maus Terminator-Sequenz, dass die negativen Sinne genomische RNA kodiert; in entgegengesetzter Orientierung auf der Polymerase I zu vereinen, eine Polymerase II Transkription Kassette (chicken β-Aktin-Promotor und polyA) kodiert für die viralen Proteine aus der gleichen Virus-Gen. cDNAs aus jeder viralen Segment werden durch RT-PCR mit Vorwärts-und Rückwärts-Primer enthält die SAPI Restriktionsendonukleasestelle und die nicht-kodierenden Regionen der einzelnen Segmente (black boxes am Ende der viralen Gene) generiert. Das PCR-Produkt wird in den PDZ mit Sap-I verdaut geklont.
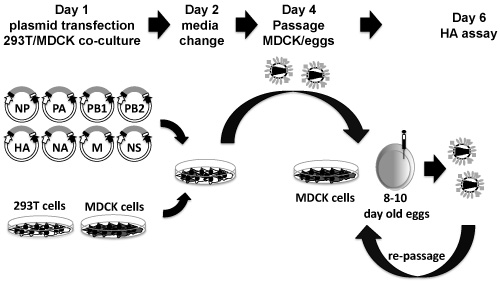
Abbildung 3. Acht-Plasmid-basierte Influenza-Rescue-System: PDZ Plasmide, welche der 8 Influenza Virus-Gene sind co-transfiziert, in Suspension, in 293T-MDCK-Zellen Co-Kulturen (Tag 1). Vierundzwanzig Stunden nach der Transfektion, Medien, ohne FBS aber mit TPCK / Trypsin ersetzt wird (Tag 2). Achtundvierzig Stunden nach dem Wechsel Medien, wird das Gewebe Kulturüberstand geerntet und verwendet werden, um MDCK oder 10-Tage alten bebrüteten Hühnereiern (Tag 4) zu infizieren. 48-72 Stunden nach der Amplifikation, Gewebe Kulturüberständen von MDCK infizierten Zellen oder Allantoisflüssigkeit aus Eiern werden geerntet und auf Vorhandensein von Viren durch HA (Tag 6). Wenn kein Virus entdeckt wird, kann die gleiche Überstände und / oder Allantois-Flüssigkeit in frisch MDCK Zellen und / oder Bruteiern wieder passagiert werden.
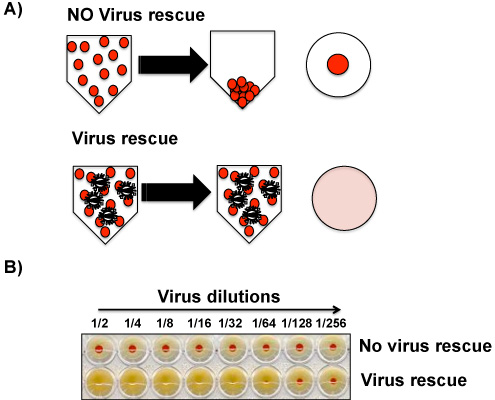
Abbildung 4. Hämagglutinin-Assay (HA): Hemagglutination von RBC durch Virus-Partikel ist makroskopisch sichtbar und ist die Basis für virale Partikel im Gewebe Kulturüberständen und / oder Allantois-Flüssigkeit zu erkennen. Obwohl die HA-Test unterscheidet nicht zwischen viralen Partikel, die infektiös sind und Partikel, die abgebaut werden und nicht mehr in der Lage, Zellen zu infizieren sind, diskriminieren, ist der Test ein guter Indikator für Vorhandensein von Viren in Proben. A) die Abwesenheit (oben) von Präsenz (unten) des Virus in den biologischen Proben wird durch die Anwesenheit von RBC in der Unterseite der Platte oder ihre Abwesenheit, bzw. ermitteltectively. B) Ein repräsentatives Ergebnis aus einer HA-Test ohne nachweisbare Mengen des Virus (oben) oder Anwesenheit (unten) des Virus gezeigt.
Diskussion
Rettung von rekombinanten Influenza-Viren von Plasmid-DNA ist ein einfacher und unkomplizierter Vorgang, sobald das Protokoll routinemäßig im Labor durchgeführt, aber am Anfang, mehrere Dinge schief gehen kann. Es ist zwingend notwendig, um gute Plasmidpräparation haben, um das Virus zu erzeugen. Die richtige Wartung der Zelllinien (293T und MDCK) ist entscheidend für eine erfolgreiche virale retten. Traditionell ist eine genetische Tag in einer Influenza-Gen-kodierenden Plasmid eingefügt, durch stille Mutagenese....
Offenlegungen
Danksagungen
Die Autoren wollen in Vergangenheit und Gegenwart Mitglieder in den Adolfo García-Sastre und Peter Palese Labors danken für die Entwicklung der Influenza reversen Genetik Techniken und Plasmide. Research in AG-S Labors wird teilweise durch CRIP, ein NIAID finanzierten Center of Excellence für Forschung und Influenza Surveillance (HHSN266200700010C) und durch NIAD gewährt R01AI046954, U01AI070469 und P01AI058113 finanziert. Research in LM-S Labor wird teilweise durch NIAID gewähren RO1AI077719 finanziert.
Materialien
Zell-Linien
293T (Katalog-Nummer CRL-11268) und MDCK (Katalog-Nummer CCL-34)-Zelllinien werden in einem 37 ° C Inkubator mit 5% CO 2 in DMEM 10% FBS, 1% PS erhalten. Die Zellen sind erhältlich Form der American Type Culture Collection (ATCC, 10801 University Boulevard, Manassas, VA. 20110-2209 USA).
Bebrüteten Hühnereiern
Embryonierte 10-Tage alten Hühnereiern können von Charles River Laboratories, specific pathogen Fee Avian Supply (SPAFAS) Avian Produkte und Dienstleistungen bezogen werden. Franklin Commons, 106 Route 32, North Franklin, CT 06254 USA. Die Eier werden bei 37 ° C vor und nach der viralen Infektion inkubiert. Vor und nach der Virusinfektion, Eier durchleuchtet, um die Lebensfähigkeit der Embryonen zu bestimmen. Es ist sehr wichtig für tote Eier vor und nach der Virusinfektion zu suchen. Vor der Infektion ein totes Ei kann leicht durch das Fehlen der Blutgefäße sowie das Fehlen von Embryos Mobilität beobachtet werden. Wenn candled, bewegen lebenden Embryos. Nach Virusinfektion ein totes Ei (wahrscheinlich Influenzavirus-Infektion im Zusammenhang) wird leicht durch die schlechte Aussehen des Eies als von den kleineren und blutigen Volumen von Allantoisflüssigkeit gesehen gesichtet werden. Infizierte-Eier sind in Doppel autoklavierbar Taschen verworfen und autoklaviert folgenden Standardverfahren.
Huhn roten Blutkörperchen (RBC)
Huhn RBC aus Truslow Farms, 201 Valley Road, Chestertown, MD 21620 gekauft werden. Lagerung bei 4 ° C. Für HA-Assays, waschen 5 ml des Huhns RBC mit 45 ml PBS 1X in einer 50 ml-Zentrifugenröhrchen. Zentrifugieren Sie für 5 Minuten bei 1000 rpm, RT. Entsorgen Sie sorgfältig den Überstand und die Nutzung einer 1:1000 Verdünnung des pelletierten RBC in PBS 1X (Endkonzentration von 0,5-1,0% RBC).
Tissue Kulturüberständen und Allantois Flüssigkeiten
Beide, Gewebe Kulturüberständen und Allantois Flüssigkeiten können bei 4 ° C gelagert werden für eine kurze Zeit. Nach der Bestätigung Virus zu retten, sind Viren aus der Zelle Überstände oder Allantoisflüssigkeit bei -80 ° C gelagert
Plasmide
Alle Plasmide sind bereit, mit einem Plasmid Maxi Kit nach den Empfehlungen des Herstellers. Alle Plasmide sind Aliquot bei Konzentrationen von 1 pg / ml in ddH 2 O und bei -20 ° C. Für kurzfristige Lagerung kann das Plasmid bei 4 ° C zu halten sein Die Konzentration des gereinigten DNA-Plasmid wird durch Spektrophotometrie bei 260 nm bestimmt, mit der Reinheit wird unter Verwendung der 260:280 nm-Verhältnis. Zubereitungen mit 1,8 bis 2,0 260:280 nm Verhältnisse gelten für angeeignet Virus zu retten Zwecke. Darüber hinaus sollte das Plasmid Konzentration und Reinheit mit Agarosegel-Chromatographie bestätigt werden. AmbiSense PDZ Plasmide (6) mit den acht Influenza A/PR/8/34 viralen Gene (7) sind in Abbildung 2 dargestellt.
Viren
Das beschriebene Protokoll zur Rettung Influenza A/PR/8/34 finden Sie unter Sicherheitsstufe (BSL) 2 Bedingungen durchgeführt werden. Kontaminiertem Material, einschließlich Gewebe Kulturüberständen und bebrüteten Eiern, sollte vor der Entsorgung sterilisiert werden. Rettung von anderen Influenza-Viren können höhere BSL Bedingungen und daher besondere Bedingungen / security Messungen müssen befolgt werden.
Gewebekultur-Medien und Lösungen
DMEM 10% FBS 1% PS: 445 ml Dulbecco modifiziertem Eagle-Medium (DMEM), 50 ml Fetal Bovine Serum (FBS), und 5 ml 100X Penicillin / Streptomycin (PS). Lagerung bei 4 ° C. Diese Medien werden verwendet, um 293T und MDCK-Zellen als auch für die Transfektionen aufrecht zu erhalten. DMEM 0,3% BA 1% PS: 495,7 ml DMEM, 4,3 ml 35% Rinderalbumin (BA). Lagerung bei 4 ° C. Kurz bevor zu verwenden, fügen TPCK behandelt Trypsin, um eine endgültige Konzentration von 1 ug / ml. Infektiöse Medien.
10X Phosphat-gepufferte Kochsalzlösung (PBS): 80 g NaCl, 2 g KCl, 11,5 g Na 2 HPO 4 .7 H 2 O, 2 g KH 2 PO 4. Add ddH 2 O auf 1 Liter auffüllen. Der pH-Wert auf 7,3. Sterilisieren im Autoklaven. Lagerung bei Raumtemperatur.
1X PBS: 10x PBS im Verhältnis 1:10 mit ddH 2 O. Sterilisieren im Autoklaven und bei Raumtemperatur lagern.
Referenzen
- Neumann, G., Watanabe, T., Ito, H., Watanabe, S., Goto, H., Gao, P., Hughes, M., Perez, D. R., Donis, R., Hoffmann, E., Hobom, G., Kawaoka, Y. Generation of influenza A viruses entirely from cloned cDNAs. Proc Natl Acad Sci U S A. 96, 9345-9350 (1999).
- Fodor, E., Devenish, L., Engelhardt, O. G., Palese, P., Brownlee, G. G., Garcia-Sastre, A. Rescue of influenza A virus from recombinant DNA. J Virol. 73, 9679-9682 (1999).
- Martinez-Sobrido, L., Garcia-Sastre, A. Recombinant influenza virus vectors. Future Virology. 2, 401-416 (2007).
- Palese, P., Shaw, M. L., Knipe, D. M., Howley, P. H. Orthomyxoviridae. The viruses and their replication. Fields Virology. , 1647-1689 (2006).
- Schickli, J. H., Flandorfer, A., Nakaya, T., Martinez-Sobrido, L., Garcia-Sastre, A., Palese, P. Plasmid-only rescue of influenza A virus vaccine candidates. Philos Trans R Soc Lond B Biol Sci. 356, 1965-1973 (2001).
- Quinlivan, M., Zamarin, D., Garcia-Sastre, A., Cullinane, A., Chambers, T., Palese, P. Attenuation of equine influenza viruses through truncations of the NS1 protein. J Virol. 79, 8431-8439 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten