Method Article
Hochauflösende LWL-Mikroendoskopiesysteme für In situ Cellular Imaging
In diesem Artikel
Zusammenfassung
In vielen biologischen und klinischen Situationen ist es vorteilhaft, zelluläre Prozesse zu untersuchen, wie sie sich entwickeln in ihrer Muttersprache Mikroumgebung. Hier beschreiben wir die Montage und die Verwendung eines Low-Cost-Glasfaser-Mikroskop, das Echtzeit-Bildgebung in der Zellkultur, Tierversuche und klinische Patientenstudien bieten kann.
Zusammenfassung
Viele biologische und klinische Studien erfordern die longitudinale Untersuchung und Analyse der Morphologie und Funktion mit zellulärer Ebene Auflösung. Traditionell werden mehrere Experimente in parallel laufen, mit einzelnen Proben aus der Studie bei sequentiellen Zeitpunkte für die Beurteilung durch Lichtmikroskopie entfernt. Mehrere intravital Techniken entwickelt worden, mit der konfokalen, Multiphotonen und zweiten Harmonischen Mikroskopie all ihre Fähigkeit bewiesen, für die Bildgebung in situ 1 verwendet werden. Bei diesen Systemen ist jedoch die erforderliche Infrastruktur komplex und teuer, mit Scanning-Laser-Systeme und komplexe Lichtquellen. Hier präsentieren wir ein Protokoll für die Konstruktion und Montage von einer hochauflösenden Mikroendoskops, die in einem Tag mit off-the-shelf Komponenten für unter 5.000 US-Dollar gebaut werden kann. Die Plattform bietet Flexibilität bei der Bildauflösung, beschreiben field-of-view, und arbeitet bei der Wellenlänge, und wir, wie diese Parameter leicht modifiziert werden, um die spezifischen Bedürfnisse der Endanwender entsprechen.
Wir und andere haben den Einsatz der hochauflösenden Mikroendoskops (HRME) in in vitro-Zellkultur 2-5 erforscht, in herausgeschnitten 6 und lebenden tierischen Geweben 2,5 und in menschlichen Geweben in vivo 2,7. Die Benutzer haben die Verwendung von mehreren verschiedenen fluoreszierenden Kontrastmittel, einschließlich Proflavin 2-4, Benzoporphyrin-derivative Monosäure Ring A (BPD-MA) 5, und Fluorescein 6,7, die alle voll erhalten haben, oder Forschungszwecke Genehmigung durch die FDA gemeldet für den Einsatz am Menschen. Hochauflösende Mikroendoskopie, in der hier beschriebenen Form kann auf eine breite Palette von Forschern in der Grundlagen-und klinische Wissenschaften appellieren. Die Technik bietet eine effektive und wirtschaftliche Lösung, die traditionelle Benchtop-Mikroskopie ergänzt, indem es dem Benutzer ermöglicht hochauflösende, Längs-Bildgebung in situ durchzuführen.
Protokoll
1. Mikroendoskops Assembly
Das hochauflösende Mikroendoskops hier (Bild 1a) beschrieben werden, sollten als Basis-Konfiguration mit mehreren Varianten möglich in Montage und Anwendung berücksichtigt werden. Wir beschreiben im Detail einer Ausgestaltung der Plattform, die entworfen, um mit Proflavin als fluoreszierende Kontrastmittel verwendet werden soll. Proflavin ist ein heller Kernfärbung mit Peak-Absorptions-und Emissions-Wellenlängen von 445 nm und 515 nm bzw.. Die Verwendung anderer Kontrastmittel wird vom Benutzer verlangen, Anregung, Emissions-und dichroitische Filter entsprechend zu wählen. Verschiedene Elemente des hochauflösenden Mikroendoskops sind allgemeiner Natur und können von mehreren Anbietern bezogen werden. Zum Beispiel sind mechanische Positionierung Komponenten aus Thorlabs, Newport, Linos verfügbar unter anderem. Compact-CCD-Kameras werden von Unternehmen, darunter Point Grey Research, Prosilica und Retiga verfügbar; die Empfindlichkeit der Kamera sollte mit Rücksicht auf die Helligkeit des Fluorophors verwendet werden soll, sowie die gewünschte Bildrate gewählt werden. High-Power Leuchtdioden (LEDs) können von Luxeon, Cree und Nichia unter anderem erreicht werden. LWL-Bündel werden von Sumitomo, Fujikura und Schott zur Verfügung. Bei der Auswahl der Komponenten für eine bestimmte Anwendung, sollte der Nutzer betrachten die inhärenten Beziehungen in der Fluoreszenzmikroskopie zwischen Fluorophor-Konzentration beteiligt, Bleichen, Beleuchtungsstärke, die Empfindlichkeit der Kamera, Verstärkung und Belichtungszeit.
- Verbinden Sie die 6 "Käfigstäbe auf dem 1,5"-Käfig Stangen, um ein Paar von 7,5 Form "lange Stäbe. Screw diese Stäbe in eine Seite des Klappspiegel-Einheit. Schrauben Sie die 0,5" Stangen an der gegenüberliegenden Seite. Schieben Sie den Käfig Würfel auf den Käfig Stangen, über die beiden unteren durch die Löcher. Schrauben Sie die 2 "Stäbe in die Seite des Käfigs Würfel (Bild 1b).
- Befestigen Sie die Kamera an einen Käfigplatte mit einem C-Mount-Adapter für SM1. Sichern Sie den Käfig Platte auf dem 0,5 "-Käfig Stäbchen, mit dem Gesicht der Klappspiegel-Einheit zu spülen.
- Legen Sie die "tube"-Linse in einen 3 "langen Tubus und sichern Sie das Objektiv mit einem Sicherungsring. Die Brennweite des Objektivs gewählt sein sollte, dass die Kerne der Glasfaser-Bündel von mindestens zwei Pixel abgetastet werden bei der Projektion auf die Kamera. Drop the Emissionsfilter in das Rohr auf der Oberseite des ersten Haltering, und fügen Sie einen anderen Ring, um den Filter zu befestigen. Beachten Sie die Ausrichtung des Filters Konvention angezeigt durch die Filter-Hersteller. Schrauben Sie den Tubus in die Seite des Käfig-Würfel am nächsten an der CCD-Kamera. Beachten Sie, dass in Abbildung 1c, dieses Objektiv und Filter ohne die 3 "Tubus für Klarheit dargestellt.
- Schließen Sie die Kamera an einen Computer und sehen Sie die Bilder auf dem Bildschirm. Richten Sie die Käfig an einem entfernten Objekt und schieben Sie den Käfig Würfel entlang der Schienen bis ein Bild im Fokus. Sperren Sie den Käfig Würfel an dieser Stelle. (Dies ist eine einfache Methode, um sicherzustellen, dass das Rohr Linse ein scharfes Bild entstehen, wenn mit dem Infinity-korrigierte Objektiv kombiniert).
- Legen Sie die dichroitischen Spiegel in die Halterung und stellen bei 45 ° in den Käfig Würfel.
- Schrauben Sie die Objektiv über einen RMS SM1 Gewindeadapter und einem verstellbaren Tubus, in das Gesicht des Käfigs Würfel gegenüber dem Rohr Linsenhalter. Ein z-Übersetzer kann anstelle des verstellbaren Tubus für die Scharfstellung verwendet werden. Screw einen SMA-Anschluss in einen Käfig Platte und befestigen diese an den Stangen, etwa auf den Arbeitsabstand des Objektivs.
- Montieren einer LED auf einem Käfigplatte und schieben Sie auf das Ende der 2 "Stangen. Hinzufügen eine Linse, eine 0,5" Tubus, so dass, wenn dieses Rohr in die Seite des Käfigs Würfel verschraubt ist, wird es ein Bild der LED Form dass füllt den Rücken Apertur des Objektivs. Diese (Kohler-Beleuchtung)-Konfiguration wird sichergestellt, dass der proximalen Stirnseite des Glasfaser-Bündel gleichmäßig ausgeleuchtet wird. Fügen Sie die Anregungsfilter dem 0,5 "Tubus und sichere Stelle mit einem Sicherungsring (Abbildung 1c).
- Bringen Sie einen SMA-Stecker an ein Glasfaser-Lichtleiter. Schrauben Sie die SMA konfektionierte Bündel in die SMA-Buchse auf der Käfigstäbe montiert. Direkte das distale Ende des Bündels zu einer Breitband-Lichtquelle (Leuchtstofflampen genügt) und beobachten Sie das Bild des Bündels proximale Fläche auf dem CCD-Kamera. Passen Sie die Position des Objektivs durch Eindrehen in das oder aus dem Käfig Würfel, bis die Faserbündel Bild erscheint im Fokus. Die einzelnen Kerne sollten deutlich sichtbar sein (Abbildung 2).
2. GRIN-Linse Assembly
Die räumliche Auflösung der Mikroendoskops kann durch das Anbringen eines Mikro-Linse oder Linsengruppe, die distale Spitze des Faserbündels erhöht werden. Diese Optiken sind so konfiguriert, dass anstatt die Bündel Spitze direkt auf das Gewebe, die Spitze auf der Gewebeoberfläche mit Verkleinerung abgebildet wird, wodurch die räumliche Sampling-Frequenz von Licht-guid verhängtIng. Kerne der Faserbündel. Der Grad der Verkleinerung entspricht der Steigerung der räumlichen Auflösung und zur gleichen Zeit, zu einem proportionalen Rückgang der field-of-view. Gradient-Index (GRIN) Linsen-Komponenten sind kompatibel mit Faser-Optik und aus GRINTECH, NSG, Schott, unter anderem zur Verfügung, und kann direkt an der distalen Spitze ein Faserbündel verklebt werden.
- Wählen Sie eine GRIN-Linse mit der gewünschten Vergrößerung und Arbeitsabstand für Ihre Anwendung. Stellen Sie sicher, dass der Durchmesser der Linse, dass der Faserbündel Sie planen, mit der Arbeit übersteigt. Wir empfehlen, dass die Faserbündel und GRIN-Linse auf separaten 3-Achsen manuelle Positionierung Stufen unter einem Low-Power-Mikroskop oder Stereoskop für die exakte Ausrichtung vor dem Kleben montiert werden.
- Geben Sie einen Tropfen von optischen Klebstoff (zB Norland UV-härtende Klebstoff) entweder auf der Linse oder ein Bündel Gesicht. Bringen Sie die beiden Komponenten in Kontakt mit der manuellen Stellungsregler. Expose die Schnittstelle zum UV-Licht für die Dosierung der vom Hersteller empfohlen.
- Zum Schutz der GRIN-Linse und die gebundene Schnittstelle, ein kurzes Stück Aluminium Kapillarrohr (Small Parts Inc.) können verwendet werden, um das Gelenk zu umschließen. Schieben Sie den Schlauch über die gemeinsame und sichere Stelle mit Epoxidharz. Schrumpfschlauch kann verwendet werden, um die Montage fertig sein.
3. Mikroendoskops Imaging
- Anwenden des Kontrastmittels in die Zellen oder Gewebe, die abgebildet werden. Mit Proflavin (0,01% w / v in PBS), können in vitro-Bildgebung von Zellen in Kultur durch kurze Inkubation (<1 Minute) und eine gründliche Spülung durchgeführt werden. Imaging von ex vivo Gewebeproben oder in vivo Gewebe ist möglich, nach topischer Anwendung des Farbstoffs. Die Aufnahme von Proflavin unter diesen Bedingungen wurde festgestellt, dass nahezu sofortige, mit bildgebenden möglich innerhalb weniger Sekunden und dauert mehrere Minuten.
- Legen Sie die LWL-Bündel in leichten Kontakt mit der Probe, die abgebildet werden. Beim Abbilden Zellen in Kultur oder ex vivo Gewebeproben, empfehlen wir die Montage der distale Ende des Faserbündels in eine sichere Befestigung mit manueller Positionierung Etappen auf XYZ-Achsen für Stabilität während der Bildgebung.
4. Repräsentative Ergebnisse:
Wenn richtig montiert, wird der Mikroendoskops als epi-Fluoreszenz-Mikroskop, durch einen kohärenten Glasfaser-Bündel weitergeleitet zu betreiben. Für eine optimale Bildqualität zu erzielen, sollten darauf achten, dass drei Bedingungen erfüllt sind zu zahlen:
- Die proximale Fläche des Faserbündels sollte auf die CCD-Kamera ohne Unschärfe abgebildet werden, um die volle Auflösung des Systems zu erreichen. Abbildung 2a, b, c zeigen einen Teil einer Faserbündel mit schlechter konzentrieren abgebildet, leichte Unschärfe und eine gute Konzentration, bzw.. Die optimale Konzentration wird durch Einstellen der axialen Position des Objektivs in Bezug auf das Bündel Gesicht gefunden.
- Die proximale Fläche des Faserbündels sollten gleichmäßig über den gesamten Durchmesser (field-of-view) beleuchtet werden. Wie in dem Protokoll Text (1,7) beschrieben, wird dies durch die Konfiguration der Beleuchtungsoptik für Kohler-Beleuchtung erreicht. Abbildung 2d zeigt ein Bild erworben, wenn eine einheitliche fluoreszierenden Probe in dieser bevorzugten Ausgestaltung beleuchtet wird, mit Abbildung 2e zeigt das entsprechende Ergebnis unter kritischen Beleuchtung. Im letzteren Fall ist die Struktur der LED auf die Faserbündel Gesicht abgebildet, was das Erscheinungsbild dieser unerwünschtes Muster auf die wahre Struktur der Probe überlagert.
- Sowohl die proximalen und distalen Flächen der Faserbündel sollte sauber und frei von Kratzern und Chips. Abbildung 2f zeigt das Vorhandensein von Ablagerungen an dem Bündel Gesicht, mit Schäden in Form von einem kleinen Chip um 5 Uhr auf der Faser Umfang. Debris aus dem Bündel Gesichter durch die Reinigung in der gleichen Weise wie herkömmliche Glasfaser-Steckverbindern, mit Objektiv Papier und Isopropanol, oder Standard-LWL-Reinigung von Werkzeugen entfernt werden. Wenn entweder Ende der Faserbündel ist verkratzt oder gesäumt, oder wenn das Bündel bricht entlang seiner Länge, das Gesicht kann flach poliert werden durch Standard-Handbuch, oder mechanisches Polieren Techniken. Wir empfehlen 12-15 um Läppen Papier für eine erste grobe Politur, mit einer abschließenden Politur auf 0,5-1,0 um Papier.
Abbildung 3a zeigt Bildgebung von 1483 Zellen in vitro, nach Markierung mit Proflavin und leichte Platzierung der bloßen Faserbündel auf die Probe. Abb. 3b zeigt die Verbesserung der räumlichen Auflösung und Reduzierung in field-of-view von einem 2,5-GRIN-Linse geklebt, um das Bündel Spitze versehen. Movie 1 zeigt in-vivo-Bildgebung des Brustfettpolster in einem Mausmodell. Hier wurde ein Faserbündel mit 0,5 mm Außendurchmesser (330 um field-of-view) durch eine 21-Gauge-Nadel weitergegeben und Fortgeschrittene in das Gewebe. Fettzellen sind deutlich sichtbar, mit der Bewegung durch den Herzzyklus offensichtlich in dieser Akquisition bei 15Frames pro Sekunde. Abbildung 3c zeigt die Abbildung der Mundschleimhaut in einem gesunden menschlichen Freiwilligen, diesmal mit einem größeren Faserbündel mit 1,5 mm Außendurchmesser (1,4 mm field-of-view). In allen Beispielen gezeigt wird, wurde Proflavin als Kernfärbung fluoreszierende Kontrastmittel verwendet.
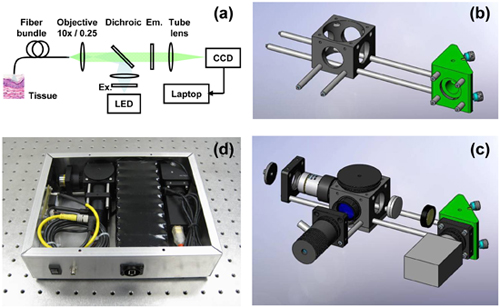
Abbildung 1. Montage der hochauflösenden Mikroendoskops (HRME). (A) Schematische Darstellung der HRME System. (B) Versammlung der wichtigsten optomechanischen Tragstruktur. (C) Zusatz von optischen Elementen, LED Beleuchtung und CCD-Kamera. (D) Foto des HRME System, in einer 10 "x 8" x 2,5 "-Gehäuse verpackt.

Abbildung 2. Einrichten der HRME. Beispiele für Bildgebung mit der Glasfaser-Bündel in (a) schlechte Konzentration, (b) eine gute Konzentration zu schließen, (c) ideal zu konzentrieren. In (d), ist eine einheitliche fluoreszierenden Ziel auf das Bündel der distalen Spitze unter Kohler (Uniform) Beleuchtung abgebildet. (E) Eine einheitliche fluoreszierenden Ziel abgebildet unter kritischen Beleuchtung, mit der Source-Struktur deutlich auf das Objekt. (F) Lose Gewebe und Zellen können die Faserbündel Gesicht, das ist auch anfällig für kleinere Schäden an seiner Peripherie-Stick.
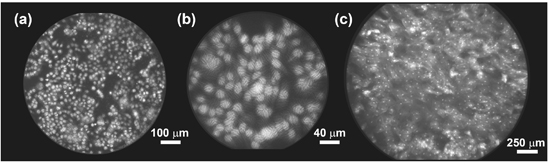
Abbildung 3. Imaging mit dem HRME. (A) 1483 Zellen in vitro, mit einem nackten Faserbündel (IGN-08/30) nach Markierung mit Proflavin 0,01% (w / v) abgebildet. (B) Das gleiche 1483 Zellkultur als in (a) gezeigt, mit einem Faserbündel mit 2,5 GRIN angesetztem Objektiv abgebildet. (C) Bild der normalen menschlichen Mundschleimhaut in vivo, nach topischer Anwendung von Proflavin 0,01% (w / v).
Movie 1. Imaging der Brustfettpolster einer Maus durch Insertion eines 450 um Außendurchmesser Faserbündel in das Lumen eines 21-Gauge-Nadel in das Gewebe geleitet. Proflavin 0,01% (w / v) wurde die Bildgebung vor Ort durch die gleiche Nadel vor dem Einsetzen der bildgebenden Faser. Ausgeliefert Klicken Sie hier, um Video anzuschauen
Diskussion
Das hochauflösende Mikroendoskopie hier beschriebene Technik stellt Forscher in der biomedizinischen und klinischen Forschung Gebieten mit einer flexiblen, robusten und kostengünstigen Methode zur Visualisierung zellulärer Details in situ. Wir haben ein Protokoll für die Montage der Imaging-System beschrieben und demonstriert ihre Verwendung in der Zellkultur in vitro und in tierischen und menschlichen Geweben in vivo. Während die bildgebenden hier vorgestellten Ergebnisse Proflavin als fluoreszierende Kontrastmittel verwendet werden, haben andere Gruppen Versionen des Systems mit LED-Beleuchtung Wellenlängen und Filter gewählt Anregungs / Emissionsspektren anderer Farbstoffe 5-7 Match unter Beweis gestellt.
Auflösung und field-of-view werden zunächst durch die Kern-zu-Kern-Abstand-und Imaging-Durchmesser der Glasfaser-Bündel bestimmt. Wir haben Bundles mit ca. 4 um Kern-Kern-Abstand und Imaging-Durchmesser von 330 um (Film 1), 720 mu m (Abbildung 2, Abbildung 3a, b), und 1400 um (Abbildung 3c) verwendet. Die kleinere Bündel durch engere Gauge-Nadeln weitergegeben werden und sind wesentlich flexibler als die größeren Fasern. Wir und andere 8 haben, in einigen Fällen festgestellt, das Aussehen der Autofluoreszenz-Emissionen aus dem Faserbündel sich. Beim Versuch, Fluorophore bei UV-Wellenlängen anregen, einsammeln oder Emission im roten Spektralbereich, sollten ihr Augenmerk auf das Niveau der Faserbündel Autofluoreszenz Beitrag zur Gesamtentwicklung Messsignal bezahlt werden.
Während die meisten der hoch auflösenden Mikroendoskopie Arbeit berichtet to-date hat eine kahle Faserbündel verwendet werden, können zusätzliche Vergrößerung durch die Verwendung von GRIN-Linsen verbunden mit der distalen Spitze gestellt werden. GRIN-Linsen bieten eine einfache und kostengünstige Möglichkeit, räumliche Auflösung zu erhöhen, obwohl ihre Anfälligkeit für optische Aberrationen und begrenzte NA gut zu erkennen ist. Wenn GRIN-Linse Leistung ist unzureichend für eine bestimmte Anwendung, Hybrid GRIN / sphärische Linse Ziele 9 oder Miniatur-Objektiv 10-11 Baugruppen können eingesetzt werden.
Das hochauflösende Mikroendoskops hier beschriebenen wesentlichen arbeitet als wide-field epi-Fluoreszenz-Mikroskop, also auch keine optische Schnitte (wie in der konfokalen Mikroskopie oder nichtlineare) zu erwarten ist. In unserer Erfahrung, mit 455 nm Anregungs-und topischen Proflavin als Kontrastmittel wird das Licht in erster Linie aus einer Tiefe, die ein paar Zellschichten gesammelt.
Dieses Protokoll soll dem Leser ermöglichen, die hochauflösende Mikroendoskops am Prüfplatz montieren, mit seinen kompakten Abmessungen von 10 "x 8". Falls gewünscht, kann das System in einer Box eingeschlossen und die elektrischen Komponenten (LED und Kamera) durch einen Akku (Abbildung 1d) mit Strom versorgt. Viele Kompaktkameras kann durch den IEEE-1394 (Firewire) und USB-Ports des Host-Computers mit Strom versorgt werden.
Offenlegungen
MP und DY haben nichts zu offenbaren. RRK hält Patente im Zusammenhang mit mikro Imaging-Plattformen.
Danksagungen
Diese Arbeit wurde teilweise durch die National Institutes of Health, gewähren R01 EB007594, dem Department of Defense Breast Cancer Research Program, Vorschlag BCO74699P7 und die Susan G. Komen Foundation Grant 26152/98188972 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| CCD camera | Point Grey Research | GRAS-14S5M | |
| LED | Thorlabs Inc. | M455L2 | Selected for use with proflavine – other fluorophores may require different parts |
| Excitation filter | Semrock | 452/45 | Selected for use with proflavine – other fluorophores may require different parts |
| Emission filter | Semrock | 550/88 | Selected for use with proflavine – other fluorophores may require different parts |
| Dichroic mirror | Chroma Technology Corp. | 485 DCLP | Selected for use with proflavine – other fluorophores may require different parts |
| Objective lens | Thorlabs Inc. | RMS 10X | |
| Tube lens | Thorlabs Inc. | AC-254-150-A1 | Select focal length to achieve required magnification to CCD |
| Condenser lens | Thorlabs Inc. | ACL2520 | |
| Cage cube unit | Thorlabs Inc. | C6W, B1C, B3C, B5C, SM1CP2 | |
| Cage rods and plates | Thorlabs Inc. | ER05 (x4), ER1.5 (x2), ER2 (x2), ER6 (x2), CP02 (x3) | |
| Fold mirror unit | Thorlabs Inc. | KCB1, PF10-03-G01 | |
| Lens tubes | Thorlabs Inc. | SM1L05, SM1L30, SM1V05 (or SM1Z) | |
| Adapters / couplers | Thorlabs Inc. | SM1A3, SM1A9, SM1T2 (x2) | |
| SMA connectors | Thorlabs Inc. | SM1SMA, 11040A | |
| LED driver | Thorlabs Inc. | LEDD1B TPS001 | |
| Fiber optic bundle | Sumitomo Bakelite Co., Ltd. | IGN-08/30 | Larger or smaller bundles are available (Sumitomo / Fujikura) |
Referenzen
- Pierce, M. C., Javier, D. J., Richards-Kortum, R. Optical contrast agents and imaging systems for detection and diagnosis of cancer. Int. J. Cancer. 123, 1979-1990 (2008).
- Muldoon, T. J., Pierce, M. C., Nida, D. L., Williams, M. D., Gillenwater, A., Richards-Kortum, R. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt. Express. 15, 16413-16423 (2007).
- Muldoon, T. J., Anandasabapathy, S., Maru, D., Richards-Kortum, R. High-resolution imaging in Barrett's esophagus: a novel, low-cost endoscopic microscope. Gastrointest. Endosc. 68, 737-744 (2008).
- Muldoon, T. J., Thekkek, N., Roblyer, D., Maru, D., Harpaz, N., Potack, J., Anandasabapathy, S., Richards-Kortum, R. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett's esophagus. J. Biomed. Opt. 15, 026027-026027 (2010).
- Zhong, W., Celli, J. P., Rizvi, I., Mai, Z., Spring, B. Q., Yun, S. H., Hasan, T. In vivo high-resolution fluorescence microendoscopy for ovarian cancer detection and treatment monitoring. Br. J. Cancer. 101, 2015-2022 (2009).
- Dubaj, V., Mazzolini, A., Wood, A., Harris, M. Optic fibre bundle contact imaging probe employing a laser scanning confocal microscope. J. Microsc. 207, 108-117 (2002).
- Dromard, T., Ravaine, V., Ravaine, S., Lévêque, J. -. L., Sojic, N. Remote in vivo imaging of human skin corneocytes by means of an optical fiber bundle. Rev. Sci. Inst. 78, 053709-05 (2007).
- Udovich, J. A., Kirkpatrick, N. D., Kano, A., Tanbakuchi, A., Utzinger, U., Gmitro, A. F. Spectral background and transmission characteristics of fiber optic imaging bundles. Appl. Opt. 47, 4560-4568 (2008).
- Barretto, R. P. J., Messerschmidt, B., Schnitzer, M. J. In vivo fluorescence imaging with high-resolution microlenses. Nat. Methods. 6, 511-512 (2009).
- Rouse, A. R., Kano, A., Udovich, J. A., Kroto, S. M., Gmitro, A. F. Design and demonstration of a miniature catheter for a confocal microendoscope. Appl. Opt. 43, 5763-5771 (2004).
- Kester, R. T., Christenson, T., Richards-Kortum, R., Tkaczyk, T. S. Low cost, high performance, self-aligning miniature optical systems. Appl. Opt. 48, 3375-3384 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten