Method Article
Die Untersuchung der Integration von Adult-geboren Neurons
In diesem Artikel
Zusammenfassung
Ein Weg, um die Integration von Neugeborenen dentatus Körnerzellen im erwachsenen Tieren Studie beschrieben wird. Diese Technik verwendet eine technisch Retrovirus zu neugeborenen Neuronen, durch elektrophysiologische Aufnahmen folgten, um in vivo funktionale Integration bestimmen Etikett.
Zusammenfassung
Neurogenese tritt bei erwachsenen Säugetieren Gehirn in der Sub-ventrikuläre Zone (SVZ) der lateralen Ventrikel und in der Sub-körnige Zone (SGZ) der hippocampalen des ganzen Lebens. Frühere Berichte haben gezeigt, dass adulte Neurogenese mit vielfältigen Störungen des Gehirns, einschließlich Epilepsie, Schizophrenie, Depression und Angst (1) verbunden ist. Die Entzifferung der Prozess der normalen und aberranten Erwachsene geboren Neuron Integration kann Licht auf die Genese dieser Erkrankungen Schuppen und informieren die Entwicklung neuer Therapien.
SGZ adulte Neurogenese Spiegel embryonale und postnatale neuronale Entwicklung, einschließlich der Stufen des Schicksals Spezifikation, Migration, Integration synaptischer und Reifung. Allerdings tritt eine vollständige Integration über einen längeren, 6-Wochen-Frist. Initial synaptischen Eingang zum Erwachsenen-geboren SGZ dentatus Körnerzellen (DGCs) ist GABAergen, gefolgt von glutamatergen Eingang bei 14 Tagen (2). Die spezifischen Faktoren, die Schaltung Bildung von Erwachsenen geboren Neuronen im Gyrus dentatus zu regulieren sind derzeit nicht bekannt.
Unser Labor verwendet eine replikationsdefizient retroviralen Vektor basierend auf dem Moloney Maus-Leukämie-Virus, fluoreszierende Proteine und die Hypothese auf regulatorische Gene, um diese wuchernden Zellen zu liefern. Diese virale Technik bietet eine hohe Spezifität und Auflösung für die Analyse von Zell-Geburtsdatum, Geschlecht, Morphologie und Synaptogenese.
Ein typisches Experiment oft beschäftigt zwei oder drei Viren mit einzigartigen Label, Transgen und Promotor-Elemente für die Single-Cell-Analyse eines gewünschten Entwicklungsprozess in vivo. Das folgende Protokoll beschreibt eine Methode für die Analyse von funktionalen neugeborenen Neuronen Integration mit einem einzigen grünen (GFP) oder rot (dTomato) fluoreszierendes Protein Retrovirus-und Patch-Clamp-Elektrophysiologie.
Protokoll
1. Virus Injection
High-Titer entwickelt Retrovirus (1 × 10 9 Einheiten / ml) wird durch Co-Transfektion von retroviralen Vektoren hergestellt und VSVG in HEK293T Zellen durch Ultrazentrifugation von viralen Überstand gefolgt. Für Herkunft und Produktionsmethoden, siehe den ausgezeichneten JoVE Demonstration (3).
Hinweis: Young adult (4-6 Wochen alt) weibliche C57BL / 6 Mäuse (Charles River) wurden unter den Standardbedingungen untergebracht. Alle Verfahren folgen dem National Research Council Guide für die Pflege und Verwendung von Labortieren unter einem Protokoll, das von der Stony Brook University IACUC genehmigt.
- Thaw 2UL von gefrorenen Retrovirus pro Tier auf dem Eis.
- Betäuben (100 ug Ketamin + 10 pg Xylazin pro Gramm Körpergewicht) und montieren Sie das Tier auf einem stereotaktischen Rahmen (Steolting). Entfernen Sie die Haare auf dem Kopf, und wischen Sie die Haut mit 70% Ethanol.
- Expose des Schädels und bohren Sie vier flachen Löchern mit einem zahnärztlichen Bohrer (0,6 mm-Bohrer) an den folgenden Koordinaten:
- anterioposterior = -2 mm von Bregma; lateral = ± 1,6 mm; ventral = 2,5 mm; anterioposterior = -3 mm vom Bregma; lateral = ± 2,6 mm; ventral = 3,2 mm.
- anterioposterior = -2 mm von Bregma; lateral = ± 1,6 mm; ventral = 2,5 mm; anterioposterior = -3 mm vom Bregma; lateral = ± 2,6 mm; ventral = 3,2 mm.
- Montieren Sie einen 1μl Hamilton, Flachbild-Spritze und injizieren 0,5 ul Retrovirus pro Standort mit einer Rate von 0,25 ml / min in den Gyrus dentatus. (Siehe oben die Koordinaten für ventralen Tiefe.) Pause von 2 Minuten nach jeder Injektion, bevor langsam Zurückziehen der Spritze Flüssigkeit Rückfluss zu verhindern. Zwischen den Injektionen, kurz abspülen der äußeren Oberfläche der Spritze mit sterilem PBS und einem Applikator, um Spuren von Blut zu entfernen.
- Schließen Sie die Wunde mit sterilen chirurgischen Nahtmaterial (Typ P-1, Größe 6-0) und kehren das Tier auf Standard Wohnbedingungen, bis die gewünschte Zeit Stadien nach der Injektion.
2. Slice-Vorbereitung
Um qualitativ hochwertige akuten Scheiben von ausgewachsenen Mäusen, verwenden wir eine modifizierte Schneiden Lösung für Stück Vorbereitung (siehe unten).
- Pre-chill Schneiden Lösung auf 0-4 ° C auf Eis und Blase mit 95% O 2 -5% CO 2 für mindestens 30 Minuten.
- Betäuben und transkardial perfuse ein Tier mit eiskaltem sauerstoffgesättigten Schneiden Lösung.
- Schnelles Entfernen des Gehirns in eine Petrischale mit Filter-Papier mit kaltem, mit Sauerstoff Zuschnittlösung vorbenetzt. Cut off des Kleinhirns und in Scheiben schneiden einer Montagefläche mindestens 1 mm anterior der (sichtbare) Injektion Koordinaten. Kleben Sie die Gehirn-auf eine vibrotome Bühne und montieren Sie ihn in den Mahlraum mit Kalt-und sauerstoffreiches Schneid-Lösung gefüllt.
- Bereiten koronalen oder horizontale Schnitte (300-350μm) und übertragen Sie sie mit einer großen Bohrung Pipette eine Inkubation Kammer mit Raumtemperatur ACSF sprudelte mit 95% O 2 / 5% CO 2.
- Inkubieren Sie die Schnitte, sprudelnde kontinuierlich, bei 32 ° C für 30-60 Minuten. Return der Kammer auf Raumtemperatur für die Dauer der Aufnahme.
3. Elektrophysiologischen Experimenten
- 34 ° C - Scheiben sind in die Aufnahme Kammer, die kontinuierlich mit Sauerstoff gesättigt ACSF ist bei 32 ° C perfundiert übertragen
- Eine bipolare Wolfram Stimulationselektrode ist in der molekularen Schicht des Gyrus dentatus mit geringer Vergrößerung Mikroskop-Objektiv (10-fach) platziert.
- Newborn DGCs in der Sub-granular zone / Granularzelltumoren Schicht werden durch die Expression von GFP oder dTomato identifiziert. Whole-cell patchclamp Aufnahme befindet sich auf neugeborene Neuronen unter hoher Vergrößerung (40X) durchgeführt.
- Firing Eigenschaften der aufgenommenen Zellen werden durch Injektion von einer Reihe von Strömen unter Current-Clamp-Modus erhalten.
- Elektrische Reize werden durch die Stimulationselektrode über eine Stimulation Isolator durch die Recording-Software gesteuert geliefert, und evozierte postsynaptische Ströme in den neugeborenen DGCs werden aufgezeichnet.
4. Data Analysis
Amplituden der evozierten postsynaptischen Antworten sind in unterschiedlichen Entwicklungsstadien der Erwachsenen-geboren Neuronen analysiert.
5. Repräsentative Ergebnisse
Mit dem obigen Protokoll ist die GFP-Expression in Neugeborenen Gyrus dentatus Neuronen ähnlich Abbildung 1 gemeinsam. Beachten Sie, dass neugeborene Neuronen einfach visualisiert werden und sowohl Dendriten und Axone sind robust bezeichnet. Expression in dünne DGC Axonen und kleine Stacheln, hängt von der Qualität und der Titer des Virus, der Promotor verwendet und die Länge der in-vivo-Expression. In unseren Händen, sind neugeborene Zellen und subzellulären Organellen in der Regel innerhalb weniger Tage nach der Injektion sichtbar, und der Wirbelsäule Ausdruck kann von den frühesten Stadien der Entwicklung zurückgeführt werden. WLoch-Zell-Aufnahmen von neugeborenen Neuronen in verschiedenen Zeitstufen ermöglichen die Untersuchung einzigartig Neugeborenen Zelle Eigenschaften, zB Aktionspotentiale (Abbildung 2a), sowie den Prozess der synaptischen Integration in bestehende neuronale Schaltkreise während der Reifung (Abb. 2b).
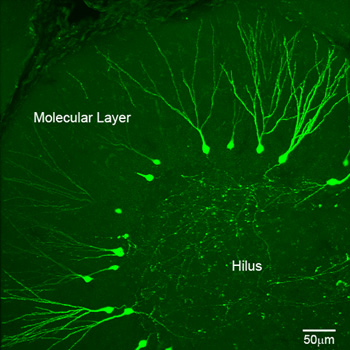
Abbildung 1 2-Photonen-konfokale Abbildung von neugeborenen Neuronen in einer horizontalen Gyrus dentatus Abschnitt einer erwachsenen Maus. Grüne Zellen sind 21dpi (Tage nach der Injektion) GFP-exprimierenden Neugeborenen DGCs mit PUX-GFP Retrovirus bezeichnet.
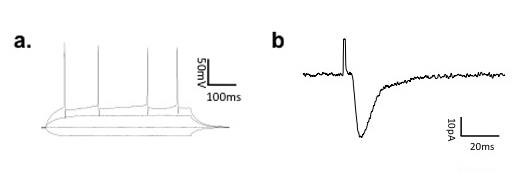
Abbildung 2 a) Aktionspotential feuern Eigenschaften eines Neugeborenen DGC bei 21 dpi. B) repräsentativ evozierten exzitatorischen postsynaptischen Ströme (EPSCs) auf ein neugeborenes DGC bei 21 dpi erfasst.
Diskussion
Kontinuierliche Neurogenese im Hippocampus von erwachsenen Säugetieren Gehirn bietet eine einzigartige experimentelle Modellsystem, um die neuronale Entwicklung und Integration in das reife Gehirn zu studieren. Das Protokoll hier vorgestellten verbindet retroviralen Kennzeichnung und elektrophysiologische Methoden, um die Integration von Neugeborenen dentatus Granulat Neuronen im Gehirn von erwachsenen Mäusen untersucht werden.
Um sicherzustellen, dass Ihre Experimente erfolgreich sind, empfehlen wir die folgenden während der kritischen Schritte des Verfahrens:
Zur Vermeidung von unerwünschten Infektion und Entzündung, sollten alle Instrumente sterilisiert (durch Autoklavieren, jede Art von Sterilisator oder 70% Ethanol) vor dem Eingriff werden. Verwenden Sie sterile PBS auf die Spitze der Spritze Nadel vor der Injektion zu waschen.
Für Virus Injektion, müssen die Tiere gut auf der stereotaktischen Vorrichtung montiert sein und die Quellen der unnötige Bewegung muss während der Injektion minimiert werden. Vergewissern Sie sich, der Kopf ist gut fixiert und fest, und passen Sie die Nase Position der Maus auf Stufe Bregma und Lambda vor Berechnung Injektion Koordinaten. Auszug Virus in die Spritze schnell um die Exposition gegenüber Raumtemperaturen zu minimieren - Retroviren sind besonders temperaturempfindlich. Inject Virus langsam in der empfohlenen Rate, um den Druck zu minimieren. Die Anwendung der empfohlenen flacher Spitze Spritze (vs. gemeinsamen abgeschrägte Spitze) wird dafür sorgen, eine gleichmäßig verteilte Gyrus dentatus Infektion Bereich.
Vor der Zubereitung Scheiben, müssen Schneid-Lösung und Inkubation ACSF mit 95% O 2 -5% CO 2 für mindestens 30 Minuten eingeleitet werden, damit Sauerstoff in die Lösung zu sättigen. Die Tiere sollten schnell durchströmt werden und Gewebe in kaltem, mit Sauerstoff gesättigte Lösung für die besten schneiden die Qualität erhalten bleibt.
Für die Aufnahme, erhöhen Sie die Reizstärke allmählich, bis es eine postsynaptische Antwort. Ort wechseln der Stimulationselektrode in der molekularen Schicht des Gyrus dentatus wie nötig.
Zusammengefasst bietet der empfohlene Ansatz einen Weg, um verschiedene Eigenschaften und mögliche funktionelle Rolle von Erwachsenen geboren Neuronen während Early-Stage-Integration zu erforschen in aktive, reife Schaltung.
Offenlegungen
Danksagungen
Diese Arbeit wurde von NINDS und American Heart Association zu S.Ge. finanziert Dieser Ansatz wurde ursprünglich gegründet, entwickelt und vom Autor in Dr. Hongjun Lied-Labor in der Johns Hopkins University. Wir möchten Dr. Hongjun Lied für seine Hilfe und Unterstützung bedanken.
Materialien
- Cutting-Lösung (in mM): 110 Cholinchlorid, 2,5 KCl, 1,3 KH 2 PO 4, 25,0 NaHCO 3, 0,5 CaCl 2, 7 MgCl 2, 10 Dextrose, 1,3 Natriumascorbat, 0,6 Natriumpyruvat, 5,0 Kynurensäure.
- Künstliche Cerebrospinalflüssigkeit (ACSF, in mM): 125.0 NaCl, 25,0 NaHCO 3, 2,5 KCl, 2 CaCl 2, 1,3 KH 2 PO 4, 1,3 MgCl 2, 1,3 Natriumascorbat, 0,6 Natriumpyruvat, 10 Dextrose.
- Interne Lösung für whole-cell patchclamp (in mm): 120 Kaliumgluconat, 15 KCl, 4 MgCl 2, 0,1 EGTA, 10,0 HEPES, 4 MgATP, 0,3 Na 3 GTP, 7 Phosphokreatin (pH 7,4, 300 mOsm).
Referenzen
- Zhao, C., Deng, W., Gage, F. H. Mechanisms and functional implications of adult neurogenesis. Cell. 132, 645-660 (2008).
- Ge, S., Goh, E. L., Sailor, K. A., Kitabatake, Y., Ming, G. L., Song, H. GABA regulates synaptic integration of newly generated neurons in the adult brain. Nature. 439, 589-593 (2006).
- Gavrilescu, L. C., Van Etten, R. A. Production of replication-defective retrovirus by transient transfection of 293T cells. J Vis Exp. , (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten