Method Article
Optical Imaging von Neuronen im Crab stomatogastrischen Ganglion mit spannungsabhängigen Farbstoffen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir die Methodik für schnelle und hochauflösende Fluoreszenz-Spannungs-sensitiven Farbstoff Bildgebung von detaillierten Aktivität von Neuronen in der Krabbe stomatogastrischen Ganglion.
Zusammenfassung
Voltage-sensitiven Farbstoff Bildgebung von Neuronen ist ein Schlüssel-Methode für das Verständnis, wie neuronale Netzwerke organisiert sind und wie die gleichzeitige Aktivität der beteiligten Nervenzellen führt zur Entstehung des integrierten Funktionalität des Netzwerkes. Hier präsentieren wir die Methodik der Anwendung dieser Technik zu identifizieren Muster erzeugenden Neuronen in der Krabbe stomatogastrischen Ganglion. Wir zeigen das Laden dieser Neurone mit dem fluoreszierenden Spannung Farbstoff Di-8-ANEPPQ und wir zeigen, wie man Bilder die Aktivität der Farbstoff beladenen Neuronen mit dem MiCAM02 hoher Geschwindigkeit und hoher Auflösung CCD-Kamera Imaging-System. Wir zeigen die Auswertung der aufgezeichneten Bilddaten mit dem BVAna Imaging-Software mit dem MiCAM02 Imaging-System verbunden. Die gleichzeitige Spannungs-sensitiven Farbstoff Darstellung der detaillierten Aktivität mehrerer Neurone in der Krabbe stomatogastrischen Ganglion angewendet zusammen mit traditionellen Techniken der Elektrophysiologie (intra-und extrazellulären Aufnahmen) eröffnet völlig neue Möglichkeiten für das Verständnis, wie central pattern generator neuronalen Netzen arbeiten.
Protokoll
1. Vorbereitung des Crab stomatogastrischen Nervous System
Adult Cancer pagurus L. wurden aus lokalen Quellen (Newcastle University, Dove Marine-Laboratories) zu beschaffen und in gefiltertes, Porenbeton Meerwasser (10 bis 12 ° C). Die Tiere wurden durch die Verpackung sie in Eis für 20 narkotisierten - 40 min vor ihrer Zerlegung. Wir verwendeten isolierten stomatogastrischen Nervensystem (Tln) 1. Die Tln wurde in einem Silikon-Elastomer-ausgekleidete (ELASTOSIL RT-601, Wacker, München, Deutschland) Petrischale merken und kontinuierlich superfundiert (7 bis 12 mL / min) mit gekühlten Kochsalzlösung (10-13 ° C). Physiologische Kochsalzlösung bestand aus (mmol * l-1): NaCl, 440; MgCl 2, 26; CaCl 2, 13; KCl, 11; Trisma Basis, 10; Maleinsäure, 5. 13 ° C und bei pH 7,4 - - 7,6 Saline wurde bei einer konstanten Temperatur von 11 gehalten.
Die detaillierten Schritte der Tln Dissektion und Vorbereitung, einschließlich der desheathing der stomatoastric Ganglion (STG), sind in der JoVE Artikel von Guttierez und Grashow 1 dargestellt. Alle Experimente wurden in Übereinstimmung mit der Europäischen Gemeinschaften Richtlinie des Rates vom 24. November 1986 (86/609/EWG) vorgenommen. Abbildung 1A zeigt eine schematische Darstellung des Tln und Abbildung 1B zeigt eine typische desheathed STG mit seiner Neuronen als flache Halbkreis in den hinteren Teil des Ganglion angeordnet.
Mit Knetmasse, die Petrischale mit dem Tln ist es, die operative Plattform der Imaging-Mikroskop (Olympus, Tokyo, Japan BW51 WI) fixiert. Sowohl die Mikroskoptisch und das Mikroskop auf einem schwingungsisolierte Tisch montiert (Scientifica, Uckfield, UK), um Bewegungsartefakte bei der optischen Aufzeichnung zu verhindern. Die Bewegungsmuster im stomatogastrischen Ganglion (STG) generiert werden anhand extrazellulären Aufnahmen 2-4. Dies wird durch die folgenden Schritte:
- Ein Vaseline-Basis zylindrischen Kammer ist um einen Abschnitt der wichtigsten motorischen Nerven (LVN) elektrisch zu isolieren den Nerv aus dem Bad (dies ist auf die Präparation der Bühne geschehen, bevor die Petrischale auf dem Betriebssystem-Plattform der Imaging-Mikroskop gelegt wird gebaut ).
- Einer von zwei Edelstahl-Elektroden-Drähte in dieses Fach gelegt, die andere in das Bad als Referenz-Elektrode.
- Das Differenzsignal wird aufgezeichnet, gefiltert und verstärkt mit einem AC-Differenzverstärker (Univ. Kaiserslautern, Deutschland).
- Die motorische Aktivität der Ganglienzellen wird überwacht mit einem Oszilloskop (DL708E; Yokogawa, Tokyo, Japan) und wird zusätzlich aufgenommen mit einem Datenerfassungs-Board (CED Power, 1401, Cambridge Electronic Design, Cambridge, UK) und der Spike 2 v6.10 Software (Cambridge Electronic Design, Cambridge, UK). Die Dateien werden analysiert mit Spike 2 v6.10 (Cambridge Electronic Design, Cambridge, UK).
2. Vorbereitung der Farbstofflösung
Wir nutzten die fluoreszierenden Spannung Farbstoff Di-8-ANEPPQ (Cambridge Bioscience) 5, die eine doppelte positive Ladung, die die Beladung des Farbstoffes durch Mikroelektroden erleichtert durch positive Stromimpulse hat. Der Farbstoff-Lösung sollte vor Licht so weit wie möglich geschützt werden. Die Farbstofflösung wird wie folgt hergestellt:
- 5 mg des Farbstoffs ist mit 1 ml F-127 Pluronic Säure in DMSO (Invitrogen) gemischt.
- Die Kunststoff-Fläschchen mit dem gelösten Farbstoff wird für 20 Minuten bei 12.000 zentrifugiert Drehung / Minute in einer Sigma Microcentrifuge 1-14 (Sigma, Osterode, Deutschland), um größere Farbpartikel, dass die Mikroelektrode verstopfen können zu trennen.
- Der Überstand (top 200 ul) der Farbstofflösung wird anschließend über ein Pipette und in einem separaten Kunststoff-Fläschchen. Beide Flaschen sind in Aluminiumfolie ein, um Lichteinfall zu verhindern gewickelt.
- Die Farbstofflösung wird bei -20 ° C eingefroren
- Vor dem Einsatz der Lösung des Farbstoffes ist, indem die geschlossene und wickelte Fläschchen in warmen (25 ° C) Wasser für 10-15 Minuten geschmolzen.
3. Dye Loading durch intrazelluläre Injektion mit der Sharp Mikroelektroden
Wir verwendeten scharfen Mikroelektroden an die Neuronen mit dem Farbstoff zu laden. Zur Überprüfung der Farbstoff Laden verwenden wir die MiCAM02 Imaging-System (SciMedia, Tokyo, Japan) 6. Das bildgebende System besteht aus zwei CCD-Kameras: Die HR-Kamera verfügt über einen größeren Sensor-Chip (6,4 mm x 4,8 mm) eine bessere räumliche Auflösung mit der besten zeitlichen Auflösung betrug 1,4 ms, hat das HS-Kamera eine kleinere (2,9 mm x 2,1 mm), aber schneller Sensor-Chip ermöglicht schnellere Bildgebung mit 0,7 ms as its best zeitlicher Auflösung. Die Schritte des Farbstoffes loading sind wie folgt:
- Mikroelektroden sind mit zog eine P-97 Flaming - Brown (Sutter Instruments, Novato, CA, USA) Elektrode Abzieher mit 10 cm lang, 1 mm Außendurchmesser Glasröhrchen mit Filament (GB100TF 8P, Science Products, Hofheim, Deutschland). Die Elektroden werden gezogen, um einen Widerstand in der habenSpektrum von 25 bis 40 MOhm in 3M KCl (geeignete ziehen Parametereinstellungen der Pipette Kochbuch von dem Hersteller der Elektrode puller vorgesehen folgen).
- Die gefrorenen Farbstofflösung wird geschmolzen und eine sehr kleine Menge davon wird in eine Microfil Nadel (Microfil - 34G, World Precision Instruments, Sarasota, FL, USA) - sog die angesaugte Farbstoff füllt rund 2 / 3 rd der Microfil Nadel .
- Die Farbstofflösung in der Microfil Nadel wird in die Spitze einer Mikroelektrode injiziert. Die Mikroelektrode wird in einer dunklen Box für 15 Minuten gelegt.
- Die Mikroelektroden ist mit 3M KCl-Lösung aufgefüllt. Die Elektrode wird dann wieder in eine dunkle Elektrode Aufbewahrungsbox für weitere 10-20 Minuten platziert, um die Farbstoff-Lösung ermöglicht die feine Spitze der Elektrode durch den Sog der Kapillare wirkende Kraft in der Mikroelektrode zu erreichen.
- Die fertig Mikroelektroden in einem Elektrodenhalter gelegt und fixiert auf die headstage der intrazellulären Verstärker (IA-251A, Warner Instruments Corporation, Hamden, CT, USA).
- Die intrazellulären Verstärker ist auf die Messkarte, dass ein Impulssignal an Stromimpulse in die Mikroelektroden-Laufwerk bereitstellt.
- Die Mikroelektrode wird sanft in die Membran einer Nervenzelle STG mit einer Mikroelektrode Manipulator (PatchStar, Scientifica Ltd, Uckfield, UK) platziert. Da der Arbeitsabstand der 10fach Objektiv (UMPLFL10XW, NA 0,30, WD 3,3 mm; Olympus Corporation, Tokio, Japan) von der Imaging-Mikroskop ist sehr klein, sollte die Mikroelektrode in eine Schräglage positioniert werden (ca. 30 °) und die Bewegung der Mikroelektrode in die richtige Position erfordert mehrere Schritte der Neuausrichtung des Mikroskop-Objektivs und Bewegung der Mikroelektrode. Zum Start der Mikroelektroden ist in der Lage, so dass seine Spitze über dem STG bewegt wird. Die Mikroskop-Objektiv ist abgesenkt, bis die Spitze der Elektrode erscheint im Fokus. Dann ist es weiter, sondern senkte nicht so viel um die Mikroelektroden-Touch. Die Mikroelektrode wird abgesenkt, bis sie-re erscheint im Fokus des Objektivs. Diese Schritte werden wiederholt, bis die Neuronen klar erscheinen in der Fokusebene des Objektivs. Dann wird der Mikroelektroden ist abgesenkt, bis sie und berührt vorsichtig durchsticht die Membran des ausgewählten STG Neurons. Dies wird überwacht mit dem Oszilloskop.
- Die intrazelluläre Elektrode wird verwendet, um die Aktivität der ausgewählten STG Neuron aufnehmen, um das Neuron aufgrund seiner Tätigkeit Profil und die Beziehung zwischen ihrer Tätigkeit und der STG-Aktivität von der extrazellulären Elektrode 2,3,7 aufgenommen zu identifizieren.
- Die intrazellulären Verstärker ist in Stromeinspeisung umgeschaltet und wird für 30 Minuten zur 10 nA positive aktuellen Schritte in die Mikroelektroden, die zuletzt für ca. 1 Sekunde und 1 Sekunde Lücken sind derzeit keine Injektion in den Mikroelektroden getrennt zu injizieren. Der eingespeiste Strom treibt die positiv geladenen Farbstoffmoleküle in die aufgezeichneten Neuronen. Werden Geräte verfügbar mehrere Neuronen gleichzeitig injiziert werden.
- Zehn Minuten nach der Injektion Zeitraum und nach dem Ende der Injektion der Farbstoff Ausbreitung des Neurons wird überprüft. Dazu verwenden wir die MiCAM02 Imaging-System (SciMedia Ltd, Tokio, Japan) mit dem 10-fach Objektiv und Beleuchtung durch den Ultra-Low-Ripple-Halogen-Lichtquelle (HL-151; Moritex, Tokyo, Japan) durch den Filter cube MSWG2 (mit 480-550 nm Anregungsfilter, Olympus Corporation, Tokio, Japan). Das bildgebende System ist auf die HR-Kamera mit 192 x 128 Pixel Auflösung, 40 ms Belichtungszeit, die "hbin"-Modus, und 10 Frames pro Imaging-Sitzung zu verwenden. Wenn der Farbstoff Befüllung erfolgreich die Bildgebung sollte einen gefärbten Fleck in das Neuron rund um den Standort der Mikroelektroden, und das gefärbte Pflaster sollte zwischen den Bildern nach 10 Minuten und nach 30 Minuten genommen werden. Wenn die Ausbreitung des Farbstoffes ist nach 30 min nicht ausreicht, ist mehr Einspritzzeit gewährt. Alternativ kann ein neuer Farbstoff Elektrode verwendet werden.
- Die Elektrode wird aus dem Neuron gezogen und das Neuron bleibt für mindestens 20-30 Minuten entspannen. Innerhalb dieser Zeit kann das nächste Neuron mit Farbstoff injiziert werden.
4. Imaging von Dyed Neurons
Die Aktivität der einzelnen Neuronen kann nach dem Farbstoff Füllvorgang abgebildet werden. Alternativ können zwei oder mehr Neuronen zu Bild gefüllt werden die gleichzeitige Aktivität von mehreren STG Neuronen. Im Prinzip viele und möglicherweise alle STG Neuronen kann mit Farbstoff gefüllt werden. Die Abbildung der Neuronen mit dem Micam 02 Imaging-System mit dem HR-Kamera gemacht. Das Verfahren der Bildgebung ist wie folgt:
- Die Mikroskop-Objektivs verändert wird und eine hohe Lichtdurchlässigkeit Effizienz 20x-Objektiv (XLUMPLFL20XW/0.95, NA 0,95, WD 2,0 mm; Olympus Corporation, Tokio, Japan) ist für die Bildgebung der Datenerhebung eingesetzt. Dieses Ziel sammelt viel Licht, dass die 10-fach Objektiv und auch höherer Vergrößerung gibt die detailliertere Bild der Neuronen. Bein g mehr Licht effizient bedeutet, dass kleine Menge an Farbstoff Laden bereits sichtbar ist mit diesem Ziel und auch, dass wir geringere Lichtintensität für die Bildgebung eine Minderung der potenziellen Foto Schäden, die auf die Neuronen, die durch den Farbstoff verursacht werden können.
- Das Mikroskop der operativen Phase wird so positioniert, dass die Neuronen, die gemeint, die abgebildet werden sollen, in das Sichtfeld des Objektivs sind und das Ziel ist auf sie konzentriert.
- Die extrazelluläre Aufzeichnung von Daten ist auch in den Micam 02 Imaging-System durch seine analogen Eingangskanal eingespeist. Dies ermöglicht die relativ leicht über der optischen Signale und entsprechende Bewegungsmuster oder extrazellulär erfasst Spikes in der Analyse-Phase.
- Die Micam 02-System ist auf 96 x 64 Pixel Auflösung mit 2,2 ms Belichtungszeit oder 48 x 32 Pixel Auflösung mit 1,5 ms Belichtungszeit verwenden. In beiden Fällen ist die "hbin 'Einstellung kann verwendet werden, wenn die Färbung der Neuronen ist nicht sehr stark sein.
- Die Lichtstärke ist so niedrig wie möglich (dh der Farbstoff in den Neuronen zu erzeugen noch ausreichende Fluoreszenz für die Bildgebung) eingestellt auf ein Foto, Modulations-und Foto Beschädigung der aufgezeichneten Neuronen zu vermeiden.
- Die Raumbeleuchtung und alle übrigen Lichtquellen ausgeschaltet sind. Darüber hinaus kann ein schwarzer Vorhang um die Aufnahme rig geschlossen werden, um Belichtung aus externen Quellen zu verhindern.
- Die Imaging-Sitzungen werden auf einen Wert zwischen 4 - 16 Sekunden lang.
- Die spontane Aktivität der Neuronen gefärbt ist über mehrere Imaging-Sitzungen aufgezeichnet.
5. Die Analyse der Optical Imaging-Daten
Zur Analyse der Bilddaten benutzten wir die BVAna Software (Version 10,08; SciMedia Ltd, Tokio, Japan) mit dem Micam 02 Imaging-System verbunden. Die Software unterstützt die Visualisierung der Bilddaten und bietet eine Reihe von Analyse-Tools sowie. Die Schritte der Datenanalyse und-interpretation sind wie folgt:
- Eine entsprechende kreisförmigen Bereich von Interesse ist auf jeden aufgezeichneten Neuronen ausgewählt. In der Regel verwenden wir 2 bis 3 Pixel Radius Regionen von Interesse für die Untersuchung Neuronen an der 48 x 32 Pixel Auflösung, und 6 bis 8 Pixel-Radius Regionen von Interesse für die Untersuchung Neuronen bei 96 x 64 Auflösung.
- Die zeitliche Glättung der Daten erforderlich sein, insbesondere dann, wenn der Farbstoff relativ geringe Menge der Fluoreszenz (low Hintergrund Wert in die die Daten bedeutet dies, kann es aufgrund der geringen Lichtintensität, die verwendet wird oder niedrigen Niveau Farbstoff Laden, zum Beispiel in einem Neuriten der aufgezeichneten Neuron). In der Regel in solchen Fällen benutzten wir die zeitliche Glättung mit 3 bis 5 Zeiteinheiten.
- Zusätzlich zu den optischen Aufnahmen haben wir auch Anzeige der extrazellulären Aufnahme, indem Sie auf den analogen Eingang des bildgebenden Systems anzuzeigen.
- Die Parameter für die Visualisierung der optischen Daten und den analogen Eingang sollte entsprechend eingestellt werden, um alle Aufnahmen auf dem Bildschirm zu sehen.
- In Anbetracht der optischen Aufnahmen der Neuronen, die extrazelluläre Aufnahme aus dem LVN, und die Klassifizierung des Neurons auf den früheren intrazelluläre Aufnahme basiert, ist es möglich, die Identität des Neurons zu ermitteln und deren Tätigkeit auf die neuronalen Aktivitäten aus den aufgezeichneten beziehen Nerv.
- Es wird erwartet, dass die optischen Aufnahmen zeigen deutlich, und ohne die Notwendigkeit der Mittelung über mehrere ähnliche Ereignisse, die neuronalen Aktivitäten entsprechend extrazellulär erfasst Spikes und auch unterschwellige Ereignisse wie hemmenden postsynaptischen Potentiale durch die Aktivität anderer Nervenzellen verursacht.
- Der Datenexport Merkmale des BVAna Software kann verwendet werden, um die optischen Aufnahmen für den ausgewählten Regionen von Interesse und auch den analogen Eingang, dass die Aufnahme aus dem lvn enthält berechnet exportieren. Die exportierten Daten können verarbeitet und analysiert werden weiter mit anderen Daten-Analyse-Software als auch (zB im einfachsten Fall Microsoft Excel (Microsoft, Redmond, WA, USA) kann für zusätzliche Visualisierung und Datenverarbeitung verwendet werden).
6. Repräsentative Ergebnisse
Abbildung 2 zeigt die gleichzeitige Aufnahme von zwei Neuronen (LP, seitliche Pylorus Neuron; PD, Pylorus Dilatator Neuron) in den Pylorus central pattern generator einer Krabbe STG zusammen mit der Aufnahme aus dem LVN. Die optischen Aufnahmen der LP und PD Neuronen auf der Grundlage ihrer intrazellulären Aufnahmen identifiziert zeigen, dass in der Tat diese Übereinstimmung auch mit der extrazellulären Aufnahmen entsprechend LP und PD Neuronen. Es ist eine konsequente 12 ms Verzögerung zwischen dem optischen und lvn Aufnahmen von Spike Peaks (siehe Einschub in Abbildung 2) durch die axonale Übertragung Verzögerung zwischen dem Ganglion und der extrazellulären Aufnahme vor Ort. Die vorgestellten Daten zeigen auch, dass die neuronale Aktivität in der Soma, die Spitzen der aufgezeichneten Neuronen entspricht eindeutig nachweisbar ist.
s/ftp_upload/2567/2567fig1.jpg "alt =" Bild 1 "/>
Abbildung 1. A) Schematische Darstellung der stomatogastrischen Nervensystems (Tln). COG, kommissuralen Ganglion; OG, Schlundganglion; STG, stomatogastrischen Ganglion; stn, stomatogastrischen Nerven; lvn, lateral ventrikuläre Nerven. B) Die Krabbe stomatogastrischen Ganglion (STG) - das Bild zeigt die halbrunde Anordnung der hinteren STG Neuronen.
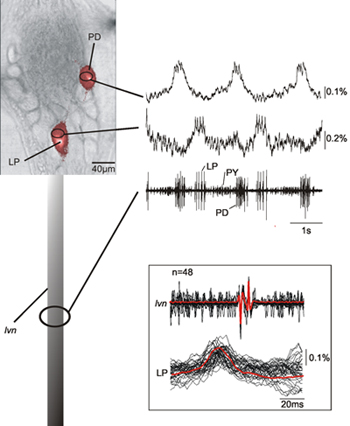
Abbildung 2. Gleichzeitige Single Sweep-Aufzeichnung eines PD und eine LP Neuron zusammen mit der Aufzeichnung des LVN. Die Daten zeigen, dass die optischen und Nerven-Aufnahmen sehr gut passen und dass wir die neuronalen Aktivitäten entsprechend Spikes aufgezeichnet bilden die Nervenzellen zu identifizieren. Der Einschub zeigt eine Überlagerung von mehreren Sweeps von LP Aktionspotentiale - sowohl optisch als auch elektrisch aufgezeichnet - und deren durchschnittliche Nachweis der Übereinstimmung zwischen optisch und elektrisch aufgezeichneten Aktivitäten. Aufgrund der Tatsache, dass unsere optischen Aufzeichnungsverfahren nicht filtern die niederfrequenten Komponenten der Daten können wir auch zu langsam Membranpotential Veränderungen charakteristisch für PD und LP Neuronen 14 Eintragung.
Diskussion
Die Spannung Farbstoff Bildgebung 8,9 von STG Neuronen in Kombination mit traditionellen Methoden der Elektrophysiologie (intra-und extrazellulären Elektrode Aufnahmen) ermöglicht ein besseres Verständnis davon, wie dieses kleine, bekannte und noch komplexe neuronale System funktioniert. Die STG ist ein Prototyp des central pattern generator (CPG) neuronalen Netzen (sie umfasst die Pylorus und Magenmühle Rhythmus Netze) 10,, 11, damit ein besseres Verständnis der entstehenden funktionellen Eigenschaften der STG auch helfen zu verstehen, wie im allgemeinen CPG-Netzwerke erzeugen ihre Netzwerk-Ebene Funktionalität. CPG-Netzwerke spielen eine entscheidende Rolle bei der Motorsteuerung 12 und auch in höheren kognitiven Funktionen 13, damit ein besseres Verständnis ihrer emergenten Eigenschaften haben einen großen Einfluss in vielen Bereichen der Neurowissenschaften.
Offenlegungen
Danksagungen
Wir danken für die Unterstützung von der School of Computing Science and Faculty of Science, Landwirtschaft und Engineering von der Universität Newcastle, von der Universität Ulm, und durch die SciMedia Ltd (Tokyo, Japan).
Materialien
| Name | Company | Catalog Number | Comments |
| MiCAM02 | SciMedia | Imaging system | |
| BVAna v.10.08 | SciMedia | Data analysis software for the MiCAM 02 imaging system | |
| HL-151 | Moritex, Tokyo, Japan | Ultra-low ripple halogen light source | |
| BX51 WI | Olympus Corporation | Upright microscope for epifluorescence imaging | |
| 20x imaging objective | Olympus Corporation | XLUMPLFL20XW/0.95 | NA 0.95, WD 2.0mm |
| 10x imaging objective | Olympus Corporation | UMPLFL10XW | NA 0.30, WD 3.3mm |
| Filter cube with 480-550 nm excitation filter and 590nm emission filter | Olympus Corporation | MSWG2 | |
| Antivibration table | Scientifica Ltd | 63-534 | |
| PatchStar electrode manipulator | Scientifica Ltd | PS-7000C | Micro-electrode manipulator |
| CED Power 1401 | Cambridge Electronic Design | Data acquisition board | |
| DL708E Oscilloscope | Yokogawa | Intracellular amplifier | |
| AC differential amplifier | University of Kaiserslautern, Germany | Extracellular amplifier | |
| P-97 Flaming – Brown type electrode puller | Sutter Instrument Co. | Electrode puller | |
| Sigma Microcentrifuge 1-14 | Sigma-Aldrich | Centrifuge | |
| Genex Pipettors Mline | Scientific Laboratory Supplies LTD | PIP7774 | PIP7774 |
| Glass micropipette with filament | Science Products | GB100TF 8P | Glass for micr–lectrodes |
| MicroFil – 34G | World Precision Instruments, Inc. | Microfil needle | |
| Spike 2 v6.10 | Cambridge Electronic Design | Electrophysiology software | |
| Di-8-ANEPPQ | Cambridge BioScience | BT61014 | Fluorescent voltage sensitive dye |
| F-127 Pluronic Acid, DMSO | Invitrogen | P-3000MP | Solvent |
| NaCl | Sigma-Aldrich | S9888 | Crab saline component |
| CaCl2 . 2H2O | Sigma-Aldrich | C3881 | Crab saline component |
| KCl | Sigma-Aldrich | P3911 | Crab saline component, electrolyte solution |
| MgCl2 . 6H2O | Sigma-Aldrich | M9272 | Crab saline component |
| Trizma base | Sigma-Aldrich | T1503 | Crab saline component |
| Maleic acid | Sigma-Aldrich | M0375 | Crab saline component |
| Elastosil RT-601 | Wacker, Munich, Germany | Lining of Petri dishes |
Referenzen
- Gutierrez, G. J., Grashow, R. G. Cancer borealis stomatogastric nervous system dissection. J Vis Exp. , (2009).
- Bartos, M., Nusbaum, M. P. Intercircuit control of motor pattern modulation by presynaptic inhibition. J. Neurosci. 17, 2247-2256 (1997).
- Blitz, D. M., Nusbaum, M. P. Motor pattern selection via inhibition of parallel pathways. J Neurosci. 17, 4965-4975 (1997).
- Stein, W., Smarandache, C. R., Nickmann, M., Hedrich, U. B. Functional consequences of activity-dependent synaptic enhancement at a crustacean neuromuscular junction. J Exp Biol. 209, 1285-12300 (2006).
- Loew, L. Potentiometric dyes: Imaging electrical activity of cell membranes. Pure & Appl Chem. 68, 1405-1409 (1996).
- Tominaga, T., Tominaga, Y., Yamada, H., Matsumoto, G., Ichikawa, M. Quantification of optical signals with electrophysiological signals in neural activities of Di-4-ANEPPS stained rat hippocampal slices. J Neurosci Meth. 102, 11-23 (2000).
- Heinzel, H. G., Weimann, J. M., Marder, E. The behavioral repertoire of the gastric mill in the crab, Cancer pagurus: an in situ endoscopic and electrophysiological examination. J Neurosci. 13, 1793-1803 (1993).
- Zecevic, D., Wu, J. -. Y., Cohen, L. B., London, J. A., Höpp, H. P., Falk, C. X. Hundreds of neurons in the Aplysia abdominal ganglion are active during the gill-withdrawal reflex. J Neurosci. 9, 3681-3689 (1989).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. J Neurosci. 26, 10925-10933 (2006).
- Nusbaum, M. P., Beenhakker, M. P. A small-systems approach to motor pattern generation. Nature. 417, 343-350 (2002).
- Marder, E., Bucher, D. Understanding circuit dynamics using the stomatogastric nervous system of lobsters and crabs. Ann Rev Physiol. 69, 291-316 (2007).
- Grillner, S. Biological pattern generation: the cellular and computational logic of networks in motion. Neuron. 52, 751-766 (2006).
- Yuste, R., MacLean, J. N., Smith, J., Lansner, A. The cortex as a central pattern generator. Nat Rev Neurosci. 6, 477-483 (2005).
- Stein, W. Modulation of stomatogastric rhythms. J Comp Physiol A. 195, 989-1009 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten