Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Studieren Zellrollen Trajectories auf Asymmetric Rezeptor Patterns
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Protokoll zu beobachten und zu analysieren Zellrollen Trajektorien auf asymmetrische Rezeptor-gemusterten Substrate. Die resultierenden Daten sind nützlich für das Engineering von Rezeptor-gemusterten Substrate für Label-freie Zelle Trennung und Analyse.
Zusammenfassung
Seitliche Verschiebung der Zellen senkrecht zu einer Strömung durch Rollen auf asymmetrische Rezeptor-Muster stellt eine Chance für die Entwicklung neuer Geräte für die Label-Free-Trennung und Analyse von Zellen 1. Solche Geräte können seitliche Verschiebung für Durchlauferhitzer Trennung oder Rezeptor-Muster, die Adhäsion modulieren, um zwischen verschiedenen Zellphänotypen oder Ebenen der Rezeptor-Expression unterscheiden zu verwenden. Das Verständnis der Natur der Zelle rollt Trajektorien auf Rezeptor-gemusterten Substrate notwendig ist für das Engineering der Substrate und Gestaltung von solchen Geräten.
Hier zeigen wir ein Protokoll zur Untersuchung von Zell rollenden Bahnen auf asymmetrische Rezeptor Muster, Zellrollen Haftung 2 unterstützen. Klar definierte, um angelegte Muster der P-Selektin-Rezeptoren wurden unter Verwendung Mikrokontaktdrucken auf Gold-beschichtete Folien, die in einer Flusskammer aufgenommen wurden. HL60-Zellen, die PSGL-1-Ligand 3 wurden über ein Feld von gemusterten Linien flossen und visualisiert auf einer invertierten Hellfeld-Mikroskop. Die Zellen gerollt und entlang der schrägen Kanten der Muster verfolgt, was in seitliche Auslenkung 1. Jede Zelle in der Regel für eine bestimmte Strecke entlang der Muster Kanten (definiert als die Kante Tracking Länge) gerollt, losgelöst von der Kante, und wieder an einem nachgeschalteten Muster. Obwohl diese Distanz macht es schwierig, die gesamte Flugbahn einer Zelle vom Eingang bis in die Strömungskammer Ausfahrt track war Partikel-Tracking-Software verwendet werden, um zu analysieren und die Ausbeute der rollenden Bahnen der Zellen während der Zeit, als sie auf einem einzigen Rezeptor bewegten gemusterte Linie. Die Bahnen wurden dann untersucht, um Verteilungen von Zellrollen Geschwindigkeiten und dem Rand Tracking Längen für jede Zelle für verschiedene Muster zu erhalten.
Dieses Protokoll ist sinnvoll für die Quantifizierung Zellrollen Trajektorien auf Rezeptor-Muster und über diese Parameter wie Muster Winkel und Schubspannung. Diese Daten werden von Nutzen sein für die Gestaltung von mikrofluidischen Bauteilen für Label-freie Zelle Trennung und Analyse.
Protokoll
1. HL60 Zellrollen
1.1. Herstellung von gemusterten Substrate.
- Mit Mikrokontaktdrucken (mCP) 4-7 zu machen abwechselnd selbstorganisierten Monoschichten (SAMs) von PEG-Moleküle auf der gold-beschichtete Glasträger: Fertigen Mikrokontaktdrucken Polydimethylsiloxan (PDMS) Briefmarken, dass der Rezeptor-Muster mit einem Neigungswinkel von α = 10 definiert ° durch eine SU-8 Formverfahren. Reinigen Sie die Goldoberfläche mit Piranha-Lösung (3:1 Mischung von Schwefelsäure zu 30% Wasserstoffperoxid) für 20 Minuten und dann spülen Sie die Oberfläche mit reichlich VE-Wasser bei 24,5 ° C vor dem Gebrauch. Ink die PDMS-Stempel mit 5 mM PEG-Lösung in Ethanol. Trocknen Sie die Stempel in Luft für 20 Minuten. Vorsichtig legte der Stempel auf der Goldoberfläche für 40 sec und stellen Sie sicher, gibt es einen guten Kontakt zwischen der Goldoberfläche und der Stempel. Kein Überdruck erforderlich ist. Spülen Sie die Oberfläche mit Ethanol und trocknen Sie es unter einem Strom von N 2.
- Inkubieren des Substrats in P-Selektin-Lösung (15 pg / mL in DPBS) mit einem Perfusionskammer (Electron Microscopy Sciences) für 3 Stunden bei 24,5 ° C um Muster die verbleibenden Bereiche mit P-Selektin. Spülen Sie die Oberfläche mit reichlich DPBS.
- Backfill die Oberfläche mit BSA (1 mg / mL in DPBS) für 1 h zu blockieren unspezifische Wechselwirkungen. Spülen Sie die Oberfläche mit reichlich DPBS.
1.2. Zellrollen Experimente in einer Flusskammer.
- Durchfluss einer Suspension von HL60-Zellen (~ 10 5 Zellen / ml) über den gemusterten Oberflächen in einem rechteckigen Flusskammer (Glycotech, Inc; Breite w = 1,0 cm, Länge = 6 cm, Höhe h = 0,0127 cm) bei 24,5 ° C. Verwenden Sie eine Spritzenpumpe (World Precision Instruments, SP230IW) auf Durchfluss von 75 ul / min erzeugen, mit entsprechenden Schubspannung rund 0,5 dyn / cm 2 (~ 0,05 Pa). Berechnen Schubspannung τ mit dem Flugzeug Poiseuille-Strömung Gleichung τ = 6μQ/wh 2, wobei μ der kinematischen Viskosität (0,001002 Pa s), Q Volumenstrom ist, ist w Breite der Flusskammer und h ist die Höhe der Flusskammer.
- Verwenden Sie einen inversen Mikroskop (Nikon TE2000-U) mit einer montierten Kamera (Andor iXon 885) zu HL60 Zellen rollenden Interaktionen mit Klebstoff P-Selektin Substrate mit einem 4 × Rekord Ziel, in der Regel mit einer Rate von 1 Bild pro Sekunde für eine Dauer von 300 s. Führen Sie drei unabhängigen Experimenten für jede Schubspannung Größe und Muster Neigungswinkel. Die vorliegenden Daten als Mittelwerte und Standardabweichung der Mittelwerte aus jedem Experiment erhalten.
- Data Analysis.
Analysieren Sie die Bildsequenzen in einem individuellen Matlab (Mathworks, Inc.) Programm, das eine particle tracking freeware 8 bis Tracks entlang der gemusterten line Kanten erzeugen genutzt. Tracks Verlängerung bis zum Ende der P-Selektin-Band ausgewählt und mit zwei geraden Liniensegmenten - eins mit der Strömung ausgerichtet ist, die andere mit dem Muster Rand ausgerichtet. Diese beiden Segmente werden dann verwendet, um den Rand Tracking Länge zu berechnen, Abrollgeschwindigkeit auf der Kante und Abrollgeschwindigkeit auf der Ebene Region.
2. Repräsentative Ergebnisse:
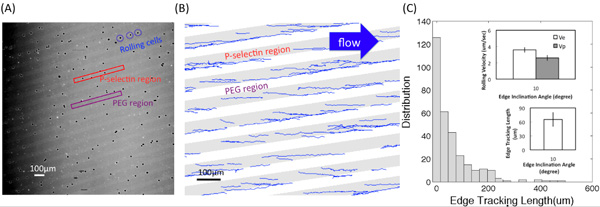
Abbildung (A) zeigt eine mikroskopische Bilder aus dem Video von HL60 rollenden Interaktionen mit Klebstoff P-Selektin Substrate mit einem 4 × Ziel umgewandelt. Helle und dunkle Regionen auf P-Selektin-Rezeptors und PEG Regionen entsprechen jeweils. Abbildung (B) zeigt die Spuren unter Verwendung eines kundenspezifischen Matlab-Programm. Die Kante Neigungswinkel betrug 10 ° und die Schubspannung betrug 0,5 dyn / cm 2. Die Kante Tracking Länge l e, Vertreibung, d, und das rollende Geschwindigkeiten auf dem Rand und innerhalb der Bänder, V e und V p, bzw., wie in Abbildung beschrieben sind (C-1). Abbildung (C-2) zeigt die Verteilung (die Anzahl der aufgenommenen Zellen) der Kante geschnitten wird. Einschübe zeigen die durchschnittlichen Wert von l e und die rollenden Geschwindigkeit auf der Kante (V e) und innerhalb der Bänder (V p) bei der Neigungswinkel α = 10 ° und die Flüssigkeit Schubspannung Größenordnung von rund 0,5 dyn / cm 2. Fehlerbalken stellen eine Standardabweichung, n = 3 wiederholten Experimenten (3 replizieren Oberflächen) für jede Bedingung.
Diskussion
Wir haben ein Protokoll beschriebenen Zellrollen Trajektorien auf asymmetrische Rezeptor-gemusterten Oberflächen hergestellt mit Mikrokontaktdrucken 2 zu prüfen. Das optische Mikroskop Bilder von strukturierten Oberfläche zeigt deutliche Kontrast zwischen PEG und P-Selektin Bereichen eingesetzt, um zu bestätigen, ob Stanzen erfolgreich ist. Sharp, geraden Kanten kann beobachtet werden, wenn das Stampfen gut durchgeführt werden. Harte Drücken des Stempels kann Stempel Deformation, die die Präzision der ...
Offenlegungen
Danksagungen
Dieses Projekt wurde von der Deshpande Center for Technological Innovation am MIT (RK und JMK) und der NSF CAREER Award 0952493 durch die chemischen und biologischen Separations Programm RK unterstützt. Wir danken dem Institute for Soldier Nanotechnologies (ISN) und der Microsystems Technology Laboratory (MTL) am MIT für die Nutzung ihrer Einrichtungen.
Materialien
| Name | Company | Catalog Number | Comments |
| Human promyelocytic leukemia cells | ATCC | CCL-240 | HL60 cells |
| Gold-coated glass slides | EMF | TA134 | Gold slides |
| (1-Mercaptoundec-11-yl)tetra(ethylene glycol) | Sigma-Aldrich | 674508 | PEG |
| Recombinant human P-selectin | R&D Systems | ADP3-050 | P-selectin |
| Bovine serum albumin | Rockland Immunochemicals | BSA-50 | BSA |
| Dulbecco’s phosphate buffered saline | Mediatech, Inc. | 21-030 | DPBS |
| Sulfuric acid | Sigma-Aldrich | 339741 | |
| Hydrogen peroxide | Sigma-Aldrich | 316989 |
Referenzen
- Karnik, R., Hong, S., Zhang, H., Mei, Y., Anderson, D. G., Karp, J. M., Langer, R. Nanomechanical control of cell rolling in two dimensions through surface Patterning of receptors. Nano Lett. 8 (4), 1153-1158 (2008).
- Lee, C. H., Bose, S., Van Vliet, K. J., Karp, J. M., Karnik, R. Examining Lateral Displacement of HL60 Cells Rolling on Asymmetric P-selectin Patterns. Langmuir. 27 (1), 240-249 (2011).
- Norman, K. E., Moore, K. L., McEver, R. P., Ley, K. Leukocyte rolling in-vivo is mediated by p-selectin glycoprotein ligand-1. Blood. 86 (12), 4417-4421 (1995).
- Bernard, A., Delamarche, E., Schmid, H., Michel, B., Bosshard, H. R., Biebuyck, H. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- James, C. D., Davis, R. C., Kam, L., Craighead, H. G., Isaacson, M., Turner, J. N., Shain, W. Patterned protein layers on solid substrates by thin stamp microcontact printing. Langmuir. 14 (4), 741-744 (1998).
- Mrksich, M., Whitesides, G. M. Using self-assembled monolayers to understand the interactions of man-made surfaces with proteins and cells. Annual Review of Biophysics and Biomolecular Structure. 25, 55-78 (1996).
- Tan, J. L., Tien, J., Chen, C. S. Microcontact printing of proteins on mixed self-assembled monolayers. Langmuir. 18 (2), 519-523 (2002).
- Lee, D., King, M. R. Microcontact Printing of P-Selectin Increases the Rate of Neutrophil Recruitment Under Shear Flow. Biotechnology Progress. 24 (5), 1052-1059 .
- Greenberg, A. W., Hammer, D. A. Cell separation mediated by differential rolling adhesion. Biotechnol. Bioeng. 73 (2), 111-124 (2001).
- Higuchi, A., Tsukamoto, Y. Cell separation of hepatocytes and fibroblasts through surface-modified polyurethane membranes. J. Biomed. Mater. Res. Part A. 71A (3), 470-479 (2004).
- Alexeev, A., Verberg, R., Balazs, A. C. Patterned surfaces segregate compliant microcapsules. Langmuir. 23 (3), 983-987 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten