Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Transfektion von Maus retinalen Ganglienzellen durch In vivo Elektroporation
In diesem Artikel
Zusammenfassung
Wir zeigen eine In vivo Elektroporation Protokoll zur Transfektion von einzelnen oder kleinen Gruppen von retinalen Ganglienzellen (RGC) und anderen Zelltypen der Netzhaut in postnatalen Mäusen über einen weiten Altersbereich. Die Fähigkeit, Label und genetisch manipulieren postnatale RGCs In vivo Ist ein leistungsfähiges Werkzeug für Entwicklungsstudien.
Zusammenfassung
Die Ausrichtung und Weiterentwicklung des RGC Projektionen zum Mittelhirn ist ein beliebtes und leistungsfähiges Modell für die Untersuchung, wie präzise Muster der neuronalen Konnektivität Form während der Entwicklung. Bei Mäusen sind retinofugal Projektionen in eine topographische Art und Form ins Auge bestimmten Schichten im Corpus geniculatum laterale (dLGN) des Thalamus und der Colliculus superior (SC) angeordnet. Die Entwicklung dieser präzisen Mustern retinofugal Projektionen hat in der Regel durch die Kennzeichnung Populationen RGCs mit Fluoreszenzfarbstoffen und Tracer, wie Meerrettichperoxidase 1-4 untersucht worden. Allerdings sind diese Methoden zu grob, um Einblick in die entwicklungsbedingten Veränderungen in einzelnen RGC axonalen Laube Morphologie, die die Grundlage retinotopen Karte Formation geben. Sie haben auch nicht für die genetische Manipulation von RGCs ermöglichen.
Vor kurzem hat der Elektroporation werden eine effektive Methode für eine präzise räumliche und zeitliche Steuerung für die Lieferung von geladenen Molekülen in der Netzhaut 5-11. Aktuelle Netzhaut Elektroporation Protokolle nicht zur genetischen Manipulation ermöglichen und die Rückverfolgung von retinofugal Projektionen eines Einzel-oder kleine Gruppe von RGCs in postnatalen Mäusen. Es wurde argumentiert, dass postnatale in vivo Elektroporation ist keine praktikable Methode zur Transfektion von RGCs seit dem Etikett Effizienz ist sehr gering und erfordert daher gezielt an embryonalen Alter, wenn RGC Vorfahren durchlaufen Differenzierung und Proliferation 6.
In diesem Video beschreiben wir eine in vivo Elektroporation Protokoll für die gezielte Verabreichung von Genen, shRNA und fluoreszierende Dextrane auf murine RGCs postnatal. Diese Technik bietet eine kostengünstige, schnelle und relativ einfache Plattform für effizientes Screening von Kandidatengenen in verschiedene Aspekte der Entwicklung des Nervensystems einschließlich Axon Rückziehen beteiligt, Verzweigungen, Laminieren, Regeneration und Synapsenbildung in verschiedenen Stadien der Entwicklung des Schaltplans. Zusammenfassend beschreiben wir hier ein wertvolles Werkzeug, das weitere Einblicke in die zugrunde liegenden molekularen Mechanismen sensorischer map Entwicklung zur Verfügung stellt.
Protokoll
1. Ausrüstung Set-up für die Elektroporation
- Elektroden: Wir modifizierten Dumont Nr. 5 Pinzette als Elektroden verwenden.
- Separate und zerbrechen die Zange.
- Einen Draht am breiteren Ende jeder Zacke. Wickeln Sie den Draht befestigt und Zinken mit Isolierband verlassen ca. 25-30 mm von der Spitze der Zinken ausgesetzt.
- Legen Sie die modifizierte Zange wieder zusammen mit einem geeigneten Kunststoff Abstandhalter (zB ein Button) zwischen den beiden Zinken zu Federwirkung sorgen.
- Elektrotechnische Anlagen: Wir verwenden einen elektrischen Stimulator Stromimpulse für die Elektroporation und ein Oszilloskop-und Audio-Monitor zu liefern, um die Wellenform und die Anzahl der Impulse der Auslieferung bestätigen.
- Schließen Sie das Kabel von einem Zinken der Zange auf ein Fußpedal, die auch in Serie mit dem Stimulator verbunden ist. Das Fußpedal funktioniert wie ein Schalter. Wenn gedrückt, es führt die Schaltung für die Elektroporation.
- Schließen Sie das Kabel aus dem anderen Stift, um den elektrischen Stimulator.
- Verbinden Sie den Stimulator auf dem Oszilloskop-und Audio-Überwachung.
- Mikropipette und Injektor Set-up: Wir verwenden scharfe gezogen Glaspipetten und die Nanoinject II-Düse-System, um sehr kleine Mengen von Farbstoff-oder DNA-Lösung direkt in die Netzhaut zu injizieren.
- Berg-Düse-System auf einem 3-Achs-Mikromanipulator.
- Pull Glaspipetten mit einer langen Kegel und kleiner Tipp.
- Zurück füllen gezogen Pipette mit Mineralöl und sicher zu Injektor (für Details Nanoinect II Bedienungsanleitung zu sehen).
- Mit scharfen microdissecting Schere ein Schnitt die Spitze der Pipette, die Schaffung einer kleinen Öffnung (~ 2-3 um).
- Füllen Sie die Pipette mit der gewünschten Menge an Injektionslösung durch die Spitze der Pipette. Solange die Integrität der Spitze hält, kann es für mehrere Injektionen und Tieren verwendet werden.
Hinweis: i) Stellen Sie sicher genug Injektionslösung in die Spitzen, so dass verfüllt Mineralöl nie in das Auge injiziert wird geladen. ii) Die Nanoinject II-System und die spezifische elektronische Geräte in diesem Video sind nicht kritisch für die erfolgreiche Durchführung Kennzeichnung RGCs. Injektionen mit anderen Geräten wie einem picospritzer und Elektroporation mit anderen gängigen Stimulatoren, können ebenfalls zu kennzeichnen RGCs verwendet werden.
2. Plasmid-Lösungen für RGC Labeling
- Für die Kennzeichnung von kleinen Clustern RGCs: Wir verwenden ein Konstrukt, das EGFP (~ 2-3 pg / mL) Enhanced Green Fluorescent Protein) unter der Kontrolle eines CAG-Promotor (chicken β-Aktin-Promotor mit einer CMV immediate early enhancer). EGFP wird mit der Palmitoylierung Abfolge von GAP-43 (Wachstum associated protein-43) gezielt an die Zellmembran (mut4EGFP) 12 markiert. Dieses Konstrukt ist als pCAG-gapEGFP bezeichnet.
- Für einzelne Zelle Etikettierung: Wir verwenden eine Kombination der beiden Konstrukte. Der erste Vektor ist ein CAG Promotor, Cre-Rekombinase (pCAG-Cre, Addgene [Cambridge, MA] Plasmid 13775) 13 und der zweite Vektor enthält eine floxed STOP-Kassette durch die Membran gezielt EGFP (pCAG-LNL-gapEGFP) gefolgt. pCAG-Cre (~ 0.15-ng/μL) wird auf ca. 1.000-10.000-fach geringerer Konzentration als pCAG-LNL-gapEGFP (~ 1-2 μgμL) verwendet, beschränkt starke EGFP-Expression auf eine kleine Anzahl von Zellen (durch die relativ geringe pCAG-Cre-Konzentration).
3. Retinal Injektion und Elektroporation Protocol
- Postnatalen Tag 0 (P0) bis P5 Welpen sind betäubt durch Hypothermie, während Mäuse älter als P5 betäubt mit einer intraperitonealen Injektion (0,7 ml / kg) von einem Cocktail von Ketamin (4,28 mg / mL), Xylazin (0,82 mg / ml) sind und Acepromazin (0.07mg/ml) 14.
- Sterilisieren alle chirurgischen Instrumenten und Elektrodenspitzen in eine heiße Perle Sterilisator. Anschließend abkühlen sowohl in steriler Kochsalzlösung vor der Verwendung zu einer thermischen Schädigung des Auges zu vermeiden.
- Bewegen Sie die Maus unter einer Dissektion Umfang und Lage Injektor.
- Bei Mäusen jünger als P14 (vor Öffnen der Augen), chirurgisch öffnen Sie das Augenlid durch Schneiden entlang der gesamten Länge der Zukunft Augenlidöffnung mit Mikro Sezieren Frühjahr Schere b.
- Machen Sie den Augapfel teilweise durch leichtes Anlegen von Druck um das Auge mit den Spitzen der Pinzette c ragen.
- Halten Sie die Augen dann durch leichtes Kneifen der Haut um den Augapfel.
- Passen Mikromanipulator und bringen Pipette in der Nähe des Augapfels.
- Presse Fußpedal, die auf die Nanoinject II-System, verbunden ist, um ein paar Tropfen Injektionslösung zu vertreiben und damit sicherzustellen, dass die Pipette nicht verstopft ist.
- Mit der einen Hand die Stabilisierung des Augapfels, bewegen Sie den Mikromanipulator so dass die Spitze der Glaspipette durch die retinalen Pigmentepithels durchbohrt und in die Netzhaut.
- Inject desIRED Menge der Lösung, indem Sie das Fußpedal für die Nanoinject II-System. Zum Beispiel zur Kennzeichnung von einzelnen RGCs machen wir eine einmalige Injektion von 2,3-4.6nL.
- Ziehen Sie die Pipette und vorsichtig Elektrodenspitzen direkt auf die Einstichstelle drücken und Fußpedal für Stimulator zu den Stromkreis zu schließen und elektroporieren das Auge. Wir verwenden in der Regel Rechteckimpulse mit Einstellungen von 25V Stärke, 50ms Dauer, 1sec auseinander. 10 Impulse (5 Impulse jeder Polarität) sind für Mäuse älter als P4 und 6 Impulse (3 Impulse jeder Polarität) für P0 bis P3 Mäuse sind aufgebracht.
- Schieben Augapfel wieder in die Steckdose und wenden sterile Augensalbe über dem Schnitt Augenlider.
- Legen Sie Tiere auf einer Temperatur gesteuert Heizkissen und vollständige Genesung, einschließlich angemessener Wiedererwärmung und Mobilität, Rückkehr Tier zu ihrer Mutter.
- Monitor Tiere alle 12 Stunden auf Anzeichen von Schmerzen, Leiden oder Beschwerden, wie z. B. Verlust der Mobilität, abnormale Körperhaltung oder Misserfolg zu pflegen. Wiederholte Runden der Narkose, Injektionen und Elektroporation sollte nicht auf demselben Tier durchgeführt werden.
4. Hinweise
- Die Methode der Injektion in diesem Video beschrieben ist 'blind' Injektion. Es ist möglich, die Menge und Ort der Injektion sichtbar bei der Arbeit mit Albino-Mäuse und gefärbte Lösungen (DII-oder Plasmid-Lösung mit Spuren von schnellen blau). Allerdings mit pigmentierten Mausstämme der Injektionsstelle kann nicht direkt sichtbar und somit ist es schwierig, verbal zu beschreiben, ob man die beabsichtigte retinalen Lage erreicht oder wie weit man die Pipette bewegen, um die RGC-Schicht gezielt. Daher raten wir dringend neue Benutzer zunächst mit DiI Injektionen in Albino-Mäusen starten, da diese Injektionen können sofort visualisiert in der Netzhaut und die Kennzeichnung von RGC Projektionen auf die Netzhaut und des Gehirns können verwendet werden, um die Qualität der Einspritzung zu beurteilen. Bereiten Sie 10% DiI in N, N-Dimethylformamid (100%) für fokale Injektionen. Ist dieser Vorgang bewältigt Benutzer sollten in der Lage, konsequent Ziel RGCs mit klaren DNA-Plasmid-Lösungen in pigmentierten Mäusen.
- Die Methode der Injektion in diesem Video beschrieben, kann verwendet werden, um Schwerpunkte DiI Injektionen zu machen, um kleine Populationen von Zellen zu retinotopy (4.6nL Etiketten ein paar hundert RGCS) 14 zu studieren und Bulk-Label RGCs mit Fluorophoren (Alexa555, 488 etc.), konjugiert mit Etikett Cholera-Toxin-Untereinheit B zu studieren Auge Segregation, ohne die Elektroporation Schritt in Nr. 10 vor. Eine maximale gesamte Injektionsvolumen von 2-3UL für Mäuse älter als P14 und 1-2UL für Mäuse jünger als P14 jeder Lösung wird empfohlen.
- Pipetten können mit Lösungen zur Injektion durch Verfüllung mit Mineralöl vor der Montage der Pipette auf den Injektor und Brechen der Spitze gefolgt werden verfüllt werden. Dies ist besonders nützlich bei der Verwendung von hohen Konzentrationen DNA-Lösungen (~ 6ug/uL), die generell sehr zähflüssig und schwer von der Spitze der Pipette zu laden.
- Wenn die Glaspipette verstopft, reinigen Sie sorgfältig die Pipettenspitze mit einem Wattestäbchen in Wasser für die DNA-Lösungen und Ethanol (100%) eingeweicht Farbstoff (DII)-Lösungen.
- Nach der Injektion in das Auge, Einfahren der Pipettenspitze aus dem Augapfel, und drücken Sie das Fußpedal wieder zu injizieren. Hiermit wird bestätigt, dass die Spitze nicht während der Injektion Prozess verstopft. Wird keine Lösung verzichtet, ist es sehr wahrscheinlich, dass die Injektion nicht erfolgreich war. Dies sollte jedoch nicht als absolute Zeichen dafür, dass die Injektion nicht erfolgreich war genommen werden. Der Experimentator kann das gleiche Auge wieder zu injizieren, wenn mehrere Injektionsstellen und die Kennzeichnung von größeren Anzahl von Zellen erwünscht ist.
- Für die Kennzeichnung einzelner RGCs, setzen Sie die Einspritzgeschwindigkeit auf die Nanoinject Schaltkasten langsam. Dies reduziert die Menge der Lösung in die Netzhaut injiziert, da das System nimmt mehr Zeit in diese Einstellung, um die Lösung zu verzichten und gleichzeitig die Spitze der Glaspipette wird schnell aus dem Augapfel eingefahren.
- Elektroporation von postnatalen Tag 0 bis 3 (P0 bis P3) Mäuse erfordert zusätzliche Aufmerksamkeit, da es sehr einfach ist, das Auge schädigen (dieser wird nach ein paar Tagen Erholung auf der Hand, wenn das Auge nachweislich kleiner als normal ist). Die Reduzierung der Anzahl der Impulse und Spannung ist ratsam, früh neugeborenen Mäusen. Nach P4 sind die Augäpfel widerstandsfähiger gegenüber der Elektroporation Schäden.
- In unserer Erfahrung Membran gezielt Versionen von EGFP oder RFP ('gapEGFP', siehe 12) weit überlegen sind unverändert GFP für die Prüfung retinofugal Projektionen an das Gehirn. Allerdings pCAG-tdTomato, die eine Membran-Targeting Modifikation fehlt, funktioniert auch gut (Abb. 1E). Darüber hinaus können Dextran konjugiert Fluoreszenzfarbstoffen auch Label RGCs mit der Elektroporation oben beschriebenen Protokoll verwendet werden.
- Typischerweise werden 9 von 10 Injektionen zu kennzeichnen RGCs führen, obwohl nur etwa 15% der Injektionen mit dem Dual-Plasmid Ansatz wirdErgebnis in nur einem einzigen RGC abgestempelt zu werden. Die Zahl der erfolgreichen Fälle können durch die Injektion von DNA in mehreren Standorten in einem Auge oder durch die Injektion von Plasmiden verschiedener fluoreszierender Proteine in jedes Auge erhöht werden.
5. Repräsentative Ergebnisse
RGC Etikettierung war in allen Altersgruppen beobachtet werden, die von P2 bis P25, mit EGFP Kennzeichnung in RGCs von 24 Stunden nach der Elektroporation und gepflegt Ausdruck für mindestens drei Wochen nach der Transfektion.
Fluoreszenzmarkierten Dendriten (Abb. 1A, B) und axonalen Lauben (Abb. 1F) der einzelnen RGCs werden übersichtlich visualisiert und rekonstruiert.
Abgesehen von RGCs, kann diese Technik verwendet, um andere retinale Zelltypen wie horizontale Zellen, bipolare Zellen und verschiedene amakrinen Zell-Subtypen (Abbildung 1C)-Label
Diese Methode funktioniert nicht mit dem normalen zeitlichen Verlauf der visuellen Karte Verfeinerung als durch normale retinotopy in die SC (Abb. 1E) gezeigt stören.
In allen Altersgruppen in etwa 90% der Fälle ein kleines Volumen Injektion (~ 2,3-4.6nL) von pCAG-gapEGFP führte zu Ausdrucks in ein paar RGCs (Abbildung 1D).
In ca. 15% der Versuche mit einer einzigen Injektion des pCAG-Cre und pCAG-LNL-gapEGFP Kombination Plasmide pro Tier, führte zu einzelnen retinalen Neurons Kennzeichnung einschließlich RGCs (Abbildung 1A, B, D) und anderen Zelltypen wie amakrinen Zellen (Abbildung 1C).
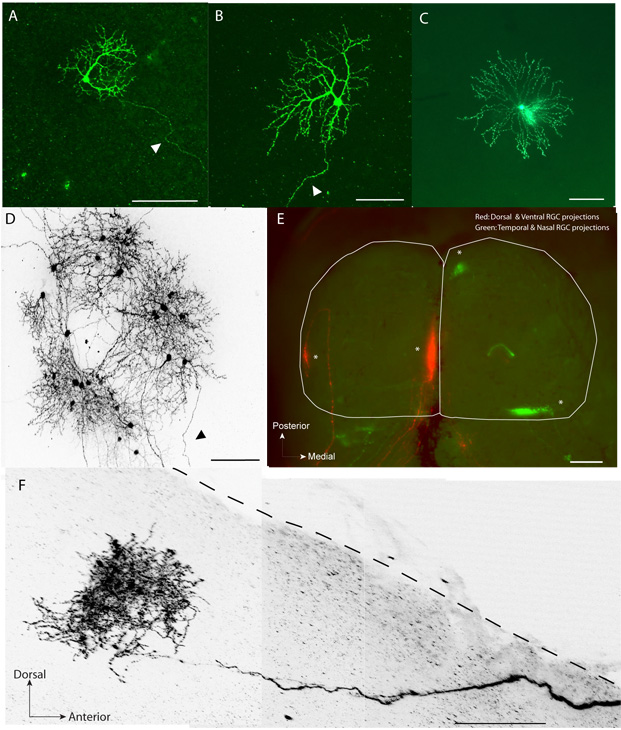
Abbildung 1 - A, B Beispiele für EGFP markierten einzelsträngigen retinalen Ganglienzellen (Pfeilspitze zeigt auf Axon) in einem flachen-mount Netzhaut postnatalen Tag 14 (P14) C. Beispiel einzelner starburst amakrine Zelle auf P8 D.. . Eine Gruppe von EGFP markierten Netzhautneuronen einschließlich RGCs und Amakrinzellen in einem flachen-mount Netzhaut P14. E. dorsalen und ventralen RGCs im rechten Auge wurden elektroporiert und beschriftet mit EGFP und zeitliche und ventralen RGCs auf dem linken Auge waren galvanisiert und beschriftet mit tdTomato auf P1. Die Zielzonen (Sternchen) von den markierten RGCs gebildet werden können in ihrer topographisch richtigen Ort in der SC auf P9 (Ganzkörper-mount, weiße Umrandung) gesehen werden. F. Beispiel eines einzelnen EGFP markierten RGC Laube (2-D-Projektion) in einen Sagittalschnitt (250 &mgr; m dick) des SC (gepunktete Linie). Aus Gründen der Übersichtlichkeit Bilder in (D) und (F) wurden in Graustufen umgewandelt und umgekehrt. Maßstabsbalken (um): (A) - (D), (F): 100; (E): 500
Diskussion
In diesem Video zeigen wir eine in vivo Elektroporation Protokoll, dass die Ergebnisse bei der Kennzeichnung von einzelnen oder kleinen Gruppen von retinalen Neuronen im postnatalen Mäusen mit DNA-Konstrukte kodieren fluoreszierende Proteine. Kleine Gruppen von fluoreszenzmarkierten RGC Projektionen auf die dLGN und SC reproduziert ähnliche Projektion Muster wie in früheren Studien mit RGC Kennzeichnung mit lipophilen Farbstoffen, was darauf hinweist, dass die Elektroporation nicht mit normalen RGC Axon Laub...
Offenlegungen
Danksagungen
Die pCAG-gapEGFP Plasmid war ein Geschenk von Dr. S. McConnell (Stanford, CA). pCAG-tdTomato Plasmid war ein Geschenk von Dr. M. Feller (Berkeley, CA). Wir danken Dr. Edward Ruthazer für die Annahme, die Verwendung einer Zwei-Plasmid-Strategie für die einzelne Zelle Kennzeichnung und Anne Schohl (Montreal, QC) für die Validierung der Zwei-Plasmid-Cre / loxP-Strategie in Pilotstudien und Crair lab Mitglieder für den technischen Support. Unterstützt durch R01 MH62639 (MC), NIH R01 EY015788 (MC) und NIH P30 EY000785 (MC).
Materialien
| Name | Company | Catalog Number | Comments |
| Materialien | Firma | Katalog-Nummer | |
|---|---|---|---|
| Dumont Nr. 5 Pinzetten | Feine Science Tools | 11252-20 | |
| Elektrostimulatoren | Grass Instruments | Modell S4 | |
| Oszilloskop | Agilent | Modell 54621A | |
| Audio-Monitor | Grass Instruments | Modell AM8B | |
| Puller | Sutter Instruments | Modell P-97 | |
| Vannas Schneidgutes | World Precision Instruments | 14003 | |
| Micro Scissors b | Ted Pella | 1347 | |
| Dumont AA Pinzetten c | Feine Science Tools | 11210-20 | |
| Nanoinject II System | Drummond Scientific | 3-000-204 | |
| Glaspipetten | Drummond Scientific | 3-000-203-G / X | |
| Fußpedal | Drummond Scientific | 3-000-026 | |
| Mineralöl | Sigma-Aldrich | M3516 | |
| DiI | Invitrogen | D-383 | |
| N, N-Dimethylformamid | Sigma | D4551 |
Referenzen
- Huberman, A. D., Feller, M. B., Chapman, B. Mechanisms underlying development of visual maps and receptive fields. Annu Rev Neurosci. 31, 479-509 (2008).
- McLaughlin, T., Torborg, C. L., Feller, M. B., O'Leary, D. D. Retinotopic map refinement requires spontaneous retinal waves during a brief critical period of development. Neuron. 40, 1147-1160 (2003).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinogeniculate and retinocollicular projections in the mouse. J Comp Neurol. 230, 552-575 (1984).
- Jaubert-Miazza, L. Structural and functional composition of the developing retinogeniculate pathway in the mouse. Vis Neurosci. 22, 661-676 (2005).
- Garcia-Frigola, C., Carreres, M. I., Vegar, C., Herrera, E. Gene delivery into mouse retinal ganglion cells by in utero electroporation. BMC Dev Biol. 7, 103-103 (2007).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. , (2009).
- Ishikawa, H. Effect of GDNF gene transfer into axotomized retinal ganglion cells using in vivo electroporation with a contact lens-type electrode. Gene Ther. 12, 289-298 (2005).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J Vis Exp. , (2008).
- Ruthazer, E. S., Haas, K., Javaherian, A., Jensen, K., Sin, W. C., Cline, H. T., Yuste, R., Konnerth, A. In vivo time- lapse imaging of neuronal development. Imaging in Neuroscience and Development: A Laboratory Manual. , 191-204 .
- Kachi, S., Oshima, Y., Esumi, N., Kachi, M., Rogers, B., Zack, D. J., Campochiaro, P. A. Nonviral ocular gene transfer. Gene Ther. 12, 843-851 (2005).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156, 394-406 (1999).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- Plas, D. T. morphogenetic proteins, eye patterning, and retinocollicular map formation in the mouse. J Neurosci. 28, 7057-7067 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten