Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Generierung von neuralen Stammzellen aus menschlichen Föten Ausrangierte Rindengewebe
In diesem Artikel
Zusammenfassung
Eine einfache und zuverlässige Methode zur Isolierung und Kultivierung von neuralen Stammzellen aus gebrauchten menschlichen fetalen kortikalen Gewebe wird beschrieben. Kulturen von bekannten menschlichen neurologischen Erkrankungen abgeleitet werden können für die Charakterisierung von pathologischen zellulären und molekularen Prozesse eingesetzt werden, sowie eine Plattform bieten, um pharmakologische Wirksamkeit zu beurteilen.
Zusammenfassung
Neurale Stammzellen (NSCs) entlang der ventrikulären Zone Neuroepithel wohnen während der Entwicklung der kortikalen Platte. Diese frühen Vorfahren die zu weiteren Zwischen-Vorläuferzellen und später die verschiedenen neuronalen und glialen Zell-Subtypen, dass die Großhirnrinde bilden. Die Fähigkeit, zu generieren und zu erweitern menschlichen NSCs (sog. Neurosphären) aus gebrauchten normalen fetalen Gewebe bietet ein Mittel, mit denen direkt zu untersuchen, um die funktionalen Aspekte der normalen menschlichen NSC Entwicklung 1-5. Dieser Ansatz kann auch auf die Generation der NSCs aus bekannten neurologischen Erkrankungen gerichtet sein, wodurch sich die Möglichkeit, Krankheitsprozesse, die Vorläuferzellen Proliferation, Migration und Differenzierung 6-9 verändern zu identifizieren. Wir haben auf die Identifizierung pathologischer Mechanismen im menschlichen Down-Syndrom NSCs, die zur beschleunigten Alzheimer-Phänotyp 10,11 beitragen könnten konzentriert. Weder in vivo noch in vitro-Maus-Modelle replizieren kann die gleiche Repertoire von Genen auf dem menschlichen Chromosom 21 befindet.
Hier verwenden wir eine einfache und zuverlässige Methode zur Isolierung Down-Syndrom NSCs aus abgetriebenen menschlichen Föten Kortex und wachsen sie in der Kultur. Die Methodik bietet spezifische Aspekte der Ernte der Gewebe, Dissektion mit begrenzten anatomischen Landmarken, Zellsortierung, Beschichtungs-und Passagieren des menschlichen NSCs. Wir bieten auch einige grundlegende Protokolle zur Induktion Differenzierung von humanen NSCs in selektiver Zell-Subtypen.
Protokoll
1. Herstellung von Lösungen und Materialien für die Präparation und Pflege von neuralen Stammzellen Kultur
- Bereiten 100ml Dissektion Medium (KNOCKOUT DMEM/F12, Invitogen) vor der Zeit und in den Kühlschrank.
- Prepare100 ml Kulturmedium (Stem Pro NSC SFM, Invitrogen) und halten bei 37 ° C in einem Wasserbad.
- Bereiten Zell-Einfriermedium (KNOCKOUT DMEM/F12 +10% FBS + 5% DMSO) für die langfristige Kryokonservierung von Zellen.
- Wenn gewünscht, bereiten 4% Paraformaldehyd (PFA) für Gewebefixierung.
- Sterile, autoklaviert Pinzette und Skalpell Klingen mit Griffe sind für die Präparation verwendet.
- Beiseite einer Pipette Pistole, 10 ml Transferpipetten und 40 uM Zellsieb (BD Falcon 352340) für Dissoziation.
- Beiseite mehrere 10 cm Kulturschalen (BD) für die Präparation, 50 ml Zentrifugenröhrchen (BD) für die Dissoziation, 1,5 ml Röhrchen für die Gewebe-Lagerung und gefrorene Röhrchen (BD) für das Einfrieren von Zellen.
2. Isolierung humaner neuraler Stammzellen aus dem menschlichen fetalen Gehirns
- Die Ernte der lebensfähiges Gewebe sofort nach Beendigung des Fötus ist entscheidend für den Erfolg des Verfahrens. Für elektive Prozeduren können Timing, um Proben zu erhalten im Voraus gebucht werden, um so Zeit nach fetalen Tod zu minimieren. Die Produkte der Empfängnis sind innerhalb von 2 Stunden nach dem Eingriff geerntet, sondern im Idealfall auf elektiven Eingriffen innerhalb weniger Minuten erreicht werden. Die fetalen Gewebe oft fragmentiert sind. Im allgemeinen sind jedoch ein wesentlicher Teil des Gehirns bleibt für visuelle Identifizierung. Einschränkungen von Gestationsalter (GA) werden von gesetzlichen Vorschriften bestimmt, sondern wurden unter Verwendung dieses Protokolls zwischen 18-22 Wochen GA.
- Fetal Gehirn ist in einer 10 ml Petrischale mit eiskaltem KNOCKOUT DMEM/F12 Lösung gegeben. Identifizieren verschiedenen Teilen des Kortex von anatomischen Landmarken. Grenzen für die Frontal-und parieto-occipital Kortex richtet sich nach den hochgerechneten Schnittpunkt der zentralen Sulcus und Sylvi-Fissur. Dissect Gewebe aus dem frontalen Kortex anterior des Sulcus centralis und entlang der Grenze von der Sylvi-Fissur mit chirurgische Messer, achten Sie darauf, halten den Ventrikel intakt und unbeschädigt sein.
- Entfernen Sie alle verbleibenden Blut und Meningen aus dem abgetrennten Block von frontalen Kortex. Wenn die Probe von ausreichender Qualität, ist es ideal, um den Block in mehrere kleinere Proben für verschiedene Zwecke zu sezieren: Sektionen (in 4% Paraformaldehyd, PFA) und Protein / mRNA-Assays (schnell in -80 ° C gefroren).
- Übertragen Sie die ausgewählten Gehirn blockieren, um ein 50 ml Zentrifugenröhrchen, und fügen Sie eiskalten KNOCKOUT DMEM/F12 Lösung bei etwa 3-mal des Gewebes der Lautstärke. Vorsichtig distanzieren das Gewebe durch mechanische Pipettieren mit einer 10 ml Vollpipette, bis alle Gewebe fragmentiert wird (in der Regel 20-30 mal) und dann filtern Sie die Zellen durch eine 40 uM Zellsieb (BD Falcon 352340) um Einzel-oder in der Nähe einzelnen Zelle zu erhalten Suspension.
- Centrifuge die Zellsuspension bei 2000 rpm und Raumtemperatur für 5 min, Zellpellet in 10 ml frisches, warmes Kulturmedium (Stem Pro NSC SFM), und zählen Sie die Anzahl der Zellen mit einer Zählkammer.
- 5 ml warmem Kulturmedium in je 25 cm 2 Kulturflaschen und Transfer 2x10 6 Zellen in jeden Kolben. Kulturen sind in einem 37 ° C / 5% CO 2-Inkubator für 1 Woche vor der Analyse. Ändern Sie die Hälfte des Mediums einmal pro Woche für weitere Kulturen oder Experimente.
3. Manipulaton neuraler Stammzellen für die weitere Charakterisierung oder Experimente
- Neurosphären in der Regel in 1 bis 2 Wochen bilden unter den empfohlenen Kulturbedingungen mit NSC Durchmesser im Bereich zwischen 200 und 400 um. Neurosphären in diesem Stadium kann mit 0,2 g / L EDTA in Calcium-und Magnesium freie Hanks Medium (Hanks) bei 37 ° C dissoziiert für 15 min auf einzelne Zellen zu erhalten. Cells Suspension bei 2000 rpm, in frischen Hanks gespült gesponnen, und replattiert in warmen Nährboden für Subkultur.
- Zur Einleitung Differenzierung werden dissoziierten Zellen auf poly-D-lysine/laminin 1 beschichtete Deckgläser in einer Dichte von 1x10 5 Zellen pro Deckglas (24mmX24mm) ausplattiert. Oligodendrozyten-Differenzierung wird durch die Aufrechterhaltung der Zellen in KNOCKOUT DMEM/F12 (Invitrogen, Main, MD) +2% B27 (50X, Invitrogen, Main, MD) +10 ng / ml bFGF 100 ng / ml SHH + 10ng/ml PDGF-AA für erreicht 2 Tage, dann Umstellung auf das gleiche Medium ohne Wachstumsfaktoren für weitere 5 Tage. Neuronale Differenzierung wird durch das Aufrechterhalten Zellen in KNOCKOUT DMEM/F12 +2% B27 (50x) für 7 Tage erreicht. Astrocyte Differenzierung wird durch Kultivieren von Zellen in KNOCKOUT DMEM/F12 +1% FBS für eine Woche getan.
- Die Transfektion von neuronalen Stammzellen mit Gene können mit dissoziierten Zellen aus dem vorgeformten Neurosphären durchgeführt werden. Hier haben wir gezeigt, dass die Stammzellen mit EGFP-C1 durch Elektroporation transfiziert. Die Elektroporation von EGFP-C1-Konstrukt wurde unter Verwendung von amaxa Nucleofector Kits für Mouse Neural Stem Cells (VPG-1004) mit amaxa Nucleofector Device (Lonza AAD-1001), nachdem das Unternehmen die Anweisung. Kurz gesagt, wurden 5 ug DNA mit 1 x 10 6 Zellen mit 100 ul Transfektion Medium gemischt und nach Puls Elektroporation wurden die Zellen in der neuralen Stammzellen erhalten Medium für weitere Kultur resuspendiert. Die Differenzierung der transfizierten Zellen wurden mit der Dissoziation von Neurosphären 3-4 Tage nach der Elektroporation verarbeitet, nach dem gleichen Verfahren in Schritt 3.2 beschrieben.
4. Freezing neuralen Stammzellen und Subkulturen
- Dissoziiert Zellsuspensionen werden zentrifugiert und in Einfriermedium mit einer Konzentration von 1x10 7 Zellen / Flasche / ml. Langsam frieren die Zellen in -20 ° C, -80 ° C dann in flüssigen Stickstoff Transfer für lange Lagerung.
- Die Zellen werden schnell mit 37 ° C aufgetaut Wasserbad gewaschen und in erwärmt DMEM/F12 +10% Serum für eine Wäsche, zentrifugiert, um das Einfrieren Medium zu entfernen, und erneut in die erwärmte Kulturmedium.
5. Repräsentative Ergebnisse:
Neurale Stammzellen von einem normalen Fötus mit 18 Wochen Schwangerschaftsdauer wurden nach dem beschriebenen Verfahren und Neurosphären nach einer Woche mit runden, glatten Rändern und ziemlich homogen Größe (Abb. 2a) zu sehen ist, kultiviert. Diese Neurosphären mit EGFP-C1 oder anderen Konstrukten transfiziert und anschließend unter Fluoreszenz-Mikroskopie (Abb.2b,). Gegründet Neurosphären wurden dann dissoziiert mit EDTA und verchromt als dispergierte Zellen auf beschichteten Deckgläsern. Zellen, die unter den jeweiligen Protokollen unterschieden wurden mit 4% parafamaldehyde fixiert und gefärbt mit verschiedenen Zelltyp spezifischen Markern. Multipotentiality ist mit der Expression von Markern bezeichnend für Neuronen (Fig2C, D, Rhodamin) Astrozyten (Fig2E, F, Rhodamin) und Oligodendrozyten (Fig2G, H, Rhodamin) beobachtet. Die Zellen nicht erworben Elektroporation von EGFP wurden auch in verschiedenen Zelltypen differenzieren und gefärbt mit verschiedenen Zell-spezifische Marker. Multipotentiality ist mit der Expression von Markern bezeichnend für Neuronen (Fig3A, B, Fluorescein) Astrozyten (Fig3C, Rhodamin und Fig3D, Fluorescein) und Oligodendrozyten (Fig3E, F, Rhodamin) beobachtet.
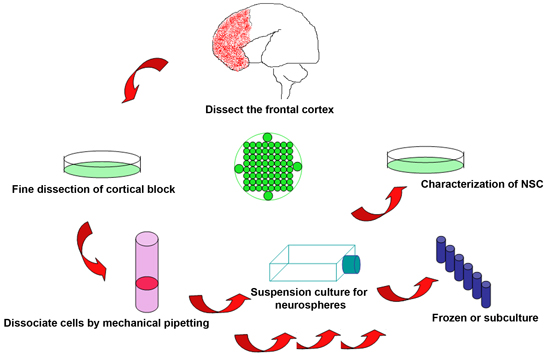
Abbildung 1. Schematische Darstellung des experimentellen Verfahren zur neuralen Stammzellen aus gebrauchten menschlichen fetalen Gehirns zu isolieren

Abbildung 2. Undifferenzierte und differenzierte menschliche Nervenzellen in vitro propagiert. (A) Neurosphären unter Phasenkontrast-Mikroskopie gezeigt demonstrieren glatte, runde Grenzen und schnelles Wachstum nach der Kultur seit über 1 Woche. (B) Einführung der verschiedenen Plasmide und Konstrukte können durch Transfektion erreicht werden. Drei Tage nach der EGFP-C1-Transfektion, zeigen mehrere Zellen die Expression des grün fluoreszierenden Proteins, wie unter Fluorescein Immunfärbung und Fluoreszenzmikroskopie zu sehen. EGFP-C1 transfizierten Neurosphären werden dissoziiert und differenziert unter verschiedenen Bedingungen zu Neuronen (C, D), Astrozyten (E, F) und Oligodendrozyten (G, H) und sehen unter Rhodaminfluoreszenz. Gleichzeitig sind transfizierten EGFP-positiven Zellen unter Fluorescein-Fluoreszenz gezeigt. Transfizierten Zellen (weiße Pfeilspitzen) sind zu unterscheiden von nicht transfizierten Zellen (weiße Pfeile). Die Zellkerne sind mit Hoechst33342 gefärbt. Scale-Bars sind 200 pm für A, 100 pm für B und 25 um für CH.
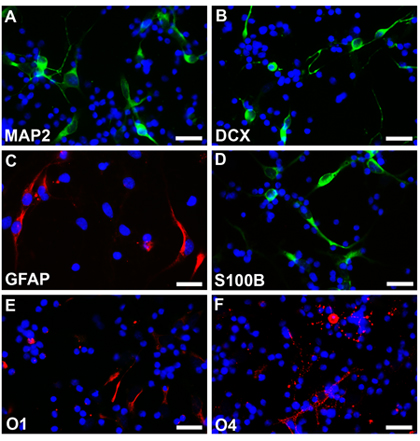
Abbildung 3. Neurosphären ohne Transfektion sind dissoziiert und differenziert unter verschiedenen Bedingungen in Neuronen (A, B, Fluorescein), Astrozyten (C, Rhodamin, D, Fluorescein) und Oligodendrozyten (E, F, Rhodamin). Die Zellkerne sind mit Hoechst33342 gefärbt. Scale-Bars sind 25 mu m für AF.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Es gibt verschiedene Ansätze zur Kultur frischem Gewebe und Herstellung von menschlichen Zelllinien. Historisch gesehen hat frischem Gewebe geerntet und sofort in verschiedenen Zelltypen im zentralen Nervensystem zu erzeugen kultiviert. Dieser Ansatz ist jedoch klar durch die Anzahl der Proben, die erhalten-die im Falle der menschlichen Proben, ist in der Regel recht klein werden kann, begrenzt. Angesichts der minimalen Grad an Manipulation, bieten frisch gezüchteten Nervenzellen den zuverlässigsten experimentelles S...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
HD054347 und NS063997-01 bis VLS: Diese Arbeit wurde zum Teil durch die National Institutes of Health unterstützt. Diese Arbeit wurde zum Teil auch durch den Empire State Stem Cell Fonds durch die New York State Department of Health Contract # C024324 zu VLS unterstützt. Die darin geäusserten Meinungen sind hier ausschließlich die des Autors und spiegeln nicht unbedingt die des Empire State Stem Cell Board, das New York State Department of Health, oder des Staates New York. VLS ist ein Doris Duke Clinical Scientist Developmental Preisträgerin. Wir danken auch Professor Timothy Vartanian für seine Gabe der Anti-O1, Anti-O4-Antikörper.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| KNOCKOUT DMEM/F12 | Invitrogen | 12660-012 | Dissoziation Medium |
| Stem Pro NSC SFM | Invitrogen | A10509-01 | Nährboden |
| Fetal Bovine Serum | Invitrogen | 10091-148 | Gefrorenes Medium |
| Hanks-Lösung (-Ca 2 +,-Mg 2 +) | Invitrogen | 14175-095 | Dissoziation Medium |
| DMSO | Sigma-Aldrich | D2650 | Gefrorenes Medium |
| EDTA | Sigma-Aldrich | 431788 | Dissoziation Medium |
| Paraformaldehyd | Sigma-Aldrich | 158127 | Fixation Lösung |
| bFGF | R & D | 234-FSE | Differenzierungsmedium |
| SHH | R & D | 1845-SH | Differenzierungsmedium |
| PDGF-AA | R & D | 221-AA | Differenzierungsmedium |
| B27 | Invitrogen | 17504-044 | Differenzierungsmedium |
| Maus Anti-MAP2 | Sigma-Aldrich | M2320 | 1:200 |
| Kaninchen Anti-DCX | Zelluläre Signale | 4604s | 1:200 |
| Kaninchen Anti-GFAP | DAKO | Z0334 | 1:200 |
| Kaninchen Anti-S100B | DAKO | Z0311 | 1:200 |
| Kaninchen Anti-O1 | Geschenke von Professor Timothy Vartanian * | 01.50 | |
| Kaninchen Anti-O4 | Geschenke von Professor Timothy Vartanian * | 01.50 | |
| 40 um Zellsieb | BD Falcon | 352340 |
* Timothy Vartanian, MD, PhD, Department of Neurology and Neuroscience, Weill Cornell Medical College, New York, USA
Referenzen
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r, Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten