Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Photobleaching Assays (FRAP & FLIP) zu Chromatin Protein Dynamics in Living embryonalen Stammzellen Measure
In diesem Artikel
Zusammenfassung
Wir beschreiben photobleaching Methoden einschließlich Fluorescence Recovery After Photobleaching (FRAP) und Fluoreszenz-Loss In Photobleaching (FLIP) zu Chromatin Protein Dynamik in embryonale Stammzellen (ES-Zellen) zu überwachen. Chromatin Protein Dynamik, die als eines der Mittel, um das Chromatin Plastizität zu studieren, ist in pluripotente Zellen verbessert.
Zusammenfassung
Fluorescence Recovery After Photobleaching (FRAP) und Fluoreszenz-Loss In Photobleaching (FLIP) ermöglichen die Untersuchung von Protein Dynamik in lebenden Zellen mit guter räumlicher und zeitlicher Auflösung. Hier beschreiben wir, wie FRAP und FLIP-Assays von Chromatin-Proteine, einschließlich H1 und HP1, in embryonalen Maus-Stammzellen (ES-Zellen) durchzuführen. In einem FRAP-Experiment werden die Zellen transfiziert, entweder transient oder stabil mit einem Protein von Interesse mit dem grün fluoreszierenden Protein (GFP) oder deren Derivate (YFP, CFP, Kirsche, etc.) fusioniert. In den transfizierten, fluoreszierenden Zellen, Bleichmittel eine intensive fokussierte Laserstrahl einer relativ kleinen Region of Interest (ROI). Die Wellenlänge des Lasers ist nach dem fluoreszierenden Protein für die Fusion eingesetzt ausgewählt. Das Laserlicht irreversibel Bleichmittel das Fluoreszenzsignal der Moleküle in der ROI und unmittelbar nach Bleichen, die Erholung der Fluoreszenz-Signal in den gebleichten Bereich - vermittelt durch den Austausch der gebleichten Moleküle mit dem ungebleichten Moleküle - wird überwacht mit Zeitraffer-Bildgebung. Die erzeugte Fluoreszenz Erholung Kurven geben Auskunft über das Protein der Mobilität. Wenn die fluoreszierenden Moleküle unbeweglich sind, wird keine Fluoreszenz Erholung beobachtet werden. In einem komplementären Ansatz, Fluorescence Loss in Photobleaching (FLIP), Bleichmittel den Laserstrahl der gleichen Stelle wiederholt und die Signalstärke wird an anderer Stelle in der fluoreszierenden Zellen gemessen. FLIP-Experimente daher messen Signalabfall statt Fluoreszenz Erholung und sind nützlich, um Protein-Mobilität sowie Protein pendelt zwischen zellulären Kompartimenten zu bestimmen. Transient Bindung ist eine gemeinsame Eigenschaft von Chromatin-assoziierten Proteinen. Obwohl die großen Anteil der einzelnen Chromatin-Protein ist an das Chromatin zu einem bestimmten Zeitpunkt in einem stabilen Zustand gebunden ist, ist die Bindung transient und die meisten Chromatin-Proteine haben eine hohe Fluktuation auf Chromatin, mit einer Verweilzeit in der Größenordnung von Sekunden. Diese Eigenschaften sind entscheidend für die Erzeugung hoher Plastizität in der Genom-Ausdruck 1. Photobleaching Experimente sind deshalb besonders nützlich, um Chromatin Plastizität mit GFP-Fusion-Versionen von Chromatin Strukturproteine, insbesondere in ES-Zellen zu bestimmen, wo der dynamische Austausch von Chromatin-Proteine (einschließlich Heterochromatin Protein 1 (HP1), Linker-Histon H1 und Core-Histonen) ist höher als in differenzierten Zellen 2,3.
Protokoll
1. Plating die ES-Zellen
T = 0 Std.
MEF plating
- Bestreichen Sie die Live-Imaging-8-Well-μ-Slides (ibidi; München, Deutschland) mit Gelatine oder in Kammern Deckgläser (Lab-Tek, Rochester, NY) oder in Glas-bottom Kulturschalen (MatTek; Ashland, MA). Lassen Sie für 5-30 min und saugen sich die freie Gelatine.
- Seed 22.000 MEFs / well in 250 ul Gesamtvolumen von DMEM [ergänzt mit 10% fötalem Rinderserum (FBS)]. Lassen Sie Zellen in einer Gewebekultur-Inkubator (37 ° C, 5% CO2) zu wachsen.
T = 6 Std.
ES-Zell-Beschichtung
- Saugen Sie DMEM.
- Seed jedem MEF gut mit 15.000 R1 Zellen / well in 250 ul Gesamtvolumen von ES-Zell-Medium beschichtet [mit 10% ESC-grade fötales Rinderserum (FBS), 1 mM Natriumpyruvat, 0,1 mM nicht essentielle Aminosäuren, 0,1 mM β-ergänzt Mercaptoethanol und 1000 U / ml Leukämie inhibierenden Faktor (LIF)], zu erhalten 30% bis 50% Konfluenz des folgenden Tages.
2. Transfektion der ES-Zellen
T = 24 Stunden
Transiente Transfektion
- Ersetzen Sie das ES-Zell-Medium mit 250 ul / well frischer ES-Zell-Medien.
- In einer 1,5-ml sterile Reagenzglas, 100 ul serumfreiem Medium [Opti-MEM (Gibco)], dann gibt man 10 ul Transit-LT1 Transfektionsreagenz (Mirus) direkt in die serumfreien Medien. Mix von sanften Pipettieren und Inkubieren bei Raumtemperatur für 5-20 min.
- Add 1,5 ug GFP Plasmid-DNA (H1E, H1o oder HP1), um die verdünnte Transit-LT1-Reagenz. Mix von sanften Pipettieren und Inkubieren bei Raumtemperatur für 15-30 min.
- Add 13,5 ul / Vertiefung der Transfektion Mischung. Schwenken Sie die 8-Well-μ-Slides, um sicherzustellen, gleichmäßige Verteilung. Nach 24 Stunden ersetzen die alten ES-Zell-Medien mit 250 ml frisches ES-Zell-Medien.
3. Performing FRAP und FLIP
T = 48-72 Stunden
- Das Experiment auf einem konfokalen Laser-Scanning-Mikroskop (CLSM) durchgeführt werden können, aber da in einem normalen FRAP / FLIP-Experiment, viele aufeinander folgende Bilder erfasst werden, ist es empfehlenswert, eine Spinnerei-Disk-konfokalen Mikroskop, die Aufnahmegeschwindigkeit ermöglicht den Einsatz und sorgt dafür, dass keine unerwünschte Probe Bleichen wird nach der ersten absichtlichen Bleichen Veranstaltung auftreten. Hier empfehlen wir die Verwendung der Revolution Spinning-Disk-konfokale System (www.Andor.com), mit dem Yokogawa CSU-X drehende Scheibe Kopf. Dieses System hat den doppelten Kapazität photobleach mit Hilfe eines speziellen FRAPPA Modul mit einem Punkt-Scanning-System, und schnell schalten das Licht zurück, um Bilder mit der sich drehenden Scheibe zu sammeln. Die 3 häufigsten fluoreszierende Proteine für photobleaching Experimenten verwendet werden, GFP, YFP und Cherry. Wenn GFP oder YFP verwendet werden, ist ein ~ 488 nm Laser erforderlich. Für Cherry, mit einem ~ 560 nm-Laser. In allen Fällen empfehlen wir die Verwendung von Festkörperlasern. Nach einer automatisierten Bühne ist nützlich, aber nicht erforderlich. Da lebende Zellen abgebildet werden, ist es unerlässlich, eine Klimakammer verwenden (wir verwenden eine von LIS, Schweiz), Controlling Sauerstoff, Feuchtigkeit, CO 2 und Temperatur. FRAP wird mit maximal Laserintensität während Bildgebung mit der minimal Laserleistung erforderlich (in der Regel im Bereich von 10%, wenn Fluoreszenz Niveau angemessen ist) durchgeführt wird.
Beachten Sie die Zellen mit fluoreszierenden Licht der geeigneten Wellenlänge, und wählen Sie eine Zelle, die GFP mit einem 60X Ölimmersion. Achten Sie auf richtigen subzellulären Verteilung. Gelegentlich, wenn Ausdruck zu hoch sind, kann das Protein die Lokalisierung "spill 'zu anderen Fächern wie der Nukleolus. Solche Zellen sollen nicht angewählt werden. - Nun setzen Sie ein Imaging-Protokoll: collect 3-5 Frames vor dem Ausbleichen, dann Euchromatin oder Heterochromatin (angesehen als kondensierte GFP Herde) photobleach und sammeln 90-120 Frames nach dem photobleach mit 250-1000 ms Intervallen: H1E-GFP, 1000 ms, H1o und HP1-GFP, 250 ms (Zeitintervall ändert sich je nach Protein Dynamik, wo hochdynamische Proteine erfordern kürzere Intervallzeit). Wir benutzen normalerweise 80-100% Laserintensität für Bleichen mit einem Laserpuls von 20-40 μseconds (1-2 Wiederholungen), aber diese Zahlen können je nach den untersuchten Proteins und der Expression ändern. Wenn Bleichen zweckmäßig ist, sollten Sie beobachten, ein "schwarzes Loch" in Ihrem GFP-Fluoreszenz. Das Schwarze Loch wird allmählich mit Fluoreszenz folgenden Erholung wieder gefüllt. Obwohl die sich drehende Scheibe erhalten bis zu rund 60 Bildern pro Sekunde (mit guten Fluoreszenzintensität und beim Zoomen in eine einzelne Zelle), empfehlen wir nicht mit dem System bei derart hohen Geschwindigkeiten durch niedrige Bildqualität und mögliche erhöhte Phototoxizität.
- Für ein FLIP-Experiment, die Einrichtung eines unterschiedlichen bildgebenden Protokoll: collect 3-5 Frames vor dem Bleichen, starten Sie dann wiederholt an der gleichen Stelle Bleichen beim Sammeln von Bildern. Für H1E-GFP, Bleichmittel alle 5 sec, für H1o-GFP, Bleichmittel alle 2 sec, und für HP1-GFP bleach alle 1 Sek.. Bleichmittel sindd sammeln Bilder immer wieder während des gesamten Experiments.
- Für beide Verfahren, wiederholen Sie den Vorgang auf 20-30 Zellen. Für statistische Zwecke Versuchswiederholung 3 mal oder mehr, vorzugsweise an verschiedenen Tagen. In homogenen Populationen und richtigen Einstellungen, ist die Standardabweichung in der Regel gering (<5%).
Für beide FRAP und FLIP, beeinflusst die Größe und Form des gebleichten Region der Erholung Dynamik und bleiben muss innerhalb eines Experiments konstant. Auch, wenn zwei Zellen miteinander verglichen werden, müssen identisch Protokolle verwendet werden und die Zellen müssen nacheinander am selben Tag wie Power-Laser und andere Bedingungen können schwanken, das Ergebnis des Experiments beeinflussen analysiert werden.
4. FRAP und FLIP Data Analysis
- In allen FRAP Frames gesammelt, messen die Fluoreszenz-Intensität in der ROI (ROI b = gebleichten Bereich), im Hintergrund-Bereich (ROI bg), und die nicht gebleicht nuklearen Bereich (ROI nb) als Funktion der Zeit vor und nach dem Bleichen. Wenn der gebleichten Region vernachlässigbar ist der gesamte Kern kann zur Normierung gewählt werden.
- Für jeden Zeitpunkt, zu normalisieren Daten nach der Formel: (ROI b - ROI bg) / (ROI nb - ROI bg) / (pbROI b - pbROI bg) / (pbROI nb - pbROI bg) bezeichnet pb pre-gebleicht. Für die Vor-Bleiche Bilder, die Sie sollten sich ein Wert von ca. 1. Das erste Bild nach der Bleiche zeigt die Bleach Tiefe. Subtrahiere den Wert von 1 für den eigentlichen Bleach Tiefe Wert. Wiederholen Sie für jede Zelle und durchschnittlich 20-30 Zellen aus jedem Experiment.
- In allen FLIP Frames gesammelt, messen die Fluoreszenz-Intensität in den nicht-nuklearen Bereich gebleicht, und der Hintergrund-Bereich (ROI nb = nicht gebleichten Bereich ROI bg = Hintergrund). Berechnung der FLIP Daten ist vergleichbar mit einem FRAP-Kurve, sollte nur die analysiert ROI (ROI nb) anders sein als die tatsächliche gebleichten Region, die nicht für die Berechnung verwendet wird: (ROI nb - ROI bg) / (pbROI nb - pbROI bg) . Es ist auch möglich, eine benachbarte Zelle (ROI n = Nachbarzelle) zur Normalisierung Zwecke zu verwenden: (ROI nb - ROI bg) / (ROI n - ROI bg) / (pbROI nb - pbROI bg) / (pbROI n - pbROI bg ).
Nach der Datenerhebung ist es möglich, an die experimentellen Daten zur Computer-Simulation passen. Dies ermöglicht die Berechnung, mit einer guten Nachbarschaft, der mobilen Fraktion, die immobile Fraktion und die halbmaximale. Wir diskutieren nicht die mathematischen und statistischen Aspekten des FRAP-Analysen hier und verweisen den Leser auf andere hervorragende Publikationen 4-9. Das Bleichmittel Tiefe bezieht sich auf die Entfernung (auf der y-Achse) zwischen der Vor-Bleiche (100%) und das erste Bild nach der Bleiche; die mobile Fraktion bezieht sich auf die Entfernung (auf der y-Achse) zwischen den bleichen Tiefe und das gewonnene Signal, wenn die Kinetik ein Plateau erreicht, und die unbeweglichen Fraktion bezieht sich auf die Entfernung (auf der y-Achse) zwischen den wiederhergestellten Signal und die pre-Bleiche (100%)-Signal (siehe Abb. 1B und 2B). Jenseits dieser Analyse gibt es gute mathematische Modelle, um die Daten passen. Für eine einzelne Exponenten der Gleichung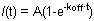
wo t die Zeit ist, ist A die mobile Fraktion, 1-A ist die immobile Fraktion und k off ist die Dissoziationskonstante, können verwendet werden, um die Daten angepasst werden und eine direkte Schätzung der Off-Rate der Bindung (k off) kann erhalten, sowie für den Parameter A, die verwendet werden, um den Verein zu berechnen können.
5. Repräsentative Ergebnisse:
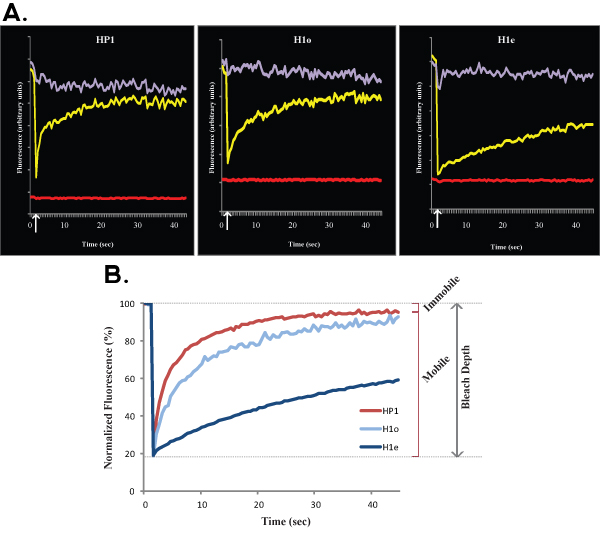
Abbildung 1. A und B zeigen repräsentative FRAP-Kurven von HP1 (links), H1o (Mitte) und H1E (rechts) in R1 ES-Zellen. Für Einfachheit und Klarheit Abbildung 1A zeigt die Rohdaten aus einer einzigen Zelle, bevor eine Normalisierung und Berechnung. Die gelbe Kurve entspricht der gebleichten Region entspricht die lila Kurve auf die nicht gebleicht nuklearen Bereich (wenn die gebleichte Region vernachlässigbar ist der gesamte Kern kann zur Normierung gewählt werden), und die rote Linie entspricht der Hintergrundfluoreszenz, die minimal in diesem Fall. Vertical Pfeil stellt die Bleiche Zeit. Normalisierte und gemittelten Daten ist in Abbildung 1B gezeigt. Beachten Sie die langsamere Erholung des H1 (blau) im Vergleich mit HP1 (rot). Auch die H1E Variante (dunkelblau) ist langsamer als die H1o Variante (hellblau). Mobile und immobile Fraktionen und Bleach Tiefe sind für HP1 angegeben.
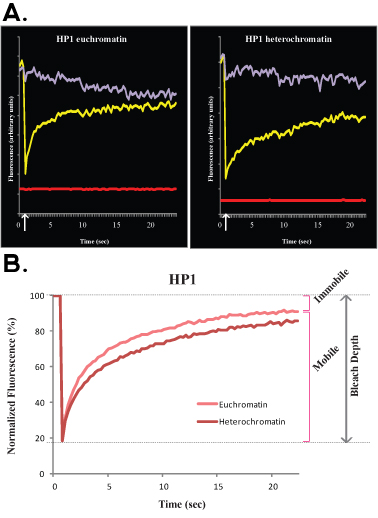
Abbildung 2. A und B zeigen repräsentative FRAP Kurven verglichen Euchromatin (links) mit Heterochromatin (rechts) von HP1 in R1 ES-Zellen. Ähnlich wie in Abbildung 1, 2A Rohdaten aus einer einzigen Zelle zeigt, gelbe Kurve, die gebleichten Region entspricht, entspricht lila Kurve, die nicht gebleicht nuklearen Bereich, und die rote Linie entspricht der Hintergrundfluoreszenz. Vertical Pfeil stellt die Bleiche Zeit. Normalisierte und gemittelten Daten ist in Abbildung 2B gezeigt. Beachten Sie die langsamere Erholung von Heterochromatin (dunkelrot) im Vergleich mit Euchromatin (hellrot). Mobile und immobile Fraktionen und Bleach Tiefe sind für Euchromatin angegeben.
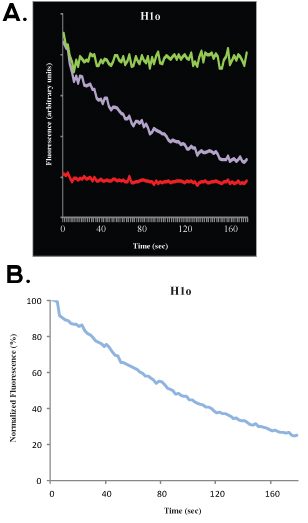
Abbildung 3.. Ein typisches FLIP-Experiment von H1o R1 ES-Zellen ist in Abbildung 3A (roh, un-normalisierten Daten) und B (normiert und gemittelt Daten) dargestellt. In diesem Versuch wurde die lila Kurve, die nicht gebleicht nuklearen Bereich entspricht, entspricht die grüne Linie zu einem benachbarten Zellkern und die rote Linie entspricht der Hintergrundfluoreszenz.
Diskussion
Anders als die meisten verfügbaren Techniken, die gereinigt Chromatin beinhalten von Zellpopulationen oder fixierten Zellen, FRAP Experimente folgen Änderungen in Chromatin Protein Dynamik in lebenden Zellen. Wir fanden Chromatin Protein Dynamik ein guter Indikator für die Chromatin Plastizität werden. Da es jedoch Absicherung erfordert das Gen von Interesse mit GFP, kann die Zugabe des fluoreszierenden Tag mit der Funktionsweise des Proteins beeinträchtigen. So, bevor Sie fortfahren mit FRAP, muss das Fusionsprote...
Offenlegungen
Danksagungen
Wir danken Mitglieder der Meshorer Labor, vor allem Shai Melcer, Adi Alajem, Edupuganti Raghu Ram, Badi Sri Sailaja, Anna Mattout und Alva Biran, für kritische Anmerkungen und für die Fehlersuche Bleichexperimenten auf einer täglichen Basis. EM ist ein Joseph H. und Belle R. Braun Senior Lecturer in Life Sciences und wird von der Israel Science Foundation (ISF 943/09), das Israel Ministry of Health (6007) der Europäischen Union (IRG-206872 und 238176) unterstützt, die Israel Cancer Research Foundation, die Interne Applikative Medical Grants der Hebrew University und dem Israel Institute Psychobiologie.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
|---|---|---|---|
| DMEM | Sigma | D5671 | |
| Gelatine | Merck | 1,04078 | |
| Opti-MEM | Gibco | 31985 | |
| Transit-LT1 | Mirus | MIR2300 | |
| 8-Well-μ-Slides | ibidi | 80826 |
Referenzen
- Phair, R. D. Global nature of dynamic protein-chromatin interactions in vivo: three-dimensional genome scanning and dynamic interaction networks of chromatin proteins. Mol Cell Biol. 24, 6393-6402 (2004).
- Meshorer, E., Girard, L. . Imaging chromatin in embyonic stem cells in StemBook. , (2008).
- Meshorer, E. Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev Cell. 10, 105-116 (2006).
- Bancaud, A., Huet, S., Rabut, G., Ellenberg, J. . Fluorescence perturbation techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, photoactivation, photo conversion, and FLIP. , (2009).
- Dundr, M., Misteli, T. Measuring dynamics of nuclear proteins by photobleaching. Curr Protoc Cell Biol. Chapter 13, Unit 13-Unit 13 (2003).
- Ellenberg, J. Nuclear membrane dynamics and reassembly in living cells: targeting of an inner nuclear membrane protein in interphase and mitosis. J Cell Biol. 138, 1193-1206 (1997).
- Lenser, T., Weisshart, K., Ulbricht, T., Klement, K., Hemmerich, P. Fluorescence fluctuation microscopy to reveal 3D architecture and function in the cell nucleus. Methods Cell Biol. 98, 2-33 (2010).
- Mueller, F., Mazza, D., Stasevich, T. J., McNally, J. G. FRAP and kinetic modeling in the analysis of nuclear protein dynamics: what do we really know. Curr Opin Cell Biol. 22, 403-411 (2010).
- Phair, R. D., Misteli, T. Kinetic modelling approaches to in vivo imaging. Nat Rev Mol Cell Biol. 2, 898-907 (2001).
- Poser, I. BAC TransgeneOmics: a high-throughput method for exploration of protein function in mammals. Nat Methods. 5, 409-415 (2008).
- Sigal, A. Generation of a fluorescently labeled endogenous protein library in living human cells. Nat Protoc. 2, 1515-1527 (2007).
- Cohen, A. A. Dynamic proteomics of individual cancer cells in response to a drug. Science. 322, 1511-1516 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten