Method Article
Visualisierung der MG53-vermittelte Cell Membrane Repair mit In vivo Und In-vitro- Systems
In diesem Artikel
Zusammenfassung
Hier beschriebenen Protokolle verwendet werden, um den dynamischen Prozess der MG53-vermittelte Zellmembran Reparatur in ganzen Tieren und auf zellulärer Ebene sichtbar machen. Diese Methoden können auf die Zellbiologie der Plasmamembran Wiederverschließen und der regenerativen Medizin untersucht werden.
Zusammenfassung
Die Reparatur der akuten Verletzung an der Zellmembran ist ein elementarer Prozess der normalen zellulären Physiologie und defekte Membran Reparatur hat zu vielen degenerativen Erkrankungen des Menschen in Verbindung gebracht worden. Die jüngste Entdeckung von MG53 als wichtige Komponente der Membran Wiederverschließen Maschinen ermöglicht eine bessere molekulare Verständnis der biologischen Grundlagen der Reparatur von Gewebe, als auch für potenzielle translationale Anwendungen in der regenerativen Medizin. Hier haben wir ausführlich die experimentelle Protokolle für die Erkundung der in vivo Funktion des MG53 in die Reparatur von Muskelverletzungen mit Laufband Protokolle an Mausmodellen, für die Prüfung der ex vivo Membran Reparatur Kapazität durch Messung Farbstoff Einstieg in isolierten Muskelfasern, und für die Überwachung des dynamischen Prozess der MG53-vermittelte Vesikeltransport und Zellmembran Reparatur in kultivierten Zellen mit lebenden Zellen der konfokalen Mikroskopie.
Protokoll
1. Laufband Laufen für Revealing das Ausmaß der Muskelverletzung in Mausmodellen
- Richten Sie den Winkel des Laufbandes Oberfläche für den Einsatz während der laufenden Protokoll. Generell ist eine flache Ebene oder einem Winkel zwischen 7 ° und 15 ° Grad bergab oder bergauf verwendet wird. Einige Laufbänder haben in integraler Apparat, um die Steigung einstellen, während andere das Laufband, durch andere Mittel erhöht werden müssen.
- Legen Sie eine Schale oder einen blauen Labor-Pad unter dem Laufband, bevor die Tiere in der Tretmühle, Abfälle von den Tieren zu sammeln während des laufenden Protokoll.
- Vor dem Ausführen von Mäusen soll die Umwelt des Laufbandes akklimatisiert werden. Dies geht darum, die Tiere im Laufband für 15 Minuten mit dem Stromnetz abgeschaltet und der Riemenantrieb des Motors auf, aber der Gurt nicht bewegen (dh mit der Geschwindigkeit 0 m / s eingestellt ist).
- Schalten Sie den Motivations-Stromnetz. Die Intensität und die Frequenz der Pulse verwendet werden kann in der Regel auf dem Laufband gesteuert werden, sondern variiert von Hersteller zu Hersteller. Im Allgemeinen ist maximale Intensität nicht erforderlich, um Mäuse zu motivieren, wenn sie bei einer hohen Frequenz (mindestens einmal alle zwei Sekunden) die Einhaltung zu verbessern.
- Aktivieren Sie das Laufband an den laufenden Protokoll beginnen. Eine erste Geschwindigkeit von etwa 5 m / min sollte eine Aufwärmphase für die Mäuse verwendet werden. Die Geschwindigkeit des Laufbandes kann langsam beschleunigt werden, in der Regel durch Zugabe von 1-2 Meter / min für jede Minute nach Beginn des Laufbandes.
- Die Einhaltung der Tiere in den meisten Protokollen kann durch eine Reihe von Kleinauflagen (5 Minuten) bei Aufwärmen Geschwindigkeit von 3 bis 10 Tage vor der experimentellen laufen beginnt verbessert werden.
- Eine akute Erschöpfung Übung wird in der Regel beinhalten die Erhöhung der Geschwindigkeit des Laufbandes mit der Zeit, bis eine maximale Geschwindigkeit (in der Regel <30 m / m) erreicht und aufrecht erhalten, bis die Mäuse Anzeichen von Erschöpfung zu zeigen. Kriterien für die Beurteilung Erschöpfung variieren, aber in der Regel eine Maus verbringen mehr als die Hälfte der Zeit auf das Stromnetz oder 5 aufeinander folgenden Sekunden auf dem elektrischen Netz ohne Rückkehr zum Laufband Oberfläche. Nach einer individuellen Maus erschöpft ist, kann aus dem Laufband entfernt werden und die gesamte Zeit laufen können aufgezeichnet werden.
- Die Veränderung des Winkels des Laufbandes kann in akuten laufenden Studien verwendet werden, um die Ausübung Last (mit einem bergauf-Winkel) zu erhöhen oder zu beschädigen exzentrische Kontraktionen (mit einem Downhill-Winkel), dass die sarkolemmalen Membranen der Muskelfasern 1 Reißen zu induzieren. Evans blue Farbstoff kann in Tiere vor solchen Verfahren für den Einsatz als histologischen Farbstoff beschädigte Muskelfasern 2,3 identifizieren injiziert werden.
- Ausdauertraining Laufen Protokolle bieten eine Übung Belastung für das Tier über einen längeren Zeitraum (bis zu Monate), um Umbau des Muskel-oder Herz-Kreislauf-System zu erzeugen. Warm up-Verfahren ist das gleiche wie oben (Schritt 1,5) jedoch die maximale Geschwindigkeit ist in der Regel niedriger und die Laufzeiten sehr lang sein können (> 1 Stunde).
- Nach Abschluss der Ausführung der Mäuse können in ihre Käfige zurück. Laufbänder in der Regel ziemlich schmutzig, während die Mäuse laufen, besonders über lange Protokolle. Es ist notwendig, um dem Laufband sauber, in der Regel mit einem 70% igem Ethanol Spray, nach jedem Gebrauch.
2. Ex vivo-Test der Membrane Repair Kapazität von isolierten Muskelfasern Nach UV-Laser Damage
- Sezieren die oberflächliche Schicht des M. flexor digitorum brevis (FDB) Muskeln von der Maus zu Fuß. Zuerst schneiden Sie die Haut der Sohle offen an der Mittellinie, während die Betreuung nicht auf die Muskeln darunter Schaden, dann horizontale Schnitte und die Haut abziehen. Die flache weiße Sehne des FDB Muskel (proximalen Sehne) zu sehen an der Fersenbein werden. Unverblümt trennen die Sehne durch die Zange und durchtrennen die Sehnen in der Nähe von Ort der Befestigung, greifen die freie Sehne durch die Zange und ziehen Sie sie sanft auf die FDB vom umgebenden Gewebe zu trennen, während beschneiden Bindegewebe, verbunden bleiben. Beim Anblick des distalen Sehnen Zweig zu den einzelnen Ziffern der FDB durch Schneiden, wo diese Sehnen, die tiefere Schicht der Muskeln verbinden entfernt werden kann.
- Legen Sie die FDB Muskelbündel in 1 ml Kollagenase-Lösung vorgewärmt auf 37 ° C in einem 1,5 ml Eppendorf-Röhrchen, kleben Sie das Rohr in einer horizontalen Ausrichtung in einem 37 ° C Schüttler und schütteln bei 200 rpm für 65 min. Times of Inkubation eventuell angepasst, um eine ausreichende Verdauung, die durch einen ausgefransten Erscheinungsbild und blasse Farbe des Muskels angegeben ist zu gewährleisten.
- Sorgfältig übertragen verdaut FDB Bündel in eine 1,5 ul Zentrifugenröhrchen mit ~ 600 ul von 2,5 Ca 2 + Tyrode über eine 1 ml Pipettenspitze mit einem abgeschnittenen Ende, die einen Durchmesser ausreicht, um die verdauten Bündel leicht durch ohne Unterbrechung hat. Vorsichtig drehen Sie die Röhre in den losen Fasern aus dem Bündel zu schütteln.
- Schneiden Sie ein 30 ul Pipettenspitze, so dass die diameter ist nur geringfügig kleiner als die Muskelbündel (zwischen 15 bis 20 &mgr; m im Durchmesser) Verwenden Sie die Pipette zu ziehen Sie die Bündel in die Pipette und dann schieben Sie sie zurück in die Lösung.. Wiederholen Sie diesen Vorgang, bis die Mehrheit der Fasern losgelöst von dem Bündel sind.
- Mix distanziert Fasern auch durch vorsichtiges Drehen der Tube, nehmen gewünschte Menge und Höhe auf ein Glas-bottom delta T Schüssel. Das Volumen, um Last auf die Effizienz der Isolation und der Anzahl der nützlichen Fasern, die auf einem Teller für ein bestimmtes Protokoll benötigt werden, variieren. Die restlichen Fasern können in die Röhrchen bei 4 ° C für ca. 6 Stunden für zusätzliche Studien abgelegt.
- Anschließend wird die Schale sitzen für 5 Minuten ruhig stehen. Dies ermöglicht die Fasern auf das Glas Boden der Schale haften.
- Setzen Sie den Glasboden Schüssel auf einem konfokalen Mikroskopie mit einem UV-Laser ausgestattet. Beachten Sie die Fasern unter Phasenmikroskopie bei> 100-facher Vergrößerung auf das Vorhandensein eines normalen Streifung Muster und eine gerade, stabförmige Form zu überprüfen.
- Add FM1-43 oder FM4-64 styrylpyridinium Farbstoffe 4 bis Lösung auf eine Endkonzentration von 2,5 uM 5.
- Um eine Beschädigung der Faser ihre Position für die Imaging-Fenster bewegen, so wird die Faser in einem 45 ° Winkel von der Spitze des Feldes der Blick auf die unten rechts (Abbildung 1) nach links orientiert. Bestrahlen ein 5x5 Pixel-Bereich (ca. 0.9μmx0.9μm) der Plasmamembran mit einem UV-Laser (80 mW oder höher, 351/364 nm) eingestellt, um maximale Leistung für 5 Sekunden. Die bestrahlte Region sollte split der Plasmamembran, das heißt, die Hälfte der 5x5 Box sollte innerhalb der Faser, während der Rest außerhalb der Faser (Abbildung 1) werden soll.
- Machen Sie Bilder von Farbstoff-Eintrag in die Faser im Abstand von jeweils 5 Sekunden für bis zu 5 Minuten.
- Wiederholen Sie Schritt 2.8 für nicht mehr als 3 Fasern pro Gericht, wie die Fluoreszenz-Farbstoff wird schließlich in die Faser Endozytose und erschweren eine Analyse der Daten. Nach 3 Fasern ein neues Gericht sollte aus Schritt 2.5 vorbereitet werden.
- Analysieren von Daten durch die Berechnung der Änderung der Fluoreszenzintensität (&Dgr; F / F 0) zwischen den einzelnen aufgenommene Bild, um die Menge an Farbstoff Eintrag zu messen. Dies erfordert die Messung der mittleren Fluoreszenz eine Fläche von etwa 200 pm 2 mit Analyse-Software wie z. B. die öffentlich zugänglich ImageJ (http://rsbweb.nih.gov/ij/). Zum Vergleich zwischen den Fasern, sollte die folgende Berechnung für jeden Frame gemacht werden: &Dgr; F / F 0, wobei F 0 ist die mittlere Fluoreszenz der Region von Interesse in der ersten erfassten Frame (t = 0; vor Verletzungen) und AF ist die Veränderung der Fluoreszenz der einzelnen nachfolgenden Frame (FF 0).
3. Live Cell Imaging Konfokale um den dynamischen Prozess der Cell Membrane Repair-Monitor
- Mikropipetten wurden aus PYREX Kapillaren aus. Die Kapillare wurde auf einer Mikropipette puller gesetzt und gezogen von voreingestellten Programm (Heat = 695; Pull = 50; Vel .= 55; Time = 250).
- Micropipette war es, ein 3-Achsen (xyz) Mikromanipulator befestigt.
- Die Zellen werden mit Plasmid-DNA mit normalen Methoden, die auf einem Glasboden delta T Schale transfiziert. Die Medien sollten bis 2,5 mm Ca 2 + geschaltet werden Tyrode Puffer vor Experimenten zu beginnen.
- Glasschalen mit transfizierten Zellen wurden auf einer Laser-Scanning-konfokalen Mikroskop mit 40x 1.3NA Ölimmersionsobjektiv platziert.
- Die akute Live-Zellschäden wurde durch Einfügen der Mikropipette in die Zellmembran durchgeführt und dann schnell zurückziehen Mikropipette aus der Zelle 3,6. Fortlaufende Live-Cell-Bilder wurden im Abstand von 1,54 s / Frame erhalten.
- Für das Saponin induzierte Membranzerstörung Assay, 0,005% Saponin (Sigma) in 2,5 mm Ca 2 + Tyrode Puffer wurde durch einen Schwerkraft-flow individuell zusammengestellt Perfusion System 7 perfundiert. Die Perfusion beträgt etwa 1 ml / min und die Durchblutung Spitze sollte direkt über der Zelle abgebildet platziert werden.
4. Repräsentative Ergebnisse:
Ein Vertreter Film der Maus Laufband kann während der Dreharbeiten gemacht werden. Der Film illustriert die Senkung der laufenden Kapazität der MG53-/ - Mäusen durch den Skelettmuskel Schaden.
Das Ausmaß der Schäden durch die UV-Laser-Schaden-Protokoll detaillierte oben verursacht, hängt von der Membran Reparatur Kapazität der Faser untersucht. Diese Kapazität wird durch den Genotyp der Maus, aus dem die Faser wurde isoliert, extrazellulären Bedingungen und gegebenenfalls auf die Proteinexpression (Transfektion oder Infektion) betroffen. Eine normale Wildtyp-Faser ermöglicht eine leichte bis Farbstoff Eintrag (Abbildung 2a) moderieren. Muskelfaser aus dem MG53-/ abgeleitet - Mäuse mit eingeschränkter Membran Reparatur Kapazität bedeutender Eintrag von Farbstoff in die Faser (Abb. 2b) anzuzeigen.
Typische Ergebnisse für Mikroelektroden Verletzungen zeigen, die Translokation von MG53-haltigen Vesikelnzeuge an die verletzte Stelle. Abbildung 3a und 3b zeigen GFP-MG53 transfizierten C2C12 Myotuben durch Insertion der Mikropipette in die Zellmembran beschädigt. In der Zelle vor Mikropipette Schaden ist GFP-MG53 auf beiden Plasmamembran und Cytoplasma 3 befindet. Nach Mikropipette Penetration bewegt GFP-MG53 Vesikel Richtung Schadstellen (wie durch Pfeil gekennzeichnet). Abbildung 3c zeigt eine GFP-MG53 transfizierten C2C12 Myoblasten mit 0,005% Saponin, ein Waschmittel, das die Plasmamembran permeabilisieren können behandelt werden. Nach Saponin Behandlung, GFP-MG53 aus Cytosol an die Zellmembran transloziert.
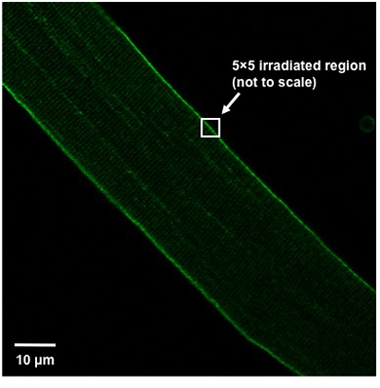
Weisleder, et al. Abbildung 1. Fiber Alignment und Verletzungen Region Definition. Korrekte Ausrichtung der isolierten Muskelfasern innerhalb des Sichtfeldes und die Definition der Verletzung Region gezeigt.
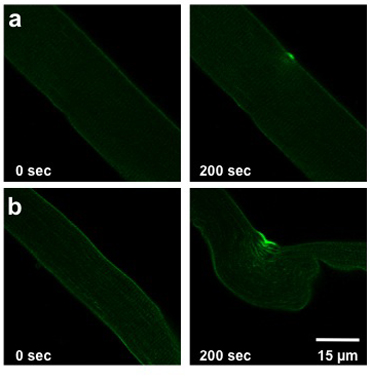
Weisleder, et al. Abbildung 2. UV-Laser Schäden FDB Faser. Images zeigen Fasern vor, um Verletzungen (0 sec, links) und bei 200 sec nach der Verletzung (rechts). Fasern aus einer Wildtyp-Maus (a) zeigen leichte Verletzungen. Fasern, die aus Mäusen mit geschwächtem Membran Reparatur (b) ermöglichen mehr Farbstoff zu geben.
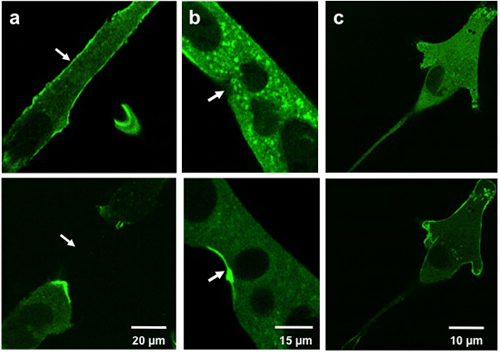
Weisleder, et al. Abbildung 3. Mikroelektroden und Saponin Schäden an kultivierten Zellen. Images zeigen C2C12 Myotuben (a, b) und einer C2C12 Myoblasten (c) vor Verletzungen (oben) und nach der Verletzung (unten). Zellen mit einer Mikroelektrode (a, b) verletzt zeigen MG53 Translokation, um Verletzungen zu Websites (Pfeile). Zellen mit Saponin (c) behandelt zeigen MG53 Translokation an die Zellmembran.
Diskussion
Laufband ist eine nützliche Methode ist die Bereitstellung einer Trainingsbelastung zu den behandelten Tieren. Als eine Methode zur Messung der Muskelfunktion und Ausdauer Kapazität ist ein notorisch lauten Ansatz, der nur schwer in eine gleichbleibend reproduzierbar 8 ausgeführt wird. Im Allgemeinen können Zeiten bis zur Erschöpfung als Endpunkt verwendet werden, um große Unterschiede zwischen den experimentellen Gruppen, wie jene zwischen einigen Knockout-Maus Linien und Wildtyp-Mäusen 9 zu beheben. Experimentelle Manipulationen, die subtiler Unterschied, wie einige pharmazeutische Prozesse zu erzeugen, kann nicht aufgelöst werden Unterschiede über den Lärm mit dieser Technik verbunden sind. Um die Reproduzierbarkeit und Sensitivität dieser Techniken zu maximieren, ist es wichtig, die Bedingungen für Sitzung zu Sitzung sehr eng zu halten. Die Zeit des Tages die Tiere ausgeübt werden, sowie die Aufwärmphase Bedingungen verwendet werden, sind wichtige Faktoren und sollte konsistent bleiben von Versuch zu Versuch.
Verzerrungseffekte können erhebliche Auswirkungen auf die Gestaltung der Laufband-Protokolle, wie bestimmte Stämme von Mäusen kann viel mehr Zeit auf dem Laufband als andere Stämme und reagieren unterschiedlich auf Ausdauertraining 10. Als allgemeine Richtlinie wird viele Mäuse in der Lage sein zu 200-300 Metern insgesamt zu einer Erschöpfung Studie mit konstanter Anstieg der Geschwindigkeit des Laufbandes (5 m / m Anfangsgeschwindigkeit mit 1 m / m pro Minute nach dem Start aufgenommen) laufen. Für ein Ausdauertraining die Mäuse können zwischen 9-12 m / m für 30 Minuten 2 oder 3 mal pro Woche durchgeführt werden. Allerdings werden die einzelnen Studien erfordern in der Regel einige Optimierungen des Protokolls zum individuellen experimentellen Anforderungen entsprechen.
Der UV-Laser-Schaden Verfahren hat sich gezeigt, dass eine effektive Methode zur Messung der Membran Reparatur Kapazität von Skelettmuskelfasern 3,6,11 werden. Ein wesentlicher Bestandteil für den Erfolg dieser Experimente ist es, nur Muskelfasern, die einen geraden, stabförmigen Aussehen Display mit einem regelmäßigen Muster von Rillen und einen reibungslosen Sarkolemm, dass nicht angezeigt wird faltig verwenden. Wenn andere Muskelfasern aktiviert sind Membran beschädigen können bereits vorhanden sein in dieser Fasern und Interpretation der Ergebnisse aus diesen Experimenten kann kompliziert sein. Es ist auch wichtig, dass die Ausrichtung der Faser und der Definition der bestrahlten Region wie in Abbildung 1 definiert werden. Dies stellt eine Verletzung von reproduzierbaren Größe, so dass Vergleich zwischen Fasern. Wenn der definierte Bereich der Verletzung liegt vollständig innerhalb der Faser, wird eine innere Verletzung als Störung des Sarkolemm erstellt werden. Darüber hinaus ist der Wert für &Dgr; F / F 0 berechnet sehr empfindlich auf die Region von Interesse für die Messung der mittleren Fluoreszenz ausgewählt. Eine Fläche von ca. 200 um 2, neben und mit der verletzten Stelle, ist angemessen. Im Gegensatz zu der Region für Verletzungen definiert, sollte dieser Bereich vollständig innerhalb der Faser. Wenn Sie Platz außerhalb der Faser enthalten, werden die daraus resultierenden leeren Bereich &Dgr; F / F 0 in Fasern mit wenig Farbstoff Eintrag zu erhöhen bei gleichzeitiger Senkung der &Dgr; F / F 0 in Fasern mit einem schwereren Phänotyp. Dies verringert die Empfindlichkeit des Tests, wodurch Vergleich zwischen den Fasern erschwert.
Für die Mikropipette Schäden Assay sollte der Winkel zwischen der Mikropipette und Glasboden Schüssel etwa 45 Grad sein, um effektiv Schäden der Zellmembran. Die Zellen wurden für Mikropipette Schaden gewählt werden sollte fest mit dem Boden der Schale angebracht werden und runden Zellen nicht, da die meisten wahrscheinlich werden sie nach Mikropipette Stossen zu lösen. Saponin permeabilzation Experimente sind technisch weniger anspruchsvoll und relativ schneller im Vergleich zu Penetration Tests Mikropipette durchzuführen. Es gibt jedoch mehrere Einschränkungen auf Saponin Schäden, einschließlich, dass nur eine Zelle pro Gericht kann verwendet werden, da Saponin wird diffus und Schäden anderer Zellen in die Schüssel.
Offenlegungen
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
|---|---|---|---|
| Nager Laufband | Columbus Instruments Exer 3 / 6 oder gleichwertig | ||
| 70% Ethanol | ISC Bioexpress | ||
| Dissection Tools wie feine Spitze Pinzette, Schere Frühjahr | World Precision Instruments | ||
| 2 mg / ml Kollagenase Typ I | Sigma | ||
| 0 CA 2 + Tyrode-Puffer (140 mM NaCl, 5 mM KCl, 10 mM HEPES, 2 mM MgCl 2, pH 7,2, 290 mosm) | Sigma | ||
| 2,5 mm Ca 2 + Tyrode-Puffer (140 mM NaCl, 2,5 mM CaCl 2, 5 mM KCl, 10 mM HEPES, 2 mM MgCl 2, pH 7,2, 290 mosm) | Sigma | ||
| Temperierbaren Schüttler | New Brunswick oder gleichwertig | ||
| Delta TPG Dish | Fisher Scientific | 1207133 | |
| LSM 510 konfokalen Mikroskop mit einem Enterprise 80 mW UV-Laser oder eine gleichwertige konfokalen Mikroskop | Zeiss | ||
| FM1-43 oder FM4-64 Farbstoffe | Invitrogen | ||
| Borosilikat Kapillaren Größe 0,8-1,0 X 100 mm | PYREX | Art.-Nr. 9530-2 | |
| Micropipette puller | Sutter Instruments | Modell P-97 | |
| 3-Achs-Mikromanipulator | Narishige | MHW-3 | |
| Radiance 2100 Laser-Scanning-konfokalen Mikroskop oder eine gleichwertige Mikroskop | BioRad | MHW-3 | |
| Saponin | Sigma | 47036 |
Referenzen
- Armstrong, R. B., Ogilvie, R. W., Schwane, J. A. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol. 54, 80-93 (1983).
- Hamer, P. W., McGeachie, J. M., Davies, M. J., Grounds, M. D. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J Anat. 200, 69-79 (2002).
- Cai, C. MG53 nucleates assembly of cell membrane repair machinery. Nat Cell Biol. 11, 56-64 (2009).
- Cochilla, A. J., Angleson, J. K., Betz, W. J. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev Neurosci. 22, 1-10 (1999).
- McNeil, P. L., Miyake, K., Vogel, S. S. The endomembrane requirement for cell surface repair. Proc Natl Acad Sci U S A. 100, 4592-4597 (2003).
- Cai, C. Membrane repair defects in muscular dystrophy are linked to altered interaction between MG53, caveolin-3, and dysferlin. J Biol Chem. 284, 15894-15902 (2009).
- Wang, X. Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair. Circ Res. 107, 76-83 (2010).
- Knab, A. M. Repeatability of exercise behaviors in mice. Physiol Behav. 98, 433-440 (2009).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol Genomics. 23, 72-78 (2005).
- Massett, M. P., Berk, B. C. Strain-dependent differences in responses to exercise training in inbred and hybrid mice. Am J Physiol Regul Integr Comp Physiol. 288, 1006-1013 (2005).
- Bansal, D. Defective membrane repair in dysferlin-deficient muscular dystrophy. Nature. 423, 168-172 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten