Method Article
Maus Oocyte Mikroinjektion, Reifung und Ploidie Beurteilung
In diesem Artikel
Zusammenfassung
Eizellen sind anfällig für Aneuploidie aufgrund von Fehlern in Chromosomensegregation während meiotischen Reifung. Aneuploiden Eier können zu Unfruchtbarkeit, Fehlgeburten oder Entwicklungsstörungen wie dem Down-Syndrom. Hier beschreiben wir Methoden, um Material der Wahl in Oozyten und Methoden zur meiotischen Reifung zu studieren und zu bewerten Ploidie einzuführen.
Zusammenfassung
Fehler in Chromosomensegregation zu aneuploiden Zellen führen. In somatischen Zellen ist Aneuploidie mit Krebs in Verbindung gebracht, aber in Gameten führt Aneuploidie zu Unfruchtbarkeit, Fehlgeburten oder Entwicklungsstörungen wie dem Down-Syndrom. Haploide Gameten Form durch artspezifische Entwicklungsprogramme, die Meiose gekoppelt sind. Die ersten Reifeteilung (MI) ist einzigartig auf der Meiose, weil Schwesterchromatiden verbunden bleiben, während homologen Chromosomen getrennt sind. Aus Gründen noch nicht vollständig verstanden ist dies reductional Division fehleranfällig und wird häufiger die Quelle der Aneuploidie als Fehler in der Meiose II (MII) oder als Fehler in der männlichen Meiose 1,2.
In Säugetieren, Eizellen Verhaftung Prophase der MI mit einem großen, intakten Keimbläschen (GV; Kern) und erst wieder Meiose, wenn sie ovulatorischen Hinweise erhalten. Nach der Meiose wieder aufgenommen wird, Eizellen komplette MI und unterliegen einer asymmetrischen Zellteilung, verhaften wieder in der Metaphase der MII. Eier werden nicht komplette MII, bis sie durch Spermien befruchtet werden. Eizellen können auch unterziehen meiotischen Reifung mit in-vitro-Kultur Bedingungen 3 etabliert. Da Generation von transgenen und Gen-gezielte Mausmutanten ist kostspielig und kann längere Zeit dauern, ist die Manipulation der weiblichen Gameten in vitro eine wirtschaftlichere und zeitsparende Strategie.
Hier beschreiben wir Methoden zur Prophase verhaftet Eizellen von Mäusen und für die Mikroinjektion zu isolieren. Jegliches Material der Wahl kann in die Eizelle eingebracht werden, sondern weil meiotisch-kompetenten Oozyten transkriptionell stillen sind 4,5 cRNA und nicht DNA, muss für ektopische Expression Studien injiziert werden. Um zu beurteilen, Ploidie, beschreiben wir unsere Bedingungen für in-vitro-Maturation von Eizellen zu MII Eier. Historisch gesehen sind Chromosom-Verbreitung Techniken zum Zählen Chromosom Nummer 6 verwendet. Diese Methode ist technisch anspruchsvoll und ist limitiert auf nur identifizieren hyperploidies. Hier beschreiben wir eine Methode, um Hypo-und hyperploidies mit intakten Eiern 7-8 zu bestimmen. Diese Methode verwendet Monastrol, ein Kinesin-5-Hemmer, dass die bipolare Spindel fällt in eine monopolare Spindel 9 so trennt Chromosomen so dass die einzelnen Kinetochoren leicht erkannt und mit Hilfe eines anti-CREST autoimmune Serum gezählt werden. Da diese Methode in intakten Eiern durchgeführt wird, sind die Chromosomen nicht verloren wegen Bedienfehler.
Protokoll
1. Maus Eizellenentnahme
- Zur Maximierung der Anzahl der Antralfollikeln von jeder Maus isoliert injizieren intraperitoneal geschlechtsreifen weiblichen Mäusen (wir verwenden 6-Wochen alten CF-1-Mäuse von Harlan) mit 5 IU von schwangeren Stute Serum Gonadotropin (PMSG).
- Bereiten Sie die Sammlung Medium (MEM / PVP) (3 ml / Maus), indem Milrinon bis 2,5 um und warm bei 37 ° C. Milrinone ist ein Phosphodiesterase-Hemmer, der meiotischen Arrest hält einmal Oozyten aus Follikeln entfernt werden. Alternativ können 3-Isobutyl-1-Methylxanthin (IBMX) (0,2 mM) oder Dibutyryl-zyklisches Adenosinmonophosphat (dbcAMP) (100 pg / ml) verwendet werden. Bereiten Sie das Kulturmedium durch Zugabe von Glutamin (1 mM) und Milrinon (2,5 pM) zu 1 ml CZB und lassen Sie es in den Inkubator für mindestens eine Stunde ausgleichen. Richten Sie die Mikro-Tropfen von jedem in einer Petrischale und Überlagerung mit Mineralöl. Die CZB Gericht ist in den Inkubator gelegt, während die MEM / PVP Schüssel bleibt draußen auf einer Folie wärmer. Andere Sammlung und Kulturmedium, die kommerziell verfügbar sind (M2 und M16 aus Sonstige Medien oder Sigma) werden auch routinemäßig eingesetzt.
- Etwa 48 Stunden nach PMSG Grundierung, Opfer der Maus mit CO 2 Sedierung durch Genickbruch folgte, sezieren die Eierstöcke und legen Sie sie in ein Uhrglas mit vorgewärmten MEM / PVP + Milrinon (MEM / PVP + M).
- Mit einer 1 ml Insulinspritze, Anker der Eierstöcke auf die Schüssel und lassen Sie die Antralfollikeln durch Punktion sie mehrmals mit 27-Gauge-(oder Nähen) Nadeln, die aneinander befestigt sind.
- Während man durch ein Dissektionsmikroskop, sammeln Kumulus-Eizell Komplexe mit einem Mund-betrieben Glaspipette. Es ist hilfreich, ein Mikroskop mit viel Kontrast haben. Alternativ kann das Medium mit dem Gewebe und Zellen auf einem Deckel aus einer Kunststoff-Petrischale pipettiert werden. Nur sammeln großen, Antralfollikeln und nicht kleiner pre-Antralfollikeln oder entblößt Eizellen. Einmal gesammelt, übertragen Sie die Komplexe zu einer microdrop der MEM / PVP + M, die auf der Folie wärmer und unter Öl ist.
- Mit einer kleinen Pipette (etwas größer als der Durchmesser der Eizelle), Pipette nach oben und unten die Komplexe, die Cumulus-Zellen zu lösen. Übertragen Sie die entblößten Eizellen mit einer größeren Pipette in ein microdrop von CZB + Milrinon (CZB + M) und in den Inkubator.
- Lassen Eizellen für mindestens 1 h in den Inkubator vor Manipulation zu erholen.
2. Oocyte Mikroinjektion
- Machen Injektion Pipetten, indem Borosilikat-Glas-Kapillarröhrchen in einem mechanischen Abzieher. Wir verwenden ein Flaming-Brown Mikropipette Puller (Modell P-97) mit folgenden Einstellungen: P = 500, Heat = 300, Pull = 150, Vel = 100, Time = 150.
- Bereiten Sie die Mikroinjektion Plattform, indem ein 5 pl Tropfen MEM / PVP + M so nah wie möglich an eine 0,5 ul Tropfen Injektion Material der Wahl (zB siRNA, cRNA, Morpholino-Oligonukleotid, etc.) auf einem 1-Kammer auch Folie, hat die Medien Kammer entfernt. Deckel mit Mineralöl und Platz auf dem Mikroskoptisch (Abb. 1).
- Legen Sie Einspritz-und Pipetten in die Halter und die Position in den Tropfen MEM / PVP + M. Schalten Sie den Stickstofftanks, dass die picoinjector und Anti-Vibrations-Tabelle verbunden sind. Öffnen Sie die Spitze des Injektionspipette durch leichtes Antippen es gegen die Haltepipette beim Befüllen mit Medium. Wenn die Öffnung zu groß ist, wird das Medium in die und aus bewegen sich schnell, und die Nadel wird die Zelle zu töten. Pipetten mit zu klein für eine Öffnung oft leicht verstopfen.
- Transfer-Oozyten (5-10) aus dem Inkubator auf die MEM / PVP + M Drop auf die Plattform. Vor der Injektion, Setup der picoinjector. Wir verwenden die folgenden Parameter auf unserer picoinjector (Model PLI-100 von Harvard Apparatus): PBal = 2,5-3,5 psi, PInj = 7,8 psi, PClear = 10-12 psi, Zeit = 3s. Dies resultiert in einem Injektionsvolumen von 5-10 pL.
- Halten Sie die Taste CLEAR, bewegen Sie die Injektionsnadel, um das Material fallen zu lassen und zu füllen. Bringen Sie es zu dem Medium fallen.
- Verwenden Sie die Haltepipette eine Eizelle zu erfassen und richten Sie die Injektionsnadel, Eizelle und Haltepipette entlang der x-Achse.
- Unter höherer Vergrößerung Voraus Injektionspipette durch die Eizelle darauf achten, den Kern zu vermeiden. Sobald die Plasmamembran ist durchbohrt, drücken Sie injizieren. Nach der Injektion ziehen Sie die Nadel. Lassen Sie die Eizelle und zu wiederholen. Nachdem alle Eizellen injiziert werden, kehren sie in den Inkubator. Halten Sie in CZB + M für die gewünschte Menge an Zeit, diese Zeit ist abhängig von der experimentellen Ziel (dh siRNA und Morpholino Knockdown (bis zu 24 h), Überexpression (3-12 h)). Bitte beachten Sie, dass Inkubationen länger als 24 h wird meiotischen Reifung Kompromiss.
3. Eizellreifung
- Nach Inkubation der Eizellen durch mehrere Tropfen CZB (Reifung Medium) und Transfer zu einem microdrop der Reifung Medium unter Öl und in den Inkubator.
- Lassen Sie 16 h für die vollständige Reifung t o Metaphase der Meiose II.
4. Ploidie Analyse
- Bereiten CZB + Monastrol (100 uM) und Platz 750 ul in den Brunnen eines Organs Kulturschale, dass Wasser in den äußeren Ring.
- Wash Eier durch mehrere Tropfen CZB + Monastrol und übertragen Sie sie in das Organ Kulturschale. Legen Sie in den Inkubator für 1 h.
- Fix die Eier durch Überführung in ein Uhrglas mit 2% Paraformaldehyd in PBS für 20 Minuten bei Raumtemperatur. Transfer in ein anderes Uhrglas mit Blocking-Lösung. Dieses Gericht kann bei 4 ° C gelagert werden bis zur Verarbeitung.
- Transfer zum Permeabilisierung Lösung (PBS + 0,3% BSA + 0,1% TritonX-100 + 0,02% NaN 3) in einem Uhrglas für 15 Minuten bei Raumtemperatur. Spülen Sie durch mehrere große Mengen von Blockierungslösung (PBS + 0,3% BSA + 0,01 Tween-20 + 0,02% NaN 3).
- Der Rest des Verfahrens ist auf dem Deckel einer 96-Well-Platte in einer feuchten Kammer bei Raumtemperatur, die vor Licht geschützt wird durchgeführt. Die Tropfen (~ 25 ul) sind innerhalb der kreisförmigen Vertiefungen platziert. Transfer-Eier Blockierungslösung für 15 Minuten.
- Zur Beschriftung Zentromere, Transfer Eier zu einem Rückgang der Sperrung Lösung mit CREST Anti-Serum bei 1:40. Inkubieren für mindestens 1 h Wash bis 3 Tropfen Blockierungslösung, Inkubation 15 Minuten in jedem.
- Transfer-Eier zu einem Rückgang der Sperrung Lösung mit Cy5-oder Alexa-Fluor-594-konjugierte anti-human IgG (1:200) und Inkubation für 1 Stunde. Wiederholen Sie die Waschschritte wie oben, außer für den letzten Schritt, gehören Sytox Green (1:5000) in Blocking-Lösung, um Chromosomen zu erkennen. Montieren Sie in 5 ul Vectashield. Um zu verhindern, Quetschen der Eier, legte 4 kleine Flecken von Vaseline an den Ecken, wo das Deckglas wird. Legen Sie ein Deckglas auf und Dichtung mit Nagellack. An einem schiebeschachtel bei 4 ° C bis zur Verarbeitung über die konfokale Mikroskopie.
- Während Bildgebung mit einer 100X Objektiv, Capture 0,4 pm Schritte in der Z-Ebene und Image der gesamten Region des Metaphase-Spindel. Graf Zentromere mit Bildbearbeitungssoftware wie Image J (NIH).
5. Repräsentative Ergebnisse:
Abbildung 2 ist ein Z-Projektion von einem euploiden Ei. In der Metaphase der MII enthalten euploiden Maus Eier 20 Chromosomenpaare und daher haben 40 Zentromere. Gelegentlich Chromosomen nicht, trotz Monastrol Behandlung zu verbreiten. Diese Situation macht es schwierig, zuverlässig zählen Zentromere und wir daher nicht enthalten diese Eier in unsere Analysen. Gelegentlich kann es schwierig sein, festzustellen, ob ein CREST-immunreaktive "spot" 1 oder 2 Zentromere ist. Mit Programmen wie Image J ist nützlich, weil man jeden Z-Abschnitt kann analysieren, während sorgfältig unter Hinweis auf die Orientierung der Chromosomen, die Zahl der Abschnitte, in denen ein "Ort" erkannt wird und die Pixel-Intensität der "Flecken". Je nachdem, wo der meiotischen Spindel relativ zu den Polkörper positioniert ist, kann die DNA-Regionen überschneiden und diese Proben sollten nicht in die Analyse einbezogen werden.
Unmanipulierten, in vivo ovulated Eier aus reproduktiv jungen Mäusen haben niedrige Aneuploidie (~ 1-2%). Jedoch aus Gründen nicht verstanden, Mikroinjektion und in-vitro-Maturation Verfahren erhöhen diese Rate nach oben von 10%. Deshalb ist es entscheidend, dass die Kontrolle injizierten Oozyten in jeder Mikroinjektion Studie enthalten sind.

Abbildung 1. Mikroinjektion Gericht eingerichtet. Eine Kammer slide mit 5 ul Tropfen MEM / PVP + M oberhalb 0.5μl Tropfen Injektionslösung. Deckel mit Mineralöl. In diesem Beispiel gibt es 3 Tropfen für 3 verschiedene Injektionslösungen und die Folie ist auf der Bühne eines Mikroskops sitzen. Auf der linken Seite ist die Mikroinjektionsnadel und auf der rechten Seite ist die Holding-Pipette. Beachten Sie, dass es ein Spiegelbild der Nadelhalter.
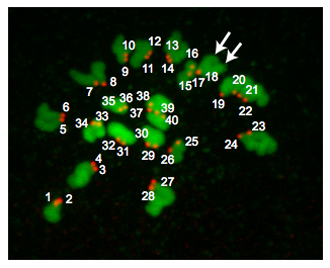
Abbildung 2. Ploidie Ergebnisse. Ein Z-Projektion eines euploiden Metaphase II Ei. DNA ist in grün gefärbt und Kinetochoren sind rot gefärbt. Die Pfeile zeigen auf 2 verschiedene Chromatid Arme darauf hinweist, dass Kinetochoren (# 17 und # 18) überlappen. Euploiden Mäuse-Eizellen enthalten 20 Kinetochor Paare (40 total "spots"). Ein aneuploid Ei enthalten würde jede Veränderung unter dieser Nummer. Wenn dieses Verfahren auf Metaphase MI-Oozyten durchgeführt wurden, befinden sich 40 Kinetochor Paare (80 total "spots") werden.
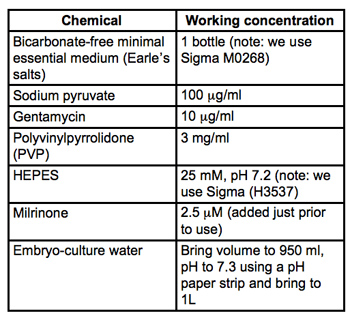
Tabelle 1. Rezept für die Sammlung und Mikroinjektion Medium (MEM / PVP + M). Alle Materialien sind embryo-culture grade und von Sigma-Aldrich. Filter durch 0,22 &mgr; m PVDF-Filter (wir verwenden Milipore Stericups) und lagern bei 4 ° C sterilisieren
iles/ftp_upload/2851/2851table2.jpg "alt =" Tabelle 2 "/>
Tabelle 2. Rezept für CZB Medium. Alle Materialien sind embryo-culture grade und von Sigma-Aldrich. Filter durch 0,22 &mgr; m PVDF-Filter (wir verwenden Milipore Stericups) und lagern bei 4 ° C sterilisieren
Diskussion
Mikroinjektion von Eizellen ist eine leistungsfähige Methode, um Mechanismen, die meiotischen Reifung 10,11, 12, 13 regulieren zu studieren. Diese Methode bietet eine kostengünstige Möglichkeit, Hypothesen testen, bevor was eine große Investition in die Entwicklung transgener und gezielte Mausmodellen. Eizellenentnahme und Mikroinjektion Techniken erfordern mehr Zeit als typische Zellbiologie Verfahren beherrschen. Spezifische Hindernisse mit der Sammlung enthalten oft die Steuerung der Mund pipettieren, Ziehen der richtigen Größe Glaspipette für die Sammlung und Strippen der Körperzellen und wachsende Sammlung Geschwindigkeit, um die Zeit, in der Eizellen außerhalb des Inkubators zu minimieren. Wir empfehlen praktizieren viele Male vor der Durchführung von Experimenten. Übertragen Eizellen zwischen Mikro unter Beibehaltung der gleichen Anzahl von Zellen ist ein guter Weg, um sich mit dieser Methode.
Der Zelltod tritt häufig beim Lernen Mikroinjektion. Dies könnte für eine Reihe von Gründen, einschließlich Injektion zu groß mit einem Volumen von Material (dh die Injektionsnadel Öffnung zu groß ist), trifft den Kern mit der Injektionsnadel, Durchstechen der gegenüberliegenden Seite der Eizelle oder die auftreten können, das Material injiziert ist giftig für die Eizelle. Das Üben mit Injektion von Puffer in Oozyten, bis Ihre Überlebensrate liegt bei mindestens 50% ist der Schlüssel zur Beherrschung dieser Technik. Wenn Eizellen reifen nicht es ist wahrscheinlich, dass die Milrinon nicht verdünnt genug. Wir empfehlen Spülen der Eizellen durch viele große Tropfen Milrinon-free CZB vor der Reifung.
Die Ploidie Analyse folgende Mikroinjektion ist eine von vielen Assays zur meiotischen Reifung zu beurteilen. Andere Routineanalysen wir den Einsatz im Labor gehören die Überwachung der Kinetik, mit dem die Eizellen Fortschritt durch Meiose, Immunfluoreszenz zur Spindel Bildung und Chromosomen-Ausrichtung und Ei-Aktivierung zu analysieren oder in-vitro-Fertilisation mit den Entwicklungs Folgen der Eizelle Manipulation 14,15, 16 zu bewerten, 17.
Offenlegungen
Danksagungen
Diese Arbeit wurde in Richard M. Schultz 's Labor durchgeführt. Die Autoren möchten auch Michael Lampson für die Konzeption der Zentromer-Counting-Assay und den Zugang zu seinem konfokalen Mikroskop erkennen. Teresa Chiang und Francesca Duncan in die Optimierung der Zentromer-Counting-Test unterstützt. Paula Stein wird von HD022681 unterstützt (RMS) und Karen Schindler wird von HD055822 unterstützt.
Materialien
Tabelle der spezifischen Reagenzien:
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Milrinone | Sigma-Aldrich | M4659 | Resuspendieren in DMSO bei 2,5 mm |
| Mineralöl | Sigma-Aldrich | M5310 | Nur Embryo-geprüft, sterilfiltriert verwenden |
| CREST Eigenserum | Immunovision | HCT-0100 | |
| Sytox Grün | Invitrogen | 57020 | |
| Anti-human Alexa 594 | Invitrogen | A-11014 | |
| Vectashield | Vector Laboratories | H-100 | |
| Paraformaldehyd | Polysciences | 577773 | |
| Albumin aus Rinderserum | Sigma-Aldrich | A3294 | |
| PMSG | Calbiochem | 367222 | |
| Monastrol | Sigma-Aldrich | M8515 | Resuspendieren in DMSO bei 100mm |
| Tween-20 | Sigma-Aldrich | 274348 | |
| TritonX-100 | Sigma-Aldrich | X-100 |
Tabelle der spezifischen Ausstattung:
| Name der Ausrüstung | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Mundstück | Biodiseno | MP-001-Y | |
| Uhrglasnà | Electron Microscopy Sciences | 70543-30 | |
| Spritze | BD | 309623 | 1ml, 27G 1 / 2 |
| 60 mm Petrischale | Falke | 351007 | |
| Glas Pasteur Pipetten | Fisher Scientific | 13-678-200 | |
| Side wärmer | Fisher Scientific | Jede Standard-Modell | |
| Dissektionsmikroskop | Jede Standard-Modell | ||
| Chamber Slide | Nunc | 177372 | |
| Kapillarrohr | Drummond | 1-000-0500 | microcaps |
| Pipette Puller | Flaming-Brown Mikropipette puller | Modell P-97 | |
| Inversen Mikroskop | Nikon | Jede Standard-Modell | |
| Mikromanipulatoren | Eppendorf | Jede Standard-Modell | |
| Picoinjector | Harvard Apparatus | Modell PLI-100 | Jede Standard-Modell |
| CO 2-Panzer | Für Inkubator | ||
| N2-Tank | Für Tisch und Injektor | ||
| Anti-Vibrations-Tabelle | Technische Herstellung | Jede Standard-Modell | |
| Inkubator | Jede Standard-Modell | ||
| Halten Pipetten | Eppendorf | 930001015 | Vacutip |
| Konfokalen Mikroskop | Leica | Jede Standard-Modell | |
| Dissection-Tools | Feine Science-Tools | Jede Standard-Modell | |
| Feuchtekammer | Wir verwenden tupperware | ||
| Deckel von 96-Well-Platte | Nunc | 263339 | |
| Objektträger | Fisher Scientific | 12-544-3 | |
| Deckgläser | Thomas wissenschaftlichen | 6663-F10 | Dicke wird für bestimmte Mikroskope variieren |
| Zentrum und Orgel Kulturschale | Fisher Scientific | 353037 | 60 X 15mm |
Referenzen
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten