Method Article
Zeitraffer-Mikroskopie der frühen Embryogenese in Caenorhabditis elegans
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt eine Technik zur Visualisierung der frühen Ereignisse der Embryogenese in den Nematoden Caenorhabditis elegans.
Zusammenfassung
Caenorhabditis elegans wurde oft als Modellsystem in Studien der frühen Entwicklungsprozessen eingesetzt. Die Transparenz der Embryonen, die genetischen Ressourcen und der relativen Leichtigkeit der Umwandlung sind Qualitäten, die C machen elegans ein hervorragendes Modell für die frühe Embryonalentwicklung. Laser-basierte konfokale Mikroskopie und fluoreszenzmarkierten tags Forschern erlauben, spezifische zelluläre Strukturen und Proteine in den sich entwickelnden Embryo zu folgen. Zum Beispiel kann man folgen bestimmten Organellen, wie Lysosomen oder Mitochondrien, mit fluoreszenzmarkierten Farbstoffen. Diese Farbstoffe können zu den frühen Embryo durch Mikroinjektion werden in die Erwachsenenwelt Gonade geliefert. Auch die Lokalisierung von spezifischen Proteinen, gefolgt unter Verwendung von fluoreszierenden Protein-Tags werden. Beispiele sind hier vorgestellte Nachweis der Verwendung eines fluoreszierenden Farbstoff lysosomalen sowie fluoreszierend markierten Histon-und Ubiquitin-Proteinen. Die markierten Histon wird verwendet, um die DNA sichtbar zu machen und damit identifizieren die Phase des Zellzyklus. GFP-markierten Ubiquitin zeigt die Dynamik der ubiquitinierte Vesikel im frühen Embryo. Beobachtungen von markierten Lysosomen und GFP:: Ubiquitin kann verwendet werden, um festzustellen, ob es Kolokalisation zwischen ubiquitinierte Vesikel und Lysosomen werden. Eine Technik für die Mikroinjektion des lysosomalen Farbstoff wird vorgestellt. Techniken zur Erzeugung transgenenic Stämme werden an anderer Stelle (1, 2) vorgestellt. Für die Bildgebung sind Embryonen von erwachsenen Hermaphroditen Nematoden geschnitten und montiert auf 2% Agarose-Pads, gefolgt von Zeitraffer-Mikroskopie auf einem Standard-Laser-Scanning-konfokalen Mikroskop oder eine sich drehende Scheibe konfokalen Mikroskop. Diese Methode sorgt für die hohe Auflösung Visualisierung der frühen Embryogenese.
Protokoll
1. Nematode Kulturen
- Besorgen Sie sich die entsprechende C. elegans Stamm aus der Caenorhabditis Genetics Stock Center (CGC) oder von einem Kollegen.
- Wachsen Nematoden auf NGM-Agar-Platten mit einem OP50 Bakterienrasen (3) ausgesät. Für die Analyse der GFP-Stämme Wachstum bei 25 ° C empfohlen.
- Der Tag vor Ihrer Mikroskopie Experiment, Pick mindestens 40 L4-Larven auf ausgesät Platten und legen die Platten bei 25 ° C über Nacht. Diese Würmer werden junge Erwachsene für das Experiment werden.
2. Injektionen
Wenn es wünschenswert, Strukturen wie Lysosomen oder Mitochondrien Ansicht ist, können Erwachsene mit Fluoreszenzfarbstoff injiziert werden, bevor Visualisierung.
- Bereiten Sie getrocknete Agarose Injektion Pads. (Dies kann man viele Tage vorher getan werden)
- Bereiten geschmolzenen 2% Agarose in Wasser. Mit einer Pasteurpipette legen 2 Tropfen auf einen 22X54 mm Deckglas. Stellen Sie ein weiteres Deckglas kreuzweise auf der Oberseite des Drop. Um die richtige Dicke zu erreichen, auf der obersten Deckglas drücken, bis der Durchmesser des Pads ist ca. 1,5 cm. Lassen Sie sitzen für 5-10 Minuten.
- Entfernen Sie die obere Deckglas. Entwässern der Agarose-Pad, indem Sie es in einem 80 ° C im Ofen für 1 Stunde oder lassen auf dem Labortisch über Nacht sitzen.
- Bereiten Mitotracker oder LysoTracker Lösung.
- Verdünnen fluoreszierendes Mittel in Egg Buffer. Wir verwenden in der Regel eine 1:10 Verdünnung der Mitotracker oder LysoTracker.
- Die Injektionsnadel wird von einem 1,2 OD Glaskapillare gemacht. Ziehen Sie die Injektionsnadel mit einer Nadel Abzieher.
- Verwenden Sie einen zog Pastuer Pipette wieder füllen die Nadel mit dem verdünnten Farbstoff.
- Legen Sie die Nadel im Licht-frei, feuchten Kammer bis zur Verwendung.
- Pre-Injection: Einrichten des Mikroskops und Nadel.
- Berg Injektionsnadel auf Injektionsgeräts. Unser Gerät ist ein Narishige Direktantrieb Mikromanipulator auf die Bühne eines Nikon TE200 inversen Mikroskop mit DIC Imaging-Fähigkeit ausgestattet, montiert.
- Schließen Sie die Nadel auf einer 1,2 mm ID Schlauch, der an den Druckregler angeschlossen ist. Entweder Druckluft oder Stickstoff kann als externe Druckquelle verwendet werden. Stellen Sie den Regler auf 20-25 psi.
- Geben Sie 2 Tropfen schweres Mineralöl (Parafin-Öl) auf die Injektion Pad.
- Ort der Injektion Pad auf das Mikroskop und senken Sie die Nadel in das Öl. Prüfen Sie, ob Flüssigkeit fließt frei machen von der Nadel, wenn Druck ausgeübt wird. Bewerben Einspritzdruck und beobachten, ob Flüssigkeit fließt der Nadel. Wenn nicht, müssen Sie vorsichtig brechen das Ende der Nadel. Die Nadel kann durch vorsichtiges Fahren die Spitze in ein kleines bisschen gebrochen Deckglas auf die Injektion Pad gelegt gebrochen werden. Nachdem die Nadel fließt, an den nächsten Schritt.
- Injection.
- Etwa 1 Stunde vor dem Betrachten Embryonen, Übertragung jungen erwachsenen Würmer in den Öltropfen auf der Injektion Pad. Führen Sie diesen Transfer mit dem Binokular. Verwenden Sie einen Platindraht Wurm holen mit einer Spitze für die Übertragung von Würmern.
- Vereinbaren von 3 bis 10 Würmer, so dass sie direkt liegend auf dem Pad. Für die Injektion ist es am einfachsten, wenn die Würmer sind parallel zueinander ausgekleidet und ein wenig weniger als ein Wurm Länge auseinander. Sobald die Würmer auf der Injektion Pad, ist es wichtig, schnell zu arbeiten und füllen Sie das Injektionsverfahren, bevor die Würmer vor Austrocknung sterben.
- Legen Sie die Deckgläser mit Würmern auf dem Mikroskoptisch der Injektion Mikroskop. Schwerpunkt in den mittleren Teil (Rhachis) des distalen Gonaden Röhre. Dann nutzen Sie die Mikromanipulator an die Spitze der Nadel in der gleichen Bildebene zu bewegen. Bewegen Sie die Bühne horizontal, so dass der Wurm durch die Nadel beschädigt ist. Sobald die Spitze der Nadel ist im Inneren der Spindel, Druck auszuüben und damit die Gonade mit dem Farbstoff-Mischung füllen. Inject sowohl Gonade Arme aller Würmer auf der Injektion Pad.
- Nach der Injektion einen zog Pasteur-Pipette auf etwa 0,5 ml Egg Buffer, um die Würmer zu liefern. Dies wird ihnen vor dem Tod der Austrocknung zu halten und es ihnen ermöglichen, von der Injektion zu erholen.
- Lassen Sie die Würmer für 1-2 Stunden bei Raumtemperatur in ein Licht-frei, Feuchtekammer erholen.
3. Agarose-Pad für die Anzeige von Embryonen
- Bereiten geschmolzenen 2% Agarose in Egg Buffer.
- Mit einer Pasteur-Pipette, legte 3 Tropfen geschmolzenen Agarose auf einen sauberen Objektträger.
- Legen Sie gleiten zwischen zwei anderen Folien, die eine Schicht Kennzeichnung Klebeband auf sie haben. Diese dienen als Abstandhalter, die sicherstellen, dass Ihre Agarose-Pad die richtige Dicke wird.
- Legen Sie einen zweiten sauberen Objektträger senkrecht nach unten auf die Agarose Tropfen. Drücken Sie nach unten, bis Oberschlitten ruht auf dem Band von Führungsschlitten.
- Kurz bevor Sie bereit sind, Embryonen für die Beobachtung montiert sind, entfernen Sie die obere Folie.
4. Montage Embryonen für die Anzeige
- Wenn Würmer nicht gespritzt haben, folgen die nächsten beiden Schritte. Andernfalls überspringen.
- Wählen Sie jungen erwachsenen Würmer von der Platte, die am Tag zuvor vorbereitet wurde. Sie sollten in der Lage sein Embryonen innerhalb der jungen Erwachsenen zu sehen.
- Wählen 5-20 Würmer auf eine ungesetzte NGM Platte. Lassen Sie die Würmer kriechen auf der ungesetzte Platte für ein paar Minuten, so dass die Würmer die meisten der Bakterien, die ihnen stecken wird verlieren.
- Erhalten junge Embryonen aus adulten Würmern
- Legen Sie ein 5-20 ul Tropfen Egg Buffer in der Mitte eines 18 mm 2 Glas Deckglas (a Deckglas Dicke von 1,5 vorzuziehen ist).
- Bewegen Sie Würmer aus der ungesetzte Platte oder Injektion Pad in die Tropfen Egg Buffer.
- Aufschneiden Würmer mit einer 26 Gauge Kanüle. Schneiden Sie den Wurm in der Nähe der Vulva. Sie sollten sehen, Embryonen austreten des Wurms.
- Berg auf Objektträger
- Kehren Sie die Objektträger, die mit der Agarose-Pad vorbereitet war und senken Sie es auf das Deckglas mit Embryonen.
- Wenn erweiterte Zeitraffer erforderlich ist, verwenden Vaseline auf die Ränder der Deckgläser Dichtung Austrocknung zu verhindern.
5. Mikroskopie
- Das Finden der geeigneten Embryonen.
- Legen Sie gleiten auf Mikroskoptisch. Scan mit 10X-Objektiv von Embryonen zu finden.
- Um Embryonen im Frühstadium, Suche nach Embryonen, die in den Prozess der Vollendung mütterlichen Meiose sind. Meiotische Embryonen aus späteren Embryonen unterschieden werden, weil sie nicht eine Verkürzung erfahren haben. (Nach Embryonen Meiose abgeschlossen haben, können Sie eine deutliche Lücke zwischen der Zellmembran und die Eierschale am vorderen Ende.)
- Sobald Sie festgestellt haben einen entsprechend inszeniert Embryo, Umzug in ein höherer Vergrößerung Objektiv für die Aufnahme der Embryogenese.
- Imaging
- In diesem Beispiel werden wir vorstellen, dass die Embryonen mCherry auszudrücken: H2B und GFP:: Ub markierten Proteine. Wir sind mit dem Zeiss LSM700 konventionellen Laser-Scanning-Mikroskop.
- Bilder werden gesammelt, indem die 63X 1.4NA Linse. Die 488 und 555 Laser sind mit minimaler Laserleistung und maximale Verstärkung eingesetzt. AZ-Stack ist alle 10-15 Sekunden gesammelt. Je nach Ausmaß der Bleichen, sind zu 30-60 Zeitpunkten gesammelt. Z-Stapel Bilder werden in einer maximalen Projektion auf die Grafik für die endgültige Zeitraffer-Video zusammengebrochen.
6. Repräsentative Ergebnisse:
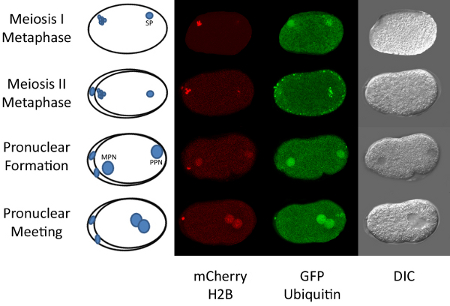
Abbildung 1. Düngung zu First Mitose in C. elegans.
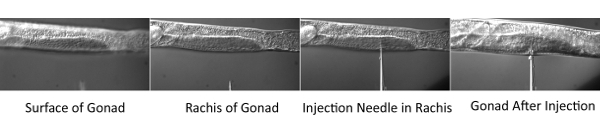
Abbildung 2. Mikroinjektion Verfahren.
Zusätzliche Video 1 Zeitraffer-Video der GFP:.. Ubiquitin sowie LysoTracker Blue in einer meiotischen Embryo Klicken Sie hier, um das Video anzusehen.
Diskussion
Nach der Fusion mit dem Sperma, erfährt der Zygote eine Reihe von dynamischen Ereignissen. Diese Ereignisse verwandeln die Eizelle von einer relativ statischen Zelle in der sich rasch entwickelnden Embryo. In vielen Organismen, sind zytoplasmatische Umlagerungen von entscheidender Bedeutung für Gründung embryonale Polarität und für Ei-Aktivierung. Die C. elegans Embryo bietet eine ausgezeichnete Gelegenheit zur Beobachtung dieser frühen Ereignisse des Ei-Aktivierung und Embryogenese. Der Embryo ist transparent und frühen Entwicklungsstadium Ereignissen relativ rasch nach der Befruchtung. C. elegans-Forscher haben viele nützliche transgene Stämme, fluoreszierend ausdrückliche markierten Proteine in der frühen Entwicklung beteiligt generiert. Mit diesen Stämmen zusammen mit RNAi oder Mutanten bietet ein leistungsstarkes System zum Präparieren der molekularen Signalwege, die Entwicklung eines vielzelligen Organismus (5, 6, 7, 8) zugrunde liegen. Dieses Video Artikel stellt einen praktischen Ansatz für die Verwendung dieser Werkzeuge und Techniken, um Ereignisse in der frühen Embryogenese in C. Rekord elegans.
Die reifen C. elegans Eizelle ist in Prophase der Meiose I festgenommen und befindet sich in der Samenblase der erwachsenen Hermaphroditen befruchtet. Nach der Befruchtung, geht die Eizelle durch den Rest der Meiose I und II. Diese Stufen können beobachtet mit fluoreszenzmarkierten Histon H2B (5) werden. Während Abschluss der mütterlichen Meiose bleibt die Spermien-DNA kondensiert (siehe Abbildung 1). Nach Abschluss der Meiose wird der mütterlichen und väterlichen DNA dekondensierten und die beiden Vorkerne bilden. Der mütterliche Vorkern wandert in Richtung der väterlichen Vorkern und sie kommen zusammen in der Nähe der Mitte des Embryos. Mitose schnell erfolgt nach pronukleären Treffen. Alle diese Ereignisse in weniger als einer Stunde. So können Zeitraffer-Mikroskopie dieser Abfolge von Ereignissen ohne weiteres durchgeführt werden. Die Durchführung dieser Technik erfordert bestimmte Anlage in Nematoden Kultivierung sowie grundlegende Kenntnisse in der Mikroskopie Neben einem konfokalen Mikroskop zugreifen.
Die hier vorgestellten Beispiel nutzt eine transgene C. elegans-Stamm, zwei fluoreszierende Proteine, GFP ausdrückt: Ubiquitin und mCherry: H2B. Ein konfokalen Laser-Scanning-Mikroskop wird verwendet, um die dynamische Lokalisierung der beiden Proteine zu beobachten. Darüber hinaus zeigen wir, dass die Injektion von fluoreszenzmarkierten LysoTracker verwendet werden, um das Schicksal der Lysosomen in den Embryo nach der Befruchtung zu folgen. Injection eines markierten Tracker kann auch zur Visualisierung von Mitochondrien oder lokalen Kalziumkonzentration (9) durchgeführt werden. Theoretisch könnte die Injektion Protokoll verwendet, um jede Art von fluoreszenzmarkierten Moleküls in den Embryo sehen zu können. Dies könnte beschriftet kleine Moleküle, Proteine, Lipide, etc. In einigen Fällen sind, kann es nicht notwendig sein, um tatsächlich zu injizieren gekennzeichnet Tracker wie die Würmer leicht Aufnahme einige Farbstoffe wie MitoTracker (10). Allerdings haben wir versucht, sowohl Einweichen und Injektion von LysoTracker und gefunden haben viel bessere Ergebnisse mit Einspritzung für die Visualisierung in Embryonen.
Technische Überlegungen:
Die technischen Herausforderungen bei diesem Verfahren besprochen werden, die Mikroinjektion Technik sowie die Schwierigkeit, in der Bildgebung sehr frühen Embryonen. Bezüglich microinjections, ist die Dicke der Agarose Injektion Pad für den erfolgreichen Injektionen. Wenn das Pad zu dick ist, wird die Würmer auszutrocknen und sterben schnell. Wenn das Pad zu dünn ist, wird die Würmer nicht mit dem Pad-Stick während der Injektion Prozess.
Die frühen Embryonen können empfindlich gegenüber Umwelteinflüssen wie Temperatur und Pufferbedingungen. Wildtyp-Embryonen zu initiieren Dekondensation der Spermien-DNA und pronukleären Migration innerhalb einer Minute oder so der Vollendung der Meiose II (4). Innerhalb von 20 Minuten sollte der erste Zytokinese beginnen. Wenn Embryonen zu sehr hohen Intensität des Laserstrahls ausgesetzt sind bzw. überhitzt oder zermahlen bei der Montage, kann dieser Vorgang gestört werden. Solche Embryonen werden Verhaftung Entwicklung. Wenn dies geschieht, sollte das Experiment mit verminderter Laserleistung oder eine dickere Agarose Pad wiederholt werden.
C. elegans Embryonen nicht sezernieren ihre Eierschale bis kurz nach der Befruchtung. Während der kurzen Zeit zwischen der Befruchtung und die Sekretion der Eierschale sind Embryonen, die nicht außerhalb der Mutter (11) lebensfähig. Einige Labors haben diese Herausforderung durch bildgebende Embryonen in utero (5, 12) vermieden werden. In utero Imaging bietet gewisse Vorteile, wie zB die Fähigkeit, Ereignisse, die während oder kurz nach der Befruchtung auftreten zu erfassen. Allerdings erfordert diese Technik die Verwendung einer Mikroskopie-System, das für tiefe Gewebe-Imaging ermöglicht. Systeme wie Zwei-Photonen-oder Multi-Photonen sind speziell für diese (13, 14) geeignet. Bei Verwendung eines herkömmlichen Laser-Scanning-oder Spinning-Disk-konfokalen Mikroskop, die besten Bilder werden aus Embryonen gewonnen, die have wurde von den erwachsenen Wurm geschnitten wie hier beschrieben.
Imaging System Überlegungen:
Die Art der konfokalen Imaging-System verwendet wird, hängt die Bedürfnisse der Nutzer. Im Allgemeinen sind die Laser-Scanning-Systeme zu empfehlen, wenn man will, um Bilder mit der höchsten Auflösung möglich zu erwerben. Auf der anderen Seite sind sich drehende Scheibe Systeme besser für die Bildgebung hochdynamische Prozesse geeignet, da der Bildaufnahme ist relativ schnell und Bleichen / Phototoxizität wird reduziert.
Die spezifischen bildgebenden Parameter werden in Abhängigkeit von den experimentellen Aufbau und der konfokalen Imaging-System eingesetzt werden. In mehrdimensionale Bildgebung, muss man die Anzahl der Kanäle, Fokusebenen und Zeit-Punkte gesammelt zu betrachten. Aufgrund der Begrenzung der Auswirkungen von Bleichen und Phototoxizität, kann eine endliche Anzahl von Bildern in einem bestimmten Experiment erworben werden. So, wenn Sie die Anzahl der Kanäle, die erworben werden erhöht, werden Sie wahrscheinlich benötigen, um die Anzahl der Brennebenen und / oder Zeitpunkte und umgekehrt zu reduzieren. Die Gesamtzahl der Bilder, die erworben werden können, werden durch die Intensität des Fluorophors als auch die Empfindlichkeit des konfokalen Mikroskops verwendet abgebildet beeinflusst werden. Intensivere Fluorophore und empfindlicher Instrumente erfordern kürzere Belichtungszeiten und damit weniger produzieren Bleichen und Phototoxizität.
Eine große Anzahl oder Imaging-Systeme stehen zur Verfügung. Wir geben Informationen über die Systeme, die in unseren eigenen Labors verwendet wurden. Für die Bildgebung Wurm Embryonen, die durch sich drehende Scheibe konfokale Mikroskopie, verwenden wir eine Nikon TE2000U inversen Mikroskop mit einer 60X/1.4 NA Plan Apo Ziel ausgestattet. Das Mikroskop ist ein Yokogawa CSU10 Spinning-Disk-Einheit, eine Hamamatsu C9100-13 EM-CCD-Kamera und ein Spectral Angewandte Forschung LMM5 Laser Merge-Modul mit vier Festkörperlaser mit einer Leistung von 405, 491, 561 und 655 nm verbunden. Mit diesem System können wir erfassen ein oder zwei Kanäle, 6-12 Fokusebenen und 25 bis 50 Zeitpunkten (bei 30 bis 60 Sekunden-Intervallen). Eine typische Belichtungszeit ist 100 bis 200 Millisekunden.
Für die Bildgebung Embryonen mit Laser-Scanning-konfokale Mikroskopie, verwenden wir ein Zeiss LSM700 mit 2 Kanälen und vier Festkörperlaser (405, 488, 555 und 635 nm) ausgestattet. Dieses System ist mit einem Zeiss Axio Observer inversen Mikroskop mit einer Plan-Apo 63X/1.4NA Ziel für Embryo Bildgebung verwendet angebracht. Das System nutzt die Zeiss ZEN-Software für die Bilderfassung, die auch begrenzte Bildverarbeitung und-analyse. Bei der Abbildung mit zwei Fluorochrome wir in der Regel zu sammeln 1-5 Fokusebenen (~ 0,5 mu m auseinander) und sammeln eine Z-Stack alle 15 Sekunden. Kollektionen werden fortgesetzt, bis signifikante photobleaching aufgetreten. Zur Erzeugung des endgültigen Zeitraffer-Video, Z-Stapel Bilder konsolidiert mit der maximalen Projektion-Werkzeug in der ZEN-Software. Videos werden von der Software als AVI-Dateien exportiert.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir möchten die Finanzierung von den National Institutes of Health (R15 GM065444-03 bis LB) und die Interne Research Program des National Institutes of Health (NIH) und dem National Institute of Diabetes and Digestive und Nierenkrankheiten (KO) zu bestätigen. Eine NSF award (DBI-0923402) finanzierte die Übernahme der LSM700 konfokalen Mikroskop. Wir möchten auch um allgemeine Unterstützung und hilfreiche Anmerkungen zum Manuskript von Dr. Andy Goldene anzuerkennen. Kredit geht an das gesamte C. elegans-Community für den Austausch von Ressourcen, Protokolle und Ideen.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Zusammensetzung |
|---|---|---|---|
| Egg Buffer | 5 mM Hepes pH 7,2, 110mm NaCl, 4mm KCl, 5 mM Mg-Acetat, 5 mM CaCl 2 | ||
| Mitotracker | Invitrogen | M-7512 | |
| LysoTracker | Invitrogen | L-7525 | |
| Injection Kapillarpipette | Harvard Apparatus, Kent, Großbritannien | GC120F-10 | |
| Needle Puller | Kopf | Modell 700C | |
| Mikroinjektor Apparatus | Tritech Forschung | Minj-1 Mikroinjektion Regulator |
Referenzen
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J Vis Exp. (18), e833-e833 (2008).
- Hochbaum, D., Ferguson, A. A., Fisher, A. L. Generation of Transgenic C. elegans by Biolistic Transformation. J Vis Exp. (42), e2090-e2090 (2010).
- Brenner, S. The Genetics of Caenrohabditis elegans. Genetics. 77, 71-94 (1974).
- Oegema, K., Hyman, A. A. Cell division WormBook. , (2006).
- McNally, K. L., McNally, F. J. Fertilization initiates the transition from anaphase I to metaphase II during female meiosis in C. elegans. Dev Biol. 282, 218-230 (2005).
- Sato, K., Sato, M., Audhya, A., Oegema, K., Schweinsberg, P., Grant, B. D. Dynamic regulation of caveolin-1 trafficking in the germ line and embryo of Caenorhabditis elegans. Mol Biol Cell. 17, 3085-3094 (2006).
- Stitzel, M. L., Pellettieri, J., Seydoux, G. The C. elegans DYRK Kinase MBK-2 Marks Oocyte Proteins for Degradation in Response to Meiotic Maturation. Curr Biol. 16, 56-62 (2006).
- Schetter, A., Askjaer, P., Piano, F., Mattaj, I., Kemphues, K. Nucleoporins NPP-1, NPP-3, NPP-4, NPP-11 and NPP-13 are required for proper spindle orientation in C. elegans. Dev. Biol. 289, 360-371 (2006).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1, (2001).
- Badrinath, A. S., White, J. S. Contrasting patterns of mitochondrial redistribution in the early lineages of Caenorhabditis elegans and Acrobeloides sp. PS1146. Dev. Biol. 258, 270-275 (2003).
- Johnston, W. L., Krizus, A., Dennis, J. W. The eggshell is required for meiotic fidelity, polar-body extrusion and polarization of the C. elegans embryo. BMC Biol. 4, 35-35 (2006).
- Parry, J. M., Velarde, N. V., Lefkovith, A. J., Zegarek, M. H., Hang, J. S., Ohm, J., Klancer, R., Maruyama, R., Druzhinina, M. K., Grant, B. D., Piano, F., Singson, A. EGG-4 and EGG-5 Link Events of the Oocyte-to-Embryo Transition with Meiotic Progression in C. elegans. Curr Biol. 19, 1752-1757 (2009).
- Centonze, V. E., White, J. G. Multiphoton excitation provides optical sections from deeper within scattering specimens than confocal imaging. Biophys J. 75, 2015-2024 (1998).
- Zinselmeyer, B. H., Dempster, J., Wokosin, D. L., Cannon, J. J., Pless, R., Parker, I., Miller, M. J. Two-photon microscopy and multidimensional analysis of cell dynamics. Methods Enzymol. 461, 349-378 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten