Method Article
Ex-vivo-Infektion von lebendem Gewebe mit onkolytischen Viren
In diesem Artikel
Zusammenfassung
Onkolytischen Viren sind für Krebstherapeutika vielversprechend. Die Fähigkeit, die infectability von Live-Gewebeproben von Patienten vor der Behandlung erhalten zu ermitteln ist ein einzigartiger Vorteil dieses therapeutischen Ansatzes. Dieses Protokoll beschreibt, wie das Gewebe für die Prozess- Ex vivo Infektion mit onkolytischen Virus und nachfolgende virale Quantifizierung.
Zusammenfassung
Onkolytischer Viren (OVS) sind neuartige Therapeutika, die selektiv in replizieren und zu töten Tumorzellen 1. Mehrere klinische Studien zur Beurteilung der Wirksamkeit einer Vielzahl von Plattformen, darunter onkolytischen HSV, Reovirus, und Vaccinia OVS als Behandlung für Krebs sind derzeit im Gange 2-5. Ein wesentliches Merkmal von onkolytischen Viren ist, dass sie genetisch verändert werden kann, um Reporter Transgene, die es möglich, die Infektion von Gewebe durch Mikroskopie oder Bio-Lumineszenz-Imaging 6,7 visualisieren macht auszudrücken. Dies bietet einen einzigartigen Vorteil, da es möglich ist, Geweben von Patienten ex vivo vor der Therapie zu infizieren, um die Wahrscheinlichkeit einer erfolgreichen onkolytischer Virotherapie 8 zu ermitteln. Zu diesem Zweck ist es wichtig, angemessen Gewebeprobe für Gewebe Heterogenität zu kompensieren und zu bewerten Gewebeviabilität, insbesondere vor der Infektion 9. Es ist auch wichtig, um die virale Replikation mit Reporter Transgene, wenn sie von den onkolytischen Plattform sowie durch direkte Titration von Geweben nach der Homogenisierung, um zwischen abortive und produktive Infektion zu unterscheiden zu folgen. Das Ziel dieses Protokolls ist es, diese Probleme anzugehen und hierin beschrieben 1. Die Probenahme und der Vorbereitung von Tumorgewebe für die Zellkultur 2. Die Beurteilung der Lebensfähigkeit des Gewebes mit dem metabolischen Farbstoff Alamar blue 3. Ex-vivo-Infektion von kultivierten Gewebe mit Vaccinia-Virus, die entweder GFP oder Luciferase 4. Nachweis der Transgenexpression durch Fluoreszenzmikroskopie oder mit einem In-vivo-Imaging System (IVIS) 5. Die Quantifizierung der Virus durch Plaque-Assay. Diese umfassende Methode hat mehrere Vorteile wie etwa eine einfachere Gewebe Verarbeitung, Entschädigung für die Gewebe-Heterogenität, die Kontrolle der Lebensfähigkeit des Gewebes und Diskriminierung zwischen abortive Infektion und Knochen fide Virusreplikation.
Protokoll
1. Tissue Verarbeitung
- Für beste Ergebnisse sollte dieses Protokoll unter Verwendung von frisch isolierten Gewebe in DMEM-Medium hinterlegt, welches 10% FBS, 1% Pennicilin / Streptomycin-Lösung und 0,1% Amphotericin B-Lösung unmittelbar nach der Operation vor der Verarbeitung sein. Ist dies nicht möglich ist, können Gewebe über Nacht in diesem Medium belassen werden bei 4 Grad vor der Verarbeitung.
- Vor der Verarbeitung der Probe, sterilisieren Metall Pinzette und Einweg-Klingen durch Hinterlegung sie in einem 70% igem Ethanol-Lösung für mindestens 5 Minuten. Ferner einen 24-Well-Platte mit 2 ml DMEM Medium mit 10% FBS, 1% Pennicilin / Streptomycin-Lösung und 0,1% Amphotericin B.
- Sammeln Sie die Gewebeprobe in einer laminaren Strömung Zellkultur Kapuze mit sterilisierten Pinzetten und Hinterlegung des Gewebes in einen leeren 15 cm Petrischale, halten den Deckel auf der Seite, sterile Seite nach oben.
- In der Zellkultur Kapuze, mit einem 2 mm Biopsiestanze auf verschiedenen Kernen aus einer Vielzahl von Regionen innerhalb des Gewebes, wie in Abbildung 1 zu erhalten. Kaution die Kerne in den Deckel der 15 cm Petrischale mit Hilfe der Pinzette, so dass genügend Platz zwischen den einzelnen Kern, so dass sie leicht entlang der horizontalen Achse geschnitten werden.
- Split jeder Kern in 4 sogar Quartale mit einem sterilisierten Rasierklinge wie in Abbildung 1.
- Mit einer Pipettenspitze, legte jeder Kern Quartal von einem bestimmten Kern in ein anderes auch von A1 bis A4, wie in Abbildung 1, die bereits mit 1,5 ml DMEM mit 10% FBS, 1% Pennicilin / Streptomycin-Lösung und 0,1% Amphotericin B-Lösung . Wiederholen Sie für jeden Kern. Dies sollte repräsentative Probenahme des Tumors, bei gleichzeitiger Minimierung der Verzerrungen in einem bestimmten und / Zustand. Zur besseren Darstellung, erhöhen Sie die Anzahl der Kerne.
2. Beurteilung der Lebensfähigkeit des Gewebes
- Nach Gewebe Verarbeitung, fügen Sie 25 &mgr; l Alamar blue gut # A1 und A2 # wie in Abbildung 1 dargestellt und Inkubation für 1 Stunde bei 37 Grad in einem befeuchteten Inkubator mit 5% CO 2.
- Nach der Inkubation mit Alamar-Blau, entfernen Sie 3 mal 100 ul von jedem A1 und A2 gut und Transfer zu 6 verschiedenen Vertiefungen einer 96-Well-Platte. Lesen Sie das Signal mit Hilfe eines Fluoreszenz-Reader (530 Anregung, 590 Emission) und halten die Daten für Ihre Unterlagen.
- Nach Alamar blue-Signal gelesen worden ist, übertragen Sie alle Stücke von Gewebe mit Hilfe einer Pipettenspitze aus gut A1 bis C1, die enthält DMEM, 10% FBS + PS + AmphoB. Achten Sie darauf, eine übermäßige Menge an Medien und A1 übertragen.
- Infect Brunnen A3 und A4 mit jeweils 10 6 PFU der GFP-exprimierenden und Luciferase-exprimierenden Vaccinia-Virus in 25 ul Medium verdünnt. Nun A2 kann mit einem Virus, das drückt jedem Transgen auch gar keine infiziert werden.
- 72 Stunden später, fügen Sie 25 ul Alamar blue in die Vertiefungen C1 und D1 und wiederholen Sie Schritt 2.2
3. Visualisierung von GFP Transgenexpression durch Fluoreszenz-Mikroskopie
- Entfernen Sie alle Zellkulturmedien für die Gewebestücke, um eine gute Fluoreszenz Bilder zu machen.
- Mit Hilfe eines Fluoreszenz-fähigen Dissektionsmikroskop, zunächst einen Phasenkontrast Bild an eine geeignete Auflösung
- Wechseln Sie zur Fluoreszenz-Modus und nehmen Sie ein Bild mit der entsprechenden Filter auf das Transgen von Interesse zu visualisieren, in diesem Fall GFP.
- Verwenden Sie ein Fluoreszenz-Filter für eine andere Wellenlänge als bisher eine mögliche aus, dass das Transgen von Interesse (wie RFP), um ein Bild der Hintergrundfluoreszenz zu
4. Visualisierung von Luciferaseexpression mit einem In-vivo-Bildgebung System (IVIS)
- Stellen Sie sicher, dass die IVIS initialisiert wird, bevor Sie beginnen.
- In Brunnen A4 und B4, mit 5 ul der Luciferin-Substrat 10 mg / ml, gut mischen und Inkubation für 5 Minuten bei Raumtemperatur.
- Stellen Sie die IVIS Exposition wurde auf 5 Sekunden und nehmen Sie ein Bild von Ihrem Brunnen. Wenn das Bild gesättigt ist, mit geringeren Belichtungszeit zu wiederholen. Wenn es kein Signal, erhöhen Sie die Belichtungszeit.
- Mit dem IVIS Imaging-Software, können Sie entfernen Hintergrund mit dem Signal von gut B4 und wählen Sie die Region von Interesse für die Lumineszenz-Signal zu quantifizieren.
5. Die Beurteilung Virustiter durch Plaque-Assay
- Vor der Quantifizierung virale Titer, muss Gewebe zunächst homogenisiert, um Viruspartikel freisetzen. Dies kann einige Monate später in den infizierten Gewebeproben durchgeführt werden bei -80
- Wiegen der Probe, die homogenisiert mit Hilfe eines analytischen Maßstab werden muss. In diesem Fall werden wir die Probe aus und A2 gesammelt.
- Legen Sie das Gewebe in einem 5 ml Polystyrol Rundboden-Falcon-Röhrchen und 1 ml PBS. Homogenisieren des Gewebes mit einem Gewebe-Homogenisator. Falls nötig, speichern das Homogenat bei -80 für die Bewertung der viralen Titer zu einem späteren Zeitpunkt.
- Um Titer Vaccinia-Virus, erste Platte 1 Million U2OS Zellen in einer 6-Well-Platte und inkubieren bei 37 Grad über Nacht, 5% CO 2 feuchtenified Inkubator, so dass sie ca. 95% erreicht Konfluenz des folgenden Tages.
- Verwenden Sie serumfreien Medien serielle Verdünnungen von Virus zu tun, achten Sie darauf, Spitzen zwischen jeder Verdünnung Schritt zu ändern. Typischerweise wir 1 in 10 Verdünnungen und verwenden 100 ul in 900 ul zu übertragen. Wie viele Verdünnungen gemacht werden, hängt von den zu erwartenden Virusausbeute.
- Nach Herstellung der Verdünnungen, entfernen Sie die Medien über die plattierten U20-Zellen fügen Sie dann 500 ul der verdünnten Virus Lager (für jede Verdünnung), um die U2OS Zellen zu infizieren. Inkubieren Sie die Zellen für 1 Stunde Minuten bei 37 Grad Celsius in einem 5% CO 2 befeuchteten Inkubator.
- Während dieser Zeit aufwärmen 2 X konzentriert DMEM mit 20% FBS und die 3% CMC-Lösung in einem 37 Grad Wasserbad.
- Nach dem 1 Stunde Inkubation, entfernen Sie die Medien über infizierte U2OS Zellen. 1:1 mischen Volumen von 3% CMC: 2X DMEM, 20% FBS zusammen und verwenden 2 ml dieser Mischung in jede Vertiefung der infizierten Zellen U2OS decken.
- Put-Zellen wieder in eine 37 Grad 5% CO 2 befeuchteten Inkubator für weitere 48 Stunden.
- Nach 48 Stunden, 2 ml Methanol-Essigsäure Fixativ auf dem CMC-Overlay in jede Vertiefung und inkubieren bei Raumtemperatur für 10 Minuten in einer Zellkultur Kapuze.
- Entsorgen Sie die feste Auflage und waschen Rest aus der Brunnen mit Leitungswasser.
- Stain der festen U2OS Zellen mit 2ml einer Coomassie-Blau-Lösung pro Well und Inkubation für 30 Minuten bei Raumtemperatur bei geringer Geschwindigkeit auf einem Schüttler.
- Entfernen Sie die Coomassie aus den Vertiefungen Fleck und waschen Sie die Teller mit Leitungswasser. Lassen Sie sich mit Deckel für etwa eine Stunde trocknen lassen.
- Die resultierende virale Plaques können leicht sichtbar in Abbildung 2c. Die Platten können auf unbestimmte Zeit in diesem Stadium gespeichert werden.
- Count-Plaques bei der Verdünnung, wo zwischen 10 und 100 Plaques sichtbar sind.
- Multiplizieren Sie die Anzahl der Plaques durch die Verdünnung verwendet gezählt und multiplizieren Sie die resultierende Zahl durch 2 zu einem Titer in PFU / ml zu erhalten. Zum Beispiel, wenn 25-Plaques in den Brunnen, wo ein Millionen-fachen Verdünnung verwendet wurde gezählt werden, ist der Titer der ersten unverdünnten Probe 25 von 1 Million von 2 oder 50 Millionen PFU / ml multipliziert. Weitere teilen diese Zahl durch das Gewicht zunächst für die Probe-Titer in PFU / g Bericht zu messen
6. Repräsentative Ergebnisse:
Um genau zu bestimmen, ob ein chirurgisch gewonnenen normal / Tumorgewebe Probe ist oder nicht infizierbaren mit dem Virus, muss man zuerst sicherstellen, dass die Gewebeprobe mindestens lebensfähig ist. Abb. 1A zeigt, dass die Rentabilität beurteilt werden kann mit einem metabolischen Farbstoff (Alamar blue) und dass sowohl Normal-und Tumorgewebe bleiben können metabolisch aktive über einen Zeitraum von mindestens 72 Stunden sein. Dies deutet darauf hin, dass Gewebe kultiviert ex vivo kann die virale Replikation zu unterstützen. Ein wesentlicher Vorteil von onkolytischen Viren ist, dass sie konstruiert werden können, um therapeutische oder Imaging Transgene exprimieren. Abb. 2D-E zeigt, dass GFP oder Luciferase aus dem Gewebe infiziert ex vivo nachgewiesen werden können, weiter unterstützen, dass diese Gewebe lebensfähig und auch infizierbaren sind. Obwohl erhöhte Transgenexpression ist in der Regel mit viralen Replikation assoziiert, bedeutet dies nicht zwangsläufig zu einer produktiven viralen Lebenszyklus, die Selbst-Verstärkung und Verbreitung, die vermutlich für therapeutische Aktivität wichtig ist, führt gleichzusetzen. Aus diesem Grund ist es notwendig, festzustellen, ob mehr Viren als das, was verwendet wurde, um zunächst zu infizieren das Gewebe hergestellt wird. Abb. 2B zeigt, dass auf virale Quantifizierung durch Plaque-Assay, mehr Viren nach 72 Stunden Infektion erhalten dann Gewebe unmittelbar nach der Infektion gesammelt. Insgesamt zeigen diese Daten, die chirurgisch exzidiert Tumorgewebe bleiben können in der Zellkultur lebensfähig für einen Zeitraum von mindestens 72 Stunden, während welcher Zeit die virale Replikation unterstützt werden kann.

Abbildung 1. Übersicht über die Gewebeentnahme / Schneiden Protokoll. Gewebeprobe wird durch das Entfernen mehrerer 2 mm-Kerne, die anschließend in vier Viertel, die zufällig in die Vertiefungen A1-A4 verteilt sind unterteilt verarbeitet. Die Farbcodes zeigen die Reagenzien in jedem gut genutzt. Die grau unterlegten Felder in den Brunnen stellen jedes Quartal seit 6 einzelne Kerne dargestellt. Das Gewebe in gut A1 ist es, einen neuen Brunnen (C1) mit den Medien nach dem ersten Alamar-Blau Lesen übertragen. Eine zweite Lesung ist am Ende der 72 Stunden Inkubation mit Viren durchgeführt. Wells A4 und B4 werden mit Luciferin nach dem 72 Stunden Inkubationszeit nach der Infektion ergänzt
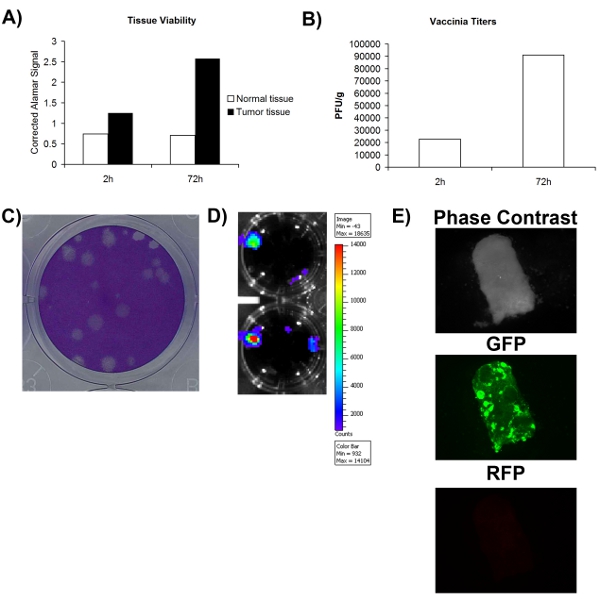
Abbildung 2. Die Lebensfähigkeit und infectability der Patienten Gewebeproben. A) Tissue Lebensfähigkeit von Alamar-Blau-Signal bei 2 Stunden und 72 Stunden nach der Sammlung gemessen. Y-Achse repräsentiert die leere korrigiert Alamar-Blau-Signal. B) Titer von Vaccinia-Virusgesammelt pro Gramm Gewebe-Proben 2 und 72 Stunden nach der Infektion. C) Beispiel von Vaccinia-Virus-Plaques auf U2OS Zellen nach Coomassie-Färbung. D) Lumineszenz-Signal von Patienten VV-Luciferase-infiziertem Gewebe erhalten aufgenommen mit IVIS. E) Fluoreszenzmikroskopie Bilder der Patient Gewebeprobe mit VV-GFP infiziert.
Diskussion
Einer der wichtigsten Schritte in diesem Protokoll ist die Beschaffung frischen Gewebeprobe. Wenn die Probe in der Zellkultur nach einer langen Wartezeit am OP-Saal in einem ungeeigneten Medien (zB PBS) gestellt, kann dieser Kompromiss Gewebeviabilität und verhindern infectability. Zu beachten ist, normales Gewebe naturgemäß anfälliger für diese Effekte als Tumorgewebe. Ein weiterer kritischer Punkt ist, wie viele Kerne werden verwendet, um das Gewebe und die Konsistenz ihrer Größe Probe. Inkonsistenzen in der Größe wird die Variabilität in Patientenproben führen, da Faktoren wie Hypoxie und infectectable Oberfläche schwanken abhängig von der Größe der Kerne und Kern-Viertel. Während dies teilweise durch Verwendung von Gewebe Aufschnittmaschinen gelöst werden kann, ist ein Vorteil der hier vorgestellten Verfahren, dass es relativ einfach ist, weniger anfällig für Verschmutzung und breit anwendbar auf eine Vielzahl von Gewebearten, darunter weich oder zähflüssig Geweben, die nicht leicht zugänglich sind das Gewebe schneiden. Bemerkenswert ist, kann die Anzahl der Kerne erhöht werden, um bessere Gewebe-Darstellung zu erhalten. Auch die Kerne in mehrere Teile (zB 5-8) geschnitten werden, um andere potenzielle Assays unterzubringen parallel wie DNA, RNA oder Protein-Extraktion durchgeführt werden. Allerdings wird die Anzahl der Stücke, in denen die Kerne, um reproduzierbare Größen geschnitten werden kann, auf die tatsächliche Größe der Kerne, die durch die Verwendung unterschiedlicher Größe Entkernern geändert werden können, hängen. Optional ist ein Weg, um Hilfe zu erhalten reproduzierbar große Gewebestücke auch die Länge der Kerne mit einem Lineal vor einer weiteren Unterteilung in kleinere Stücke. Das Protokoll kann natürlich geändert werden, um andere Viren beherbergen, und wir haben festgestellt, dass Gewebe können lebensfähig sein und unterstützt die Replikation für bis zu 6 Tage. Das Protokoll kann weiter auf Messungen von anderen viral-Ausdruck Transgene einschließlich cytrokines erweitert werden. Nach der Infektion kann Gewebe auch in Paraffin für weitere Schnitte und Färben von immunhistochemischen Methoden, die zur weiteren Verfeinerung des Gewebes Histologie ermöglicht und wie sie sich auf virale Infektion 10-12 eingebettet werden.
Offenlegungen
Danksagungen
Wir möchten Dr. Hesham Abdelbary für die Bereitstellung von menschlichen chirurgischen Proben für die Daten in Abb. 2 dargestellt danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| Hohe Glukose DMEM | Hyclone | SH30243.01 | |
| Fetal Bovine Serum | NorthBio Inc. | NBSF-701 | |
| Amphotericin B-Lösung | Sigma Aldrich | A2942 | Verwenden Sie bei 0,1% |
| Pennicilin-Streptomycin | Sigma Aldrich | P4333 | Verwenden Sie bei 1% |
| Alamar Blue | Invitrogen | DAL1025 | |
| D-Luciferin Kaliumsalz | Molecular Imaging Products | D-Luciferin Kaliumsalz 1g | Resuspendieren in PBS bei 10 mg / ml und Filter auf 0,22 um Filter |
| MEM Pulver | Gibco | # 41500018 | Machen Sie in der Hälfte der vorgeschlagenen Volumen von 2X MEM und Filter auf 0,22 um Filter vor der Verwendung der |
| Carboxymethylcellulose (CMC) | Sigma Aldrich | C9481 | Machen Sie eine 3% ige Lösung in VE-Wasser und Autoklaven. Beachten Sie, dass Pulver kann einige Zeit dauern resuspendieren |
| Coomassie Brilliant Blue R | Sigma Aldrich | B7920 | |
| 2 mm Biopsiestanze | Miltex | MX-33 bis 31 | |
| Double Edge Prep Blades | Personna Medical Care | 74-0002 | |
| Fluoreszenz-Mikroskop disection | Leica | Modell M205 FA | |
| In-vivo-Imaging-System (IVIS) | Caliper Life Sciences | IVIS ® 200 Serie | |
| Tissue Tearor | Biospec Produkte | Modell 985370-395 |
Referenzen
- Parato, K. A., Senger, D., Forsyth, P. A., Bell, J. C. Recent progress in the battle between oncolytic viruses and cancer. Nat Rev Cancer. 5, 965-976 (2005).
- Renouf, L. C., Thway, K., Sibtain, A., McNeish, I. A., Newbold, K. L., Goldsweig, H., Coffin, R., Nutting, C. M. Phase I/II study of oncolytic HSV GM-CSF in combination with radiotherapy and cisplatin in untreated stage III/IV squamous cell cancer of the head and neck. Clin Cancer Res. 16, 4005-4015 (2010).
- Lal, R., Harris, D., Postel-Vinay, S., de Bono, J. Reovirus: Rationale and clinical trial update. Curr Opin Mol Ther. 11, 532-539 (2009).
- Park, B. H., Hwang, T., Liu, T. C., Sze, D. Y., Kim, J. S., Kwon, H. C., Oh, S. Y., Han, S. Y., Yoon, J. H., Hong, S. H., Moon, A., Speth, K., Park, C., Ahn, Y. J., Daneshmand, M., Rhee, B. G., Pinedo, H. M., Bell, J. C., Kirn, D. H. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Breitbach, C. J., Reid, T., Burke, J., Bell, J. C., Kirn, D. H. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev. 21, 85-89 (2010).
- Boeuf, F. L. e. Synergistic interaction between oncolytic viruses augments tumor killing. Mol Ther. 18, 888-895 (2010).
- Silva, N. D. e., Atkins, H., Kirn, D. H., Bell, J. C., Breitbach, C. J. Double trouble for tumours: exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. Cytokine Growth Factor Rev. 21, 135-141 (2010).
- Diallo, J. S. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
- Cooke, S. L. Intra-tumour genetic heterogeneity and poor chemoradiotherapy response in cervical cancer. Br J Cancer. , (2010).
- Pennington, K., Chu, Q. D., Curiel, D. T., Li, B. D. L., Mathis, J. M. The Utility of a Tissue Slice Model System to Determine Breast Cancer Infectivity by Oncolytic Adenoviruses. J Surg Res. , 1-6 (2010).
- Hochberg, M. Tropism of herpes simplex virus type 1 to non-melanoma skin cancers. Br J Dermatol. , (2010).
- Kuip, H. v. a. n. d. e. r. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. BMC Cancer. 6, 86-86 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten