Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein In Vitro System zur Tumor Vegetationsruhe und die Umstellung auf Metastasen Study
In diesem Artikel
Zusammenfassung
Eine modifizierte 3-D in vitro-System vorgestellt, bei der Wachstumseigenschaften von mehreren Tumorzelllinien in rekonstituierte Basalmembran mit dem ruhenden oder proliferative Verhalten der Tumorzellen in einer metastatischen sekundären Standort korrelieren In vivo.
Zusammenfassung
Wiederauftreten von Brustkrebs folgt oft eine lange Latenzzeit, in denen es keine Anzeichen von Krebs und Metastasen können nicht klinisch manifest werden erst viele Jahre nach der Entfernung des Primärtumors und der adjuvanten Therapie. Eine wahrscheinliche Erklärung für dieses Phänomen ist, dass Tumorzellen Metastasen ausgesät, sind resistent gegen herkömmliche Therapien, und bleiben für längere Zeit 1-4 ruhend.
Die Existenz der ruhenden Krebszellen an sekundären Standorten wurde bisher als Ruhestrom Einzelzellen, dass weder vermehren noch Apoptose 5-7 beschrieben. Darüber hinaus hat dieser Einzelzellen wurde gezeigt, dass aus dem Primärtumor in einem frühen Stadium der Progression der Erkrankung 8-10 verbreiten und aufzuhalten, in dem Patienten Knochenmark, Blut und Lymphknoten 1,4,11 Wachstum verhaftet. Daher das Verständnis der Mechanismen, die Ruhe-oder den Wechsel zu einem proliferativen Zustand zu regulieren ist entscheidend für die Entdeckung neuer Targets und Interventionen, um ein Rezidiv zu verhindern. Allerdings hat der Entschlüsselung der Mechanismen, die die Umstellung von Tumor Dormanz zu Metastasen durch den Mangel an verfügbaren Modell-Systeme behindert.
in vivo und ex vivo Modellsystemen zu metastatischen Progression von Tumorzellen Studie wurden zuvor 1,12-14 beschrieben. Allerdings sind diese Modell-Systeme haben nicht in Echtzeit und in einem hohen Durchsatz Weise mechanistische Einblicke in das, was löst die Entstehung des einsamen ruhenden Tumorzellen als Metastasen wuchern zur Verfügung gestellt. Vor kurzem haben wir ein 3D-in vitro-System entwickelt, um die in vivo Wachstum Eigenschaften von Zellen, die entweder ruhend (D2.OR, MCF7, K7M2-AS.46) oder proliferative (D2A1, MDA-MB-231, K7M2) metastatischen Verhalten zeigen Modell in vivo. Wir haben gezeigt, dass Tumorzellen, Dormanz weisen in vivo an einem metastasierenden site Ruhe bleiben, wenn in einem 3-Dimension (3D) Basalmembran-Extrakt (BME) kultiviert, während Zellen hoch metastatischen in vivo leicht in 3D-Kultur vermehren, nachdem variable, aber relativ kurze Ruheperioden. Wichtig ist durch die Nutzung der 3D-in vitro-Modell-System haben wir gezeigt, zum ersten Mal, dass die ECM Zusammensetzung eine wichtige Rolle bei der Regulierung, ob ruhenden Tumorzellen führt zu einer proliferativen Zustand wechseln und haben bestätigt, diese in in-vivo-Studien 15-17 spielt. Daher bietet das Modell-System in diesem Bericht beschriebenen In-vitro-Methode zur Modellierung Tumor Dormanz und studieren den Übergang zu proliferative Wachstum durch die Mikroumgebung induziert.
Protokoll
1. Zellkultur Wartung der ruhenden und metastasierten Tumor-Zelllinien
- Wachsen ruhenden (D2OR / MCF7/K7M2-AS.46) und metastasierenden Tumorzellen (D2A1 / MDA-MB-231 / K7M2) in 10 cm Petrischalen mit Dulbecco modifiziertem Eagle-Medium (DMEM) hohen Glucose und 10% fötalem Rinderserum ( FBS) und Antibiotika. Sobald die Zellen 70-80% Konfluenz erreichen, um die folgenden Assays gehen.
2. Zellproliferationsassay ruhender (Ruhe) und metastasierten (wuchernde) Tumorzellen in einer 3D-BME-System kultiviert
Die Kultivierung ruhenden / metastatischen Zellen im 3D-System
- Thaw Cultrex growth factor-reduzierten Basalmembran-Extrakt (BME) in 4 ° C Kühlschrank eine Nacht vor der Durchführung der Tests. Beachten Sie die BME auf Eis sollte zu jeder Zeit behandelt werden.
- Am folgenden Tag, Ort, eine 96-Well-Platte auf einem Tablett mit Eis in einen laminaren Haube. Coat jede Vertiefung mit 50-100 &mgr; eiskaltem BME mit einem Spender mit einer Spritze. Achten Sie darauf, keine Blasen in den Vertiefungen gebildet werden. Platzieren Sie den 96-Well-Platte mit BME in einem befeuchteten Inkubator beschichtet mit 5% CO 2 bei 37 ° C für 30 Minuten.
- In der Zwischenzeit absaugen Medien aus dem ruhenden und oder metastasierende Tumorzellen (hergestellt in Abschnitt 1). Spülen Kultur-Platten mit 10 ml Phosphat-gepufferte Kochsalzlösung, pH 7,4 (PBS). Saugen Sie das PBS und fügen 2ml Trypsin bei 37 vorgewärmten ° C, um die Kultur-Platten. Die Inkubation in einer feuchten 5% CO 2 bei 37 ° C, für 5 min.
- Transfer-Zellen auf eine 15 ml konische Röhrchen mit 5 ml DMEM high glucose mit 10% FCS und Antibiotika ergänzt und zählen Sie die Zellen.
- Spin down die gesamte Zellzahl in einer Gewebekultur Zentrifuge mit einer Geschwindigkeit von 1500g kultiviert werden, bei Raumtemperatur für 5 min. In unseren Tests haben wir bereiten 2X10 3 Zellen / well für jede Zelllinie oder Zeitpunkt untersucht werden. Dies kann jedoch in Abhängigkeit von den verwendeten Zelllinien.
- Vorsichtig absaugen des Überstandes. Beachten Sie, in den meisten Fällen das Pellet nicht sichtbar ist. Daher lassen einige Medien hinter sich. Tippen Sie auf der Unterseite der 15ml konischen Rohr mit den Fingern, um sicherzustellen, dass eine Suspension von Einzelzellen gewonnen wird. Re-suspend das Pellet mit DMEM niedrige Glukose mit Antibiotika ergänzt mit 2% FCS + 2% BME (Assay Medien). 100 ul des Assays Medien sollten für jeden 2x10 3 Zellen aufgenommen werden. Man reibt die Zellen oft mit einer 5ml Pipette, um sicherzustellen, dass eine einzelne Zelle Suspension gehalten wird.
- Platte eine 100 &mgr; der Zelle Mischung pro Vertiefung auf der Oberseite des 96-Well-BME beschichtete Platte. Für Hintergrundinformationen Evaluierung (in Abschnitt 2.8) Platte zusätzlich 100 &mgr; pro Well nur den Assay Medien auf der Oberseite des 96-Well-BME beschichtete Platte. Inkubieren Sie die kultivierten 96 Well-Platten in einem befeuchteten 5% CO 2-Inkubator bei 37 ° C. Die Zellen sollten alle wieder zugeführt 4 Tage mit dem Test-Medien.
Proliferation Assay:
- Proliferationsassay der Zellen: add in die Vertiefungen an den gewünschten Zeitpunkten 20 ul der Zellzahl 96 wässrige Lösung Cell Proliferation Assay-Kit. Inkubieren in einer befeuchteten 5% CO 2-Inkubator bei 37 ° C für 2h. Mit einem ELISA-Plate Reader Aufzeichnung der Absorption bei 490nm. Für Hintergrundinformationen Evaluierung und Subtraktion, addieren 20 &mgr; l des Cell Titer 96 wässrige Lösung Cell Proliferation Assay-Kit, um Brunnen vor beschichtet mit BME und nur mit Assay-Medium überlagert. Mit einem ELISA-Plate Reader Aufzeichnung der Absorption bei 490 nm.
3. Immunfluoreszenzfärbung für die Zell-Signalmolekülen in ruhenden (Ruhe) Tumorzellen und / oder metastasierten (wuchernde) Tumorzellen
Die Kultivierung ruhenden / metastatischen Zellen im 3D-System für Immunfluoreszenz-Färbung
* Das folgende Protokoll ist eine Modifikation eines 3D-Kultur-Protokoll von Debnath J et al 18 veröffentlicht.
- Bereiten BME, wie in Abschnitt 2.1 beschrieben. Am nächsten Tag: Ein 8-Kammer-Objektträger aus Glas, das auf einem Tablett mit Eis in einen laminaren Haube. Coat jede Vertiefung mit 50ul eiskaltem BME mit einem 200 ul Pipetman. Stellen Sie sicher, BME gleichmäßig verteilt und keine Blasen in den Vertiefungen gebildet. Legen Sie die 8 Kammern Objektträger aus Glas mit BME in einer befeuchteten 5% CO 2 beschichtet bei 37 ° C für 20 min.
- Ernte in Vegetationsruhe befinden und oder metastatischen Zellen aus Abschnitt 1 und zur Vorbereitung der Kultur, wie in Abschnitt 2,3 bis 2,4 beschrieben. Sammeln Sie die Gesamtzahl der Zellen in einem 15 ml konischen Rohr kultiviert werden. Wir bereiten 5 x10 3 Zellen / well für jede Zelllinie und Zeitpunkt untersucht werden. Spin down die Zellen in einer Gewebekultur Zentrifuge mit einer Geschwindigkeit von 1500g, bei Raumtemperatur für 5 min. Saugen Sie den Überstand vorsichtig. Beachten Sie, dass das Pellet nicht sichtbar ist, daher lassen einige Medien hinter sich. Tippen Sie auf der Unterseite der 15ml konischen Rohr mit den Fingern, um sicherzustellen, dass eine einzige erhaltene Zellsuspension wird.Re-suspend das Pellet mit Assay-Medium. 400μl des Assay Medien sollten für jeden 5x10 3 Zellen aufgenommen werden. Man reibt die Zellen mehrfach mit 5 ml Pipette. Dieser Schritt ist sehr wichtig, um sicherzustellen, dass die einzelne Zelle Suspension gehalten wird.
- Platte 400μl der Zelle Mischung pro Vertiefung auf der Oberseite eines jeden der 8 Kammern mit BME beschichtet. Inkubieren Sie die kultivierten 8 Kammern Objektträger aus Glas-System in einem befeuchteten 5% CO 2-Inkubator bei 37 ° C. Die Zellen sollten alle wieder zugeführt 4 Tage mit dem Test-Medien.
Immunfluoreszenzfärbung:
- Bei der gewünschten Zeitpunkten, saugen die obere Schicht der Medien und fügen 200 ul der Fixateur mit 4% Paraformaldehyd (PFA), 5% Saccharose und 0,1% Triton X-100 und Inkubieren bei Raumtemperatur für 5 Minuten. Saugen Sie das Fixativ und fügen 200 ul von 4% PFA mit 5% Saccharose und Inkubieren bei Raumtemperatur für 25 Minuten.
- Saugen Sie das Fixativ, fügen Sie 400 ul der Phosphat-gepufferter Kochsalzlösung (PBS) in jede Vertiefung. Inkubieren für 10 Minuten bei Raumtemperatur. Saugen Sie das PBS und geben Sie 400 μ PBS mit 0,05% Tween 20 für 10 Minuten bei Raumtemperatur.
- Blockieren Sie die fixierten Zellen bei Raumtemperatur mit 200 ul von entweder 10% Esel Serum oder mit 3% BSA für 1 Std. (Blocking-Lösung verwendet werden empirisch sollte für jeden primären Antikörper bestimmt werden).
- Absaugen der Blockierungslösung und fügen 200 ul des primären Antikörpers (Verdünnung sollte empirisch für jede primäre Antikörper verwendet werden ermittelt werden). Verdünnen Sie den Primärantikörper in 10% Esel-Serum, wenn 10% Esel-Serum für die Sperrung verwendet wurde oder verdünnten Primärantikörper in 3% BSA, wenn 3% BSA blockiert Lösung verwendet wurde. Inkubieren mit dem primären Antikörper über Nacht bei 4 ° C.
- Absaugen des Antikörpers, waschen Sie die Platte mit 400μl PBS für 15 Minuten und zweimal wiederholen. Saugen Sie das PBS und fügen 200 ul der Esel-anti-jeweilige-IgG, konjugiert mit Rhodamin rot (Verdünnung sollten empirisch ermittelt werden), decken die 8 Chamber Slide mit Alufolie und inkubieren für 1 Stunde bei Raumtemperatur.
- Waschen Sie die Wells mit 400μl PBS (3x15 Minuten pro Waschgang). Absaugen PBS. Montiert mit Vectashield Eindeckmedium mit DAPI. Dry Folien für 40 Minuten bei Raumtemperatur im Dunkeln. Dias können für 1 Woche bei 4 ° C aufbewahrt werden Bewahren Sie die Folien in der Dunkelheit. Bild gleitet durch konfokale Mikroskopie.
4. Repräsentative Ergebnisse:
Ein Beispiel für eine Verbreitung Analyse der ruhenden D2.0R und metastatischen D2A1 Tumorzellen in der 3D-Kultur ist in Abbildung 1A dargestellt. D2.0R Zellen sind ruhende (Ruhe) durch den gesamten experimentellen 14 Tage Kultur Periode, während der hoch metastatischen D2A1 Zellen nur für vier Minuten vor sechs Tagen, nach denen sie beginnen sich zu vermehren ruhen. Während der ersten Ruhephase, bleiben viele Zellen einsam in der 3-D-Kultur (Abb. 1B; Tag 4), während andere nicht-proliferierende Zellen mehrzelligen Sphäroiden zu bilden. Der Übergang von D2A1 Zellen aus einem ruhenden zu proliferativen Zustand in 3-D-Kultur (Abb. 1B; Tag 12) wird mit dramatischen Veränderungen in der Zellmorphologie verbunden. Daher kann dieser Test verwendet werden, um welchen Faktor zu testen / s kann ruhenden D2.0R Zellen auslösen, von ihren inaktiven Zustand entstehen und welchen Faktor / s kann D2A1 Zellen, um den Übergang zu verhindern von ihren inaktiven Zustand. Abbildung 2 ist ein Beispiel für einen Agenten Verhindern D2A1 Zellen um den Übergang von ruhenden zu einem proliferativen Zustand. Wie in Abbildung 2 dargestellt ist, erhalten Behandlungen D2A1 Zellen mit einem spezifischen Inhibitor der Myosin-Leichtketten-Kinase (ML-7) D2A1 Zellen in einem inaktiven Zustand.
Zelluläre Signale in den ruhenden und proliferierenden Tumorzellen in das 3D-System kultiviert werden durch Immunfluoreszenzfärbung für die Zell-Signalmolekülen untersucht werden. Wie in Abbildung 3 dargestellt eine deutliche Steigerung in Myosin Light Chain-Phosphorylierung in D2A1 Zellen (rote Färbung) durch Reorganisation des f-Aktin-Filamente bilden Aktin Stress-Fasern (grüne Färbung) folgte tritt beim Übergang von der Ruhephase (1-4 Tage) Proliferation (Tag 7). Allerdings blockiert Myosin Light Chain Kinase-Aktivität in D2A1 Zellen durch shRNA oder bestimmte Arzneimittel (ML-7) behält D2A1 Zellen in einem Ruhezustand und führt zu einer Hemmung der Myosin-Leichte-Kette-Phosphorylierung und f-Aktin Stress Faser Organisation (Abbildung 4).
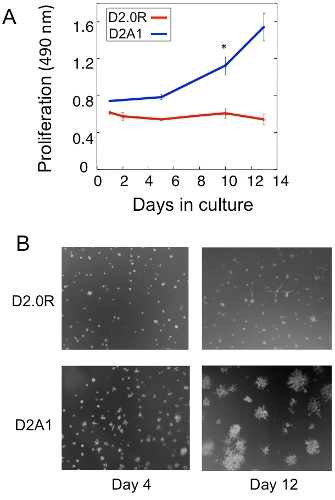
Abbildung 1. In vitro Modell zur einsamen Tumorzellen Dormanz und die Umstellung auf Metastasen zu untersuchen. A) Proliferation ruhender D2.0R und metastatischen D2A1 in 3-D Cultrex BME, n = 8 (Mittelwert ± SE). Repräsentative Ergebnisse der drei Experimente (* p ≤ 0,05). B) Lichtmikroskopische Bilder von D2.0R und D2A1 Zellen in 3-D Cultrex BME Vergrößerung x20 kultiviert.Abbildung von Barkan et AL 17 modifiziert.
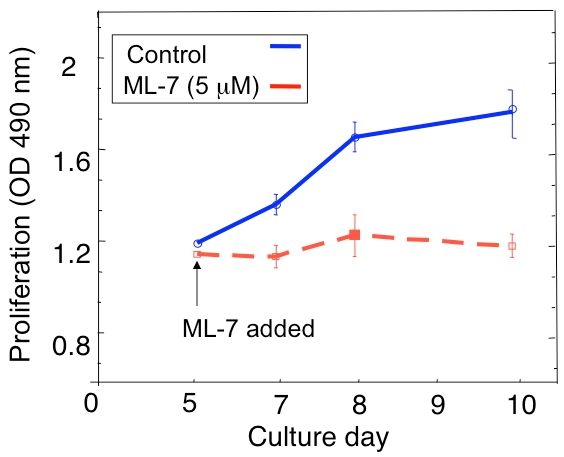
Abbildung 2. Verhindern Sie den Schalter von D2A1 Zellen aus dem Schlafzustand (Ruhe), um die Proliferation in der 3D-Kultur-System durch die Hemmung der Myosin Light Chain Kinase (MLCK). Zeitlicher Verlauf der D2A1 Zellproliferation in 3-D Cultrex BME, n kultivierten = 8 (Mittelwert ± SE). Die Zellen wurden unbehandelt (Kontrolle), oder behandelt mit einem spezifischen Inhibitor der MLCK (ML-7, 5 M) für 48 Stunden zu Beginn der Kultur Tag 5. Abbildung von Barkan et AL 17 modifiziert.
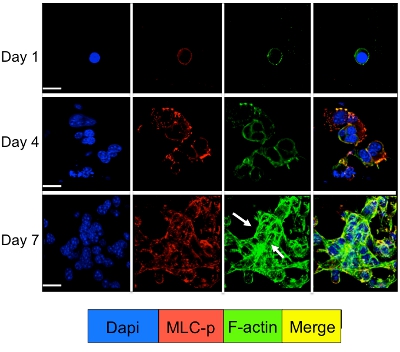
Abbildung 3. Myosin Light Chain-Phosphorylierung durch f-Aktinreorganisation beim Wechsel von D2A1 Zellen aus dem Schlafzustand zu proliferative Wachstum. D2A1 Zellen wurden in 3-D Cultrex BME am 8. Kammer Glasplättchen kultiviert. Die Zellen wurden fixiert und mit DAPI (blau) für die nukleare Lokalisation, Phalloidin (grün) für f-Aktin und mit einem Antikörper gegen die phosphorylierte Form von Myosin Light Chain (MLC-p) (rot), wie zu verschiedenen Zeitpunkten angegeben. Merge von f-Aktin und MLC-p-Färbung (gelb). Expression von MLC-p wurde während des Übergangs von D2A1 Zellen aus dem Schlafzustand (Tage1-4) auf proliferative Wachstum (Tag 7) von Aktin-Stress Faserbildung (Pfeile), gefolgt erhöht. Die konfokale Mikroskopie, Vergrößerung x63. Weiße Balken entspricht 20 Mikrometer. Abbildung von Barkan et AL 17 modifiziert.
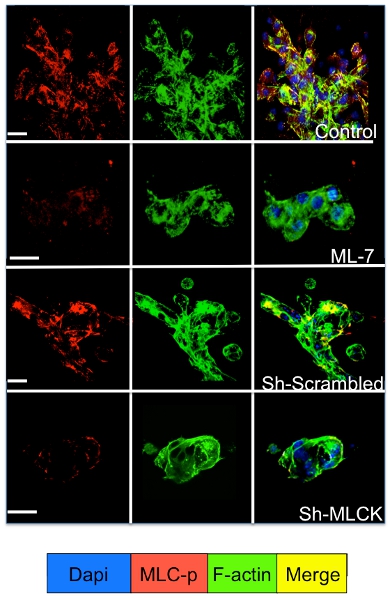
Abbildung 4. . Hemmung der Myosin Light Chain Kinase (MLCK) vermittelt f-Aktin Stress Faserbildung in D2A1 Zellen D2A1 Zellen wurden unbehandelt (Kontrolle), oder behandelt mit Inhibitor für MLCK (ML-7, 5 M), für 48 Stunden ab dem Tag der Kultur 5, oder mit Rühr-oder MLCK shRNA behandelt und gefärbt für die phosphorylierte Form von Myosin Light Chain (MLC-p) (rot), f-Aktin (grün) und Zellkerne (blau). Merge von f-Aktin und MLC-p-Färbung (gelb). Die konfokale Mikroskopie, Vergrößerung x63. Weiße Balken entspricht 20 Mikrometer.
Diskussion
Die zugrunde liegenden Mechanismen, die Tumorzellen verbreitet zu halten in einem Ruhezustand oder das Ergebnis in ihrem Übergang zu Metastasen noch weitgehend unbekannt. Dieses Phänomen war extrem schwierig, in menschlichen Patienten 4,12 und einigen präklinischen Modellen wurden entwickelt, um dieses Problem zu beheben studieren. Dennoch haben einige in-vivo-und ex-vivo-Modell für Tumor Dormanz charakterisiert worden (Übersicht in 1,12). Allerdings kann die in-vivo-Modellen...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde zum Teil durch die Interne Research Program des National Cancer Institute unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| DMEM high glucose | Invitrogen | 11965-118 | |
| DMEM niedrigen Blutzuckerwerten | Invitrogen | 11885-092 | |
| Fötales Rinderserum (FBS) | Invitrogen | 10091-148 | |
| Wachstumsfaktor-reduzierten 3-D Cultrex Basalmembran Extract | Trevigen Inc. | Protein-Konzentration zwischen 14-15mg/ml | |
| D2.0R und D2A1 Zelllinien | 5,19 | ||
| K7M2 und K7M2AS1.46 Zellen | 20 | ||
| MCF-7 und MDA-MB-231 Brustkrebszellen | ATCC | ||
| Ein 8 Kammer Objektträger aus Glas-System | (Lab-Tek, Thermo Scientific) | 177402 | |
| Zellzahl 96 wässrige Lösung Zellproliferation Assay-Kit | Promega | G3580 | |
| Vectashield Eindeckmedium mit DAPI | Vector Laboratories Inc. | H-1200 | |
| Normale Esel-Serum | Jackson ImmunoResearch | 017-000-121 | |
| Elisa Plate Reader | Bio-Tec | Rekord 490nm | |
| Konfokalen Mikroskop | Zeiss-LSM-510 | Vergrößerung x63 |
Referenzen
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten