Method Article
Vorbereitung von Adult Drosophila Augen für Thin Schnitte und mikroskopische Untersuchung
In diesem Artikel
Zusammenfassung
Ein Standard-Ansatz zur Erwachsenen vorbereiten Drosophila Augen für semi-dünne Schnitte und leichte mikroskopische Analyse wird hier vorgestellt. Das Protokoll kann bei grober morphologische Analyse von Fehlsichtigkeiten eingesetzt werden, oder mit den angegebenen Einstellungen können verwendet werden, um genetische Voraussetzungen von Genen in bestimmten Zelltypen des Auges (zB klonale Analyse von Photorezeptoren) oder für elektronenmikroskopische Analyse zu bestimmen.
Zusammenfassung
Drosophila ist seit langem als Modellsystem verwendet worden, um Entwicklung zu studieren, vor allem wegen der Leichtigkeit, mit der sie genetisch manipulierbaren. Im Laufe der Jahre haben eine Fülle von Mutanten und technischen Tricks wurden entwickelt, damit anspruchsvolle Fragen gestellt und beantwortet werden in einer angemessenen Höhe der Zeit. Fundamental Einblick in das Zusammenspiel von Bauteilen aller bekannten großen Signalwege hat in uns gewonnen und genetische Studien Drosophila. Die Fliege Auge hat sich außerordentlich gut für die Mutationsanalyse geeignet sein, da unter Laborbedingungen, fliegt ohne funktionelle Augen überleben können. Darüber hinaus ist die Oberfläche des Insekts Auge von rund 800 individuelle Einheit Augen (Facetten-oder Facettenaugen), dass eine regelmäßige, glatte Oberfläche bilden, wenn bei unter einem Binokular betrachtet komponiert. So ist es leicht zu sehen, ob eine Mutation könnte der Entwicklung des Auges oder das Wachstum von extern auf der Suche nach dem Verlust der glatten Oberfläche ('rough Auge "Phänotyp; Abb. 1). Beeinträchtigen oder insgesamt Auge Größe, bzw. (für Beispiele von Bildschirmen auf der Grundlage externe Auge Morphologie siehe zB 1). Nachfolgende detaillierte Analysen Auge Phänotypen benötigen Fixierung, Kunststoff eingebettet und Dünnschicht-Schnitte von erwachsenen Augen.
Die Drosophila Auge entwickelt sich aus der so genannten Eye-Imaginalscheibe, eine Tüte mit Epithelzellen, und vermehren sich differenzieren in Larven-und Puppenstadium Stufen (für eine Übersicht siehe zB 2). Jedes Ommatidium besteht aus 20 Zellen, darunter acht Photorezeptoren (PR-oder R-Zellen;. Abb. 2), vier Objektiv-sezernierenden Zapfen, Pigmentzellen ("Sechseck" um R-Zell-Cluster) und eine Borste. R8 [Abb.; Die Photorezeptoren jedes Ommatidium, am leichtesten durch ihre lichtempfindlichen Organellen, die Rhabdomere sind in einem Trapez aus den sechs "äußeren" (R1-6) und zwei "inneren" Photorezeptoren (R7 / 8 aus organisiert identifiziert . 2] ist unter R7 und damit nur in den Abschnitten aus den tieferen Bereichen des Auges zu sehen). Das Trapez jeder Facette ist genau mit denen der Nachbarn und der gesamten ap und dorsoventral Achsen des Auges (Abb. 3A) ausgerichtet. Insbesondere die Facettenaugen der dorsalen und ventralen (schwarz und rote Pfeile jeweils) Hälften des Auges sind Spiegelbilder voneinander und entsprechen den beiden chiralen Formen während planaren Zellpolarität Signalisierung (für eine Übersicht siehe z. B. 3) etabliert.
Die Methode, die semi-dünne Auge Abschnitte erzeugen (wie in Abb.. 3 dargestellt) hier beschriebene geringfügig von der ursprünglich von Tomlinson und Ready 4 beschrieben modifiziert. Es ermöglicht die morphologische Analyse aller Zellen mit Ausnahme der transparenten Kegel-Zellen. Darüber hinaus kann das Pigment der R-Zellen (blau Pfeilspitzen in Abb.. 2 und 3) als Zell-autonome Marker für den Genotyp eines R-Zelle, also genetische Voraussetzungen von Genen in einer Untergruppe von R-Zellen verwendet werden können leicht bestimmt werden 5,6.
Protokoll
1. Fly Kopf Dissektion
- Vergewissern Sie sich, alle Materialien zur Hand (einschließlich Gelatine beschichtete Objektträger). Bereiten Glutaraldehyd und Osmium Fixiermittel (siehe unten). Per Genotyp einzubetten, Aliquot 200 ul Glutaraldehyd fix Lösung in 1,5 ml Röhrchen auf Eis.
- Anesthetize Fliegen an den CO 2-Pad (wir normalerweise sezieren sieben fliegen Köpfe auf sechs pro Genotyp einbetten bei einem Kopf während des Verfahrens wird zerstört).
- Halten und leicht drücken den Brustkorb der Fliege, Rücken nach oben, mit einer Pinzette und mit einem scharfen Skalpell den Kopf abzuschlagen.
- Stabilisieren Sie die Fliege Kopf durch den Hals berührend mit der Pinzette und sorgfältig abschneiden ein kleiner Teil eines Auges. Dies erhöht die Penetration der Fixierlösung (wenn Sie Ihr Auge Abschnitte für klonale Analyse verwenden möchten, schneiden Sie das Auge mit keinem oder kleinere Klone). Vermeiden Sie die Berührung und Beschädigung der intakten Auge, das später sein wird geschnitten.
- Berühren Sie die Spitze mit einer Pinzette oder das Skalpell an der Oberfläche des Auges abgeschnitten und den Transfer der Kopf in Glutaraldehyd / Phosphat-Fixativ auf Eis (die Köpfe oft schwimmen auf der Fixativ) Der sezierte Köpfe sollten nicht in Glutaraldehyd Fix für länger aufbewahrt werden als 15 Minuten vor der Zugabe von Osmium. Wiederholen Sie die Schritte 1,2 bis 1,5 mit den anderen fliegt aus dem gleichen Genotyp.
2. Fixierung und Einbettung (Handschuhe für alle Stufen!)
- Spin the flyheads in Eppendorf-Zentrifuge für 1 Minute bei 10.000 Umdrehungen pro Minute. Weiter auch wenn Köpfe nicht sinken.
- Add 200 ul von OsO 4-Lösung und fix für mindestens 30 Minuten und bis zu 1 Stunde auf Eis.
- Mit einer Pasteurpipette entfernen Glutaraldehyd / Osmium-Lösung (stellen Sie sicher, um eine ordnungsgemäße Entsorgung Verfahren verwenden!) Und ersetzen mit 200 ul Osmium-Lösung. Inkubieren auf Eis für 1-6 Stunden. Achten Sie immer darauf die Köpfe vollständig mit Flüssigkeit bedeckt ist und entfernen Sie niemals die gesamte Lösung als die Köpfe oder Augen kann zusammenbrechen!
- Mit einer Pasteurpipette verwerfen Fixativ, fügen 0,5-1ml 30% Ethanol und Inkubation für mindestens 5 Minuten auf dem Eis (stellen Sie sicher, um eine ordnungsgemäße Entsorgung Verfahren zu verwenden, da das Ethanol enthält nun Osmium!).
- Wiederholen Sie den obigen Schritt mit 50%, 70%, (80%), 90% und zweimal 100% Ethanol. Fügen Sie die 80% Ethanol Schritt, wenn mit den Augen für elektronenmikroskopische Analyse. Nach dem 70% Waschschritt können die Proben aus dem Eis entfernt werden.
- Ersetzen Sie das Ethanol mit dem gleichen Volumen von Propylenoxid (volatile, weiterhin in der Haube arbeiten). Inkubieren für 10 Minuten bei Raumtemperatur.
- Wiederholen Propylenoxid zu waschen. Die Arbeit in Gruppen, wenn die Verarbeitung vieler Genotypen parallel zu vermeiden Kollabieren der Augen durch Verdunstung des Propylenoxid.
- Entfernen Sie die meisten der Propylenoxid und mit einem Kunststoff-Transfer Pipette etwa 500μl einer 1:1-Harz: Propylenoxid Lösung. Äquilibrieren über Nacht bei Raumtemperatur.
3. Embedding und Anordnung in Formen
- Stellen Sie sicher, dass alle Formen gekennzeichnet sind, um den Überblick über Ihre verschiedenen Genotypen zu halten, dann füllen Sie die Formen mit 100% Harz. Nicht überfüllen (keine "hohe Hügel" über die Oberfläche der Formen, wenn man gerade über der Oberfläche der Form). Verwenden von Hard-Harz für EM-Analyse.
- Mit einem Transferpipette, entfernen Sie die 50% Harz aus den Köpfen, ersetzen mit 100% Harz, und inkubieren für 3-4 Stunden bei Raumtemperatur. Als Köpfe mit Harz infiltriert werden, werden sie auf den Boden des Röhrchens sinken.
- Mit einem Zahnstocher, dass auf eine harte Oberfläche einmal zu einem kleinen Haken zu schaffen getroffen wurde, Transfer ein Kopf an der Zeit, in eine Form.
- Legen Sie Aluminiumfolie auf der Arbeitsfläche Ihres Binokular, um es gegen Harz Verschüttungen zu schützen.
- Mit einem Präpariernadel und suchen wenn Ihr Umfang, schwenken den Kopf leicht in den Harz und vorsichtig bewegen sie den Boden der Form nahe dem spitzen Ende.
- Richten Sie die Oberfläche des intakten (!) Auge (oder Ihre Zukunft Schnittebene, wenn Sie Querschnitte haben wollen) Hals abwärts mit der vorderen Wand der Form, so dass Sie sicher zu halten die tangentiale Oberfläche des Auges etwa einen halben Kopf Durchmesser vom Schimmel Wand. In seltenen Fällen ein Auge zusammen, die als ein leerer Raum zwischen der Oberfläche des Auges und der Kopf Nagelhaut zu sehen ist. Wenn Sie eine zusammengebrochen Auge haben, ersetzen Sie es mit dem 7. Ersatz Auge.
- Wiederholen Sie dies mit allen Köpfen. Einmal mit allen Ausrichtungen erfolgen, überprüfen Sie alle Augen zu machen, dass sie bewegte sich nicht, wenn Sie die Nadel entfernt aus dem Harz.
- Wenn Sie Probleme mit den Augen bewegen, wenn Sie die Präpariernadel entfernen müssen, Position des Auges, wie gewünscht, schnell zurückziehen der Nadel ein wenig weg vom Kopf und dann langsam entfernen Sie die Nadel vollständig.
- Backen Sie die Formen über Nacht bei 70 ° C.
4. Trimmen und Schneiden
- Entfernen gehärtete Blöcke aus den Formen durch Biegen der Formen, keeping verfolgen, welche Block entspricht dem Genotyp (zB Filiale in kleinen Szintillationsgefäße).
- Zum Beschneiden, verwenden Sie ein Futter für Ihr Mikrotom das Gesicht montiert ist bis auf einen Block aus Plexiglas oder Aluminium. Montieren Sie den Block zu trimmen, Augen-up, in das Futter.
- Unter der Dissektion Umfang mit einem Teflon beschichtet gestochen hieß, sorgfältig abgeschnitten nur die oberste Schicht des Blocks. Dies hinterlässt eine klare Oberfläche, durch welches man die Augen sehen sollte und kann so die Zukunft voraussagen Schnittebene. Vermeiden Sie Schnitte Ihre Finger!
- Cut off überschüssige Kunststoff auf beiden Seiten des Kopfes und auf der Vorderseite (also das, was verwendet werden, um die Oberseite der Form werden bei der Ausrichtung der Augen), bis die meisten der Kunststoff um den Kopf abgeschnitten wird. Am besten ist es langsam an den Kopf abzuschneiden mehrere dünne Schichten aus Kunststoff.
- Mit einem sauberen Rasierklinge vorsichtig dünne Schichten von der Spitze das Auge genau in der Ebene, die Sie weiter unten (in der Regel tangential auf das Auge, in einem leichten Winkel zur ursprünglichen Oberfläche der Form).
- Fahren Sie weiter bis Sie anfangen, nur um wegschneiden der äußeren Oberfläche des Auges. Achten Sie darauf, saubere Bereiche der Klinge, um eine glänzende, transparente Oberfläche, die Ausrichtung macht in dem Mikrotom leichter zu erhalten.
- Zur Einsparung von Rasierklingen, verwenden ältere Klingen für den Roh-Besatz an den Seiten des Blocks und eine frische Klinge für die feinen Trimmen (erste Schnitt und 4,6). Am Ende haben Sie eine dreiseitige Pyramide mit einem leicht geneigten, cut-off top, die Ihre Zukunft Schnittebene entspricht.
- Montieren Sie den Block in das Mikrotom. Actual Schnitte ist abhängig von der Art des Mikrotoms und wird nicht im Detail beschrieben werden. Wir verwenden eine Sorvall MT5000 mit einer histo Qualität Diamantmesser auf 0,5 bis 1 &mgr; Abschnitte geschnitten. Für lichtmikroskopische Analyse, nicht leichten Variationen in Schnittdicke keine Rolle. Wenn sectioning Klone von einem White + Transgen, Abschnitt markiert 1 &mgr; Abschnitte, um sicherzustellen, genug Pigmentkörnchen neben der Rhabdomere pro Abschnitt (Abb. 2).
- Abschnitte werden auf dem Wasser schwimmen. Heben ersten 20-30 Abschnitte mit einem abgeflachten Ende eines hölzernen Q-Tip von unterhalb der Wasseroberfläche in eine rotierende Bewegung und überführen sie in einen Tropfen Wasser auf einer Gelatine beschichteten Objektträger (gehalten auf einer Heizplatte auf etwa 100 ° C ).
- Wiederholen Sie mit weitere 20-30 Abschnitten. Warten Sie, bis das Wasser verdampft ist und Abschnitte bleiben, um die Folie. Normalerweise Abschnitte 3 Augen in drei Spalten (drei Augen) durch twp Zeilen (oben / unten Abschnitte) angeordnet passen gut auf einer Folie.
5. Färbung und mikroskopische Analyse
- Sofern sectioning Klone, Flecken Abschnitten. Legen Sie gleiten mit Abschnitten auf einem Heizblock auf 90 ° C. Dispense Toluidine-Blau-Färbung Lösung aus einer 30 ml Spritze an einem 0,22 &mgr; m-Filter auf den Objektträger und Färbung für 10 Sekunden. Sofort ausgiebig spülen mit destilliertem Wasser. Der Luft trocknen lassen.
- Mit einem Kunststoff Transferpipette, verteilen 3 Tropfen DPX Eindeckmedium auf den Objektträger geben und mit einem Deckglas. Top mit 3 Groschen und lassen Sie die Eindeckmedium aushärten (zB über Nacht bei Raumtemperatur).
- Bild mit einem Lichtmikroskop. Verwenden Sie ein 5x oder 10x Objektiv zu einem guten Teil zu finden und dann zu einem 63x Ölimmersion Schalter zur detaillierten Analyse und Fotografieren. Wir verwenden normalerweise Phasenkontrast-Einstellungen, aber Dunkelfeld Optik Arbeit als gut.
6. Repräsentative Ergebnisse:
Am häufigsten sind die Augen aus Kunststoff für eine detaillierte Analyse der externen groben Auge Phänotypen als Teil eines genetischen Bildschirm oder in den Prozess der Erprobung genetische Interaktionen mit Genen bekannt, entweder allgemeine Struktur des Auges oder Polarität beeinflussen erkannt eingebettet. Typische Ergebnisse von Augen-Abschnitte sind in Abbildung 3 dargestellt. Wild-Typ Ommatidien (Abb. 3A) zeigen die volle Photorezeptor Ergänzung durch ein Gitter von Pigmentzellen umgeben. Im Gegensatz dazu in einem Schielen (stbm, aka van-Gogh-7) Mutante, die ommatidial Polarität verloren geht und, obwohl die volle Photorezeptor Ergänzung vorhanden ist, werden Dreh-und Chiralität randomisiert (Abb. 3B). Da außerdem die stbm Allel geschnitten in aw war - Hintergrund sind die Pigmentkörnchen in Abb. fehlt. 3B. 3C zeigt ein Beispiel für eine klonale Analyse. Drosophila Rho-Kinase (drok) für ommatidial Rotation als auch für die strukturelle Integrität des Auges 8 ist erforderlich. Homozygote drok 2 Klone durch das Fehlen von Pigment in den Pigmentzellen und die Rhabdomere (in der Regel identifiziert werden können, sind Klone induziert mit eyeless-FLP und einem P-Element mit einem stark exprimierten weiß Markergen ergänzen Hintergrund w - Mutation in der Wildnis -Typ und heterozygot Gewebe). Es ist somit möglich, Mutanten Gebieten, die durch Mangel an Pigment zu identifizieren. Aufgrund der Zell-Autonomie der Pigmentierung in der R-cells bereits erwähnt, Genotypen einzelner R-Zellen bestimmt werden kann (siehe Pfeilspitzen in Abb.. 3C) werden.
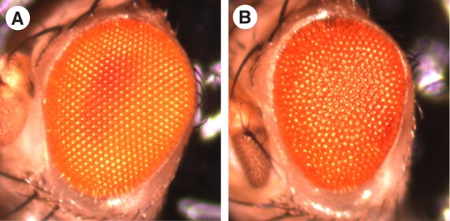
Abbildung 1. Die Drosophila Auge ist ein ausgezeichnetes Modell für Biologen, da im Gegensatz zu der glatten Oberfläche eines Wildtyp-Auge (A), wird die Oberfläche eines mutierten Auge von außen oft rauh (B), was auf der zugrunde liegenden Auge Phänotypen . In allen Figuren ist anterior der linken und dorsal wird. Bilder mit freundlicher Genehmigung von Dr. Jennifer Curtiss, NMSU, Las Cruces, NM, USA.
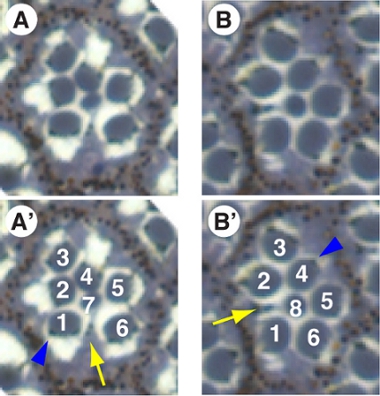
Abbildung 2. Lichtmikroskopische Aufnahmen einzelner Ommatidien geschnitten mit dem beschriebenen Verfahren. Nur sieben R-Zellen sichtbar sind zu einem Zeitpunkt pro Ommatidium, da R7 liegt auf der R8. (A, A ') (Auf der R7 Ebene ist die Zellkörper der R7 zwischen R1 und R6 gelber Pfeil in A) festgestellt. " Im Gegensatz dazu bei der R8-Ebene (B), ist die Zellkörper der R8 zwischen R1 und R2 (gelber Pfeil in B ') nachgewiesen. Blaue Pfeile markieren die Pigmentkörnchen, die als Zell-autonome Pigment-Marker verwendet werden kann.

Abbildung 3. Tangential Schnitte durch Wildtyp-(A), stbm (B) und drok (C)-Mutante erwachsenen Drosophila Augen. Schematics unterhalb der Abschnitte zeigen die Polarität der Facettenaugen (siehe (A) für Pfeile). Kreise repräsentieren Ommatidien mit Defekten in der Photorezeptor ergänzen. Gelbe Linien repräsentieren die dorsal / ventral Symmetrielinie (Äquator). Im Gegensatz zu den gut orientierten Facettenaugen von Wildtyp-(A) ist die planare Organisation in der stbm Mutante (B) verloren. Beachten Sie, dass der Abschnitt der stbm Mutanten gezeigt farblos ist aufgrund seiner w - Mutanten Hintergrund. (C) Weil drok Mutationen tödlich sind, müssen sie in Klone analysiert werden. So sind pigmentierte Zellen Wildtyp-oder heterozygot (blaue Pfeile), während R-Zellen ohne Pigment (offene blaue Pfeile) homozygote Mutante. Neben Rotation Mängel, drok Mutanten zeigen auch strukturelle Defekte wie fehlende oder überschüssige Anzahl von R-Zellen. Beachten Sie, dass für die klonale Analyse, die Abschnitte nicht gefärbt werden, um nicht zu verdecken die Pigmentkörnchen.
Diskussion
Mit Drosophila als Modellorganismus, genetische Screens führten zur Identifizierung von vielen zu den Gründungsmitgliedern von Genfamilien essentiell für die meisten der hoch konservierten Signalwegen in höheren Eukaryonten einschließlich des Menschen. Da unter Laborbedingungen, ist eine funktionelle Auge entbehrlich für das Überleben, ist das Auge besonders gut geeignet Gewebe für die Entdeckung neuer Genfunktionen und die Bewertung der genetischen Netzwerken. Ultrastrukturelle Analyse der Fliege Auge mit dem beschriebenen Verfahren führte somit zu grundlegenden Entdeckungen relevant für die Entwicklung und Krankheit. Ursprünglich war einzigen Zelle klonale Analyse unter Verwendung von X-ray induzierten Klone mit bekannten eng verbundenen Zell-autonome rezessiven Marker kombiniert. In jüngerer Zeit hat die Verfügbarkeit des FLP / FRT-System, um Klone zu erzeugen, erheblich die phänotypische Analyse der letalen Mutationen in Auge Abschnitte 6,9 erleichtert.
Die Analyse der Augen-Abschnitten ist nicht zu Tangentialschnitt hier beschriebenen beschränkt. Falls gewünscht, können die Köpfe in beliebiger Orientierung in den Formen ausgerichtet werden und Querschnitte erhalten, um tiefere Schichten in den Kopf, wie die Lamina und Medulla zu studieren. Die hier beschriebene Protokoll ist somit eine vielseitige Methode zur Analyse von Auge und Kopf Strukturen Drosophila Erwachsene.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Ich möchte Dr. Jennifer Curtiss für die Bilder in Abb. danken. 1 und Jeremy Fagan und Dr. Florence Marlow für die kritische Durchsicht des Manuskripts. Unsere Arbeit wird von NIH 1R01GM088202 unterstützt.
Materialien
Allgemeine Ausstattung:
- Für allgemeine fliegen Tierhaltung siehe 10
- Standard Dissektionsmikroskop (zB Nikon SMZ-645 Stereo-Zoom-Mikroskop), vorzugsweise mit einem Ring Lichtquelle zu verhindern wirft einen Schatten deiner Hände.
- CO 2 Fly-Pad, mit 3 mm Whatman-Papier bedeckt, um Schutz gegen Schmutz beim Präparieren bieten.
- Gelatine beschichtete Objektträger: Man löst 10g Gelatine und 1g CrKSO 4 x 12 H 2 O in 1 l Wasser auf einer Heizplatte (bring fast zum Kochen bringen, dauert ca. 2 Std.). Dip gut gewaschen (Seife) und gespült (dH 2 O) gleitet in Haltern in Gelatine-Lösung und an der Luft trocknen mit Folie abgedeckt über Nacht.
- Wärmeschrank (70 ° C; alte Vakuumöfen, die für Nitrocellulosefilter Trocknung verwendet wurden, sind für diesen Zweck gut geeignet).
- Mikrotom in der Lage ultradünne Schnitte (0.5-1 um dicke Abschnitte), die zB mittels Elektronenmikroskopie Einrichtungen verwendet. Wir verwenden eine Sorvall MT5000 Ultramikrotom mit einem Histo Qualität Diamantmesser. Glass Messer auch funktionieren.
Fixation Lösungen:
- Bereiten Sie eine Stammlösung von 0,2 M Natriumphosphat, pH 7,2.
- Bereiten Sie 2% Glutaraldehyd in 0,1 M Natriumphosphat-Puffer, pH 7,2 (bei 4 ° C für 4 Wochen gelagert werden). Machen Sie zumindest genug, um 200 ul pro Genotyp Sie einbetten möchten haben. Keep on ice.
- Osmium-Lösung: 2% OsO 4 in 0,1 M Natriumphosphat, pH 7,2. Machen Sie nur genug, um 200 ul pro Genotyp Sie einbetten möchten haben, da die Lösung nicht gespeichert werden können. Keep on ice.
Glutaraldehyd und OsO 4 sind sehr giftig und sollte mit äußerster Vorsicht in einen gut belüfteten Haube behandelt werden. Verwenden Sie Filter Tips beim Umgang mit OsO 4 zu verhindern, Schwärzung der Pipette.
Dehydration: Stellen Sie 30%, 50%, 70%, (80%), 90% und 100% Ethanol. Vorzugsweise kühl 30%, 50%, 70% Ethanol auf Eis vor dem Gebrauch.
Färbelösung:
1% Toluidine-Blau in 1% Borax.
| Name | Company | Catalog Number | Comments |
| Weich | Schwer | ||
|---|---|---|---|
| Harz A | 54g | 50g | |
| Härter B | 44.5g | 50g | |
| Accelerator C | 2.5g | 1.75g | |
| Weichmacher D | 10g | 0.75g |
Tabelle 1. Harzzubereitung
Um das Harz herzustellen, sorgfältig, aber gründlich mischen Sie alle Zutaten in einen Plastikbecher mit einem Magnetrührer mit großer Rührstab. Vermeiden Sie Luftblasen. Nach dem Mischen Aliquot in Standard-Szintillationsgefäße oder ähnlichen Behältnissen und bei -20 ° C. Benutzen Sie ein weiches Harz für alle Anwendungen, wenn Ihr EM-Anlage fragt nach dem härteren Formulierung. Benutzen Sie Handschuhe, um Harz Griff (krebserregend in ihrer polymerisierten Form). Um Harz auf Geräten und Abfällen polymerisieren, backen bei 70 ° C über Nacht. Abfälle dürfen dann sicher entsorgt werden und Geräte gereinigt und wiederverwendet werden. Verschüttete polymerisierten Harz kann mit Isopropanol gereinigt werden.
| Reagens | Lieferant | Katalog-Nummer |
|---|---|---|
| Fly-Pad | zB Genesee | 59-119 |
| Glutaraldehyd | Sigma | G7526-10 X 10 ML |
| OsO 4 | Polysciences, Inc. | 0972A-20 |
| Propylenoxid | Fischer | 04332-1 |
| Skalpellgriffe, für # 3 | Fischer | 22080046 |
| Skalpellklingen Nr. 11 | Fischer | 08 bis 916-5B |
| Transferpipetten | Fischer | 13 bis 711-7M |
| Durcupan (R) ACM Harz | Sigma (Fluka) | 44610-1EA |
| Stahl Präpariernadel | Fischer | S17346 |
| BEEM flachen Einbettform | Electron Microscopy Sci. | 70904-12 |
| Teflon beschichteten Klingen | Electron Microscopy Sci. | 71970 |
| Q-Tip (sterile Tupfer) | Fischer | 14-959-81 |
| Glasobjektträger | Fischer | 12-550-143 |
| Deckgläser Nr. 1, 22X60 mm | Fischer | 12-531k |
| Gelatine | Fischer | ICN96010280 |
| Cr (III) K SO 4 Dodecahydrat | Sigma | 243361 |
| Diamant-Histo Messer, 6mm | Diatome US | 60-Seine |
| Toluidinblau O | Fischer | BP107-10 |
| Borax (Na-Tetraborat) | Fischer | AC20629-1000 |
| DPX Eindeckmedium | Sigma | 44581-100ML |
Tabelle 2. Materialien
Referenzen
- Harvey, K. F., Pfleger, C. M., Hariharan, I. K. The Drosophila Mst ortholog, hippo, restricts growth and cell proliferation and promotes apoptosis. Cell. 114, 457-457 (2003).
- Secombe, J., Li, L., Carlos, L., Eisenman, R. N. The Trithorax group protein Lid is a trimethyl histone H3K4 demethylase required for dMyc-induced cell growth. Genes Dev. 21, 537-537 (2007).
- Cagan, R. Principles of Drosophila eye differentiation. Curr Top Dev Biol. 89, 115-115 (2009).
- Jenny, A. Planar cell polarity signaling in the Drosophila eye. Curr Top Dev Biol. 93, 189-189 (2010).
- Tomlinson, A., Ready, D. F. Cell fate in the Drosophila Ommatidium. Dev. Biol. 123, 264-264 (1987).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in the Drosophila ommatidium. Dev. Biol. 120, 366-366 (1987).
- Jenny, A., Darken, R. S., Wilson, P. A., Mlodzik, M. Prickle and Strabismus form a functional complex to generate a correct axis during planar cell polarity signaling. Embo J. 22, 4409-4409 (2003).
- Zheng, L., Zhang, J., Carthew, R. W. frizzled regulates mirror-symmetric pattern formation in the Drosophila eye. Development. 121, 3045-3045 (1995).
- Reinke, R., Zipursky, S. L. Cell-cell interaction in the Drosophila Retina: The bride of sevenless Gene is required in photoreceptor cell R8 for R7 cell development. Cell. 55, 321-321 (1988).
- Wolff, T., Rubin, G. M. strabismus, a novel gene that regulates tissue polarity and cell fate decisions in Drosophila. Development. 125, 1149-1149 (1998).
- Winter, C. G. Drosophila Rho-associated kinase (Drok) links Frizzled-mediated planar cell polarity signaling to the actin cytoskeleton. Cell. 105, 81-81 (2001).
- Xu, T., Rubin, G. M. Analysis of genetic mosaics in developing and adult Drosophila tissues. Development. 117, 1223-1223 (1993).
- Stocker, H., Gallant, P. Methods Mol Biol. Dahmann, C. 420, Springer. 27-27 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten