Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Verfahren zur Markierung Gefäßsystem in embryonalen Mäuse
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt eine Methode zur Kennzeichnung embryonalen Haut und Thymus Blutgefäße.
Zusammenfassung
Die Einrichtung eines funktionalen Blutgefäß-Netzwerk ist ein wesentlicher Bestandteil der Organogenese und ist für eine optimale Organfunktion erforderlich. Zum Beispiel in der Thymusdrüse richtigen Gefäße Bildung und Strukturierung ist wesentlich für Thymozyten Einstieg in die Orgel und reifen T-Zellen-Ausgang an die Peripherie. Die räumliche Anordnung der Blutgefäße in der Thymusdrüse ist abhängig von Signalen aus dem lokalen Mikroumgebung, nämlich Thymus Epithelzellen (TEC). Mehrere neuere Berichte deuten darauf hin, dass eine Störung dieser Signale führt in Thymus Blutgefäß Defekte 1,2. Frühere Studien haben Techniken verwendet, um die Neugeborenen und adulten Thymus Gefäßsystem 1,2 label beschrieben. Wir zeigen hier eine Technik zur Kennzeichnung Blutgefäße in der embryonalen Thymus. Diese Methode kombiniert die Verwendung von FITC-Dextran oder Griffonia (Bandeiraea) Simplicifolia Lektin I (GSL 1 - isolectin B 4) V. facialis Injektionen und CD31 Antikörper-Färbung zu Thymus vaskulären Strukturen und PDGFR-β zu Thymus perivaskulären Mesenchym 3-5 Etikett zu kennzeichnen. Die Möglichkeit der Verwendung Kryoschnitten oder Vibratom Abschnitte ist ebenfalls vorhanden. Dieses Protokoll kann verwendet werden, um Thymus vaskulären Mängel, die entscheidend für die Festlegung der Rolle der TEC-basierten Molekülen in Thymus die Bildung von Blutgefäßen zu identifizieren. Da die Methode kennzeichnet die gesamte Gefäßsystem, kann es auch verwendet, um den vaskulären Netze in mehreren Organen und Geweben während der Embryo einschließlich Haut-und Herz 6-10 analysieren.
Protokoll
1. Fluorescein markiertem Dextran und GSL I-isolectin B 4 V. facialis Injektionen zu embryonalen Blutgefäßen Label
- Bereiten FITC-Dextran (50ug/mL) in Phosphat-gepufferter Saline (PBS) oder GSL 1 - isolectin B 4 (20ug/200uL) in PBS in einem 1,5 ml Eppendorf-Röhrchen und warm bis 37 ° C. Add 100 ul auf Lager 1,25 Fast Green / PBS, die FITC-Dextran-Lösung (Gesamtvolumen 1 ml) und 180uL of stock 1,25 Fast Green / PBS auf die GSL 1 - isolectin B 4 (Gesamtvolumen 200 &mgr; l), so dass die Lösung sichtlich blau.
- Dissect E14.5-E18.5 Embryonen und Dottersack zusammen, so dass die Allantois Stiel (Nabel-Arterie und Vene) intakt.
- -Embryonen eine neue Petrie Schüssel (60 X 15 mm) und tauche sie in PBS bei Raumtemperatur.
- Position des Embryos zu einer sagittalen Ansicht des Kopf / Gesicht geben. Verwenden Sie Micro-Pinzette vorsichtig fassen den Embryo an der Spitze.
- Mit einer 30G Nadel injiziert 50ul FITC-Dextran (50ug/mL) oder GSL 1 - isolectin B 4 (20ug in 200 &mgr; l PBS) in die V. facialis und dabei die Nadel in Richtung der Rückseite des Kopfes.
- Wenn der Farbstoff sichtbar in die Nabelvene ist, entfernen Sie die Nadel und trennen Sie die Embryos aus der Allantois-Stiel (Nabel-Arterie und Vene).
- Nach Injektionen, erlauben Embryo in PBS bei Raumtemperatur bleibt für 2-3 Minuten, so dass der Farbstoff zirkuliert im gesamten Embryo.
2. Whole-mount Analyse der Haut Gefäßsystem
- Nach Abzug der Farbstoff im gesamten Embryo zirkulieren, zu entfernen Hautproben aus Regionen der Extremitäten, Rücken und Bauch, etc. 8,9.
- Waschen Sie die Haut Probe in kaltem PBS, und fixieren in 4% PFA / PBS für 2 Stunden 8,9. 3 x waschen für jeweils 10 Minuten in 4 ml klare Flasche mit 2 ml kaltem PBS.
- Legen Sie Hautprobe auf einen Objektträger und 100 ul der Montage Medien zu jeder Folie und einem Deckglas.
- Lassen Sie die Objektträger in einem dunklen Lagerraum trocken.
- Fahren Sie mit 2 'Image Acquisition "Abschnitt Schritt.
3. Multi-Farb-Kennzeichnung von Thymus und Herz Gefäßsystem und perivaskulären Zellen für Gefrierschnitte (aus Abschnitt 1, Schritt 7 weiter)
- 'Flash freeze' ganze Embryo in flüssigem Stickstoff. Embryonen werden können und bei -80 ° C bis zur Analyse.
- Alternativ herauspräparieren Thymus, spülen in 4 ° C PBS, und fix in 2 ml 4% Paraformaldehyd (PFA) / PBS für 2 Stunden. 3 x je 10 Minuten in kaltem PBS, Ort Thymi in OCT und einfrieren und lagern bis zur Verwendung bei -80 ° C.
- Für Kryoschneiden verbreitete ÜLG auf einen Abschnitt 'block' und montieren Sie den Embryo oder seziert Organe / Gewebe zum Schneiden.
- Cut gefrorenen Gewebe in 10 pm dicke Schnitte und sammeln auf Folien.
- Fix Abschnitte in Aceton für 5-10 Minuten. 3 x waschen mit kaltem TBS.
- Block in 10% Esel Serum / TBS in einer feuchten Kammer bei Raumtemperatur.
- Inkubieren Abschnitte 1 Stunde Übernachtung mit 100 ul Primärantikörper in einer feuchten Kammer bei 4 ° C: in diesem Beispiel verwenden wir Ratte anti-Maus-CD31 (1:100) zu kennzeichnen Endothel und Ziege anti-Maus PDGFR-β (1:100) zu kennzeichnen perivaskulären Zellen. Es ist sinnvoll, Folien mit individuell zugeschnittenen Streifen Parafilm abdecken, um sicherzustellen, dass der Antikörper gleichmäßig über den Querschnitt verteilt.
- Nach der Inkubation mit dem Primärantikörper, waschen Abschnitte 3 mal in kaltem TBS. Inkubieren mit 100 ul entsprechenden Sekundärantikörper für mindestens 30 Minuten.
- 3 x waschen mit kaltem TBS. 100 l der Montage Medien zu jeder Folie und einem Deckglas.
- Lassen Sie die Objektträger in einem dunklen Lagerraum trocken.
- Proceed to 'Image Acquisition "Abschnitt.
4. Multi-Farb-Kennzeichnung von Thymus Gefäßsystem und perivaskulären Zellen für Vibratom Abschnitte (aus Abschnitt 1, Schritt 7 weiter)
- Dissect aus Thymus Lappen vom Embryo und spülen Sie mit kaltem PBS.
- Fix Thymus in 4% PFA / PBS bei Raumtemperatur für 2 Stunden.
- Wash in PBS-Triton X (0,15%) 3-mal, 10 Minuten und Platz Thymi in einer kleinen Kunststoff-Kartusche und tauchen in 4% niedrig schmelzende Agarose / PBS (~ 4 ° C). Der Thymus ist in Kontakt mit der Unterseite der Patrone sein.
- Lassen Agarose auf Eis (3-5 Minuten) zu festigen. Verwenden einer Rasierklinge abgeschnitten überschüssige Agarose. Fügen Sie Leim auf die Vibratom Block und halten Probe, um den Block.
- Add kaltem PBS zu Vibratom Wasserbad, bis die Probe und Klinge eingetaucht sind.
- Set Geschwindigkeit und Amplitude (hoher Amplitude und niedriger mittlerer Geschwindigkeit ist ideal für weiche Thymus Abschnitte). Die Amplitude reduziert werden, wenn Teile zerbrechen aufgrund von zu viel Aufregung sein.
- Cut 50 um Abschnitte.
- Mit einem Pinsel, sammeln Abschnitte in einem 24-well Mikroplatten in kaltem PBS.
- Block Abschnitte in 500 ul 10% Esel-Serum in PBS-Triton X (0,15%) für 30 Minuten.
- Inkubieren Abschnitte für 8 Stunden bis über Nacht mit dem primären Antikörper, wie anti-CD31-und Anti-PDGFR-β, In einer überdachten 24-Well-Mikroplatten.
- 3 x waschen mit PBS-Triton X (0,15%) auf insgesamt 8 Stunden bei 4 ° C.
- Block Abschnitte in 10% Esel-Serum in PBS-Triton X (0,15%) für 30 Minuten.
- Inkubieren Abschnitte für 8 Stunden bis über Nacht bei 4 ° C mit entsprechenden Sekundärantikörper.
- 3 x waschen mit PBS-Triton X (0,15%) auf insgesamt 8 Stunden bei 4 ° C.
- Re-fix Proben in 4% PFA / PBS für 30 Minuten auf Eis.
- 3 x waschen mit PBS-Triton X (0,15%) über 30 Minuten auf Eis.
- Entwässern Proben durch ein abgestuftes MeOH / PBS-Triton X-Serie: 25% MeOH, 50% MeOH, 75% MeOH und 100% MeOH in 10 Minuten für jeden Schritt. Ersetzen Sie 100% MeOH mit frischem MeOH nach 10 Minuten und inkubieren für 1 Stunde bei Raumtemperatur.
- In einem Glasbehälter, mischen BABB (Benzylalkohol: Benzylbenzoat) im Verhältnis 1:2. Kombinieren Sie BABB mit MeOH für eine Endkonzentration von 50% BABB und 50% MeOH. Inkubieren Sie die Probe in BABB: MeOH für 10-15 Minuten.
- Transfer-Probe auf einem Glasbehälter mit 100% BABB und Inkubation für 10-15 Minuten oder bis gelöscht, bei Raumtemperatur.
- Füllen Depression slide (0.7mm Tiefe) mit frischem 100% BABB und Transfer Probe auf die Seite. Add Deckglas (Nr. 1,5) und Dichtung mit 2-3 Schichten von Nagellack. Lassen Sie Nagellack zu härten im Dunkeln bei Raumtemperatur, dann speichern Probe bei 4 ° C.
Hinweis: Folien müssen absolut dicht vor dem konfokalen Bildaufnahme werden. Die Bilder sollten innerhalb von 12-24 Stunden erworben werden, als Fluoreszenzfarbstoffe in BABB verblassen kann. - Proceed to 'Image Acquisition "Abschnitt.
5. Bildaufnahme
- Bild 10 um Gefrierschnitten mit einem konfokalen Mikroskop mit dem Plan-Apochromat 20X/0.8 Ziel (512 x 512 Pixel) mit 488 - (FITC-dextran/GSL 1 - isolectin B 4), 543 - und 633-nm-Laser-Linien.
- Erwerben Sie konfokalen z-Abschnitte whole mount Haut und 50 um Agarose eingebetteten Schnitten mit der Plan-Apochromat 10X/0.4 Ziel (512 x 512 Pixel) mit 488 - (FITC-dextran/GSL 1 - isolectin B 4), 543 -, und 633-nm-Laser-Linien. Serielle Z-Abschnitte sollten nacheinander auf 1-Mikron gesammelt werden für den jeweiligen Kanal.
- Rekonstruieren seriellen Z-Sektionen mit Zeiss AxioVision 4.6 oder andere Bild-Analyse-Software.
6. Repräsentative Ergebnisse:
Effiziente Kennzeichnung des embryonalen Gefäßsystems ist entscheidend für die Beurteilung von Defekten an Blutgefässen in embryonalen Mäuse. Abbildung 1 zeigt spezifische Kennzeichnung von E16.5 Thymus Blutgefäße (1A-B) und Co-Markierung mit CD31 (1B), zusätzlich zu Verfärbung der rechten und linken Ventrikel (1E-F), bzw.. Die GSL I-isolectin B-4-Protokoll für Gefrierschnitte wie in den Abschnitten 1, 3 und 5 beschrieben wurde in diesen Experimenten verwendet. Whole-mount Kennzeichnung der Haut Blutgefäß-Netz auf E16.5 Mäusen, mit Hilfe der Protokolle in den Abschnitten 1, 2 beschrieben, und 5 ist in Abbildung 1C-D gezeigt.
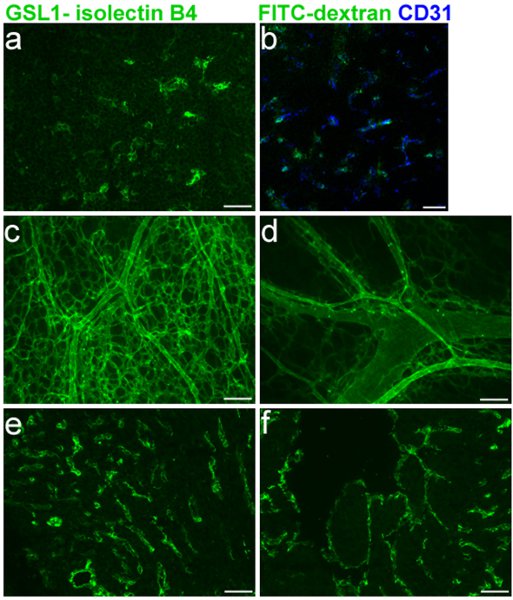
Abbildung 1 Legend. FITC GSL I - isolectin B 4 V. facialis Injektionen in E16.5 Maus-Embryonen. a. Gefrier der embryonalen Thymus nach der Injektion. b. Merge von CD31 co-Kennzeichnung mit isolectin B 4. c. und d. Whole-mount der embryonalen Haut Gefäße nach der Injektion. e. und f. Gefrier von embryonalen Herzen e. (rechts Ventrikel) f. (linker Ventrikel) nach der Injektion.
Diskussion
Whole-mount und PECAM-1 (CD31) Flecken auf Abschnitte sind den herkömmlichen Verfahren zur Kennzeichnung der Gefäße in der embryonalen Mäuse. Diese Methoden erfordern den Einsatz von direkten und / oder indirekte Immunfluoreszenz und Reinigungsmittel zur Mäusegewebe permeabilisieren. Dies erweist sich als recht zeitnah zu verarbeiten. Hier haben wir eingesetzten FITC-Dextran oder isolectin B 4 V. facialis Injektionen direkt beschriften Sie die embryonale Gefäßsystem, wodurch die Voraussetzung für Anti...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von den Zuwendungs-Zahlen R01AI055001 und R01AI082127 von NIAID zur NRM und SREB Dissertation Fellowship Award JLB unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
|---|---|---|---|
| FITC-Dextran | Sigma | FD150S-1G | |
| Fluorescein GSL 1 - isolectin B 4 | Vector Laboratories | FL-1201 | |
| Fast Green | MP Biomedicals | 195178 | |
| PFA | Fluka | 76240 | |
| Fetal Bovine Serum | Atlanta Biologicals | S11550 | |
| Optimal Cutting Temperature Compound (OCT | VWR | 25608-930 | |
| Aceton | JT Baker | 9006-33 | |
| Donkey Serum | Jackson | 017-000-121 | |
| Ratte anti-Maus-CD31, | BD Pharmingen | 558736 | |
| Ziege anti-Maus PDGFR-β | R & D Systems | AF1042 | |
| Esel-anti-Ratte CD31 Alexa 647 (Invitrogen) | Biolegend | 102516 | |
| Esel anti-Ziege Alexa 594 (Invitrogen) | Invitrogen | A11058 | |
| Triton X -100 | Sigma-Aldrich | X-100 | |
| Low Melt Agarose / PBS | Sigma-Aldrich | A9414-25G | |
| Methanol | Fisher Scientific | A413-4 | |
| Benzylalkohol | Acros Scientific | 148390010 | |
| Benzyl Benzoate | Acros Scientific | 105860010 | |
| Depression rutscht | Fisher Scientific | S175201 | |
| Fluorogel | Electron Microscopy Sciences | 17985-10 | |
| Deckglas (22x22) -1,5 | Thermo Scientific | 152222 | |
| Zeiss LSM 510 Meta konfokalen Mikroskop | Zeiss | ||
| Micro Pinzette | Roboz | RS-5135 | |
| Parafilm Nr. OM992 | Fisher Scientific | 13-374-16 | |
| 12 und 24 Well-Mikroplatten | Evergreen Scientific | 222-8044-01F | |
| Superfrost / Plus Mikropräparate | Fisher Scientific | 12-550-15 | |
| 4mL klaren Fläschchen | National Scientific | B7800-2 |
Referenzen
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten