Method Article
Elektroporation von Craniofacial Mesenchym
In diesem Artikel
Erratum Notice
Zusammenfassung
Craniofacial Knorpel entwickeln in engem Kontakt mit anderen Geweben und sind schwer zu lebenden Tieren zu manipulieren. Wir sind mit Elektroporation, um molekulare Werkzeuge während des Wachstums des kraniofazialen Skeletts liefern unter Umgehung der frühen Embryonalentwicklung Effekte. Dieser Ansatz erlaubt es uns, effizient Testkandidat Moleküle In vivo.
Zusammenfassung
Elektroporation ist eine effiziente Methode der Bereitstellung von DNA und andere geladene Makromoleküle in das Gewebe zu präzisen Zeitpunkten und in genauen Standorte. Zum Beispiel, Elektroporation wurde mit großem Erfolg verwendet worden, um Nerven-und Retina-Entwicklung in Xenopus-Studie, Huhn und Maus 1-10. Es ist jedoch wichtig anzumerken, dass in all diesen Studien, Ermittler wurden nicht gezielt Weichteile. Weil wir in kraniofazialen Entwicklung interessiert sind, passten wir eine Methode zur Gesichts-Mesenchym Ziel.
Wenn wir die Literatur gesucht, fanden wir zu unserer Überraschung, nur sehr wenige Berichte über erfolgreiche Gentransfer in Knorpelgewebe. Die meisten dieser Studien waren Gentherapie-Studien, wie siRNA oder Proteinen Lieferung in chondrogene Zelllinien, oder Tiermodellen von Arthritis 11-13. In anderen Systemen, wie Huhn oder eine Maus, die Elektroporation von Gesichts-Mesenchym war eine echte Herausforderung (persönliche KommunikIonen, Dept of Craniofacial Development, KCL). Wir stellten die Hypothese, dass Elektroporation in procartilaginous und knorpeligen Gewebe in Xenopus könnte besser funktionieren. In unseren Studien zeigen wir, dass Gen-Transfer in die Gesichts-Knorpel tritt effizient in einem frühen Stadium (28), wenn das Gesicht Primordium noch von Weichgewebe umfasst vor Knorpel Differenzierung.
Xenopus ist ein sehr zugänglicher Wirbeltier-System für die Analyse von kraniofazialen Entwicklung. Kraniofazialen Strukturen sind gut sichtbar in Xenopus als in jedem anderen Wirbeltier-Modell, vor allem weil Xenopus Embryonen extern befruchtet werden mit Hilfe von Analysen der frühesten Stadien, und die Erleichterung leben Bildgebung bei einzelnen Zelle Auflösung, sowie die Wiederverwendung der Mütter 14. Unter Wirbeltieren Modelle entwickeln extern, ist Xenopus mehr nützlich für die kraniofaziale Analyse als Zebrafisch, wie Xenopus Larven größer und leichter zu dissect und die Entwicklung von Gesichts-Region besser zugänglich zu Bildgebung als die entsprechende Region in Fisch. Darüber hinaus ist Xenopus evolutionär näher an den Menschen als Zebrafisch (~ 100.000.000 Jahre näher) 15. Schließlich in diesen Phasen sind Xenopus Kaulquappen transparent, und die gleichzeitige Expression von fluoreszierenden Proteinen oder Molekülen wird eine einfache Visualisierung der Entwicklung von Knorpeln zu ermöglichen. Wir gehen davon aus, dass dieser Ansatz wird es uns ermöglichen, schnell und effizient Testkandidat Moleküle in einem in vivo Modellsystem.
Protokoll
Teil 1A. Ausrüstung
Mikroskop: aufrecht Stereo-Binokular mit Low-Power-Ziel
- Spannung / Pulse Generator: BTX ECM 830 Square Wave Elektroporationssystem
- Pipette puller: P-87 Micropipette Puller (Sutter Instrument Company, CA)
- Manipulator: Grob-oder kombinierte Grob-und Fein je nach Zubereitung.
- Micropipette Inhaber: Fine Science Tools
- Elektrode: hausgemachte
- Elektroporation Kammer: homemade
L-förmige Elektroden:
- Cut 8 cm von hochreinem 0,4 mm Wolframdraht (Goodfellow) und bringen sich in der Mitte ein 1ml Spritze mit putty (wir verwenden Blu-Tack). Leave 4 cm Wolframdraht von der Spitze der Spritze und biegen Spitze in L-Form ausgesetzt, 1 cm vom Ende (Abb. 1A).
- Trim Spitze, so dass am Ende 0,5 mm misst in Länge. TSein Tipp ist die Elektrode Terminus.
- Run über Wolframdraht parallel zur Spritze und es verwenden, um die Elektrode Impulsgeber anschließen.
- Wiederholen Sie den Vorgang macht ein Paar von Elektroden.
- Bringen Elektroden Rechteckimpuls-Generator über DC-Kabel.
Elektroporation Kammer
- Den Boden 90 mm Schale mit ca. 5 mm ungiftige Knete.
- Füllen Gericht mit Elektroporation Medien.
- Mit Nr. 5 Uhrmacher-Pinzette schnitzen eine T-förmige Vertiefung (Abb. 2). Die lange gut gemessen werden sollte ~ 2 mm x 2 mm x 10 mm und die kurzen ~ 2 mm x 2 mm x 5 mm. Die Elektroporation Gericht kann gewaschen und wiederverwendet werden.
Teil 1B. Reagenzien
DNA oder geladene Makromoleküle
- Mikropipetten: 1 mm breit 4 "lang Borosilikatglas Kapillaren (WPI, TW100-F)
- Kulturmedien: Normal Amphibian Media (NAM)
- > 10 X Bestand: 1100 mM NaCl, 20mM KCL, 10 mM Ca (NO 3) 2 • 4H 2 O, 1 mM EDTA.
- Autoklaven und lagern bei 4 ° C.
- 1 X NAM: Verdünnen von 10x Lager, Puffer mit 0,1 mM NaHCO 3 und 0,2 mM Na 3 PO 4.
- Xenopus laevis Kaulquappen, Stufe 28
DNA-Präparation:
- Bereiten Expressionsplasmide über Standardprotokolle.
- Resuspendieren DNA auf eine Endkonzentration von 1 ug / ul in Nuklease freies H 2 0.
* Wir hatten Erfolg mit Vektoren, die einen starken CMV-Promotor, wie pCS2 + [16]. Für Abstammung Analyse, wir gehören in der Regel DNA, grün fluoreszierende Protein (GFP pCS2 +) bei einer Endkonzentration von 0,1 ug / ul. [DNA-Konzentrationen zwischen 0,1-3 ug / ul wurden ebenfalls getestet. Wir fanden, dass die Konzentrationen unterhalb von 0,8 ug / ul ineffizient markierten Zellen, während DNA-Konzentrationen von mehr als 2 g / m &u; l nicht verbessert Elektroporation Effizienz].
Morpholino Oligonukleotid Zubereitung:
(Hinweis:. MOs müssen fluoresceinated werden (3'-Carboxyfluorescein modifiziert) oder anderweitig gegen Gebühr)
- Resuspendieren Morpholino-Oligonukleotide (MOs) (GeneTools, www.genetools.com ) in einer Konzentration von 2 mM in Nuklease freies H 2 0.
- Hitze Aliquot der Stammlösung bei 65 ° C für 5 Minuten.
- Verdünnen, um eine Endkonzentration von 0,5 mM in Nuclease freies Wasser.
* 0,1-1mM MO-Lösungen getestet. 0,5 mM MO-Lösungen reichten für die Elektroporation von vielen mesenchymalen Zellen.
Mikropipetten
- Bereiten Mikropipetten aus Borosilikatglas Kapillaren (1 mm breit, 4 "lang, WPI-Nr. TW100-F). Verwenden Nadel puller zu Mikropipetten mit einem 8-12 mm langen Kegel und feine Spitze vorzubereiten.
- Crush-Spitze ~ 2 mmVon der Spitze mit einer Pinzette, die Schaffung eines zerklüfteten brechen.
Medien
- Incubation Medien: Bereiten Sie frischen 3 / 4 Normal-Amphibian Media (NAM) von 1x Lager. Add 0,025 mg / ml Gentamycin.
- Elektroporation Medien: wie oben, mit 0,1% Benzocain (Sigma, 06950).
2. Elektroporation
Micropipette Setup
- Füllen Mikropipette mit ~ 1 ul Injektionslösung.
- Sichere Mikropipette in Mikromanipulator und heften sich an Mikroinjektor (Picospritzer II).
- Angle Mikropipette bei 50 ° von der Tischplatte.
- Set Einspritzdruck bei 20 PSI.
- Kalibrieren Mikropipette zu 30 nl pro Puls zu injizieren.
Tadpole Vorbereitung
- Anesthetize Stufe 28 Xenopus Larven durch Inkubation in Elektroporation Medien für 5 Minuten.
- Transfer narkotisierten Kaulquappe in Elektroporation Kammer mit Elektroporation Medien gefüllt. Position Embryoinnerhalb der langen gut, so dass der Kopf in der T-Kreuzung mit dorsalen Seite nach unten und Bauchseite ausgesetzt ruht. Der Kopf sollte leicht im Vergleich zu den Schwanz angehoben werden.
- Mit einer Pinzette vorsichtig zu sichern Kaulquappe in gut mit den umliegenden Plastilin. (Hinweis:.. Wenn die Kaulquappen nicht gesichert ist, kann es zucken und Kontaktelektrode bei der Elektroporation In diesem Fall verwerfen die Kaulquappe als Kosmetiktücher schwer beschädigt wird)
Elektroporation
- Legen Sie Mikropipette Spitze unmittelbar hinter der Zement-Drüse und in Gesichts-Mesenchym.
- Inject 30 nl Lösung in Mesenchym.
- Retract Mikropipette.
- Schnell align Elektrodenspitzen parallel zum Kopf des Embryos (Abb. 3).
- Bewerben 8 50 ms, 20mV Rechteckimpulse.
- Retract Elektroden.
- Mit einer Pinzette vorsichtig Entlassung aus gut Kaulquappe und Transfer zum 3 / 4 NAM, 0,025 mg / ml Gentamycin.
- Kaulquappen können in 3 / 4 NAM, 0,025 mg / ml Übernacht inkubiert werdenight, oder länger.
- Screen-Embryonen für die effiziente Elektroporation durch Fluoreszenzmikroskopie nach 24 Stunden.
3. Repräsentative Ergebnisse:
Die Verwendung von fluoreszierenden Molekülen erlaubt eine einfache Screening von Embryonen elektroporiert. Abbildung 4 zeigt eine typische Charge von MO elektroporiert Kaulquappen ~ 12, 48 und 96 Stunden nach der Elektroporation mit 14,5 ° C inkubiert Mit Fluoreszenz-Mikroskopie kann MOs unmittelbar nach der Elektroporation visualisiert werden und bleiben für einige Tage nach der Elektroporation. Nach unserer Erfahrung ist die Fluoreszenz schwach erkennbar im Stadium 46 (ca. 5 Tage später). In den Knorpeln, sinkt dramatisch Fluoreszenz nach dem Beginn der Differenzierung (~ st 42), jedoch besteht MO Fluoreszenz stärker in andere Zelltypen wie der pharyngealen Endoderm. Die Fluoreszenzmikroskopie zeigt, dass Oligonukleotide in mehreren kraniofazialen Gewebe einschließlich Knorpel eingebaut werden. Oligonukleotid-Fluoreszenz ceine oft im Gewebe auf beiden Seiten des Kopfes sichtbar gemacht werden. Dies ist wahrscheinlich auf eine schnelle Diffusion der Injektionslösung während der lose kraniofazialen Mesenchym vor der Elektroporation.
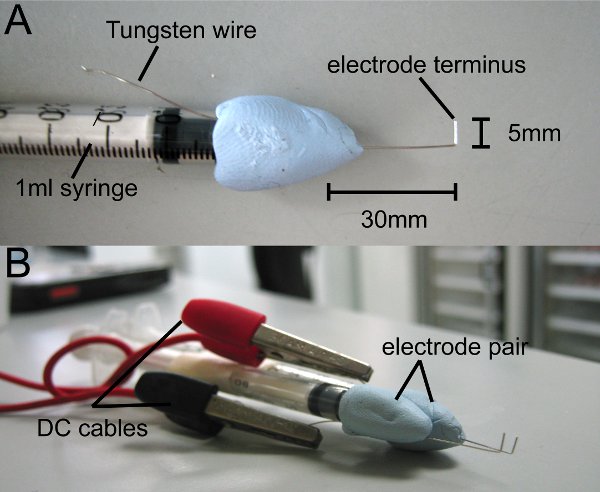
Abbildung 1 Homemade Elektroden. L-förmige Wolframdraht ist es, eine 1 ml Spritze mit nicht-toxischen oder Kitt befestigt. (A) Die Elektrode terminus misst 5 mm. (B) Befestigen Sie ein Paar von Elektroden, so dass die Enden parallel laufen. Die Elektroden sind an Impulsgeber von DC-Kabel angeschlossen.

Abbildung 2 Elektroporation Kammer. (A) 90 mm-Schale mit Plastilin gesäumt ist mit Medien und eine T-förmige Kammer mit Nr. 5 Uhrmacher-Pinzette geschnitzt gefüllt. (B) Die lange Seite misst 2 mm X 2 mm X10 mmwährend der kurzen misst 2 mm X 2 mm X 5 mm. Der Kopf des Embryos liegt in der T-Kreuzung, Bauchseite auf.
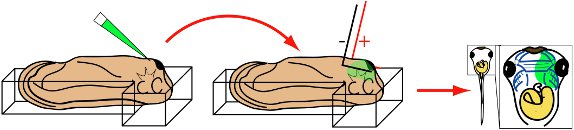
Abbildung 3 Schematische Darstellung der Elektroporation Verfahren. St. 28 Kaulquappe ist in Elektroporation Kammer platziert, Bauchseite auf. Mikropipette in Gesichts-Mesenchym zugrunde liegenden Zement Drüse eingefügt. Inject. Mikropipette wird entfernt und L-förmigen Elektroden sind parallel ausgerichtet flankierenden den Kopf. Wenden Sie acht 50 ms, 20 mV Rechteckimpulse. Retract Elektroden. Wachsen Kaulquappen zu wünschen Stufen. Visualisieren MOs oder GFP-Expression mittels Fluoreszenzmikroskopie.
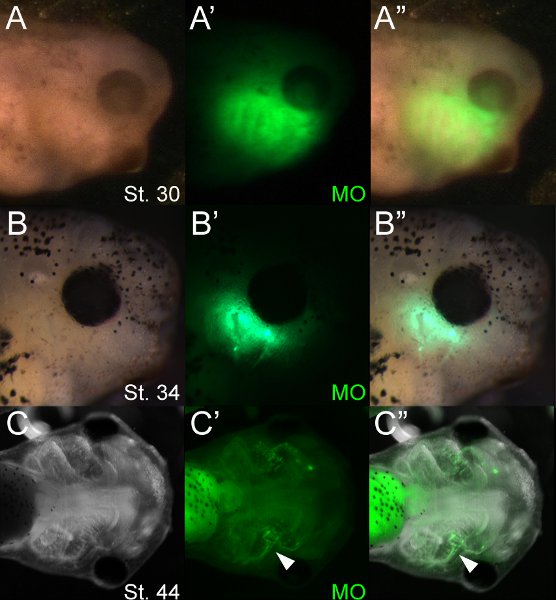
Abbildung 4 Vertreter Kaulquappen 12 (A), 48 (B) und 96 (C) Stunden nach der Elektroporation (Stufen 30, 34 bzw. 44). (A "-B") Fluorescent MO innerhalb kraniofazialen Mesenchym bei Hirsch visualisiert werdenES 30 und 34 Jahren. Fluoreszenz kann in Knorpel im Stadium 44 (Pfeilspitze, C'-C ") nachgewiesen werden. Der Darm ist sehr autofluoreszierenden.
Diskussion
In diesem Video haben wir die Machbarkeit der Elektroporation-vermittelte Gentransfer in die Gesichts-Mesenchym von Xenopus Kaulquappen nachgewiesen. Mit diesem Ansatz können wir umgehen frühen Entwicklungsstadium Einfluss der Manipulation von Gen-Funktion ermöglicht es uns, spezifische Gewebe zu späteren Zeitpunkten Ziel. Unsere Studien zeigen, dass heterogene Populationen von kraniofazialen mesenchymalen Zellen beeinflusst werden kann, so dass wir Abstammung elektroporiert Zellen sowie Zell-autonome Anforderungen für Proteine von Interesse zu untersuchen. In Kombination mit Live-Bildgebung können wir mit diesem Ansatz Genfunktion Studie über die Zeit, während der kraniofazialen Entwicklung. Dieses neuartige Verfahren hebt die Lenkbarkeit des Xenopus für das Studium der Organogenese. Wir gehen davon aus, dass diese Methode im Großen und Ganzen kann angepasst werden, um Morphogenese und Differenzierung von anderen Geweben sowie zu studieren.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt.
Danksagungen
Wir sind dankbar, dass Nancy Papalopulu und Boyan Bonev für die Unterstützung bei Xenopus Elektroporation. Wir danken auch Marc Dionne für die kritische Durchsicht, Jeremy Green und John Wallingford für hilfreiche Diskussionen und die Mitglieder des Liu-Labor für ihre Unterstützung. Diese Arbeit wurde durch Zuschüsse aus dem BBSRC (BB/E013872/1) und dem Wellcome Trust (081880/Z/06/Z) zu KJL finanziert.
Referenzen
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev. Cell. 20, 19-32 (2011).
- Haas, K. Single-cell electroporation for gene transfer in vivo. Neuron. 29, 583-591 (2001).
- Calegari, F. Tissue-specific RNA interference in post-implantation mouse embryos using directional electroporation and whole embryo culture. Differentiation. 72, 92-102 (2004).
- Drinjakovic, J. E3 ligase Nedd4 promotes axon branching by downregulating PTEN. Neuron. 65, 341-357 (2010).
- Falk, J. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC. Dev. Biol. 7, 107-107 (2007).
- Hewapathirane, D. S., Haas, K. Single Cell Electroporation in vivo within the Intact Developing Brain. J. Vis. Exp. (17), e705-e705 (2008).
- Kuriyama, S. Tsukushi controls ectodermal patterning and neural crest specification in Xenopus by direct regulation. of BMP4 and X-delta-1 activity. Development. 133, 75-88 (2006).
- Mende, M., Christophorou, N. A., Streit, A. Specific and effective gene knock-down in early chick embryos using morpholinos but not pRFPRNAi vectors. Mech. Dev. 125, 947-962 (2008).
- Neumann, E. Gene transfer into mouse lyoma cells by electroporation in high electric fields. Embo. J. 1, 841-845 (1982).
- Price, S. R. Regulation of motor neuron pool sorting by differential expression of type II cadherins. Cell. 109, 205-216 (2002).
- Grossin, L. Direct gene transfer into rat articular cartilage by in vivo electroporation. Faseb. J. 17, 829-835 (2003).
- Khoury, M. A comparative study on intra-articular versus systemic gene electrotransfer in experimental arthritis. J. Gene. Med. 8, 1027-1036 (2006).
- Takahashi, D. Down-regulation of cathepsin K in synovium leads to progression of osteoarthritis in rabbits. Arthritis. Rheum. 60, 2372-2380 (2009).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Wheeler, G. N., Brandli, A. W. Simple vertebrate models for chemical genetics and drug discovery screens: lessons from zebrafish and Xenopus. Dev. Dyn. 238, 1287-1308 (2009).
- Turner, D. L., Weintraub, H. Expression of achaete-scute homolog 3 in Xenopus embryos converts ectodermal cells to a neural fate. Genes. Dev. 8, 1434-1447 (1994).
Erratum
Formal Correction: Erratum: Electroporation of Craniofacial Mesenchyme
Posted by JoVE Editors on 6/28/2013. Citeable Link.
A correction was made to Electroporation of Craniofacial Mesenchyme. There was an incorrect unit used for the voltage.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten