Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
High-Throughput-Kristallisation von Membranproteinen mit dem Lipidische Bicellen Methode
In diesem Artikel
Zusammenfassung
Bicellen sind Lipid / amphiphile Mischungen, die Membranproteine (MPs) halten in einer Lipid-Doppelschicht, sondern verfügen über einzigartige Phase Verhalten, das High-Throughput-Screening ermöglicht durch Kristallisation Roboter. Diese Technik hat erfolgreich eine Reihe von hochaufgelösten Strukturen von prokaryotischen und eukaryotischen Quellen erzeugt. Dieses Video beschreibt Protokolle zur Erzeugung der Lipid-Bicellen Mischung unter Einbeziehung Abgeordneten in die Bicellen Mischung, die Einrichtung von Kristallisationen Studien (sowohl manuell als auch maschinell) und Ernte-Kristalle aus dem Medium.
Zusammenfassung
Membranproteine (MPs) spielen eine entscheidende Rolle in vielen physiologischen Prozessen wie Pumpen spezifische Moleküle durch die ansonsten undurchlässige Membran-Doppelschicht, dass alle Zellen und Organellen umgibt. Änderungen in der Funktion des Abgeordneten führen in vielen menschlichen Krankheiten und Störungen, daher bleibt ein komplexes Verständnis ihrer Strukturen eine entscheidende Ziel für die biologische Forschung. Allerdings bleibt die Strukturbestimmung der Abgeordneten eine große Herausforderung oft aus ihrer Hydrophobizität.
Abgeordnete haben erhebliche hydrophobe Regionen innerhalb der Doppelschicht eingebettet. Reinigungsmittel werden häufig verwendet, um diese Proteine aus der Doppelschicht erzeugt ein Protein-Detergenz Mizellen, die dann in ähnlicher Weise als lösliche Proteine manipuliert werden können aufzulösen. Traditionell gehen Kristallisation Studien mit einem Protein-Waschmittel-Gemisch, aber oft widerstehen Kristallisation oder erzeugen Kristalle von schlechter Qualität. Diese Probleme entstehen aufgrund derReinigungsmittel in der Lage ist, angemessen imitieren die Doppelschicht zu einer schlechten Stabilität und Heterogenität. Darüber hinaus das Waschmittel schirmt die hydrophobe Oberfläche des MP Reduzierung der Fläche für Kristall-Kontakte. Zur Umgehung dieser Nachteile Abgeordnete kann in Lipid-Medien, die eine bessere Simulation ihrer endogenen Umgebung kristallisiert werden, und hat vor kurzem zu einem de novo-Technik für MP Kristallisation.
Lipidische kubische Phase (LCP) ist ein dreidimensionales Lipiddoppelschicht durch ein vernetztes System von wässrigen Kanäle 1 eingedrungen. Obwohl Monoolein ist das Lipid der Wahl haben Lipide wie monopalmitolein und monovaccenin auch genutzt, um LCP 2 zu machen. Abgeordnete werden in das LCP, wo sie in drei Dimensionen und Futtermitteln Kristallkeime diffuse eingearbeitet. Ein großer Vorteil des LCP ist, dass das Protein in einer nativen Umgebung bleibt, aber die Methode hat eine Reihe von technischen Nachteilen einschließlich High viscosity (erfordert spezialisierte Einrichtungen) und Schwierigkeiten bei der Kristall-Visualisierung und Manipulation 3,4. Aufgrund dieser technischen Schwierigkeiten, verwendeten wir eine andere Lipid-Medium für die Kristallisation-Bicellen 5,6 (Abbildung 1). Bicellen sind Lipid / amphiphile Mischungen hergestellt, indem ein Phosphatidylcholin Lipid (DMPC) mit einem Amphiphil (CHAPSO) oder eine kurzkettige Lipid (DHPC) gebildet. Innerhalb der einzelnen Bicellen Disc erzeugen die Lipid-Moleküle eine Doppelschicht, während die amphiphile Moleküle Linie der apolaren Ecken für eine vorteilhafte Eigenschaften der beiden Doppelschichten und Waschmittel. Wichtig ist, dass unter ihrer Sprungtemperatur haben Protein-Bicellen Mischungen eine reduzierte Viskosität und sind in einer ähnlichen Weise wie Waschmittel-solubilisierten Abgeordnete manipuliert, so dass Bicellen kompatibel mit Kristallisation Roboter.
Bicellen wurden erfolgreich eingesetzt, um kristallisieren verschiedene Membranproteine 5,7-11 (Tabelle 1). Diese wachsende Sammlungvon Proteinen demonstriert die Vielseitigkeit des Bicellen zur Kristallisation sowohl alpha Helix und beta-Faltblatt Abgeordneten aus prokaryotischen und eukaryotischen Quellen. Aufgrund dieser Erfolge und der Einfachheit der High-Throughput-Umsetzung sollte Bicellen Bestandteil jedes Membranprotein Kristallographen Arsenal sein. In diesem Video beschreiben wir die Bicellen Methodik und bieten eine Schritt-für-Schritt-Protokoll für den Aufbau High-Throughput-Kristallisation Studien von gereinigtem MPs mit Standard-Robotik.
Protokoll
I) Vorbereitung einer Bicellen Lipid: Bicellen Basis Kristallisation von vier grundlegenden Schritten (Abbildung 2) besteht; ii) der Einbau von gereinigtem Protein in die Bicellen Medium; iii) Kristallisation Studien (manuell oder maschinell); amphiphile Mischung und iv) Visualisierung, Kristall-Extraktion und Einfrieren. Diese Schritte werden im Folgenden detailliert beschrieben
1. Vorbereitung der Bicellen
Amphiphile Kombinationen und über einen weiten Konzentrationsbereich: Bicellen können in einer Vielzahl von Lipid zu bilden. Daher ist Konditionen-eine anfängliche Zusammensetzung-Basis von früheren, erfolgreichen empfohlen (Tabelle 1). Die gelungene Mischung ist der DMPC: CHAPSO Bicellen Formulierung, die entweder gekauft werden kommerziell als vorgemischte ready-to-use Formulierung (siehe Tabelle der Reagenzien unten) oder vorbereitet in das Labor, wie beschrieben. CHAPSO Mischung bei einer 2,8:1 Molverhältnis: Bei dieser Übung werden wir 1 ml 35% DMPC vorzubereiten.
- abwiegen 0,26 g DMPC (Mr 677,9 g / mol), 0,09 g CHAPSO (Mr 630,9 g / mol) und fügen deionisiertem Wasser auf ein Endvolumen von 1,0 ml.
- Die Bicellen Prozentsatz zwischen 10% -40% mit variieren DMPC: CHAPSO Molverhältnis von 2.6-3.0:1 (Tabelle 1).
- Hinweis: Je höher die Konzentration der Bicellen desto schwieriger ist es mit dem Lipid was zu einer höheren Viskosität der Lösung auflösen. Allerdings kann eine konzentrierte Bicellen Formulierung vorteilhaft sein, wenn die Protein-Konzentration niedrig ist.
- Lösen des Lipid, um eine homogene Lösung zu erhalten erfordert erhebliche Anstrengungen, so dass dieser Schritt die meiste Zeit in Anspruch in der Bicellen Methode. Radeln Sie durch die folgenden Schritte, bis die DMPC ist völlig gemischt:
- Wärmen Sie die Mischung auf ~ 40 ° C mit einem Wasserbad oder einem Inkubator und Wirbel für ~ 1 Minute.
- Hinweis: Da mehrere Zyklen durchgeführt werden, die Erwärmung der Mischung in eine gelartige con ErgebnisKonsistenz macht es schwierig, Wirbel.
- Das Gemisch wird auf Eis und Wirbel für ein paar Minuten. Kühlung hilft verflüssigen die Lösung macht es einfacher, Wirbel.
- Hinweis: Da mehrere Zyklen durchgeführt werden, kann die Mischung beim Abkühlen trübe.
- Wiederholen Sie die oben aufgeführten Schritte (1.2.1 und 1.2.2), bis die Lipid vollständig gelöst ist.
- Hinweis: Dieser Vorgang kann mehrere Stunden dauern. CHAPSO Formulierung: Bicellen Bildung wird durch die Änderungen in Phasenverhalten des DMPC angegeben. Nach der Fertigstellung wird die Mischung ein klares Gel auf oder oberhalb der Raumtemperatur und einer viskosen Flüssigkeit auf Eis.
- Wärmen Sie die Mischung auf ~ 40 ° C mit einem Wasserbad oder einem Inkubator und Wirbel für ~ 1 Minute.
- Die Bicellen Mischung ist nun einsatzbereit und kann bei -20 ° C für eine langfristige Lagerung (bis 5 Jahre) gehalten werden. Wegen der Gefahr der Hydrolyse der Phospholipid-Kopfgruppe, ist es nicht ratsam, Bicellen bei Raumtemperatur zu lagern für längere Zeit.
2. Der Einbau von Protein in Bicellen
Die meisten MP Strukturen aus Bicellen erhalten wurden in DMPC kristallisiert: CHAPSO Bicellen Konzentration im Bereich von 2 bis 8% mit einer Proteinkonzentration von 8 bis 12 mg / ml (Tabelle 1). Wenn möglich, sollte Einstiegsbildern nutzen diese Richtlinien sowie die Konzentrationen können bei der Optimierung der Bühne zu sehen sein. Im Vergleich zu den LCP-Verfahren wird das Protein Aufnahme mit Bicellen ein einfacher Prozess (Abbildung 3), die am selben Tag sollte die Kristallisation Studien sein.
- Auftauen DMPC: CHAPSO Bicellen Mischung bei Raumtemperatur, bis die Phase Änderungen ein klares Gel.
- Hinweis: Mehrere Frost-Tauwetter wirkt sich nicht auf Bicellen Verhalten.
- Legen Sie die Mischung auf Eis zu verflüssigen und kurz vortexen, um eine homogene Bicellen Phase wieder herzustellen. Wenn auf Eis gelegt, kann die Mischung trübe.
- From diesem Punkt an, halten Sie die Bicellen Mischung und gereinigtes Protein auf Eis. Dies wird die Bicellen in einer flüssigen Phase macht es zugänglich Pipettieren zu halten.
- Fügen Sie die Bicellen Mischung auf das gereinigte Detergenz-solubilisierten Proteins in einem 1:4 (V / V)-Verhältnis.
- Zum Beispiel: 100 ul Protein-Bicellen Mischung wird durch Mischen von 80 ul Protein mit 20 ul Bicellen erhalten. Wenn die Protein-Konzentration beträgt 15 mg / ml und die Konzentration Bicellen beträgt 35%, wird dies ein Bicellen-integriert Proteinmischung mit einer Proteinkonzentration von 12 mg / ml und eine Bicellen Konzentration von 7% zu geben.
- Durch vorsichtiges Pipettieren den Inhalt auf und ab, bis die Lösung klar und homogen.
- Hinweis: Wenn Blasen erscheinen, eine schnelle Runde (30-60 Sekunden, 13000 rpm, 4 ° C) mit einer Tischzentrifuge können sie entfernen.
- Inkubieren Sie die Mischung auf Eis für mindestens 30 min, um vollständige Einbindung von Protein int förderno Bicellen. Die Protein-Bicellen Mischung ist nun bereit für die Kristallisation Studien.
3. Einrichten Kristallisation Studien
Weitere Lipid-Kristallisation Techniken wie die LCP erfordern eine spezielle Ausrüstung durch das Medium der hohen Viskosität, aber die einzigartige Phasenverhalten Bicellen ermöglicht die Umsetzung in praktisch jeder Standard-Kristallisation Format, einschließlich Robotik (Abbildung 3). Kristallisation Studien können entweder in hängenden oder sitzenden Tropfen Formate mit handelsüblichen Bildschirmen durchgeführt werden.
- Ob die Einrichtung Trays manuell oder mit Hilfe eines Roboters Kristallisation, zur Erhaltung des Protein-Bicellen Mischung auf Eis. Dies hält die Protein-Bicellen Mischung kalt und sicherzustellen, dass die Viskosität der Lösung ist minimal.
- Manuelle Kristallisation Trials - Mit einem Standard-Pipette, kann das Protein-Bicellen Mischung mit Reservoir-Lösung in der gleichen Weise vermischt werden als normal funktionierened für lösliche oder Reinigungsmittel-solubilisierten Membranproteinen.
- Hinweis: Bewahren Sie die Protein-Bicellen Mischung auf Eis während der Studien.
- Robotic Kristallisation Trials - Wir haben diese Studien für die Mosquito Kristallisation Roboter zugeschnitten sind, aber im Prinzip (nach dem gleichen Vorsichtsmaßnahmen) die Technik soll kompatibel mit allen Kristallisation Roboter. Die folgenden Tipps sollen sicherstellen, dass die Protein-Mischung Bicellen kühl bleibt und genau durch den Roboter pipettiert:
- Vorkühlung der Platte hält die Protein-Mischung Bicellen indem man sie auf Eis.
- Pipette das Protein-Bicellen Mischung in der Platte und weiter auf die Platte auf Eis halten. Diese Platte sollte der letzte Punkt, auf den Roboter vor Beginn der Ausführung zu gehen.
- Set-up das Reservoir-Fach und Kristallisation Deckel auf der Plattform 3 und 5 jeweils der Mücke Roboter.
- Die Platte enthält Protein-Bicellen Mischung auf Gleis 4der Mücke Roboter. Dadurch ist gewährleistet, das Protein-Bicellen Mischung ist der letzte, von dem Roboter aufgenommen und es wird sofort entlassen.
- Um zu verhindern, Heizung und erhöhter Viskosität, nicht zu verwechseln das Reservoir mit dem Protein-Bicellen Mischung.
- Bei der Durchführung von mehreren Bildschirmen, sofort wieder die Bicellen-Protein-Platte auf Eis für die Kühlung, sobald ein Durchlauf beendet ist.
- Tropfenvolumentensiometer und Verhältnis (Protein: Reservoir) kann als bei herkömmlichen Kristallisation Studien gewählt werden. Zum Beispiel können erste Kristall-Studien mit dem Mosquito Roboter eingerichtet werden mit 0,25 ul Protein: Bicellen Mischung plus 0,25 ul Reservoir.
- Inkubieren Sie die Kristall-Studien in einer Kammer bei 20 ° C. Die Temperatur ist ein guter Screening und Optimierung Parameter, da das Phasenverhalten Bicellen ist temperaturabhängig.
- Höhere Temperaturen verursachen die lamellare Phase 12 (Abbildung 1), die den Vorteil der Pre-Organisation hatdas Protein in Schichten. Temperaturen unter 20 ° C kann abgeschirmt werden, aber man sollte nicht unter 4 ° C, da dies die Lipide zu fällen führen über längere Zeiträume.
- In der gleichen Weise wie herkömmliche Kristallisation Studien sollten Bicellen Studien auf einer regulären Basis für Kristall-Optik und das Wachstum überwacht werden. Wir empfehlen die Schalen auf den 1. und 3. Tag nach dem Setup durch wöchentliche Kontrolle folgte überprüfen.
- Kristall-Optimierung durchgeführt werden kann mit Methoden routinemäßig für Waschmittel Kristalle einschließlich Grid-Screening, Additiv-Screening, wechselnde Temperaturen etc. Zusätzlich Bicellen Prozentsatz und Protein verwendet: Bicellen Verhältnis variiert werden kann. Darüber hinaus können Bicellen mit spezifischen Lipiden, die notwendig für die Stabilität des Proteins oder Funktion kann dotiert sein.
4. Visualisierung, Kristall-Extraktion und Gefrieren
Seit Kristall Studien mit dem Protein-Mischung Bicellen eine Viskosität ähnlich Protein-Detergenz Tropfen-, Visualisierungs-und Kristall-Extraktion ist Routine und wird wie herkömmliche Set-ups durchgeführt.
- Visualisierung: Im Gegensatz zu LCP Medien, erfordert oft hochwertige Beleuchtung unter normalen und polarisiertem Licht für Kristall-Erkennung, Visualisierung wird nicht durch Bicellen behindert. Farbige sowie farblos Proteinkristall Tropfen können leicht analysiert werden mit Standard-Mikroskope und keine besondere Ausrüstung erforderlich ist.
- Bicellen, wie andere Lipid-Medien neigen dazu, einen hohen Prozentsatz der Fehlalarme zu erzeugen. Ein UV-Mikroskop hilft enorm bei der Differenzierung von Protein aus Salzkristallen (Abbildung 4).
- Extraktion und Gefrieren: Crystal Gewinnung und Einfrieren ist relativ einfach und erfordert keine Auflösung der umgebenden Bicellen Medien. Darüber hinaus bietet die Bicellen Phase selbst einige moderate Kryo-Schutz.
5. Repräsentative Ergebnisse:
nt "> Es dauert in der Regel 2-3 Tage nach Kristallen zu erscheinen und etwa eine Woche oder mehr für sie, um ihre maximale Größe wachsen. Dies war der Fall für Bakteriorhodopsin und Maus voltage-dependent Anion Channel 1 (mVDAC1) Kristalle 4,8 . Für andere Membranproteine kann es mehrere Wochen dauern, für das Kristallwachstum, so ist es wichtig, weiterhin die Überwachung der Kristall-Studien weit über die ersten Wochen.Wie bei anderen fetthaltigen Medien neigen Bicellen zu Formen, die zu sein scheinen kristalline bilden können. Es wurde auch beobachtet, dass sie einen höheren Anteil an Salz und Spülmittel Kristalle führen. Ein UV-Mikroskop, das Tryptophan-Fluoreszenz detektiert kann erheblich dazu beitragen, zu eliminieren, wie nicht-proteinhaltigen Fehlalarme. Abbildung 4 zeigt Lipid Formen, Salz und Protein-Kristalle als im sichtbaren und UV-Licht betrachtet, um zu unterscheiden die verschiedenen Ergebnisse, die beobachtet werden können.
83fig1.jpg "/>
Abbildung 1. Bicellen Schematische. Bicellen sind von einer Doppelschicht Lipid-Molekül wie DMPC (blau) und ein Amphiphil wie CHAPSO (grün), welche die hydrophoben Kanten der Doppelschicht schützt zusammen. Da die Temperatur erhöht wird, durchlaufen Disc-like Bicellen eine Phasenumwandlung in eine perforierte Lamellen-Blatt 12.
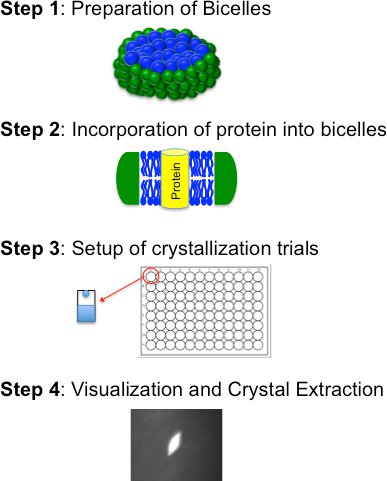
Abbildung 2. Flowchart für die Bicellen Kristallisationsverfahren, in der die vier grundlegenden Schritten.

Abbildung 3. Kristall Studien set-up schematisch. Gereinigtes Detergenz-solubilisierten Membranproteinen können direkt mit Bicellen auf Eis durch einfaches Pipettieren den Inhalt vermischt. Nach Inkubation der Protein / Bicellen Mischung auf Eis ~ 30 Minuten, Kristallisation Studienkann so eingerichtet werden mit einem beliebigen Standard-Format, einschließlich Robotik.

Abbildung 4. Visualisierung von Kristall-Studien. Sichtbares Bild (oben) und UV-Bild (unten) von (A) nadelförmige Kristalle in einem Salz-only Zustand beobachtet. Keine Fluoreszenz kann von den Kristallen nachgewiesen werden, ein Hinweis auf falsch positive. (B) stabförmige Kristalle gebildet in einem MPD Zustand. Der Kristall fluoresziert schwach, aber erwies sich als nicht-proteinhaltigen mit Röntgenbeugung. (C) Crystal etwa vier Wochen nach dem Einrichten Studien beobachtet. Die starke Fluoreszenz unter UV-Licht bestätigt es ist ein Protein-Kristall.
| Nein. | Protein | Quelle | Bicellen Formulation | Protein Concentratiauf | Detergens 1 | Auflösung (A) | Referenz |
| 1 | Bacteriorhodopsin 2 | Halobacterium salinarum | 8% DMPC: CHAPSO (2,8:1) | 8 mg / ml | 2,0 | Faham und Bowie, 2002 | |
| 8% DTPC: CHAPSO (3:1) | 8 mg / ml | 1,8 | Faham et al., 2005 | ||||
| 2 | β2-adrenergen Rezeptor / Fab-Komplex | Homo sapiens | 8,3% DMPC: CHAPSO (3:1) | 10 mg / ml | DDM | 3.4/3.7 | Rasmussen et al., 2007 |
| 3 | Voltage-dependent Anion Kanal 1 | Mus musculus | 7% DMPC: CHAPSO (2,8:1) | 12 mg / ml | LDAO | 2,3 | Ujwal et al., 2008 |
| 4 | Xanthorhodopsin | Salinibacter ruber | 4,2% DMPC, 5% NM | 4 mg / ml | DDM | 1,9 | Luecke et al., 2009 |
| 5 | Rhomboid Protease | Escherichia coli | 2% DMPC: CHAPSO (2,6:1) | 9 mg / ml | Nonyl Glucosid | 1,7 | Vinothkumar, 2011 |
1-Waschmittelformulierungen für Membran-Protein-Aufreinigung verwendet
2 native Lipide aus Purpurmembranen kann entlang während der Reinigung durchgeführt werden
Tabelle 1. Zusammenfassung der Kristallisationsbedingungen für Membran-Protein-Strukturen gelöst mit Bicellen.
Diskussion
Bicellen sind eine einzigartige Lipid-Medien, die eine native Doppelschicht-ähnliche Umgebung bieten und gleichzeitig verhalten, als ob durch Detergenzien solubilisiert. Diese Eigenschaft verleiht Bicellen einen entscheidenden Vorteil gegenüber anderen Lipid-basierte Kristallisationsverfahren, da es keine Lernkurve oder spezielle Geräte für diese Technik erforderlich. Sobald Bicellen verfügbar sind, weder zu kommerziellen oder vorbereitet in das Labor, können sie direkt gemischt mit gereinigtem Protein und von die...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir möchten Drs danken. James Bowie und Salem Faham für die technische Expertise und Beratung über die Bicellen Methode und Dr. Aviv Paz für hilfreiche Diskussionen. Wir erkennen Le Du für experimentelle Unterstützung. Rachna Ujwal hat finanzielles Interesse an MemX Biosciences LLC, die jedoch nicht unterstützen diese Arbeit. Diese Arbeit wurde zum Teil durch Zuschüsse der NIH (RO1 GM078844) unterstützt.
Materialien

Referenzen
- Landau, E. M., Rosenbusch, J. P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins. Proceedings of the National Academy of Sciences. 93, 14532-14535 (1996).
- Caffrey, M., Lyons, J., Smyth, T., Hart, D. J. Chapter 4 Monoacylglycerols: The Workhorse Lipids for Crystallizing Membrane Proteins in Mesophases. Current Topics in Membranes. 63, 83-108 (2009).
- Nollert, P., Landau, E. M. Enzymic release of crystals from lipidic cubic phases. Biochem. Soc. Trans. 26, 709-713 (1998).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Faham, S., Bowie, J. U. Bicelle crystallization: a new method for crystallizing membrane proteins yields a monomeric bacteriorhodopsin structure. J. Mol. Biol. 316, 1-6 (2002).
- Faham, S., Ujwal, R., Abramson, J., Bowie, J. U. Chapter 5 Practical Aspects of Membrane Proteins Crystallization in Bicelles. Current Topics in Membranes. 63, 109-125 (2009).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14, 836-840 (2005).
- Luecke, H. Crystallographic structure of xanthorhodopsin, the light-driven proton pump with a dual chromophore. Proceedings of the National Academy of Sciences. 105, 16561-16565 (2008).
- Ujwal, R. The crystal structure of mouse VDAC1 at 2.3 Å resolution reveals mechanistic insights into metabolite gating. Proceedings of the National Academy of Sciences. 105, 17742-17747 (2008).
- Vinothkumar, K. R. Structure of rhomboid protease in a lipid environment. J. Mol. Biol. 407, 232-247 (2011).
- Rasmussen, S. G. F. Crystal structure of the human [bgr]2 adrenergic G-protein-coupled receptor. Nature. 450, 383-387 (2007).
- Prosser, R. S., Hwang, J. S., Vold, R. R. Magnetically aligned phospholipid bilayers with positive ordering: a new model membrane system. Biophys. J. 74, 2405-2418 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten