Method Article
Intrakranielle Implantation mit anschließender 3D In Vivo Bioluminescent Imaging von Murine Gliome
In diesem Artikel
Zusammenfassung
Intrakranielle Implantation von GL261-Zellen in C57BL / 6 Mäusen produziert maligne Gliome, dass viele Merkmale der menschlichen Glioblastoma multiforme zu rekapitulieren. Wir verwendeten GL261-Zellen stabil exprimiert Luziferase, damit wir verwenden In vivo Bildgebung zu folgen Tumorprogression. Die Operation und 3D In vivo Bildgebung demonstriert.
Zusammenfassung
Die Maus Gliom 261 (GL261) als in-vivo-Modell erkannt, dass rekapituliert viele der Funktionen des menschlichen Glioblastoma multiforme (GBM). Die Zelllinie wurde ursprünglich von intrakraniellen Injektion von 3-Methyl-cholantrene in eine C57BL / 6 syngenen Mausstamm 1 induzierte, deshalb immunologisch kompetenten C57BL / 6 Mäuse verwendet werden kann. Während wir GL261 verwenden, können das folgende Protokoll für die Implantation und Überwachung jeder intrakraniellen Maus-Tumor-Modell verwendet werden. GL261-Zellen wurden stabil exprimieren, Leuchtkäfer-Luciferase (GL261-luc) entwickelt. Wir schuf auch die helleren GL261-luc2 Zelllinie durch stabile Transfektion der luc2 Gen aus dem CMV-Promotors exprimiert. C57BL/6-cBrd/cBrd/Cr Mäusen (Albino-Variante der C57BL / 6) von der National Cancer Institute, Frederick, MD wurden verwendet, um das Licht Dämpfung durch schwarze Haut und Fell zu eliminieren. Mit dem Einsatz von Albino C57BL / 6 Mäusen, in-vivo-Bildgebung mit dem IVIS Spectrum in vivo imAltern ist ab dem Tag der Implantation (Caliper Life Sciences, Hopkinton, MA) möglich. Die GL261-luc und GL261-luc2 Zelllinien zeigten die gleichen In-vivo-Verhalten der Eltern GL261-Zellen. Einige der gemeinsamen histologischen Merkmale in der menschlichen GBM und das Maus-Modell beinhalten: Tumor-Nekrose, pseudopalisades, Neovaskularisation, Invasion, Hyperzellularität und Entzündungen 1.
Vor der Implantation Tiere wurden durch eine intraperitoneale Injektion von Ketamin (50 mg / kg), Xylazin (5 mg / kg) und Buprenorphin (0,05 mg / kg), in einem stereotaktischen Apparat und einen Einschnitt gelegt betäubt wurde mit einem Skalpell über die aus kranialen Mittellinie. Ein BOHRLOCHRESERVOIR war 0.1mm posterior zum Bregma und 2,3 mm nach rechts von der Mittellinie aus. Eine Nadel wurde bis in eine Tiefe von 3mm und zurückgezogen 0.4mm bis zu einer Tiefe von 2,6 mm eingesetzt. Zwei ul der GL261-luc oder GL261-luc2 Zellen (10 7 Zellen / ml) wurden im Verlauf von 3 Minuten infundiert. Die BOHRLOCHRESERVOIR wurde geschlossenmit bonewax und der Schnitt genäht.
Nach stereotaktische Implantation der Biolumineszenz-Zellen sind ab dem Tag der Implantation nachweisbar und der Tumor kann unter Verwendung des 3D-Bildrekonstruktion Merkmal der IVIS Spectrum Instrument sein. Tiere erhalten eine subkutane Injektion von 150μg Luciferin / kg Körpergewicht 20 min vor der Bildgebung. Tumorlast wird unter Verwendung bedeuten Tumor Biolumineszenz im Laufe der Zeit. Tumor-tragende Mäuse wurden täglich auf Morbidität beurteilen beobachtet und wurden eingeschläfert, wenn einer oder mehrere der folgenden Symptome vorhanden sind: Lethargie, das Versagen der ambulate, gekrümmte Haltung, das Versagen der Bräutigam, Anorexie was bei> 10% Gewichtsverlust. Die Tumore wurden offensichtlich in all der Tiere bei der Obduktion.
Protokoll
1. Cell Culture
- Die GL26 Zelllinie wurde von der Division of Cancer Treatment und Diagnose (DCTD) National Cancer Institute (NCI), Frederick, MD erhalten. Zur Erleichterung der eine quantitative Messung der Tumor Wachstumsrate GL261-Zellen wurden Biolumineszenz mit der Lentiphos HT-System (Clontech Laboratories, Inc., Mountain View, CA) mit dem Lenti-X HT Packaging Mix (Clontech Laboratories, Inc.) und der FUW- GL-Plasmid (ein großzügiges Geschenk aus dem Labor von JB Rubin, MD, PhD). Die Zellen wurden in Dulbecco modifiziertem Eagle-Medium (DMEM) mit 10% Tetracyclin-freien fötalem Kälberserum (; Clontech Laboratories, Inc. FCS) gehalten. GL261-Zellen wurden ebenfalls stabil mit dem Gen für luc2 mit dem pGL4.51 [luc2 / CMV / Neo]-Vektor (Promega Corp, Madison, WI) und FuGENE 6 Transfektionsreagenz (Roche Applied Science, Indianapolis, IN) folgende Bedingungen festgelegt durch transfizierte des Herstellers. Die luc2 Gen ist ein Codon optimierten Version von firefly luciferase, dass eine wesentlich höhere Lichtausbeute als die Standard-luc-Gen liefert. Stabile Transfektanten wurden ausgewählt und in DMEM Medium mit 10% FCS und 100 ug / ml Geneticin (G418, Invitrogen Corp, Carlsbad, CA) erhalten.
- Vor der Implantation des gezüchteten Zellen werden durch trypsinzation geerntet, gewaschen und wieder DMEM ohne Serum und in DMEM ohne Serum in einer Konzentration von 1 x 10 7 Zellen / ml.
2. Chirurgie Setup 2
- Eine sterile Umgebung ist im gesamten Operation beibehalten, einschließlich aller chirurgischen Instrumente, Zubehör, Handschuhe, Tücher, etc..
- Zehn Wochen alte C57BL/6-cBrd/cBrd/Cr (Albino C57BL / 6) Mäuse sind aus dem National Cancer Institute in Frederick Tierproduktion Programm gekauft und bei einem durchschnittlichen Gewicht von 20 Gramm (NCI, Frederick, MD).
- Die Tiere werden narkotisiert durch intraperitoneale Injektion von Xylazin (5 mg / kg), Ketamin (50 mg / kg) und Buprenorphin (0,05 mg / kg). Zue Prise getan wird, um sicherzustellen, dass das Tier ausreichend betäubt vor der Operation begonnen wird. Movement (wenn auch geringe) jeder Teil des Tieres ist ein Indiz für eine Absenkung des Niveaus der Anästhesie. Tiere sofort zusätzlich 3,3 mg / kg Xylazin und 26,6 mg / kg Ketamin gegeben. Die Körpertemperatur aufrechterhalten wird mit einer Lampe und sterile Wundauflagen für den Körper.
- Sobald das Tier richtig betäubt, werden sie auf den gepolsterten Bett der stereotaktischen Fördergerüst (Modell 900 Small Animal Stereotaktische, David Kopf Instruments) [Abb. 1] platziert.
- Eine kleine Menge (4.1 inch) von AKWA Tränen Ophthalmic Schmiermittel Salbe wird über die Hornhaut aufgetragen.
- Das Tier ist in der stereotaktischen Rahmen, indem Sie das Maul des Tieres (indem Sie Ihren Zeigefinger und Daumen auf der ganzen Tieres Kiefer) und schieben Sie die oberen Schneidezähne in die Vertiefung in der stereotaktischen Rahmen befestigt. Die Klemme wird angezogen, um den Kopf des Tieres in das Headset sicher dafür sorgen, dass the Kopf ausgerichtet ist und die Augen sind zentriert, so dass Sie sicher, jedoch nicht mit Gewalt auf den Kopf des Tieres ausüben.
- Die O 2-Schlauch ist unten in der Nähe des Tieres Nasenlöcher verklebt. Oxygen Durchflussmenge beträgt 0,5 l / min.
- Der untere Rücken und Schwanz ist bis auf die stereotaktische Bett zu hüten, Atmung Kompromiss abgeklebt.
- Die Operationswunde Website wird rasiert. Povidin-Jod-Swab Sticks verwendet werden, um den Bereich zwischen den Augen zurück, um den Bereich zwischen den Ohren mit Jod zu waschen, so dass Sie sicher, dass das Jod nicht in die Augen des Tieres zu tropfen.
- Die Zellen werden für die Implantation unmittelbar vor der Operation und bereit sind, regelmäßig gemischt, um sicherzustellen, dass sie sich nicht absetzen.
- A 10 ul, 50 mm World Precision Instruments (WPI), Sarasota, FL, Spritze mit 26 Gauge abgeschrägte Nadel mit der Zelle Inokulum geladen. Wenn die Zellen miteinander verklumpt sein scheinen kann es notwendig sein, um die Spritze zu laden.
- Die 10 ul Spritze wird dann in den UMP3-1 Ultram platzierticroPump Mikro-Injektor (WPI, Sarasota, FL).
3. Intrakranielle Implantation 2
- Der Hautschnitt erfolgt über eine Größe 15 Skalpell und Hakenpinzette. Ein 10-15 mm Schnitt längs von zwischen die Augen des Tieres gemacht, und sich dadurch das Tier die Ohren Freilegung der Bregma (Kreuzung der sagittalen und Koronarnaht an der Oberseite des Schädels). Seien Sie sicher, dass zur Identifizierung der Bregma denn es kann leicht mit dem Sinus-Bereich, der distal der Bregma [Abb. 2] ist verwechseln.
- Nachdem das Tier sediert es erhält eine intra-incisional Injektion von 0,25% (2,5 mg / ml) Bupivacain.
- Ein BOHRLOCHRESERVOIR beträgt 0,1 mm posterior zu Bregma und 2,3 mm nach rechts von der Mittellinie aus durch langsames Drehen einer 16-Gauge-1 ½-Zoll-Nadel mit der Hand, die Anwendung wenig Druck auf die Nadel, während Drehen, bis der Schädel eingedrungen und das Gehirn ausgesetzt ist.
- Die Kanüle wird in die Position bewegt mit dem Microdrive stereotactic Spritze, bis diese gerade berührt die Hirnoberfläche. Von dieser Position aus wird die Nadel in das Gehirn zu einer Tiefe von 3 mm fortgeschritten und hielt in Platz für 3 Minuten.
- Die Nadel ist .4 mm bis zu einer Tiefe von 2,6 mm unter der Oberfläche des Gehirns entzogen, wodurch eine kleine Tasche, wo die Zellen infundiert werden. Es ist an dieser Stelle optional ein Röntgenbild der Nadel in das Tier zu ergreifen, um eine ordnungsgemäße Platzierung und Tiefe sorgen.
- Die Zellsuspension wird über 3 Minuten mit dem Mikro-Injektor Set auf ein Volumen von 2000 nL (2 mL) mit einer Infusionsgeschwindigkeit von 667 Nl / min infundiert.
- Die Nadel ist in Platz für 2 Minuten, um das Auslaufen von der Website der Infusion zu verhindern links.
- Die Nadel wird langsam vollständig zurückgezogen.
- Die BOHRLOCHRESERVOIR ist mit Knochen Wachs mit einem Penfield Dissektor gefüllt.
- Der Schnitt wird vernäht mit einem 4:0 (1,5 metric) Vicryl Naht machen, dass keine großen Lücken in der Haut verbleiben. Vicryl ist ein Nahtmaterial, dass aufzulösens, und daher Nähte müssen nicht entfernt werden, wenn der Schnitt geheilt werden.
- Nach der Operation werden die Tiere in einem Käfig unter eine Wärmelampe, die auf die gewünschte Höhe eingestellt ist, dass die untere Fläche des Käfigs zu 30 ° C erwärmen platziert Als die Tiere vollständig wach sind (wie von der normalen Bewegung in den Käfig beurteilt) sind sie zu gruppieren Gehäuse zurück. Oral Ibuprofen ist ihr Trinkwasser über 5 Tage nach der Operation aufgenommen. 100 mg der Kinder-Ibuprofen (100mg/5ml) ist ein Standard 473 ml Nagertränke aufgenommen. Die Tiere werden täglich beobachtet und abgebildet und wog alle 3 Tage. Zwei Wochen nach der Implantation Beobachtung ist es, zweimal pro Tag erhöht. Die Tiere werden eingeschläfert, wenn sie Anzeichen von schlechter Gesundheit, die gekrümmte Haltung, eingeschränkter Mobilität und sichtbaren Verlust an Körpergewicht (≥ 20%) gehören zu zeigen. Diese Symptome sind einer veröffentlichten Antwort auf den Tumor und sie reproduzierbar erscheinen ca. 1 Tag vor dem Tod durch den Tumor.
4. In vivo Biolumineszenz Imaging 3
- Starten Sie die [Living Image]-Software.
- Die IVIS Imaging System wird durch Anklicken des [Initialize IVIS System]-Taste auf der unteren rechten Seite des Control Panels initialisiert.
- Wählen Sie die [Leuchtende] Imaging-Modus auf der oberen linken Seite des Control Panels.
- Zur Bestimmung der optimalen Zeitpunkt der Bildgebung nach Luciferin-Injektion wird eine kinetische Untersuchung notwendig ist [Abb. 3]. Diese Beschreibung gilt für Glühwürmchenluciferase;
- Inject 10 &mgr; l / g Körpergewicht von D-Luciferin firefly (15mg/ml in PBS; Caliper Life Sciences Katalog XR-1001 oder ein ähnliches Produkt von einem anderen Anbieter) in das Tier, wie unten beschrieben.
- Warten Sie 3 Minuten, und dann betäuben die Maus, indem Sie sie in das Gas Anästhesie Kammer (2% Isofluran-Gas in O 2).
- Schalten Sie den Gas-Narkose, um die Kammer und öffnen Sie die Anästhesie-Ventil und das Vakuum auf der IVIS vielfältig. Anschließend wird der sedierten Tiervon der Temperatur gesteuert Imaging-Plattform, so dass Sie sicher, dass die Maus Nasenloch richtig in der Gas-Narkose vielfältigen platziert. Das erste Bild sollte in etwa 5 Minuten nach dem Luciferin Injektion ergriffen werden. Bis zu 5 Tieren kann zu einer Zeit in der IVIS Spectrum Instrument abgebildet werden. Wenn weniger als 5 Tiere abgebildet sind, ist es möglich, die ungenutzten Verteiler (s)-Stecker auf Isofluran-Gas zu sparen.
- Weiter zu nehmen Bilder alle 3 Minuten, indem eine Sequenz von bis zu einer Stunde auf eine kinetische Kurve für Luciferin Ausdruck zu erzeugen.
- Klicken Sie auf das [Sequence Setup]-Taste auf dem Bedienfeld.
- Der Sequenz-Editor angezeigt wird.
- In dem Bedienfeld die Einstellungen für das erste Biolumineszenz Bild in der Sequenz.
- Wir empfehlen Ihnen, mit Medium Binning.
- Wir empfehlen auch Auto-Exposure, um die optimale Belichtungszeit zu ermitteln.
- Wählen Sie die [Pause]-Taste in der Reihenfolge Editor einend eine Verzögerung von 3 Minuten zwischen jeder Aufnahme.
- Klicken Sie auf [Add] in der Sequenz-Editor. Acquisition Parameter werden dann in die Tabelle eingefügt.
- Wiederholen Sie Schritt 4 für jedes Bild in der Sequenz.
- Sobald die Kurve aufgebaut ist, kann die optimale Belichtungszeit, indem die Signalstärke (Intensität) als Funktion der Zeit bestimmt werden. Bild Tieren zum Zeitpunkt der höchsten in vivo Photonen zählen, um die stärksten und genaues Signal zu bekommen.
- Frühe Experimente verwendet intraperitoneal (ip) Injektion von Luciferin, aber ip Injektionen gelegentlich führte zeitweise Ergebnisse zeigen, wenig bis gar keine Biolumineszenz in den Tumor. Wir stellten die Hypothese, dass die gelegentliche zufällige Fehlen des Signals durch die Lieferung der Luciferin, den Darm oder anderen inneren Organen war. Wir begannen daher zur subkutanen (sc) Injektionen Luciferin verwenden und sah mehr Bildgebung Reproduzierbarkeit [Abb. 3].
- ZwanzigMinuten nach sc Injektion werden die Tiere betäubt, indem sie sie in eine Kammer mit 2% Isofluran-Gas in O 2, bis sie nicht mehr reagiert werden.
- Die narkotisierten Tier (e) sind die bildgebenden Kammer verschoben. Augensalbe sollte für die kinetische Untersuchung wegen der Länge der Bildgebung verwendet werden. Es ist nicht für die anderen bildgebenden Verfahren erforderlich, da sie nur von kurzer Dauer sind.
- Das Bild wird bei mittlerer Binning mit einer 5 Minuten Einwirkzeit erworben. Die automatische Übernahme Option kann auch verwendet werden.
- Wenn das Signal gesättigten und / oder Ohnmacht bei mittlerer Binning können Binning oder Belichtungszeit eingestellt werden.
- Die Programmdateien und die anschließende Bild Kommentare sind in dem Computer des Benutzers Verzeichnis gespeichert.
5. 3D-Imaging 3
- Klicken Sie auf das [Imaging Wizard] in den [Sequence Setup]-Fenster der Systemsteuerung.
- Wählen Sie die [Biolumineszenz] Imaging-Modus auf dem Imaging-Assistenten zu starten Bildschirm und click [Next].
- In der "Biolumineszenz - DLIT" Fenster der Imaging-Assistenten wählen Sie die [Firefly] Reporter-Sonde. Die Emission / Anregung des ausgewählten firefly Quelle Spektrum wird mit den sechs entsprechenden Filter Selektionen erworben werden angezeigt.
- Der letzte Bildschirm wird mit Standard-Optionen, Auto exposure Aufnahmeparameter und des Field of View C. Standardeinstellungen funktionieren sehr gut zählen erscheinen, aber diese Einstellungen können bei Bedarf geändert werden.
- Klicken Sie auf [Weiter] und die Sequenz-Editor-Fenster wird mit der Sequenz von sechs Spektralbereichen bei 20 nm breite Filter (560 nm, 580 nm, 600 nm, 620 nm, 640 nm und 660 nm) bestückt werden. Drücken Sie [Acquire Sequence]. Der erste Filter (560 nm) wird eine strukturierte Lichtmuster mit einem Laser Galvanometer zur Oberflächentopographie zu etablieren.
- Wählen Sie die [Topographie] Registerkarte in der Tool-Palette. Oberflächenglättung kann zur Berücksichtigung etwaiger spitzen Winkel in den Wiederaufbau geschaffen angewendet werden. DieStandardmäßig niedrigen Glättung wird empfohlen.
- Klicken Sie auf [Create] und die Tomographie-Analyse wird angezeigt. Zeichnen Sie einen Crop-Box, die das ganze Tier gehören und klicken Sie dann auf [Weiter].
- Der Schwellwert wird als lila Maske über den ausgewählten Bereich angezeigt werden. Die Maske sollte automatisch auf das Foto des Tieres angepasst werden. Wenn nötig, passen Sie die Schwelle der Maske, um mehr angemessen fit die Umrisse des Tieres.
- Klicken Sie auf [Fertig] und die rekonstruierte Netz erscheint. Die Rekonstruktion kann dann in der Registerkarte Ergebnisse gespeichert werden.
- Nach der Gründung des Tieres Oberflächentopographie, die [DLIT 3D-Rekonstruktion] gehen Drop-Down auf der Tool-Palette.
- Unter dem [Analyze] Registerkarte wählen Sie alle sechs Wellenlängen für den Wiederaufbau durchzuführen. Deaktivieren Sie Bilder, die gesättigte Pixel oder zählt unter 600 ergab. Lassen Sie die Einstellungen im [Parameter] Registerkarte als Standard.
- Unter [Eigenschaften] klicken, sollten "Muscle" als Standard-Wahl für börsennotierte werdenr Tissue Eigenschaften, und "Firefly" sollte als Quelle Spektrum aufgeführt werden.
- Klicken Sie auf [Rekonstruieren] unter der Registerkarte Analysieren und die 3D-Rekonstruktion des Tieres Oberfläche und die entsprechende Rekonstruktion der Signalquelle sollte erscheinen [Abb. 4].
- Um zu bestimmen, Signal Lage und Intensität, wählen Sie die Voxel-Taste auf der 3D-Registerkarte der Tool-Palette.
- Zeichnen Sie ein Quadrat um alle angezeigten Voxel und die gesamte Fluss-Messungen ist in der Unterseite des Volumens Registerkarte angezeigt.
- Klicken Sie auf [Center of Mass], um das Signal Standort der ausgewählten Voxel zu identifizieren. Koronare, sagittale und transaxial Scheiben des Tieres erscheint und mit der [Measurement Cursor-Anzeige] der Abstand von der Tier-Oberfläche, die Voxel-Center kann gemessen werden.
- Bitte beachten Sie die Lebens-Image Software Benutzerhandbuch für weitere Informationen über Co-Registrierung der Orgel Atlanten und andere erweiterte Funktionen.
6. Data Analyse 3
- Nachdem das Bild erfasst und gespeichert, Zugriff auf die Programm-Datei durch Klicken auf die Schaltfläche [Durchsuchen] und wählen Sie die Datei.
- Die Bildinformationen können unter [View] zu finden → [Bildinformationen].
- Die Intensität des Signals kann durch Auswahl der Region Of Interest (ROI) [ROI Tools]-Taste quantifiziert werden. Achten Sie darauf, das Bild unter der [Photon]-Modus wird durch Auswahl von "Photon" auf der Dropdown-Liste auf der linken oberen Ecke des Bildes Bedienfeld analysiert.
- Wählen Sie die [Messung ROI]-Taste aus dem "Typ" Dropdown-Liste. Wählen Sie den ROI Form von Interesse; Optionen sind Kreis, Quadrat, und oder Gitter. Decken alle Bereiche der Intensität auf dem aufgenommenen Bild.
- Der ROI Position ist, indem Sie den ROI Form Auswahl der Region mit dem Biolumineszenz-Signal gesetzt.
- Die Signalintensität des ROI wird durch Anklicken des [Measure]-Taste berechnet. Die ROI-Label zeigt die Intensität. ROI ist können verwaltet und gespeichert werden using der Living Image Software.
7. Repräsentative Ergebnisse:
Erfolgreiche Zelle Implantation ist offensichtlich, wenn implantierten Zellen nachweisbar sind mit dem IVIS Spektrum am Tag der Operation. Beide GL261-luc und GL261-luc2 Zellen nachweisbar sind, jedoch wird die luc2 Gens ein höheres Niveau der Biolumineszenz [Abb. 5]. Bilder kurz nach der Implantation entnommen haben unspezifische Signalisierung auf das Tier die Pfoten und Nase, die als Hintergrund außer Acht gelassen werden sollte. Signal am Ort der Implantation entfernt ist real und das Signal wird mit der Zeit zunehmen [Abbildung 6]. Der Rückgang der Signalstärke am Tag 6 ist reproduzierbar und sehr wahrscheinlich durch den Verlust von Tumor zu nehmen von einigen der implantierten Zellen. Quantitative Messungen der Tumorlast reproduzierbar sind, dass sie sollten stetig ansteigen, bis das Tier letztendlich erliegt der Krankheit. Allerdings wird Wachstumskurven weitgehend über den Stand der implantierten Zellen und oder unvermeidbare kleinere var hängen ssigkeit in der Implantation. Unser Labor hat zum Bild implantierten Tiere gewählt alle drei Tage.
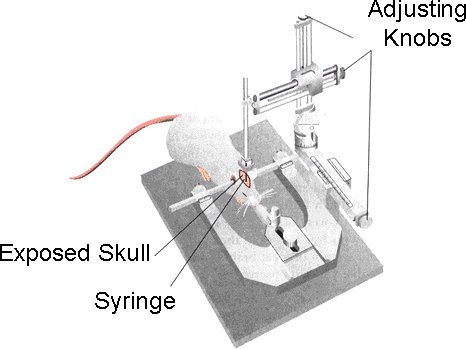
Abbildung 1. Nach der Maus richtig betäubt, ist es in der stereotaktischen Rahmen plaziert. Die Maus Kopf Befestigung erfolgt über den Mund zu klemmen.

Abbildung 2. Nach der Haut geöffnet ist die wichtigste anatomische Orientierungspunkte wie auch die Bregma, die koronare und sagittale Nähte werden identifiziert. Die BOHRLOCHRESERVOIR wird 2,3 mm auf der rechten Seite des Bregma durch langsames Drehen einer 16-Gauge-1 ½-Zoll-Nadel mit einer kleinen Menge Druck, bis der Schädel eingedrungen und das Gehirn ausgesetzt ist.
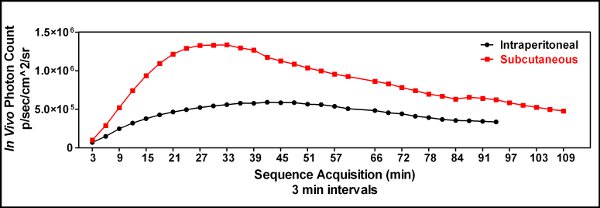
Abbildung 3. Eine kinetische Vergleich der subkutanen (iles/ftp_upload/3403/3403fig3_1.jpg "alt =" Figure3.1 "/>) versus intraperitonealen (  ) Luciferin Injektion wurde durchgeführt, um die Nützlichkeit einer subkutanen Injektion Luciferin zu demonstrieren und den optimalen Zeitpunkt für Bild folgenden Luciferin Verwaltung zu identifizieren. Drei Minuten nach dem Luciferin injiziert wurde die Maus sediert wurde, platziert in der IVIS Spectrum Instrument und bebildert alle 3 Minuten bis zu einer Stunde und alle 6 Minuten später auf eine kinetische Kurve der Biolumineszenz erzeugen. Diese zeigten, dass eine subkutane Verabreichung Luciferin überlegen eine intraperitoneale Injektion in unseren Händen war, und dass die optimale Zeit, um Bild die Tiere betrug etwa 25 Minuten nach der Injektion, wenn Luciferin GL261-luc-Zellen verwendet wurden.
) Luciferin Injektion wurde durchgeführt, um die Nützlichkeit einer subkutanen Injektion Luciferin zu demonstrieren und den optimalen Zeitpunkt für Bild folgenden Luciferin Verwaltung zu identifizieren. Drei Minuten nach dem Luciferin injiziert wurde die Maus sediert wurde, platziert in der IVIS Spectrum Instrument und bebildert alle 3 Minuten bis zu einer Stunde und alle 6 Minuten später auf eine kinetische Kurve der Biolumineszenz erzeugen. Diese zeigten, dass eine subkutane Verabreichung Luciferin überlegen eine intraperitoneale Injektion in unseren Händen war, und dass die optimale Zeit, um Bild die Tiere betrug etwa 25 Minuten nach der Injektion, wenn Luciferin GL261-luc-Zellen verwendet wurden.
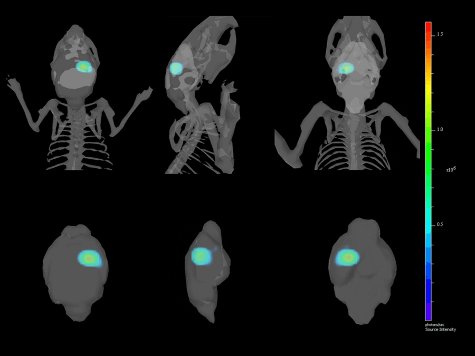
Abbildung 4. Multiple Ansichten eines 3-Dimensional RekonstitutionKrawall des intrakraniellen Implantation von GL261-luc2 Zellen mit der Maus Skelett und Gehirn Zusammenarbeit registriert.
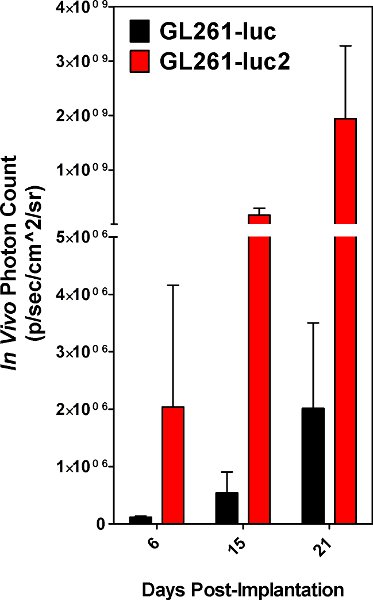
Abbildung 5. Photon zählt von Tumoren, die sich aus GL261-luc-Zellen vs GL261-luc2-Zellen erhalten. Die Ergebnisse werden im Durchschnitt von 5 Tieren.

Abbildung 6. Graph der GL261-luc das Wachstum von Tumorzellen in ein Albino C57BL / 6 Maus. Biolumineszenz wurde alle 3 Tage und aufgetragen als in vivo Photonenzahl gegenüber Tage nach der Implantation. Fotos zeigen Biolumineszenz zu verschiedenen Zeitpunkten. Coloration ist ein Hinweis auf Biolumineszenz (Pixel-Intensität), die relativ zur Tumorzelle Nummer (Farbbalken rechts dargestellt). Nachdem das Tier die Krankheit erlag das Gehirn seziert und Luciferin wurde topisch auf die ex vivo imag erhalten wurdee in der Abbildung gezeigten Einsatz.
Diskussion
Die Zelle Inokulum wird in einer Tiefe von 2,6 mm von der Oberfläche des Gehirns nach der Erstellung eines 0,4 mm Tasche infundiert. Um eine korrekte Platzierung und Tiefe der Nadel sorgen für eine X-ray kann aufgenommen mit einem C-Arm oder ähnliches Röntgenbild Intensivierung Gerät, jedoch ist diese optional. Komplikationen bei der Operation auftreten können, wenn das Tier nicht ordnungsgemäß betäubt, an welchem Punkt kann das Tier während der Zellteilung Infusion zu bewegen. Dies kann zu Undichtigkeiten der Zelle Mix oder Blutungen aus Nadel zu verfolgen. Austreten von Zellen verursacht ektopische Wachstum von Tumorzellen. Es ist auch wichtig, nicht die Punktion der Ventrikel, was getan werden kann, wenn die BOHRLOCHRESERVOIR wird medial von der 2,3 mm in das Protokoll 4 beschrieben. Die richtige Platzierung der Nadel und Zelle verteilt wurde durch Infusion einer Maus mit 2 ul Methylenblau und seziert das Hirngewebe um die Position der infundierten Farbstoff überprüfen getestet.
In diesem Protokoll haben wir die IVIS Spectrum in-vivo-Bildgebung und t verwendeter lebt Image Software (v 4.0) für die Verwendung mit diesem Instrument. (Caliper Life Sciences). Alle vergleichbaren in-vivo-Imaging-System und Bild-Analyse-Tools können verwendet werden, um ähnliche Ergebnisse zu erzielen. Diese Systeme bieten einige Vorteile gegenüber herkömmlichen Magnet-Resonanz-Tomographie (MRT), um das Wachstum eines experimentellen intrakraniellen Tumor zu folgen. Der offensichtlichste ist die relativen Kosten der 2-Instrumente - Tier MRT-Geräte sind wesentlich teurer und erfordern in der Regel die Dienste eines qualifizierten MRI-Techniker. In-vivo-Bildgebung, wie, was hier beschrieben, kann durch den Endverbraucher durchgeführt werden. Die Biolumineszenz Daten quantitative, während die Quantifizierung von MRT-Daten ist zeitaufwändig und etwas ungenau. Darüber hinaus zeigen MRT-Aufnahmen Ödemen und Entzündungen zusätzlich zu Tumorzellen und es kann schwierig sein, Tumor-Behandlung Wirkung zu trennen. Aus diesen Gründen erhalten genaue volumetrische Messungen des wachsenden Tumors kann eine Herausforderung sein. Biolumineszenz erfordert ATPDaher nur lebende Tumorzellen beitragen, die Tumorgröße Daten. Trotzdem gibt es einige Vorteile der MRT, ob eine Maschine zur Verfügung steht. Cells müssen nicht mit einem Biolumineszenz-Marker werden durch MRI sichtbar gekennzeichnet sein. Die Fähigkeit, peri-Tumor-Ödem visualisieren kann ein Vorteil für einige experimentelle Protokolle werden. Eine Stärke der beiden Technologien ist, dass mit einem nicht ausschließt, die Verwendung der anderen, so können Daten über das Wachstum des Tumors sowie das Vorhandensein von peri-Tumor-Ödemen und Entzündungen aus dem gleichen Tier gewonnen werden, wenn beide Technologien verfügbar sind an den Forscher.
Offenlegungen
Freier Zugang zu diesem Artikel wird von Caliper Life Sciences gefördert.
Danksagungen
Wir möchten Dr. Joshua B. Rubin für das großzügige Geschenk der Plasmide für die Lentivirus-System sowie Mahil Rao für hilfreiche Anregung für die Vorbereitung der GL261-luc-Zellen erkennen.
Wir bedanken uns bei Studenten Unterstützung Brain Tumor Research (SSBTR), The Barrow Neurological Foundation und The Wallace Foundation für ihre großzügige Unterstützung.
Tierversuche wurden in Übereinstimmung mit den Richtlinien und Vorschriften her durch die Institutional Animal Care und Verwenden Ausschuss der St. Joseph-Hospital und Medical Center eingerichtet durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes oder Lieferung | Firma | Katalog-Nummer | Kommentare |
| GL261-luc2 Bioware Ultra- | Caliper Life Sciences | GL261-luc2 | |
| Dulbecco Modified Eagle Medium (DMEM) | Invitrogen | 10313039 | |
| Geneticin (G418) | Gibco (Invitrogen) | 11811-023 | |
| Fetal Calf Serum (FCS) | Invitrogen | 26140079 | |
| Phospate Buffered Saline (PBS) | Invitrogen | 70011044 | |
| C57BL/6-cBrd/cBrd/Cr Mäuse | NCI-Frederick | ||
| AKWA Tränen Lubricant Augensalbe | Akorn Inc | 17478-062-35 | |
| Ketaset (Ketamin Hydrochlorid) | Wyeth | 11570775 | |
| Sedazine (Xylazinhydrochlorid) | Wyeth | 10031894 | |
| Small Animal stereotaktische Instrument | Kopf Instruments | 900 | |
| UltraMicroPump mit SYS-Micro4-Controller | World Precision Instruments | UMP3-1 | Falls nicht vorhanden, ist es möglich, manuell ziehen |
| 10 &mgr; l-Spritze mit 26 Gauge abgeschrägte Nadel | World Precision Instruments | SGE010RNS | |
| Adison Zange | World Precision Instruments | 500092 | |
| Penfield Dissector | Codman | 65-1015 | |
| 16g 1 ½ Precision Glide Needle | Beckton, Dickinson and Company (BD) | 305198 | |
| Chirurgische Klinge Griff | BD | 371030 | |
| Größe 15 Blatt | BD | 371315 | |
| 4-0 Vicryl Naht | Ethicon | VCP496G | |
| Knochenwachs | Medline | DYNJBW25 | |
| Povidin-Jod-Swab Sticks | Medline | MD93901 | |
| D-Luciferin Kaliumsalz | Caliper Life Sciences | 122796 | |
| Forane (Isofluran) | Baxter | 1001936060 | |
| OPMI Pentero Mikroskop | Carl Zeiss, Inc. | Jeder OP-Mikroskop genügt | |
| Xenogen IVIS Spectrum mit optionalem Anästhesie-System | Caliper Life Sciences |
Referenzen
- Candolfi, M. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. J Neurooncol. 85, 133-148 (2007).
- Stafford, P., Abdelwahab, M. G., do, K. i. m., Preul, Y., Rho, M. C., M, J., Scheck, A. C. The ketogenic diet reverses gene expression patterns and redudes reactive oxygen species levels when used as an adjuvant therapy for glioma. Nutr Metab. 7, (2010).
- Caliper Life Sciences, Inc. . Living Image Software Version 4.0. VivoVision Systems. , (2010).
- Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (2001).
- Jouanneau, E., Poujol, D., Gulia, S., Le, M. I., Blay, J. Y., Belin, M. F. Dendritic cells are essential for priming but inefficient for boosting antitumour immune response in an orthotopic murine glioma model. Cancer Immunol Immunother. 55, 254-267 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten