Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Electric Field-gesteuerte gerichtete Wanderung von neuralen Vorläuferzellen in 2D-und 3D-Umgebungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll zeigt Methoden verwendet werden, um 2D-und 3D-Umgebungen in speziell angefertigten electrotactic Kammern einzurichten, die Zellen verfolgen können In vivo / ex vivo Verwendung von Zeitraffer-Aufnahme an der Ebene einzelner Zellen, um Galvanotaxis / electrotaxis und andere zelluläre Reaktionen untersuchen zu Gleichstrom (DC) elektrische Felder (EF) zu lenken.
Zusammenfassung
Endogene elektrische Felder (EF) kommen natürlicherweise in vivo und spielen eine entscheidende Rolle bei der Gewebe / Organ Entwicklung und Regeneration, einschließlich der des zentralen Nervensystems 1,2. Diese endogenen EF durch zellulären Regulation der Ionentransport mit dem elektrischen Widerstand von Zellen und Geweben kombiniert erzeugt. Es wurde berichtet, dass EF angewandte Behandlung kann der funktionellen Wiederherstellung von Verletzungen des Rückenmarks bei Tieren und Menschen 3,4 zu fördern. Insbesondere hat EF-gerichtete Wanderung in einer Vielzahl von Zelltypen 5,6, einschließlich neuralen Vorläuferzellen (NPC) 7,8 nachgewiesen. Anlegen eines Gleichstroms (DC) EF ist nicht eine allgemein verfügbare Technik in den meisten Laboratorien. Wir haben detaillierte Protokolle für die Anwendung von DC EFs beschrieben, um Zell-und Gewebekulturen zuvor 5,11. Hier präsentieren wir eine Video-Demonstration der Standard-Methoden auf einem berechneten Feldstärke einzurichten 2D-Basis eind 3D-Umgebungen für NPCs und zu zellulären Reaktionen auf EF Stimulation in beiden einzigen Zelle Wachstumsbedingungen in 2D, und der organotypischen Rückenmark Scheibe in 3D untersuchen. Die Wirbelsäule ist ein idealer cordslice Empfänger Gewebe zum Studium NPC ex vivo Verhalten, nach der Transplantation, weil die zytoarchitektonischen Gewebeorganisation wird auch in diesen Kulturen 9,10 erhalten. Darüber hinaus ist diese ex vivo-Modell ermöglicht auch Verfahren, die derzeit technisch nicht möglich, Zellen in vivo mittels Zeitraffer-Aufnahme auf der Ebene einzelner Zellen zu verfolgen. Es ist von entscheidender Zelle muss auf das Verhalten nicht nur in einer 2D-Umgebung zu bewerten, sondern auch in einer 3D-organotypischen Bedingung, die die in vivo-Umgebung imitiert. Dieses System ermöglicht hochauflösende Bildgebung mit Deckglas-basierte Gerichte im Gewebe oder Organ Kultur mit 3D-Tracking einzelner Zellmigration in vitro und ex vivo und kann ein Zwischenschritt, bevor sie auf in sein vivo Paradigmen.
Protokoll
1. Neurale Vorläuferzellen Zellisolation
- Sezieren ganze Gehirne von E14-16-Mäusen und in kaltem DMEM/F12 Basismedium. Entfernen Sie alle Meningen unter einem Mikroskop anatomischen und Transfer Gehirne in eine 35 mm Petrischale.
- Verwenden feinen Pinzette mechanisch zu distanzieren Gehirne in Gewebefragmente und übertragen Sie sie auf einem 15 ml-Tube, dann zentrifugieren Proben bei 800 rpm für 3 Minuten, um Verschmutzungen zu entfernen.
- Add DMEM/F12 mit bFGF und EGF und verreiben mit einer 1 ml Pipette.
- Übergeben Sie die Zellsuspension durch ein Sieb, um Zelle eine einzelne Zelle Suspension zu erhalten.
- Platte Zellen in Kolben bei 2-5 x 10 4 Zellen / ml, führen Sie eine vollständige Medium alle 3 Tage und den Durchgang Zellen alle 6 Tage.
- Nach mindestens 5 Passagen, Digest Neurosphären, um einzelne Zellen unter Verwendung von Trypsin und EDTA und wachsen auf poly-D-lysine/laminin-coated electrotactic Kammern (hergestellt wie unter Punkt 2 beschrieben). Mit dem wachsenden Medium mit N2-Supplement,bFGF und EGF zu jeder Zeit zu pflegen Eigenschaften der NPCs.
2. Herstellung der Kammer electrotactic
- Planen 22 x 11 mm Glasstreifen durch Teilen autoklaviert 22 x 22 mm Dicke Nr.1 Deckgläser in der Mitte mit einem Diamant-Stift.
- Erstellen Sie eine frei stehende Glas auch von Innenmaßen 22 x 10 mm miteinander verklebt, vier vertikal stehend 22 x 11 mm Streifen mit Hochvakuum-Silikonfett. Lassen Sie die Wells vollständig trocknen und aushärten über Nacht.
- Am folgenden Tag legen zwei 22 x 11 mm Glas-Streifen, die parallel zueinander, wobei ein Spalt von 10 mm, auf der Basis eines 100 mm Kulturschale mit Silikonfett. Abdichten den Bereich zwischen diesen Streifen, indem eine 22 x 22 mm Deckglas an jedem Ende, an der Unterseite der Schale mit Fett auf drei Seiten, aber nicht dem Zentrum am nächsten.
- Das Glas gut in Schritt 2.2 auf den Deckel rutscht vorbereitet, so dass die Innenwände einen geschlossenen Raum zu schaffen für die Aussaatdie Zellen auf der Unterseite der Platte. Wasserdichte alle Fugen mit Silikon einfetten. Coat diese Region beschränkt nacheinander mit Poly-D-Lysin dann Laminin: 1 ml Poly-D-Lysin in die Kammer zu verlassen und für 5 Minuten, damit das Poly-D-Lysin an der Unterseite der Platte zu binden; waschen Sie die Kammer mit sterilem PBS zweimal, dann verdünnt Laminin in sterilem PBS auf 20 ug / ml zu erhalten und zu verwenden, um die Unterseite der Platte bestimmt. Lassen Sie bei Raumtemperatur über Nacht.
- Am folgenden Tag, Ernte-Zellen und bereiten 1 ml Suspension mit 1 x 104 Zellen. Entfernen Sie Laminin aus dem Glas gut, so dass es an der Luft trocknen vollständig und ersetzen mit 1 ml Zellsuspension. Die Schale im Inkubator bei 37 ° C für mindestens 4 Stunden zur Befestigung zu ermöglichen.
- Sobald die Zellen konfluent sind ausreichend entfernen Medium aus der Kammer. Entfernen Sie vorsichtig das Glas gut. Bilden ein Dach über den Zellen durch vorsichtiges Befestigung, mit Silikonfett, einer autoklavierten 22 x 22 mm DeckglasBrückenschlag zwischen den beiden 22 x 11 mm Streifen. Die Zellen mit ein paar Tropfen des Mediums zu vermeiden Austrocknen.
- Bilden eine isolierte Mediumspeicher an jedem Ende der Kammer durch die Schaffung von zwei wasserdichte Silikonfett Barrieren, die von einem Rand der Schale zur anderen laufen, über die Kammer Dach. Füllen der Kammer mit frischem Medium, wodurch eine Durchströmung von einem Medium Reservoir zu dem anderen. Senden Sie das Gericht in den Inkubator für 12 Stunden auf die Erholung der Zellen zu ermöglichen.
3. Anwendung eines elektrischen Feldes an die Kammer electrotactic
- Bereiten Sie einen Deckel auf die Schüssel durch das Bohren Sie zwei Löcher, eins über jedem Behälter der Migration Kammer positioniert zu decken.
- Ersetzen Sie alle Medium in der Kammer mit Kulturmedium mit 25 mM HEPES-Puffer und die Schale in der temperaturgeführten Imaging-System. Richten Sie die experimentellen Parameter für Zeitraffer-und Multi-Positions-Aufnahme. Richten der Kammer, so dass die Kathode und Anodeauf der linken und rechten festgelegt, um sicherzustellen, dass die EF-Vektor horizontal verläuft, wie sie das Mikroskop betrachtet und in das Abbildungssystem.
- Füllen Sie zwei Bechergläser mit Steinberg-Lösung (58 mM NaCl, 0,67 mM KCl, 0,44 mM Ca (NO 3) 2 · 4H 2 0, 1,3 mM MgSO 4 · 7H 2 0 und 4,6 mm Trizma Base, pH 7,4). Eine separate Becher auf jedes Medium Behälter unter Verwendung vorgefertigter Glasbrücken (Glasröhren ~ 13 cm lang und ca. 3 mm im Durchmesser, und Biegen zu einer U-Form durch Erhitzen in einem Bunsenbrenner), mit 2% (w / gefüllt v) Steinberg's-Agar-Lösung, die durch die Löcher im Deckel. Füllen Sie den Stromkreis, indem Ag / AgCl-Elektroden verbunden mit einer DC-Stromversorgung in jedem Becher der Steinberg-Lösung.
- Stellen Sie die Spannung Regler an der Stromversorgung auf 0 und schalten Sie ein. Messen der Spannung über dem electrotactic Kammer beim Einschalten die Spannung Zifferblatt, mit einem Voltmeter, und Anpassung an die experimentellen Anforderungen.
- Start Zeitraffer-Aufnahme. Führen Sie ein Mediumwechsel und justieren Sie die Spannung, je nach Bedarf, jede Stunde. Frisches Medium, Drogen oder chemische Mittel können zu den Stauseen hinzugefügt werden, wie erforderlich. Wenn durchführen Medium ändern, können zwei Optionen, wie unten in Betracht gezogen werden:
- Option Nr.1 - Zum Anhalten der Zeitraffer-Aufnahme vorübergehend, entfernen Sie vorsichtig Glas Brücken von Kammer zu vermeiden störende Deckelklappe, verwenden Sie einen sterilisierten Pasteurpipette vorsichtig ersetzen alle Medium durch frisches Medium und stellte das Glas wieder Brücken, dann die Aufnahme fortzusetzen.
- Option Nr.2 - Alternativ, custom made Deckel Deckel mit 4 Löchern (zwei über jedem Reservoir der Migration Kammer positioniert) kann auch für mittlere Veränderung Zweck verwendet werden. Zwei für Glasbrücken Verbindung, die beiden anderen für Medienwechsel. Option 2 ermöglicht eine kontinuierliche Aufzeichnung ohne Störungen während Mediumwechsel.
4. Herstellung des organotypischen Rückenmarks Slice
- Sezieren Lumbar Rückenmark von 2 Wochen alten C57 BL / 6 Mäuse.
- In Scheiben schneiden Rückenmark in 500 pm dicke Schnitte mit einem McIlwain Gewebe Chopper.
- Separate Scheiben unter einem Mikroskop anatomischen und wählen Scheiben mit intakten sagittal / axial Rückenmark Struktur.
- Teller Scheiben in einer 35 mm Petrischale mit 30 ul Matrigel und legen Sie sie in der Mitte erscheint wie möglich zu schließen und pflegen sie in einem 5% CO 2-Inkubator bei 37 ° C für mindestens 30 min, bis das Matrigel Proteine selbst zusammen zu produzieren ein dünner Film, der die Oberfläche des Rückenmarks Schicht umfasst. Es ist sehr wichtig, um sicherzustellen, dass Matrigel wurde komplett zusammengebaut, inkubieren Sie die Petrischale bei 37 ° C für weitere 30 min, wenn nötig.
- Fügen Sie 4-6 ml DMEM/F-12-Medium mit 25 mM HEPES-Puffer und 15 bis 20% fötalem Kälberserum sehr schonend, so dass mittel fließen direkt auf die Scheibe zu vermeiden. Sicherstellen, dass die Scheibe nicht vollständig in Medium eingetaucht, so dass die Oberfläche der Explantate gut ausgesetztdie Luft. Ändern Medium zweimal wöchentlich.
5. Die Injektion von Hoechst 33342 beschriftet NPCs in den organotypischen Rückenmark Scheibe
- Bereiten Sie den NPC Suspension bei 1 × 10 6 Zellen / ul.
- Pre-Inkubation der Zellsuspension in Medium mit 5 uM Hoechst 33342 für 30 min.
- Verwenden Sie kapillaren Glasröhre bis 2 ul Suspension in das Rückenmark Scheibe langsam microinject unter dem Mikroskop. Stellen Sie sicher, Kapillar-Glasrohr geht durch den Matrigel (rosa Teil unter dem Mikroskop) und erreichen an der Innenseite der Scheibe des Rückenmarks (graue Gewebe unter dem Mikroskop), im Inneren des Rückenmarks Slice für mindestens 30 Sekunden bleiben, um Zellsuspension überfahren zu vermeiden. Legen Sie die Petrischale mit Rückenmark Scheibe in Inkubator (37 ° C 5% CO 2) und lassen Sie es über Nacht.
- Am nächsten Tag, wenden eine EF von 500 mV / mm des Rückenmarks Schicht mit Hoechst 33342-markierten NPCs in der electrotactic Kammer (unter Verwendung der Verfahren beschrieben3).
6. Repräsentative Ergebnisse
Wenn NPCs wurden auf einen Bereich von physiologischen EF zeigten sie stark gerichtete Wanderung in Richtung der Kathode (1) ausgesetzt ist. Die gleiche Beobachtung wurde auch bei einer einzelnen Zelle auf der organotypischen Rückenmarks Slice ex vivo-Modell, eine 3D-Umgebung in vivo Bedingungen nachahmen (Abbildung 2).
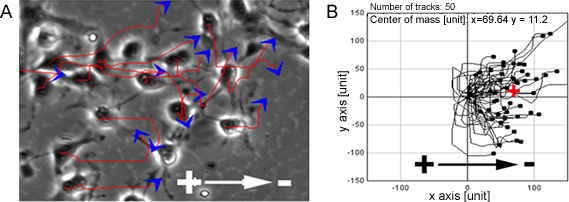
Abbildung 1. NPCs zeigen gerichtete Wanderung in EFs. PCs zeigten hoch gerichtete Wanderung zur Kathode, wenn EFS ausgesetzt sind, repräsentieren roten Linien und blauen Pfeile Flugbahnen und die Richtung der Bewegung der Zellen (A). B zeigt die Migrationswege von NPCs. Bar: 50 um.
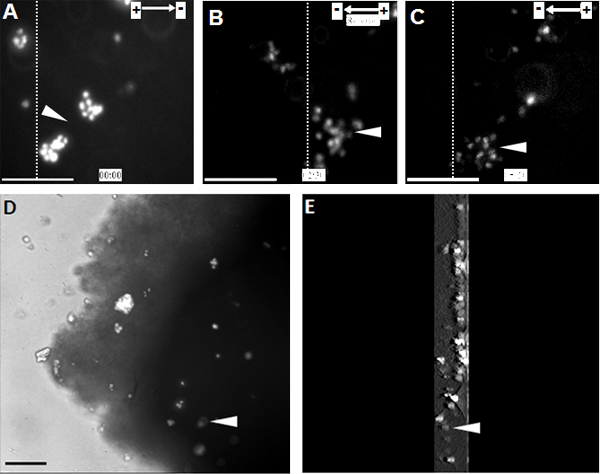
Abbildung 2. Die transplantierten NPCs für gerichtete Wanderung in Richtung der Kathode in der organotypischen Rückenmarks Slice . (A) NPCs mit Hoechst 33342 beschriftet wurden in den organotypischen Rückenmark Scheibe am Startpunkt des EF Behandlung transplantiert. NPCs migriert gerichtet in Richtung der Kathode für 2,5 Stunden, an welchem Punkt die EF Polarität umgekehrt wurde (B). Ändern EF Polarität löste eine scharfe Umkehr der electrotaxis gegenüber der neuen Kathode (C). (D) Bild von transplantierten NPCs innerhalb des Rückenmarks Scheibe am Ende der Zeitraffer-Aufnahme. (E) Eine 3D-Rekonstruktion von transplantierten NPCs innerhalb des Rückenmarks in Scheiben schneiden. 3D-Scanning-Sektionen waren 300 um Dicke, ausgehend von der Mitte und endet an der Unterseite der Scheibe. Die gepunkteten Linien zeigen die relativen Positionen der gleichen Population von transplantierten Zellen am Anfang, Umkehr und Endpunkte der EF Behandlung (A - C, jeweils). Pfeilspitzen zeigen den gleichen Population von Hoechst 33342 markierten NPCs. Bar: 50 um.
Diskussion
Die Protokolle verwenden wir auf der Basis früherer Studien 5,11. Mit Hilfe dieser Methoden stabilen Kultur und elektrischer Strom Bedingungen aufrecht erhalten, während ein EF-Agar über Brücken, Steinberg-Lösung und Ag / AgCl-Elektroden, um Zellen oder in Scheiben individuell gestaltet electrotactic Kammern von standardisierten und präzise Abmessungen kultiviert werden. Die Tiefe der Kammern kann eingestellt werden, um Platz für verschiedene Dicken Probe 11 zu, und im Falle von Zellen, Kamm...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der Royal Society URF Zuschuss UF051616, Großbritannien und den European Research Council StG Zuschuss 243261 BS unterstützt. Die Arbeit im Labor MZ wird auch durch eine California Institute of Regenerative Medicine Zuschuss RB1-01417 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| FGF-basic Rekombinantes humanes | Invitrogen | PHG0026 | 20 ng / ml |
| Rekombinantes humanes EGF | Invitrogen | PHG0311 | 20 ng / ml |
| N2-Supplement (100X) Flüssigkeit | Invitrogen | 02048 | |
| DMEM/F12-Medium (high Glucose) | Invitrogen | 31330-095 | |
| Poly-D-Lysin | Millipore | A-003-E | |
| Natürliche Mauslaminin | Invitrogen | 23017-015 | |
| Wachstumsfaktor reduziert Basalmembran-Matrix (Matrigel) | BD Biosciences | 354230 | |
| HEPES-Puffer | Gibco | 15630 | |
| McIlwain Gewebe Chopper | Die Mickle Laboratory Engineering Co Ltd | TC752-PD | |
| Dow Corning Hochvakuum-Silikonfett | Sigma-Aldrich | Z273554 |
Referenzen
- Huttenlocher, A., Horwitz, A. R. Wound healing with electric potential. N. Engl. J. Med. 356, 303-303 (2007).
- McCaig, C. D., Rajnicek, A. M., Song, B. Controlling cell behavior electrically: current views and future potential. Physiol. Rev. 85, 943-943 (2005).
- Borgens, R. B., Jaffe, L. F., Cohen, M. J. Large and persistent electrical currents enter the transected lamprey spinal cord. PNAS. 77, 1209-1209 (1980).
- Shapiro, S., Borgens, R., Pascuzzi, R. Oscillating field stimulation for complete spinal cord injury in humans: a phase 1 trial. J. Neurosurg. Spine. 2, 3-3 (2005).
- Zhao, M., Song, B., Pu, J. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442, 457-457 (2006).
- Yao, L., Shanley, L., McCaig, C. Small applied electric fields guide migration of hippocampal neurons. J. Cell. Physiol. 216, 527-527 (2008).
- Li, L., El-Hayek, Y. H., Liu, B. Direct-current electrical field guides neuronal stem/progenitor cell migration. Stem Cells. 26, 2193-2193 (2008).
- Meng, X., Arocena, M., Penninger, J. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp. Neurol. 227, 210-210 (2011).
- Bonnici, B., Kapfhammer, J. P. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Shichinohe, H., Kuroda, S., Tsuji, S. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Song, B., Gu, Y., Pu, j. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nature Protocol. 2, 1479-1479 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten