Method Article
Elektrophysiologische Charakterisierung von GFP-exprimierenden Zellpopulationen in der intakte Retina
In diesem Artikel
Zusammenfassung
Dieser Artikel zeigt die Aufzeichnung der einzelnen Zellen aus fluoreszenzmarkierten neuronaler Populationen im intakten Maus Netzhaut. Durch die Verwendung von Zwei-Photonen-Anregung Infrarot transgenetically markierten Zellen wurden für Patch-Clamp-Aufzeichnung gezielt ihr Licht Antworten rezeptiven Feld Eigenschaften und Morphologie zu studieren.
Zusammenfassung
Die Untersuchung der physiologischen Eigenschaften und synaptischen Verbindungen von bestimmten Nervenzellen im intakten Gewebe ist eine Herausforderung für die Zellen, die auffällige morphologische Merkmale fehlen oder zeigen eine geringe Bevölkerungsdichte. Dies gilt insbesondere für Netzhaut-Amakrinzellen, ein außerordentlich vielgestaltige Gruppe von Interneuronen, dass rund 30 Subtypen bei Säugetieren 1 umfassen. Obwohl er ein wesentlicher Bestandteil der visuellen Verarbeitung durch die Formgebung der Netzhaut Ausgang 2, haben die meisten dieser Subtypen nicht bis jetzt in einen funktionalen Zusammenhang untersucht, weil das mit diesen Zellen mit einer Aufnahme-Elektrode ist ein seltenes Ereignis.
In jüngster Zeit ist eine Vielzahl von transgenen Mauslinien zur Verfügung, die zum Ausdruck Fluoreszenzmarker wie grün fluoreszierende Protein (GFP) unter der Kontrolle von Promotoren für die Membran-Rezeptoren oder Enzymen, die spezifisch für nur eine Teilmenge von Neuronen in einem bestimmten Gewebe 3,4 sind. Diese Pre-markierten Zellen werden daher accessible zu richten Mikroelektroden-Targeting unter mikroskopischer Kontrolle, ermöglicht die systematische Untersuchung ihrer physiologischen Eigenschaften in situ. Allerdings ist Anregung von fluoreszierenden Markern durch das Risiko der Phototoxizität für die lebenden Gewebe begleitet. In der Netzhaut, ist dieser Ansatz zusätzlich durch das Problem erschwert, dass Anregungslicht entsprechende Stimulation der Photorezeptoren und damit bewirkt, zuzufügen Photopigment Bleichen und die Übertragung der Netzhaut Schaltungen in ein Licht-adaptierten Zustand. Diese Nachteile werden durch Verwendung von Infrarot-Anregung durch einen modengekoppelten Laser in kurzen Pulsen von Femtosekunden-Bereich geliefert zu überwinden. Zwei-Photonen-Anregung bietet genügend Energie für Fluorophors Erregung und gleichzeitig schränkt die Anregung zu einem kleinen Gewebevolumen Minimierung der Gefahren von Lichtschäden 5. Auch lässt er die Netzhaut reagiert auf visuelle Reize, da Infrarot-Licht (> 850 nm) nur schlecht durch Photopigmente 6 absorbiert.
in situ Aufnahmen elektrophysiologischen von GFP-exprimierenden Zellen, die optisch durch Zwei-Photonen-Anregung ausgerichtet sind. Die Netzhaut ist vorbereitet und gepflegt in der Dunkelheit und kann auf optische Reize, die durch den Kondensator des Mikroskops (Abbildung 1) projiziert werden, unterworfen werden. Patch-Clamp Aufnahme von Licht Reaktionen können mit Dye-Füllung, um die Morphologie zu offenbaren und für Gap Junction-vermittelte Farbstoff Kopplung an benachbarte Zellen zu überprüfen, so dass die Zielzelle kann auf verschiedenen experimentellen Ebenen untersucht kombiniert werden.
Protokoll
Die folgende Beschreibung geht davon aus, dass der Experimentator ein grundlegendes Verständnis der retinalen Struktur, Patch-Clamp-Aufzeichnung, und zwei-Photonen-Mikroskopie hat. Für nützliche Informationen über die Einrichtung und den Betrieb eines Patch-Clamp-Setup und Zwei-Photonen-Imaging-System siehe Lit. [7-12].
1. Tier-und Gewebe-Vorbereitung
- Halten Sie mit der Maus für mindestens 3 h dunkel-adaptierten In der Zwischenzeit bereiten 1-2 l extrazellulärer Lösung, bestehend aus (in mm) 125 NaCl, 2,5 KCl, 1 CaCl 2, 1,6 MgCl 2, 25 NaHCO 3, 10 D-Glucose und äquilibrieren es auf pH 7,4 durch Begasung mit Carbogen (5% CO 2 in O 2) bei Raumtemperatur. ein
- Euthanize der Maus in eine luftdichte Kammer, die durch CO 2 Überdosierung durch Genickbruch folgte. Dieses Verfahren und die folgenden Schritte sollten in der Dunkelheit durchgeführt werden. Verwenden Sie dim langwelligen Beleuchtung (wir Block kurzen Wellenlängen aus einer Kaltlichtquelle durch eine 690 nm-longpass Filter) zur Unterstützung der persönlichen Vision und dabei die Augen des Tieres dunkel-adaptierten (Mäuse haben nur schlechte Sicht in den roten Teil des Lichtspektrums). Für die Arbeit in völliger Dunkelheit mit Infrarot-Beleuchtung (> 800 nm) und tragen Nachtsichtgeräte.
- Entkernen Augen mit einem Paar von gekrümmten Iris Schere und übertragen Sie sie auf einen Teller extrazellulären Lösung unter einem Binokular gelegt.
- Entfernen Sie die Hornhaut und des Ziliarkörpers durch das Öffnen der Augen Glühbirne an der ora serrata (der Grenze zwischen Netzhaut und Ziliarkörper) mit einem Paar Frühling Schere (verwenden wir zunächst eine Lanzette zu durchbohren Ausgangspunkt für das Schneiden). Nehmen Sie die Linse und sorgfältig trennen die Netzhaut vom Pigmentepithel. Wenn die Ausrichtung der Netzhaut ist entscheidend für Ihre Studie zeigen, dass er wie in Ref. [12]. Schneiden Sie den Sehnerv zwischen Netzhaut und Pigmentepithel und entfernen Sie die Netzhaut von der Augenmuschel. Beachten Sie die Richtung des retinalen Oberflächen: das Innere des eingerollt-up Netzhaut ist die ganglIonen-Zellen-Seite, die außerhalb der Photorezeptor Seite.
- Entfernen Sie den Glaskörper aus der inneren Netzhaut durch leichtes Ziehen Sie ihn mit Hilfe eines hölzernen Zahnstocher. Zu diesem Zweck verwenden Sie eine kleine Menge der extrazellulären Lösung, deckt gerade die Netzhaut. Der Glaskörper klebt an den Zahnstocher und zentrifugal aus der Netzhaut gezogen werden. Dann bewerben kurze Schnitte entlang der retinalen Umfang zu erleichtern Abflachung des Gewebes.
- Übertragen Sie die Netzhaut in der Aufnahme Kammer Photorezeptor-Seite nach unten, breitete es auf dem Glasboden (wir verwenden eine feine Bürste) und fixieren es mit einem Nylon-aufgereiht Rahmen aus Edelstahl. Bereiten Sie die zweite Netzhaut in gleicher Weise und halten Sie es in carboxygenated extrazellulären Lösung für den späteren Gebrauch dunkel angepasst.
2. Recordings
- Installieren Sie die Aufnahme Kammer im Dunkeln unter einer aufrechten Laser Scanning Mikroskop und superfuse der Netzhaut Vorbereitung kontinuierlich (nicht weniger als 5 ml / min) mit carboxygenated extrazellulären Lösung auf 35 ° C erhitzt Das Mikroskop (auch mit einer Infrarot-empfindliche CCD-Kamera ausgestattet) befindet sich auf einem stoßdämpfenden Luft Tabelle in einem Faraday-Käfig für die elektronische Abschirmung entfernt. Bedecken Sie den Käfig mit einem nicht-transparenten Vorhang für die Vorbereitung in der Dunkelheit zu halten. Wir haben auch off Licht von Computermonitoren Bildschirm durch rote transparente Folie.
- Tune die Infrarot-Laser 850-870 nm oder längeren Wellenlängen, wechseln Sie in modengekoppelten Zustand und die Verwendung der Zwei-Photonen Anregung von GFP-exprimierenden Zellen zu visualisieren. Dämpfen Sie den Laser-Ausgang mit Neutralfilter durch die Laser-Scanning-Software bis zu einem gewissen Grad, der gerade ausreicht für eine klare Anerkennung der fluoreszierenden Zellen gesteuert wird
- Für Patch-Clamp-Aufnahmen in Current-Clamp-Modus verwenden Glasmikropipetten (wir verwenden Borosilicatglasröhren von 1,5 mm Außendurchmesser und 0,225 mm Wandstärke) mit intrazellulären Lösung, bestehend aus (in mm) 125 K-Gluconat, 10 KCl, 0,5 EGT gefülltA, 10 HEPES, titriert auf pH 7,4 mit KOH (was eine Pipette Widerstand von etwa 5 MW). Beachten Sie, dass andere experimentelle Bedingungen wie Voltage-Clamp-Aufzeichnung eine andere Lösung erfordern. Wenn Farbstoff Injektionen gewünscht werden, fügen Sie eine fluoreszierende Sonde (wir verwenden 10 mM Alexa Fluor 594) oder ein Tracer-Molekül (3% Neurobiotin). Legen Sie die Mikropipette in die Halterung und stellen Sie sicher, dass die Referenzelektrode (chlorierte Silberdraht) in Kontakt mit der extrazellulären Lösung in der Aufnahme Kammer ist.
- Druck auf die Mikropipette und Ziel einer GFP-exprimierenden Zellen (wir verwenden eine 40-fach Wasserimmersionsobjektiv; NA 1,25). Amakrine Zellkörper in den Ganglienzellen (direkt unter der Oberfläche in der aktuellen Ausrichtung der Netzhaut) sowie in den proximalen Teil der inneren Körnerschicht (etwa 55-75 um tief in der Vorbereitung) gelegen. Vor Mikropipette Kontakt mit der Zielzelle, die innere Grenzmembran (eine Hülle aus Gliazellen endfeet gemacht) an der NetzhautOberfläche durchdrungen werden. Erfolgreiche Penetration durch intrazelluläre Lösung, die aus der Mikropipette Spitze getrieben wird und löst die innere Grenzmembran von der zugrunde liegenden Retina wie auf eine Infrarot-Übertragung Bild von der IR-CCD-Kamera aufgenommen beobachtet werden anerkannt.
- Nähern Sie sich dem gewünschten Zelle durch den Vergleich der soma Position aus der Zwei-Photonen-Bild mit dem Bild der IR-CCD-Kamera, die die Position der Aufnahme Mikropipette. Beachten Sie, dass dieser Schritt nicht leicht zu erreichen und erfordert etwas Übung, weil die GFP-exprimierenden Zelle hat, um in der Infrarot-Übertragung Bild erkannt werden, um die Mikropipette auf sie zu lenken. Korrekte Ausrichtung ist erreicht, wenn die Mikropipette Spitze verursacht Dellen von der Zelloberfläche, die in der Zwei-Photonen-Bild zu sehen ist. Alternative zu diesem Verfahren mit einem Fluoreszenzfarbstoff (zB Alexa Fluor 594, 100 uM) in der intrazellulären Lösung der Mikropipette Position in der Zwei-Photonen-Bild zeigen. Zwei-Photonen-Anregung Infrarot ermöglicht eine ausreichende Fluoreszenz dieses Farbstoffs, um die Mikropipette erkennbar. Zu diesem Zweck stellen Sie den Erfassungsbereich in der Laser-Scan-Software, um auch rote Fluoreszenz.
- Lassen Sie den Druck aus der Mikropipette und erhalten eine whole-cell Patch-Clamp-Konfiguration in Current-Clamp-Modus. Eine brauchbare Aufnahme sollte ein Membranpotential von -50 bis -55 mV und dauern mindestens 20 min.
- Gegenwärtige optische Reize durch eine Stimulation Software (wir verwenden QDS von Thomas Euler, Universität Tübingen, Deutschland) 11 auf einem Computer-Monitor erstellt. Passen Sie die räumliche Lage der Stimulation auf das aufgenommene Zelle zentriert werden: Markieren Sie die Zelle Position auf dem Monitor zeigt die Übertragung Bild der IR-CCD-Kamera und in der Mitte punktförmig Reiz auf ihn. Tune der Reizintensität durch Einfügen Neutralfilter in den Strahlengang. Für die Kalibrierung des Monitors Spektrum und Intensität siehe Ref. [14]. Wählen Sie eine prolonged Interstimulus Intervall (zB 15 s) zu vermeiden Anpassung. Fügen Sie eine Photodiode in den Strahlengang zur Aufzeichnung des Stimulus Timing zu halten.
- Starten Sie den Stimulationsprotokoll und notieren Sie die leichte Reaktionen (wir verwenden eine Abtastrate von 10 kHz mit Filterung bei 5 kHz für Nicht-Spike-Zellen, für Spike-Aufnahme eine höhere Abtastrate wie 20 kHz wird empfohlen). Verwenden Sie das Licht Stimulation Software, um die Aufnahme-Software auslösen.
- Für Farbstoff füllen lassen fluoreszierendes Mittel diffundieren in die Zelle aufgenommen und 30-45 min vor sorgfältig Zurückziehen der Mikropipette aus der Zelle. Achten Sie darauf, sich aus dem Zellkörper. Wenn die nicht-fluoreszierenden Tracer Neurobiotin verwendet wurde, muss es Visualisierung durch Bindung an Streptavidin konjugiert mit einem Fluorophor (wir verwenden Streptavidin-Cy3, 1:400 über Nacht bei 4 ° C nach 20 min Paraformaldehyd Fixierung der Netzhaut; für Farbstoff-Kopplung Studien Streptavidin Inkubationszeit kann bis 3 d verlängert werden). Alternativ kann die Injektion auch mit durchgeführt werdenscharfen Elektroden (> 100 M), wenn der Farbstoff iontophoretisch in den aufgespießt Zelle (Rechteckimpulse: 0,25-1 nA, 100 ms, 100 ms Intervall, Gesamtzeit 3-6 min) angetrieben.
3. Repräsentative Ergebnisse:
Die folgenden Ergebnisse stammen aus einer Studie über eine Maus, die grün fluoreszierende Protein (GFP) unter der Promotor für Tyrosinhydroxylase 13,14, das Enzym katalysiert den geschwindigkeitsbestimmenden Schritt in Katecholamin-Synthese (TH:: GFP-Maus). Basierend auf die Helligkeit des GFP-Signal zwei getrennte Zellpopulationen zu unterscheiden sind (Abbildung 2A). Zellen, die das höhere GFP-Ebene besitzen Zellkörper in der inneren Körnerschicht (INL, Abbildung 2a) oder Vertriebene in den Ganglienzellen (GCL, 2B) und schichten in der Mitte der inneren plexiformen Schicht (IPL, Abbildung 2C) . Sie wurden als Typ-2-Zellen 14-16 identifiziert und könnte systematisch in Bezug auf Morphologie untersucht werden (Abbildung 3) und wählenrische Aktivität (Abbildung 4), obwohl die Bevölkerungsdichte beträgt nur 250 Zellen / mm 2.

Abbildung 1. Schematische Darstellung des experimentellen Aufbaus. Zwei-Photonen-Anregung (rot gepunktete Lichtweg) von Fluorophor-exprimierenden Zellen im intakten Netzhaut ermöglicht die visuelle Ausrichtung nach einer Mikropipette (grüne Emission Lichtweg). Die Netzhaut ist auf optische Reize durch den Kondensator des Mikroskops (gelb Lichtweg) projiziert unterzogen und zellulären Licht Antworten werden aufgezeichnet.
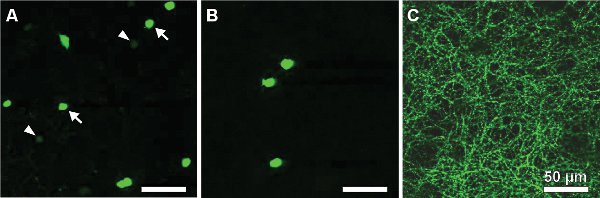
Abbildung 2. GFP-exprimierenden Zellen in einer retinalen Flatmount eines TH:: GFP-Maus. Typ-1-Zellen (DA-Zellen) in der INL mit schwacher Fluoreszenz (A, siehe Pfeile) befinden und intensiv beschriftet Typ-2-Zellen: Zwei Populationen können durch die Helligkeit des GFP-Signals unterschieden werdenmit Zellkörper entweder in der INL (A, siehe Pfeile) oder Vertriebene in der GCL (B) und einer dendritischen Schichtung in Stratum S3 der IPL (C). Scale-Bars, 50 um.
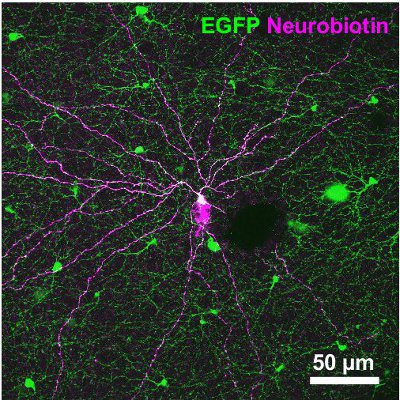
Abbildung 3. Morphologie eines Typ-2-Zellen mit dem Tracer Neurobiotin injiziert. Der Tracer wurde anschließend visualisiert durch Streptavidin-Cy3 Bindung (magenta). Die Aufnahme, die auch der Darstellung ist die GFP-Signal (grün), ist eine Projektion der Bildstapel für die GCL und IPL. Scale-bar, 50 um.
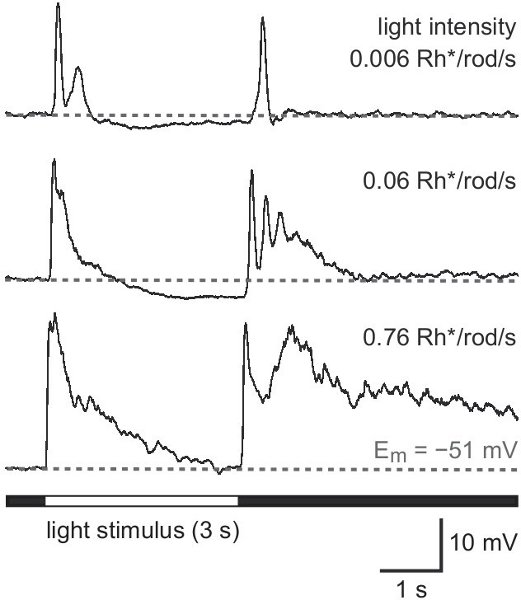
Abbildung 4. Leichte Reaktionen eines Typ-2-Zellen in der GCL entfernt. Antwort-Muster, um weißes Licht voll-Beleuchtung mit zunehmender Intensität in den skotopischen Bereich. Reizintensität ist in Photoisomerisierungen pro Stange pro Sekunde (Rh * / rod / s) angegeben. Eine anhaltende Stimulus von 3 s wurde zur besseren deutliche verwendetion der Antwort Komponenten bei Beginn des Stimulus (ON response) und Offset (OFF-Antwort).
Diskussion
Diese Methode bietet die Möglichkeit, elektrischen Eigenschaften von bestimmten Nervenzellen im intakten Netzhaut unter Sichtkontrolle ohne Einfluss auf die Anpassungsvarianten Zustand der Netzhaut zu untersuchen. Es ist besonders für die Charakterisierung von Zellen, die derzeit eher schlecht studiert aufgrund der geringen Bevölkerungsdichte wie die meisten Populationen von Amakrinzellen geeignet. Zwei-Photonen-Anregung ermöglicht hochauflösende und kontrastreiche Abbildungen auch aus tieferen Teilen des Gewebes 17, eine Voraussetzung für die präzise Ausrichtung und erfolgreiche Patch-Clamp-Zellen vor allem in den INL mit seiner hohen Dichte der Zellkörper.
Die isolierten Maus Netzhaut lebensfähig ist für 3-4 h unter den experimentellen Bedingungen. Wenn die zweite Netzhaut in völliger Dunkelheit unter ständiger Carbogen Begasung gespeichert wird, behält es die violette Farbe des ungebleichten Photopigment und kann nach Abschluss Experimente mit der ersten Netzhaut verwendet werden. In der Anfang, die auf dasausgewählten Zelle mit der Mikropipette in die Netzhaut wholemount ist ein bisschen schwierig und erfordert einige Übung, vor allem bei Arbeiten in der Dunkelheit. Inklusive einem Fluoreszenzfarbstoff in der Mikropipette kann Vereinfachung des Verfahrens, weil die Zelle und Mikropipette sichtbar unter zwei-Photonen-Anregung sind zur gleichen Zeit. Allerdings kann das Hinzufügen von Komponenten, um die intrazelluläre Lösung behindern Gigaseal Bildung oder führen Sie die Aufnahmequalität zu leiden. Nach erfolgreich erreicht, kann eine gute Aufnahme für ca. 1 h. letzten
Während die Infrarot-Anregung Licht selbst nur schlecht von der Netzhaut absorbiert, aufgeregt GFP-exprimierenden Zellen emittieren im sichtbaren Teil des Spektrums Licht. Allerdings sind Fluorophore nur in einem kleinen Fokalvolumen, die nicht geeignet ist, die Anpassungsvarianten Zustand der Netzhaut verändern aufgeregt. Umso mehr, Erregung ist nur für die Ausrichtung benötigt und kann während der Aufnahme von Licht Reaktionen ausgeschaltet werden.
Die usefulness für diesen Ansatz ist bereits durch Studien über spezifische Populationen von Amakrinzellen 14,18, aus dem elektrophysiologischen Ableitungen sonst nur durch Zufall 12 haben gezeigt hätten. Schließlich kann diese leistungsfähige Technik weiter, indem sie eine pharmakologische Ansatz 14, Ca 2 +-Imaging 19 oder indem Sie injizierten Zellen für immunzytochemische Studien oder Elektronenmikroskopie ausgebaut werden. Auf diese Weise kann die funktionelle Position eines bestimmten Zelltyp in der retinalen Schaltkreise entschlüsselt werden.
Offenlegungen
Die Mäuse wurden behandelt und eingeschläfert in Übereinstimmung mit den Richtlinien des Instituts für Tierschutz und die Gesetze zu Tierversuchen von der deutschen Regierung begeben werden.
Danksagungen
Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft (WE849/16 1 / 2 bis KD und RW) unterstützt. Wir danken Thomas Euler (Töbingen, Deutschland) für das Licht Stimulation Software QDS.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent / Equip-ment | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| Nachtsichtgeräten | Gutzeit GmbH, Warthausen, Deutschland | Xtron F1 | umfasst ein 800 nm-Lichtquelle |
| Optische Filter | Schott, Mainz, Deutschland | RG9 | Langpassfilter mit cutoff bei 690 nm |
| Iris Schere | Feine Science Tools | 14061-09 | gebogen mit 22 mm Klinge |
| Frühling Schere | Feine Science Tools | 15000-00 | Gerade mit 3 mm Klinge |
| Recording Kammer | Luigs & Neumann GmbH, Ratingen, Deutschland | 200 bis 100 500 0180 Typ A (TC) | Teflon Kammer mit untenliegender Deckglas (ca. 0,15 mm, Nr. 2-100 500 0182) |
| Durchlauferhitzer | Multichannel Systems, Reutlingen, Deutschland | PH01, TC01 | beheizbaren Perfusionskanüle mit Temperatur-sEnsor und Temperaturregler |
| Laser-Scanning-Mikroskop | Leica Microsystems | DM LFS | gesteuert durch Leica Confocal Software |
| Air Tisch | Newport | VH 3036W-OPT | |
| Laser | Spectra-Physics | Tsunami modengekoppelten Ti: Saphir-Laser | |
| CCD-Kamera | PCO AG, Kelheim, Deutschland | Pixelfly QE | einschließlich Steuerungs-Software |
| Micropipette Glaskapillaren | Hilgenberg, Malsfeld, Deutschland | 1408411 | |
| Micropipette puller | Sutter Instrument | P-97 | |
| Alexa Fluor 594 | Invitrogen | A-20004 | Fluoreszenzfarbstoff |
| Neurobiotin | Axxora | VC-SP-1120-M050 | nicht-fluoreszierenden Tracers |
| Streptavidin-Cy3 | Dianova | 016-160-084 | |
| Micromanipulator | Luigs & Neumann GmbH, Ratingen, Deutschland | 210-100 000 0010 | motorisierten Mini25 Manipulators mit Anzeige SM-5 |
| Patch-Clamp-Verstärkers | npi electronic GmbH, Tamm, Deutschland | SEC-05LX npi | |
| Digitizer | National Instruments | BNC-2090 | |
| Datenerfassungssoftware WinWCP | John Dempster, University of Scotland, Glasgow, UK | http://spider.science.strath. ac.uk / sipbs / software.htm | |
| Visuelle Reizgenerators QDS | Thomas Euler, Universität Tübingen, Deutschland | muss auf einem separaten Computer Steuerung von 2 Monitoren (User Interface, Stimulus-Monitor) betrieben werden | |
| Neutralfilter | ITOS, Mainz, Deutschland |
Referenzen
- Masland, R. H. The fundamental plan of the retina. Nat. Neurosci. 4, 877-886 (2001).
- Baccus, S. A. Timing and computation in inner retinal circuitry. Annu. Rev. Physiol. 69, 271-290 (2007).
- Haverkamp, S., Inta, D., Monyer, H., Wässle, H. Expression analysis of green fluorescent protein in retinal neurons of four transgenic mouse lines. Neuroscience. 160, 126-139 (2009).
- Siegert, S., Gross-Scherf, B., Del Punta, K., Didkovsky, N., Heintz, N., Roska, B. Genetic address book for retinal cell types. Nat. Neurosci. 12, 1197-1204 (2009).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Euler, T., Detwiler, P. W., Denk, B. Directionally selective calcium signals in dendrites of starburst amacrine cells. Nature. 418, 845-852 (2002).
- Sakmann, B., Neher, E. Single-Channel Recording. , Plenum Press. (1995).
- Jackson, M. B. Whole-cell voltage clamp recording. Current Protocols in Neuroscience. Gerfen, C. , Wiley. (1997).
- Majewska, A., Yiu, G., Yuste, R. A custom-made two-photon microscope and deconvolution system. Pfügers Arch. - Eur. J. Physiol. 441, 398-408 (2000).
- Yuste, R., Konnerth, A. maging in Neuroscience and Development: A Laboratory Manual. , Cold Spring Harbor Laboratory. (2005).
- Euler, T., Hausselt, S. E., Margolis, D. J., Breuninger, T., Castell, X., Detwiler, P. B., Denk, W. Eyecup scope - optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Arch. - Eur. J. Physiol. 457, 1393-1414 (2009).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nat. Protoc. 5, 1347-1352 (2010).
- Matsushita, N., Okada, H., Yasoshima, Y., Takahashi, N., Kiuchi, K., Kobayashi, K. Dynamics of tyrosine hydroxylase promoter activity during midbrain dopaminergic neuron development. J. Neurochem. 82, 295-304 (2002).
- Knop, G. C., Feigenspan, A., Weiler, R., Dedek, K. Inputs underlying the ON-OFF light responses of type 2 wide-field amacrine cells in TH-GFP mice. J. Neurosci. 31, 4780-4791 (2011).
- Zhang, D. Q., Stone, J. F., Zhou, T., Ohta, H., McMahon, D. G. Characterization of genetically labeled catecholamine neurons in the mouse retina. Neuroreport. 15, 1761-1765 (2004).
- Contini, M., Lin, B., Kobayashi, K., Okano, H., Masland, R. H., Raviola, E. Synaptic input to ON-biploar cells onto the dopaminergic neurons of the mouse retina. J. Comp. Neurol. 518, 2035-2050 (2010).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat. Methods. 2, 932-940 (2005).
- Dedek, K., Breuninger, T., de Sevilla Müller, L. P., Maxeiner, S., Schultz, K., Janssen-Bienhold, U., Willecke, K., Euler, T., Weiler, R. A novel type of interplexiform amacrine cell in the mouse retina. Eur. J. Neurosci. 30, 217-228 (2009).
- Denk, W., Detwiler, P. B. Optical recording of light-evoked calcium signals in the functionally intact retina. Proc. Natl. Acad. Sci. U.S.A. 96, 7035-7040 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten