Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
RNAi-vermittelte Gen-Knockdown und
In diesem Artikel
Zusammenfassung
In diesem Protokoll kombinieren wir RNAi-vermittelte Gen-Silencing mit ein In-vivo- Diurese Assay, um die Auswirkungen Knockdown von Genen von Interesse Studie wurde auf Moskito-Flüssigkeit ausgeschieden.
Zusammenfassung
Dieses Video demonstriert Protokoll eine effektive Technik, um ein bestimmtes Gen in einer Insekten und die Durchführung einer neuartigen Bioassay zur Ausscheidung zu messen. Diese Methode kann verwendet werden, um ein besseres Verständnis des Prozesses der Diurese bei Insekten erhalten werden und ist besonders nützlich bei der Untersuchung der Diurese in blutsaugende Arthropoden, die aufnehmen können große Mengen an Flüssigkeit in einem einzigen Blutmahlzeit sind.
Das RNAi-vermittelten Gen Knockdown mit einem In-vivo-Assay kombiniert Diurese wurde von der Hansen-Labor entwickelt, um die Effekte der RNAi-vermittelte Reduktion von Aquaporin-Gene auf Aedes aegypti Moskito Diurese 1 studierst.
Das Protokoll ist Setup in zwei Teile: der erste Beispiel demonstriert, wie man ein einfaches Moskitonetz Injektionsgerät konstruieren und zur Vorbereitung und injizieren dsRNA in den Brustkorb von Mücken für RNAi-vermittelte Gen-Knockdown. Das zweite Beispiel demonstriert, wie Sie feststellen,Ausscheidung in Moskitos mit einem In-vivo-Bioassay.
Protokoll
Teil I - RNAi-vermittelten Gen-Knockdown in der Erwachsenenbildung Aedes aegypti Mücken. Für Experiment Überblick siehe Abbildung 1.
1. dsRNA-Synthese
- Synthetisieren spezifische dsRNAs gegen Gene von Interesse und Kontrolle dsRNAs. Anmerkung: Es wird empfohlen die Entwicklung Primer für die PCR-Fragmente im Bereich von 300 bis 500 Basenpaare am 3'-Ende der spezifischen cDNA 2 und mit dem T7-Primer-Sequenz am 5 'befestigt Ende (5'-TAA TAC GAC TCA CTA befindet TAG GG-3 '). Die Einzigartigkeit der Fragmente sollte durch BLASTN Analyse 3 bestätigt werden.
- Verwenden Sie die Ambion MEGAscript T7 High Yield Transcription Kit (Ambion, Tisch von Reagenzien), die T7-RNA-Polymerase nutzt für die Transkription Reaktion auf dsRNA zu synthetisieren. Hinweis: ähnliche Reagenzien und Kits sind verfügbar anderswo.
- Um dsRNA zu reinigen, fällt mit Lithiumchlorid gemäß den Anweisungen mit dem MEGAscript Kit.
- Nach purificatIonen, löst den dsRNA Pellet in sterilem Wasser. Um eine ausreichende Viskosität für die Mikroinjektion zu gewährleisten, sollten die dsRNA-Konzentration nicht mehr als 2 ug / ul.
2. Injektionspräparat
- Eine einfache Mikro-Injektor kann durch Schläuche, Schere, Nadel ein Metall, eine 1 ml Spritze und einer 1 ml Kunststoff-Pipettenspitze (siehe Abbildung 2) konstruiert werden. Der Schlauch sollte ~ 40 cm Länge geschnitten werden. Alternativ kann ein automatisches Mikroinjektor wie Drummond Nanojet II 4 verwendet werden.
- Schneiden Sie die Spitze der Spritze (Nadel-Hub) bei 2 ml Skalenmarkierung und entfernen Sie den Gummistopfen Kopf aus dem Kolben.
- Lochen Sie ein Loch mit einer Nadel aus Metall in der Gummi-Kolbenkopf und Ort des Gummikolbens Kopf in den Nacken in der Nadel-Hub.
- Die Nadel-Hub in einem Ende des Rohrs und stellen eine 1-ml-Kunststoffröhrchen Pipettenspitze in dem anderen Ende, die als das Mundstück (alternativ kann ein 10 ml sy verwendet wirdringe verwendet werden, um den Luftdruck zu erzeugen, die für Injektion) werden.
- Legen Sie eine Glaskapillare Nadel in das Loch in der Gummikolben Kopf und brechen Sie die Spitze der Nadel ab, so dass die Breite ist groß genug für Flüssigkeit ungehindert durchfließen. Hinweis: Die optimale Größe der Nadelspitze muss empirisch ermittelt werden - wenn die Breite der Nadel ist zu groß, das wird in der Trauma und eine hohe Sterblichkeit zur Folge haben Moskito, wenn die Nadel Breite zu klein ist, wird es unmöglich sein zu durchdringen die Mücke Exoskelett.
- Tauchen der Injektionsnadel in die vorbereitete Probe dsRNA und stellt die flüssige Probe in die Injektionsnadel durch Ansaugen der Flüssigkeit mit dem Mundstück (oder einer Spritze). Hinweis: Dieser Schritt ist für alle flüssigen Reagenzien, die in Mücken gespritzt werden, einschließlich der PBS-Puffer, der in der in vivo Diurese Assay-Protokoll verwendet wird (siehe unten).
3. Sammeln und Anesthetize Moskitos
- Collectiont Moskitos mit einem batteriebetriebenen Aspirator in einen Sammelbehälter. Legen Sie eine Kappe über die Sammlung Fläschchen und legen Sie das Fläschchen auf eine saubere CO 2-Pad, um Mücken zu betäuben. Hinweis: Alternativ können Mücken auf Eis betäubt.
4. Mosquito Injection
- Öffnen Sie die Sammlung Fläschchen und legen die Mücken direkt an der CO 2-Pad und warten, bis Mücken betäubt sind.
- Entsorgen Sie alle Männer.
- Richten Sie die Mücken auf der Seite, um für einen leichteren Zugang zur Injektion zu ermöglichen.
- Schnappen Sie Mücken an den Beinen oder Flügeln, um Verletzungen zu vermeiden. Sie können auch einen feinen Pinsel oder Feder, um Mücken zu manipulieren.
- Wenn Sie bereit sind, um die erste Mücke injizieren, sanft unterstützen eine Seite des Thorax mit der Zange und legen Sie die Spitze der Nadel in die andere Seite des Thorax (Abbildung 2). Es ist besser, in einem dünnen Abschnitt der Oberhaut injizieren und zu vermeiden Drücken der Nadelo tief in den Brustkorb.
- Sobald die Nadel ist vorhanden, blasen die Flüssigkeit in der Mücke. Die gewünschte Menge kann durch Überwachen des Flüssigkeitsmeniskus in der Nadel bestimmt werden. Die Anzahl von Millimetern, die für eine spezifische Volumen durch Berechnen der Zylindervolumen der Glaskapillare Nadel (&pgr; r 2 h) bestimmt werden. Die wirksame Menge an dsRNA, die typischerweise für die Injektion verwendet wird, ist 1 ug.
- Sobald die Flüssigkeit in Mücke injiziert wird, einfahren vorsichtig die Nadel. Wenn ein großer Flüssigkeitströpfchen bildet sich auf der Außenseite des Thorax, sollte die Stechmücke verworfen werden. Dann wiederholen Sie diesen Vorgang beim nächsten Stich.
5. Mosquito Rückgewinnung und Speicherung
- Nach der Injektion setzen die Moskitos in einem Behälter für die Lagerung. Zum Beispiel, gesäumt ein Pint Wachs Pappbecher (Suppentassen) mit Mesh-Abdeckung mit dem Pappdeckel gesichert. Der Deckel hat ein Abschnitt aus der Netzbezug ausgesetzt werden geschnitten. Sobald die gesamte Mosquitoes im Container platziert werden, platzieren Sie den Behälter in einer kontrollierten Umweltbedingungen Kammer für die Inkubation und bieten die Moskitos mit einer Nahrungsquelle, wie z. B. 20% Saccharose getränkten Wattebausch auf der Oberseite des Mesh-Abdeckung platziert. Vor der Durchführung der In-vivo-Assay Diurese, nehmen die dsRNA-injizierten Moskitos einer Wasserquelle für 12 Stunden, um die Hydratation Zustand jedes Moskito standardisieren.
- Die Effizienz der dsRNA-vermittelte Gen-Knockdown kann variabel sein. Gen-Silencing konnte 1 Tag nach der Injektion beginnen und es könnte bis zu 6 Tage nach der Injektion 4. Der optimale Zeitpunkt, um maximale Gen Knockdown erreichen muss empirisch für jedes Gen verwendet wird, bestimmt werden. Generell warten wir 3 Tage nach dsRNA Injektion, bevor wir fortfahren.
Teil II - In-vivo-Assay Diurese bei erwachsenen Stechmücken Aedes aegypti
Hinweis: Dieses Protokoll wurde von den Autoren entwickelt worden undverwendet für die RNAi-vermittelte Knockdown von Aquaporin-Proteine in der Gelbfieber-Mücke Aedes aegypti ein. Um die Variabilität zwischen den einzelnen Mücken zu vermeiden, sollte Moskitos in Gruppen analysiert werden. Aus technischen Gründen, empfehlen wir Gruppen von 5 Mücken pro Behandlung - gibt es eine begrenzte Menge an Zeit, um die erste Messung durchzuführen Gewicht vor Mücken, Urin auszuscheiden nach der Injektion beginnen.
6. Sammeln und Anesthetize Moskitos
- Vor der Sammlung des Moskitos, nimmt das Gewicht von einem leeren Sammlung Fläschchen mit einer Kappe mit einer analytischen Präzisionswaage. Diese Ampulle wird für alle folgenden Messungen verwendet werden.
- Sammelt 5 weiblichen Mücken in den tarierten Sammlung Fläschchen mit einem Aspirator. Legen Sie die Kappe über dem Fläschchen Sammlung und lassen Sie es auf der CO 2-Pad sitzen für ein paar Sekunden, um die Mücken zu betäuben.
7. Erste Gewichtsmessung
- Nehmen Sie ter Einwaage Messung der 5 Mücken, indem Sie die Sammlung Fläschchen mit den Moskitos mit der Kappe auf der Präzisionswaage.
- Berechnen Sie das Gewicht der Gruppe von 5 Mücken, indem sie das Gewicht der Moskitos und die Sammlung Fläschchen mit Kappe und Subtraktion des Gewichts des leeren Sammlung Fläschchen mit Kappe.
- Öffnen Sie die Sammlung Fläschchen und legen die Mücken direkt an der CO 2-Pad nach der Aufnahme des Gewichts der Mücken. Wenn die Moskitos beginnen zu erwachen während der Gewichtsmessung, stellen Sie die Flasche auf den CO 2-Pad für einige Sekunden vor dem Öffnen und Platzieren der Moskitos auf dem Pad.
8. Injektionspräparat
- Richten Sie das Mikro-Injektor nach den Anweisungen in der RNAi-vermittelten Gen-Knockdown-Protokoll gegeben.
- Stellen Sie ein Glas Kapillarnadel im Mikro-Injektor und brechen Sie die Spitze der Nadel ab, so dass die Breite ist groß genug für Liquid ungehindert durchfließen.
- Tauchen die Nadel in PBS-Puffer und stellt den Puffer in der Injektionsnadel, ist die gewünschte Menge für dieses Protokoll verwenden 1,25 l PBS für jedes Moskito. Hinweis: Dieser Betrag ahmt die durchschnittliche Menge an Blutplasma, die sich von einer weiblichen Stechmücke 5 getroffen wird.
9. Mosquito Injection
- Richten Sie die Moskitos um eine leichtere Bedienung mit dem Mikro-Injektor ermöglichen.
- Sobald die Nadel ist vorhanden, blasen PBS-Puffer in der Mücke.
- Sobald die Flüssigkeit in der Mücke injiziert wird, kann ein Tröpfchen an der Außenseite des Thorax zu bilden. Diese Tropfengröße muss sorgfältig vor dem nächsten Schritt entfernt werden.
- Wiederholen Sie diesen Vorgang Injektion beim nächsten Stich. Mit zunehmender Erfahrung werden Moskito-Überlebensrate fast 100% betragen nach der Injektion.
10. Mit einem Gewicht Moskitos
- Nach der Injektion ist, setzen Sie die Moskitos in der Sammlung Fläschchenund Kappe. Machen Sie den ersten Gewichtsmessung der 5 Mücken, indem Sie die Sammlung Fläschchen mit den Moskitos mit der Kappe auf der Präzisionswaage.
- Berechnen Sie das Gewicht der Gruppe von 5 Mücken, indem sie das Gewicht der Mücken und der Sammlung Fläschchen mit Kappe und subtrahieren das Gewicht des leeren Sammlung Fläschchen mit Kappe. Hinweis: Moskitos beginnt, Urin innerhalb von 2 Minuten nach Entnahme aus dem CO 2-Betäubung Pad ausscheiden, so ist es wichtig, das Gewicht Messung vorzunehmen, bevor sie ausscheiden zu starten.
- Platzieren Sie Moskitos in einem kleinen Container, in dem sie beginnen, Urin ausscheiden wird.
11. Zweite und die folgenden Maße Gewicht
Hinweis: Gewicht Messungen der Moskitos sollte in Intervallen von 30 Minuten genommen werden, aber dies kann zu kürzeren oder längeren Abständen, je nach Exkretionsraten eingestellt werden.
- Nach 30 Minuten sammeln die Group von 5 Moskitos mit einem Aspirator in der gleichen Sammlung Fläschchen mit Kappe. Machen Sie den nächsten Gewichtsmessung der Mücken, indem Sie die Sammlung Fläschchen mit den Moskitos mit der Kappe auf der Präzisionswaage.
- Nach der Messung, platzieren Sie die Mücken im gleichen Betrieb Behälter für die nächsten 30 Minuten.
- Dieser Vorgang wird für eine gewünschte Zeitspanne.
12. Bestimmen Mosquito Ausscheidungsrate
- Die Gesamtmenge an Flüssigkeit, die in der Gruppe von 5 Moskitos injiziert wurde, kann durch Subtrahieren des ursprünglichen Gewichts des Moskitos aus dem Gewicht unmittelbar nach der Injektion zu berechnen.
- Die Menge an Urin, die durch die Gruppe von Moskitos zu einem bestimmten Zeitpunkt wurde ausgeschieden werden durch Subtrahieren des ursprünglichen Gewichts des Moskitos aus dem Gewicht der Moskitos in dem bestimmten Zeitpunkt berechnet werden.
- Die Ausscheidungsrate zu einem bestimmten Zeitpunkt durch Dividenden berechnet werdenDing die Menge an Urin zu diesem Zeitpunkt durch die Gesamtmenge an Flüssigkeit injizierten (Tabelle 1) ausgeschieden.
13. Repräsentative Ergebnisse
RNAi-vermittelte Gen-Ausschaltung und in vivo-Assays haben Diurese durch die Hansen-Labor verwendet worden, um die Auswirkungen der Aquaporine in Aedes aegypti Diurese zu studieren. Drei Aquaporine, die in Aedes aegypti Malpighischen Gefäßen exprimiert werden, wurden mit erheblichen Auswirkungen auf die Ausscheidung Preise im Vergleich zu Stechmücken 1 zu kontrollieren klopfte. Abbildung 4 zeigt repräsentative Ergebnisse eines Experiments, wo die Diurese Assay verwendet wurde, um die Ausscheidung Raten zwischen Aedes aegypti und Culex quinquefasciatus vergleichen bei verschiedenen Temperaturen.
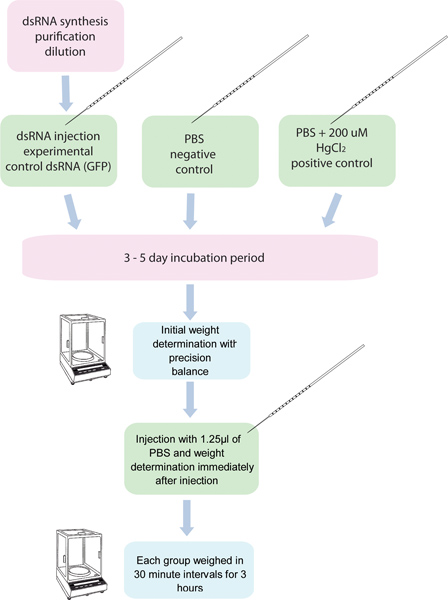
Abbildung 1. Flussdiagramm des RNAi-/ Diurese Assay. 5 Gruppen von 10 Mücken each sind mit dsRNA für eine bestimmte Gen injiziert und weitere fünf Gruppen von jeweils zehn Mücken sind mit Kontroll-dsRNA injiziert. Eine weitere Gruppe von Mücken mit 200 pM HgCl 2 in PBS injiziert wird als eine positive Kontrolle verwendet. Diese Mücken sind vor der Injektion und nach der Injektion in 30 Minuten Intervallen für 3 Stunden gewogen.
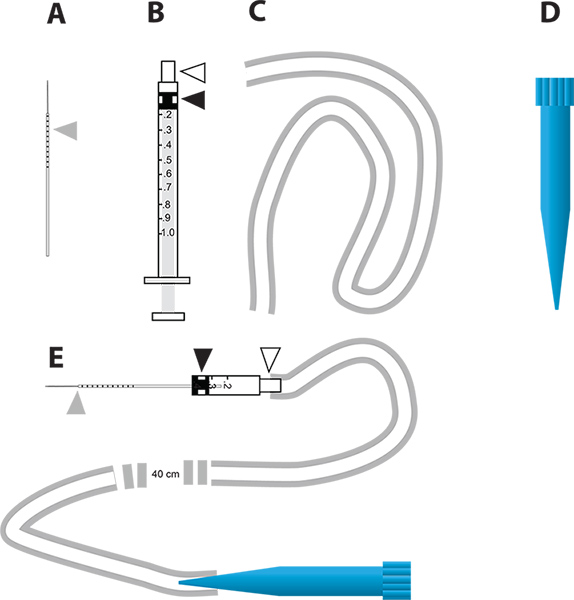
Abbildung 2. Eine einfache Mikro-Injektion Gerät für die RNAi-vermittelte Gen-Knockdown-und in vivo-Assay Diurese. A. Die Glaskapillare Injektionsnadeln verwendet. Das graue Dreieck steht für die Millimeter-Schritten auf der Nadel gezogen, um die Menge an Flüssigkeit injiziert in der Mücke zeigen. B. 1 ml Spritze benutzt, um die Mikro-Injektor zu konstruieren. Das weiße Dreieck stellt die Nadelnabe und der schwarze Dreieck stellt das Gummikolben Kopf an dem Kolben in der Spritze. C. Der Schlauch verwendet, um das Mundstück zu befestigender Injektor. D. 1 ml Einweg-Pipettenspitze (blaue Spitze), die als Sprachrohr der Mikroinjektion Gerät verwendet wird. E. Die Mikroinjektion Gerät, das AD Teile enthält. Klicken Sie hier für eine größere Abbildung anzuzeigen .
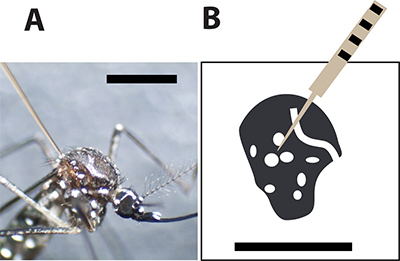
Abbildung 3. Optimale Moskito Injektionsstelle. A. Weibliche Mücke Aedes aegypti mit einer Glaskapillare Nadel zwischen den großen Schuppen am Thorax injiziert. Der schwarze Balken zeigt 1 mm zum Größenvergleich. B. Eine Zeichnung des weiblichen Stechmücke Thorax und die weißen Flecken repräsentieren die weißen Schuppen in der Mücke Exoskelett. Die Injektionsnadel muss die Mücke stechen zwischen den Spots zu Sterblichkeitsrate während der Injektion zu minimieren.
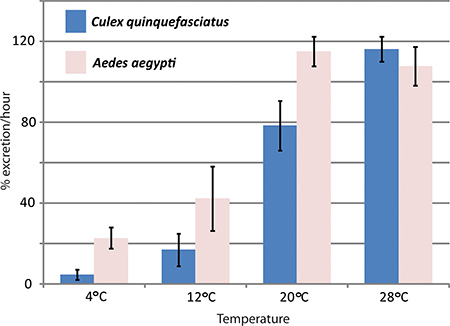
Abbildung 4. Auswirkungen von Temperaturtur auf Culex quinquefasciatus und Aedes aegypti Diurese. Die Diurese Assay wurde mit zwei Arten von Stechmücken, Aedes aegypti und Culex quinquefasciatus durchgeführt, bei verschiedenen Temperaturen. Die Ausscheidungsrate während der ersten Stunde nach der Injektion wird in Prozent angegeben.
| Gruppe | TARA (G) | nicht gespritzt (G) | nach der Injektion (G) | 1h nach der Injektion (G) | Durchschnittsgewicht (mg) | Mengen injiziert (Ul) | Menge ausgeschieden (Ul) | % Ausgeschieden |
| 1 | 7,5938 | 7,6057 | 7,6104 | 7,6096 | 2,38 | 0,94 | 0,16 | 17,0 |
| 2 | 7,8252 | 7,8349 | 7,8415 | 7,8403 | 1,94 | 1,32 | 0,24 | 18,2 |
| 3 | 7,8896 | 7,9026 | 7,9077 | 7,906 | 2,6 | 1,02 | 0,34 | 33,3 |
Tabelle 1. Aedes aegypti in vivo Diurese Testergebnisse. Rohdaten aus den in vivo-Assay mit Diurese Aedes aegypti weibliche Moskitos bei 4 ° C
Diskussion
Die RNAi-Protokoll verwendet wurde im Labor von Alexander Raikhel wurde an der University of California Riverside 6,7 entwickelt und ist vergleichbar mit einem Protokoll, das von Garver und Dimopoulos 4 veröffentlicht. Der experimentelle Ansatz in diesem Video-Protokoll gezeigt werden verwendet, um Gene in Insektenzellen Diurese in einem in-vivo-Umgebung verwickelt zu werden. Die Ausscheidungsorgane der Insekten, die Malpighischen Gefäßen, haben das Interesse von Generationen v...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren danken Victoria Carpenter für ihre kritischen Kommentare dieses Protokolls.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz oder Ausrüstung | Firma | Katalog-Nummer | Kommentare |
| MEGAscript T7 High-Yield-Kit | Ambion, Inc. | AM1334 | |
| PBS-Puffer | Sigma-Aldrich | P4417 | |
| Kunststoffschlauch | Lokale Anbieter | PVC | |
| 1 ml Kunststoff-Pipettenspitze | VWR | 83007-376 | Blaue Spitze |
| 1 ml-Spritze | Becton, Dickinson and Company | 309602 | |
| Schere | Lokale Anbieter | ||
| Metall-Nadel | Carolina Biologicals | 654307 | Größe 5 |
| Fly-Pad | Genesee Scientific | 789060 | |
| Batteriebetriebene Aspirator w / Sammelfläschchen | Upma Labs | IPMM 2000 | |
| Feine Spitze Pinzette | World Precision Instruments | 14095 | |
| Glaskapillare Nadeln | World Precision Instruments | 1B200-6 | |
| Stereo Dissektionsmikroskop | Leica Microsystems | S6D | |
| Analytische Präzisionswaage | Mettler Toledo | AB54S | |
| Saccharose | Sigma-Aldrich | 84097 | |
| Ein Pint gewachst ausgekleideten Karton Tassen | Lokale Anbieter | Hergestellt Suppentassen | |
| Mesh-Netz | Lokale Anbieter | Kunststoff-fly Gaze |
Referenzen
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten