Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Labeling Stammzellen mit Ferumoxytol, eine FDA-Zulassung Eisenoxid-Nanopartikel
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Technik zur Kennzeichnung und Verfolgung von Stammzellen mit FDA-Zulassung, superparamagnetische Eisenoxid (SPIO), ferumoxytol (Feraheme). Diese zellulären bildgebendes Verfahren, das Magnetresonanz-(MR)-Bildgebung nutzt zur Visualisierung, ist leicht zugänglich für die langfristige Überwachung und Diagnose von Erfolg oder Misserfolg Stammzellen engraftments bei Patienten.
Zusammenfassung
Stammzell-basierte Therapien bieten erhebliches Potenzial für den Bereich der regenerativen Medizin. Dennoch bleibt noch viel zu verstehen in Bezug auf die in vivo Kinetik der transplantierten Zellen werden. Eine nicht-invasive Methode, um wiederholt zu überwachen transplantierten Stammzellen in vivo erlauben würde Ermittler direkt zu überwachen Stammzell-Transplantationen und identifizieren erfolgreiche oder erfolglose Transplantation Ergebnisse.
Eine breite Palette von Stammzellen weiterhin für unzählige Anwendungen untersucht werden. Dieses Protokoll konzentriert sich auf 3 verschiedenen Stammzell-Populationen: menschliche embryonale Nierenzellen 293 (HEK293-Zellen), humanen mesenchymalen Stammzellen (hMSC) und induzierten pluripotenten Stammzellen (iPS-Zellen). HEK 293 Zellen aus menschlichen embryonalen Nierenzellen in Kultur mit geschert Adenovirus 5 DNA gewachsen abgeleitet. Diese Zellen weit verbreitet sind in der Forschung eingesetzt, weil sie leicht kultiviert werden, wachsen schnell und sind leicht transfiziert. hMSCs sind bei erwachsenen Knochenmark gefunden. Diese Zellen ca.n als undifferenzierte Zellen repliziert werden unter Beibehaltung Multipotenz oder das Potential, in einer begrenzten Anzahl von Zellanlagen unterscheiden. hMSCs können Abstammungslinien von mesenchymalen Geweben, einschließlich Osteoblasten, Adipozyten, Chondrozyten, Sehnen, Muskeln und Knochenmarkstroma unterscheiden. iPS-Zellen sind genetisch adulten Zellen, die modifiziert wurden, um Gene und Faktoren ähnlich definierenden Eigenschaften von embryonalen Stammzellen umprogrammiert auszudrücken. Diese Zellen sind pluripotent dh sie haben die Fähigkeit, sich in allen Zelllinien 1 unterscheiden. Beide hMSCs und iPS-Zellen haben Tissue Regenerationsfähigkeit in-vivo demonstriert.
Magnetresonanztomographie (MRT) zusammen mit der Verwendung von superparamagnetischen Eisenoxid (SPIO) Nanopartikel-Zell-Labels haben sich für in vivo Verfolgung von Stammzellen aufgrund der Nähe mikroskopischen anatomischen Auflösung effektiv, erlaubt eine längere Blut-Halbwertszeit, die Längs-Bildgebung und die hohe sensitivity für Zell-Erkennung durch MR-Bildgebung von SPIO sofern Nanopartikel 2-4. Darüber hinaus ist der MR-Bildgebung mit dem Einsatz von SPIOs klinisch übersetzbar. SPIOs eines Eisenoxid-Kern mit einer Dextran, Carboxydextran oder Stärke Oberflächenbeschichtung, die den bioreaktiven Eisenkern aus dem Plasma-Komponenten enthalten dient zusammen. Diese Mittel schaffen lokale Magnetfeldinhomogenitäten, die zu einem verringerten Signal auf T2-gewichteten MRT-Bilder zeigen 5 führen. Leider sind SPIOs nicht mehr hergestellt. Zweite Generation, ultrakleinen SPIOs (USPIO), bieten jedoch eine gute Alternative. Ferumoxytol (FerahemeTM) ist eine USPIO einer nicht-stöchiometrischen Magnetit Kern durch eine Polyglucose Sorbit carboxymethylether Mantel umgeben sind. Die kolloidalen, Partikelgröße von ferumoxytol ist 17-30 nm durch Lichtstreuung bestimmt. Das Molekulargewicht beträgt 750 kDa, und die Relaxivität konstant bei 2T MRI Feld ist 58,609 mM-1 sec-1 Stärke 4. Ferumoxytol wurde vor kurzem von der FDA genehmigte eines ein Eisenpräparat zur Behandlung von Eisenmangel bei Patienten mit Nierenversagen 6. Unsere Gruppe hat dieses Mittel in einer "off label" Einsatz für die Zell-Kennzeichnung Anwendungen eingesetzt. Unsere Technik demonstriert eine effiziente Markierung von Stammzellen mit ferumoxytol, die zu erheblichen MR-Signal Auswirkungen der markierten Zellen auf MR-Bildern führt. Diese Technik kann für nicht-invasive Überwachung der Stammzelltherapie in der vorklinischen und klinischen Umgebungen eingesetzt werden.
Protokoll
1. Tag 1
1) Platte Zellen
- Platte hMSC in einer T75-Kolben bei einer Konfluenz von 80% mindestens 18-24 Stunden vor der Markierung. Siehe Tabelle 1 für den Unterricht für alternative Fahrzeuge.
2. Tag 2
2) Bereiten Kennzeichnung Lösung. Diese Vorbereitung wird eine (1) T75-Kolben bei 80% Konfluenz mit einer Konzentration von 400 ug Fe / ml Etikett. Siehe Tabelle 1 für den Unterricht für alternative Fahrzeuge.
- Erstellen Sie eine Lösung (Lösung 1) durch Mischen von 1 ml Serum-freien Medien und 93,1 ul ferumoxytol (Bestand: 30 mg / ml) in einem 15 ml konischen Röhrchen.
- Erstellen Sie eine zweite Lösung (Lösung 2) durch Mischen von 1 ml Serum-freien Medien und 7 pl Protaminsulfat (Bestand: 10 mg / ml) in einem zweiten 15 ml konischen Röhrchen.
- Lassen Sie jede Lösung für 5 Minuten ruhen lassen.
- Add-Lösungen 1 und 2 zusammen. Vorsichtig mischen die neuen Kennzeichnungsvorschriften Lösung. Lassen Sie die Lösung für 5 Minuten ruhen lassen, um USPIO-pro erlaubenHistamin-Sulfat-Komplexe zu bilden.
- 5 ml Serum-freien Medien zu den gemischten 2 ml SPIO / Protaminsulfat-Lösung für ein Endvolumen von 7 ml.
3) Bereiten Zellen für die Etikettierung
- Saugen Sie die Medien aus den Zellen.
- Vorsichtig waschen Zellen einmal mit 2-3 ml vorgewärmten Mg / Ca-freien D-PBS oder Serum-freien Medien zu abspülen verbleibende Serumproteine und oder anderen Medien-Komponenten, die Kontrastmittelaufnahme und Kennzeichnung Effizienz beeinträchtigen könnten. Saugen Sie die Spülflüssigkeit.
4) Label-Zellen
- Fügen Sie die komplette 7 ml Lösung zur Kennzeichnung von Zellen.
- Legen Sie Zellen in einem Inkubator (37 ° C / 5% CO 2) und damit die Zellen bei der Kennzeichnung Lösung für 4 Stunden inkubiert.
- Add 700 ul FCS die Etikettierung Lösung der Zellen, um eine endgültige Konzentration im Serum von 10% zu erreichen. Serum zugesetzt wird, um die Wiederherstellung der angereicherten Umwelt, von denen die Zellen sind daran gewöhnt, und in mi unterstützennimizing Zelltod, die von einem abrupten Übergang zu 24 Stunden Exposition gegenüber einem Serum-freien Umgebung führen könnten.
- Lassen Sie die Zellen, die mit der Etikettierung Lösung für weitere 20 Stunden inkubiert.
3. Tag 3
5) Bereiten Sie markierten Zellen
- Saugen Sie die Kennzeichnung Lösung von Zellen.
- Vorsichtig spülen Zellen mit 2-3 ml vorgewärmten Mg / Ca-freien D-PBS. Saugen Sie die PBS. Es ist wichtig, Mg / Ca-freiem PBS Verwendung als Mg und Ca wird die Effizienz von Trypsin im nächsten Schritt zu beeinträchtigen.
- 2 ml vorgewärmten 0,05% Trypsin zu den Zellen und kippen Sie den Kolben hin und her, um die gesamte Oberfläche des Kolbens zu gewährleisten ist mit einer dünnen Schicht von Trypsin behandelt. Legen Sie die Zellen in einem Inkubator (37 ° C / 5% CO 2) und damit die Zellen für 5-7 Minuten oder ruhen, bis Zellen von der Platte lösen beginnen. Es kann notwendig sein, um Distanz unter einem Mikroskop zu bestätigen. Klopfen Sie leicht den Seiten des Kolbens, wenn notwendig, facilitate Zelloberflächen-Distanz.
- 4 ml vorgewärmten komplette Medien in den Kolben auf die Trypsin zu neutralisieren. Vorsichtig spülen Sie die Flasche mit einer Pipette die Trypsin / media / Zell-Lösung nach oben und unten mehrere Male. Sammeln Sie die gesamte Lösung in einem 15 ml konischen Röhrchen. Zentrifugieren Sie die Zell-Lösung bei 400 RCF für 5 Minuten.
- Vorsichtig absaugen den Überstand ohne die Zellpellet. Resuspendieren der Zellen in 5 ml Medium (Serum mit oder Serum-frei). Zentrifugieren Sie die Zell-Lösung bei 400 RCF für 5 Minuten.
- Wiederholen Sie die Zelle waschen in Schritt 5.5 beschrieben. Insgesamt werden Zellen dreimal gespült werden, um restliche, frei Kontrastmittel in den Medien und auf der Oberfläche der Zellen zu entfernen.
- Zählen von Zellen an dieser Stelle auf das genaueste Zellzahl zu erreichen, wie Zellen während der letzten Waschen verloren geht. Führen Sie eine Viabilitätstest von Zellen. Die Zellen sind nun bereit für die anschließende Analyse und oder experimentelle Anwendung. MR-Bildgebung mit T1-w durchgeführt werden und T2-w-Parameter, denn obwohl ferumoxytol ist ein T2-w-Kontrastmittel, ferumoxytol zeigt auch T1-Effekte. Vertreter T2-w MRT-Parameter, die Bild ferumoxytol markierten Zellen verwendet werden können: FSE oder SE_Multislice Sequenzen mit einer TR von 2000-2500 ms und einer TE von 60-80 ms. Zum Erwerb einer T1-w Bild, verringern Sie die TE-Wert auf einer FSE oder SE_Multislice Sequenz oder verwenden Sie einen GRE-Sequenz mit einer hohen TR und niedrige TE. Abbildung 4 zeigt eine mögliche in vivo-Anwendung für markierte Stammzelle Bildgebung.
4. Repräsentative Ergebnisse:
Markierten Zellen zeigen eine deutliche Verdunkelung oder negativen Kontrast auf T2-gewichteten MRT-Bilder und eine Aufhellung oder positiven Kontrast auf T1-gewichteten MRT-Bilder (Abbildung 2). Längs der MR-Bildgebung und die Lebensfähigkeit Tests 5 Tage nach der Kennzeichnung keine signifikanten MR-Signal und keine signifikanten Auswirkungen auf die Lebensfähigkeit im Vergleich zu unmarkiertem Kontrollen (Daten nicht gezeigt) nachgewiesen.
jove_content "> markierten Stammzellen können anschließend in verschiedene Zelltypen differenzieren oder intravenös in vivo Untersuchung injiziert.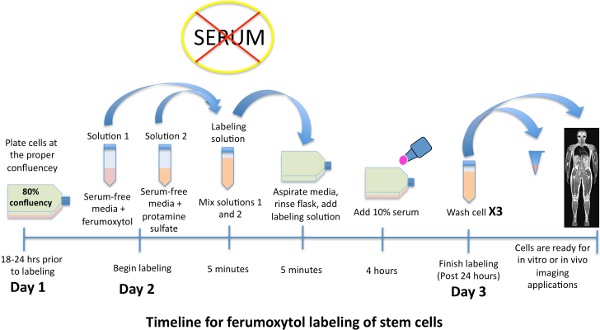
Abbildung 1. Schematische Zeitplan für die Kennzeichnung Stammzellen mit Eisenoxid-Nanopartikel, ferumoxytol.

Abbildung 2. MR-Bilder des sagittalen Querschnitte thrrough Eppendorf-Röhrchen mit Zellen in einem Zell-Pellet. A) steuert Unlabeled. B) markierten Zellen zeigen eine deutliche T2 oder negative Kontrastmittel auf T2-gewichteten FSE oder SE_Multislice Bildgebung und eine T1-oder positive Kontrastmittel Effekt auf die T1-gewichteten GRE-Sequenz.
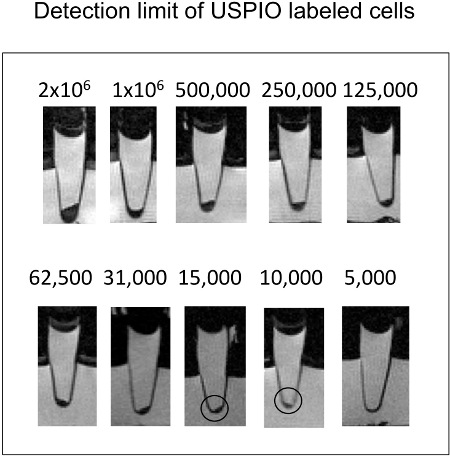
Abbildung 3. Sagittal Querschnitte der Eppendorf-Röhrchen mit Zellen in Zell-pelkönnen. So wenig wie 10.000 ferumoxytol markierten Zellen können über T2-w MRT erkannt werden.
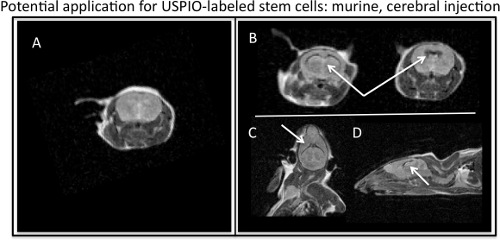
Abbildung 4. MR Visualisierung von ferumoxytol-markierten Stammzellen in Mäuse-Hirnventrikel injiziert. A) Axial-, MR-Bild von murinen barin ohne Injektion von USPIO-markierten Stammzellen. B) Axial, C) koronal und D) sagittal MRT Darstellung des T2, negative dagegen Wirkung USPIO-markierten Stammzellen (weiße Pfeile) in einem murinen Gehirn injiziert.

Tabelle 1. Menge Anpassungen für die Markierung von Zellen in alternativen Gefäßen.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Verbesserung der Wirksamkeit von Stammzellen engraftments ist entscheidend für die Weiterentwicklung der regenerativen Medizin. Eine nicht-invasive Visualisierung Technik für Stammzellen in vivo signifikant verbessert unsere Fähigkeit, Mechanismen, die eine erfolgreiche Transplantation Ergebnissen führen verstehen. Magnetische Kennzeichnung für MR-Visualisierung, wie das Verfahren, das wir gezeigt haben, können in vivo Verfolgung von Stammzellen mit der MR-Bildgebung. Magnetisch markierte Stammze...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Alle Mitwirkenden an dieser Studie bieten keine Meldungen vor.
Danksagungen
3R01AR054458-02S2: Diese Arbeit wurde durch ein Stipendium des National Institute of Arthritis and Bewegungsapparates und Hautkrankheiten unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| D-MEM Hohe Glucose | Sigma | D5648 | Oder andere Basismedium für die gewünschte Stammzelllinie verwendet werden |
| D-PBS (Ca + +, Mg + + frei) | GIBCO | 14190-144 | |
| Trypsin-EDTA 0,05% | Invitrogen | 25300-120 | |
| Fetal Bovine Serum (FBS) | Hyclone | SH30071.03 | |
Ferumoxytol (Feraheme) | AMAG | 59338-0775-01 | |
| Protaminsulfat | APP Pharm. | 22930 |
Referenzen
- Narsinh, K. H., Plews, J., Wu, J. C. Comparison of human induced pluripotent and embryonic stem cells: fraternal or identical twins? Mol Ther. 19, 635-638 (2011).
- Bulte, J. W. In vivo MRI cell tracking: clinical studies. AJR. Am. J. Roentgenol. 193, 314-325 (2009).
- Henning, T. D., Boddington, S., Daldrup-Link, H. E. Labeling hESCs and hMSCs with Iron Oxide Nanoparticles for Non-Invasive in vivo Tracking with MR Imaging. J. Vis. Exp. (13), e685-e685 (2008).
- Tallheden, T., Nannmark, U., Lorentzon, M. In vivo MR imaging of magnetically labeled human embryonic stem cells. Life. Sci. 79, 999-1006 (2006).
- Jung, C. W., Jacobs, P. Physical and chemical properties of superparamagnetic iron oxide MR contrast agents: ferumoxides, ferumoxtran, ferumoxsil. Magn. Reson. Imaging. 13, 661-674 (1995).
- Coyne, D. W. Ferumoxytol for treatment of iron deficiency anemia in patients with chronic kidney disease. Expert. Opin. Pharmacother. 10, 2563-2568 (2009).
- Li, Z., Suzuki, Y., Huang, M. Comparison of reporter gene and iron particle labeling for tracking fate of human embryonic stem cells and differentiated endothelial cells in living subjects. Stem Cells. 26, 864-873 (2008).
- Metz, S., Bonaterra, G., Rudelius, M. Capacity of human monocytes to phagocytose approved iron oxide MR contrast agents in vitro. Eur. Radiol. 14, 1851-1858 (2004).
- Nedopil, A., Klenk, C., Kim, C. MR signal characteristics of viable and apoptotic human mesenchymal stem cells in matrix-associated stem cell implants for treatment of osteoarthritis. Invest. Radiol. 45, 634-640 (2010).
- Kraitchman, D. L., Heldman, A. W., Atalar, E. In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation. 107, 2290-2293 (2003).
- Stuckey, D. J., Carr, C. A., Martin-Rendon, E. Iron particles for noninvasive monitoring of bone marrow stromal cell engraftment into, and isolation of viable engrafted donor cells from, the heart. Stem Cells. 24, 1968-1975 (2006).
- Henning, T. D., Sutton, E. J., Kim, A. The influence of ferucarbotran on the chondrogenesis of human mesenchymal stem cells. Contrast. Media. Mol. Imaging. 4, 165-173 (2009).
- Arbab, A. S., Yocum, G. T., Kalish, H. Efficient magnetic cell labeling with protamine sulfate complexed to ferumoxides for cellular MRI. Blood. 104, 1217-1223 (2004).
- Nedopil, A. J., Mandrussow, L. G., Daldrup-Link, H. E. Implantation of Ferumoxides Labeled Human Mesenchymal Stem Cells in Cartilage Defects. J. Vis. Exp. (38), e1793-e1793 (2010).
- Arbab, A. S., Yocum, G. T., Wilson, L. B. Comparison of transfection agents in forming complexes with ferumoxides, cell labeling efficiency, and cellular viability. Mol Imaging. 3, 24-32 (2004).
- Babic, M., Horak, D., Trchova, M. Poly(L-lysine)-modified iron oxide nanoparticles for stem cell labeling. Bioconjug Chem. 19, 740-750 (2008).
- Golovko, D. M., T, H. enning, Bauer, J. S. Accelerated stem cell labeling with ferucarbotran and protamine. Eur. Radiol. 20, 640-648 (2010).
- Lu, M., Cohen, M. H., Rieves, D. FDA report: Ferumoxytol for intravenous iron therapy in adult patients with chronic kidney disease. Am. J. Hematol. 85, 315-319 (2010).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten